Galogen birikmalar mavzusi bo'yicha xabar. Galogenlar va ularning birikmalari. Galogenlar va ularning birikmalarining biologik ahamiyati
Shuningdek o'qing
Galogenlar (yunon tilidan. halos - tuz va genlar - generator) - asosiy kichik guruhning elementlari VII guruhlar davriy jadval: ftor, xlor, brom, yod, astatin.
Erkin holatda galogenlar ikki atomli F 2, Cl 2, Br 2, I 2 molekulalaridan tashkil topgan moddalar hosil qiladi.
TABIATDA BO'LISH
Galogenlar tabiatda faqat birikmalar holida uchraydi.
Ftor faqat tuzlar shaklida bo'ladi, har xil tarqalgan toshlar. Yer qobig'idagi ftorning umumiy miqdori atomlarning 0,02% ni tashkil qiladi. Ftorli minerallar amaliy ahamiyatga ega: CaF 2 - flor shpati, Na 2 AlF 6 - kriolit, Ca 5 F(PO 4) 3 - florapatit.
Eng muhimi tabiiy birikma xlor
natriy xlorid (galit) bo'lib, u boshqa xlor birikmalarini ishlab chiqarish uchun asosiy xom ashyo bo'lib xizmat qiladi. Natriy xloridning asosiy massasi dengiz va okeanlar suvlarida uchraydi. Ko'pgina ko'llarning suvlarida ham ko'p miqdorda NaCl mavjud - Elton va Baskunchak ko'llari. Boshqa xlor birikmalari mavjud, masalan, KCl - silvinit, MgCl 2 *KCl*6HO - karnallit, KCl*NaCl - silvinit.
Brom tabiatda xlor tuzlari bilan birga natriy va kaliy tuzlari shaklida, shuningdek, sho'r ko'llar va dengizlar suvlarida uchraydi. Metall bromidlar mavjud dengiz suvi. Sanoat ahamiyatiga ega bo'lgan er osti burg'ulash suvlarida brom miqdori 170 dan 700 mg / l gacha. Jami brom tarkibi er qobig'i 3*10-5% atomlar.
Ulanishlar yod
dengiz suvida mavjud, lekin shunchalik oz miqdordaki, ularni suvdan to'g'ridan-to'g'ri izolyatsiya qilish juda qiyin. Biroq, to'qimalarda yod to'playdigan ba'zi suv o'tlari mavjud, masalan, kelp. Bu alglarning kuli yod ishlab chiqarish uchun xom ashyo bo'lib xizmat qiladi. Yodning katta miqdori (10 dan 50 mg / l gacha) er osti burg'ulash suvlarida mavjud. Yer qobig'idagi yod miqdori 4*10-6% atomdan iborat. Yod tuzlarining kichik konlari - KIO 3 va KIO 4 - Chili va Boliviyada mavjud.
umumiy og'irlik astata yoqilgan globus 30 g dan oshmasligi taxmin qilinadi.
Jadval. Galogen atomlari va molekulalarining elektron tuzilishi va ayrim xossalari
|
Belgi element |
|||||
|
Ordinal Raqam |
|||||
|
Tuzilishi tashqi elektron qatlam |
2s 2 2p 5 |
3s 2 3p 5 |
4s 2 4p 5 |
5 s 2 5 p 5 |
6 s 2 6 p 5 |
|
Nisbiy elektro salbiy (EO) |
4,0 |
3,0 |
2,8 |
2,5 |
~2,2 |
|
Atom radiusi, nm |
0,064 |
0,099 |
0,114 |
0,133 |
– |
|
Darajalar oksidlanish |
1, +1, +3, |
– |
|||
|
Agregatsiya holati |
Och yashil |
Yashil-sariq. |
Buraya |
To'q binafsha |
Qora |
|
t °pl.(°S) |
219 |
101 |
114 |
227 |
|
|
t ° qaynash (°C) |
183 |
185 |
317 |
||
|
r (g/sm3) |
1,51 |
1,57 |
3,14 |
4,93 |
– |
|
Suvda eruvchanligi (g/100 g suv) |
reaksiyaga kirishadi |
2,5: 1 |
3,5 |
0,02 |
– |
|
Ism |
Atom tuzilishi diagrammasi |
Elektron formula |
|
Ftor |
F +9) 2) 7 |
… 2s 2 2p 5 |
|
Xlor |
Cl +17) 2) 8) 7 |
… 3s 2 3p 5 |
|
Brom |
Br +35) 2) 8) 18) 7 |
…4s 2 4p 5 |
|
Yod |
I +53) 2) 8) 18) 18) 7 |
…5s 2 5p 5 |
1) Tashqi energiya darajasining umumiy elektron konfiguratsiyasi nS 2 nP 5 .
2) Elementlarning atom sonining ko'payishi bilan atomlarning radiuslari ortadi, elektr manfiyligi pasayadi va metall xossalari(metall xossalari ortadi); galogenlar kuchli oksidlovchi moddalardir, elementlarning oksidlanish qobiliyati ortishi bilan kamayadi atom massasi.
3) Atom massasi ortishi bilan rang quyuqroq bo'ladi, erish va qaynash nuqtalari va zichlik oshadi.
GALOGENLAR OLISH
1. Galogenidlarning eritmalari va eritmalarini elektroliz qilish:
2NaCl + 2H 2 O = Cl 2 + H 2 + 2NaOH
2 KF = 2 K + F 2 (olishning yagona yo'li F 2)
2. Vodorod galogenidlarining oksidlanishi:
2 KMnO 4 +16 HCl =2 KCl +2 MnCl 2 +5 Cl 2 +8 H 2 O – Xlor ishlab chiqarishning laboratoriya usuli
14HBr+K 2 Cr 2 O 7 =2KBr+2CrBr 3 +3Br 2 +7H 2 O
MnO 2 + 4 HHal = MnHal 2 + Hal 2 + 2 H 2 O – Laboratoriya – (xlor, brom, yod ishlab chiqarish uchun)
3. Sanoat usuli - xlor bilan oksidlanish (brom va yod uchun):
2KBr+Cl 2 =2KCl+Br 2
2KI + Cl 2 = 2KCl + I 2
Kimyoviy xossalari
Misol tariqasida xlor yordamida galogenlarning xossalarini ko'rib chiqamiz:
|
1. Metallar bilan o'zaro ta'siri |
2K + Cl 2 →2KCl tajribasi Mg + Cl 2 → MgCl 2 |
|
2.Nometalllar bilan reaksiyalar |
H 2 + Cl 2 → 2HCl |
|
3. Sovuqda ishqorlar bilan o'zaro ta'siri |
2NaOH + Cl 2 → NaCl + NaClO + H 2 O |
|
4. Qizdirilganda ishqorlar bilan o'zaro ta'siri |
6NaOH + 3Cl 2 → 5NaCl + NaClO 3 + 3H 2 O |
|
5. Faolligi kam galogenlarning galogenidlardan siljishi |
2KBr + Cl 2 → 2KCl + Br 2 |
|
6. Suv bilan |
H 2 O + Cl 2 ↔ HCl + HClO (xlorli suv) |
GALOGENLARNING QO'LLANISHI
|
Ftor |
turli ftoridlar (SF 6, BF 3, WF 6 va boshqalar), shu jumladan ksenon (Xe) va kripton (Kr) asil gazlarining birikmalarini ishlab chiqarishda ftorlashtiruvchi vosita sifatida keng qo'llaniladi. Uran geksaftorid UF 6 uran (U) izotoplarini ajratish uchun ishlatiladi. Ftor teflon, boshqa ftoroplastlar, ftorli kauchuk, ftor o'z ichiga olgan ishlab chiqarishda ishlatiladi. organik moddalar va texnologiyada keng qo'llaniladigan materiallar, ayniqsa tajovuzkor muhitga qarshilik talab qilinadigan hollarda, yuqori harorat va h.k. |
|
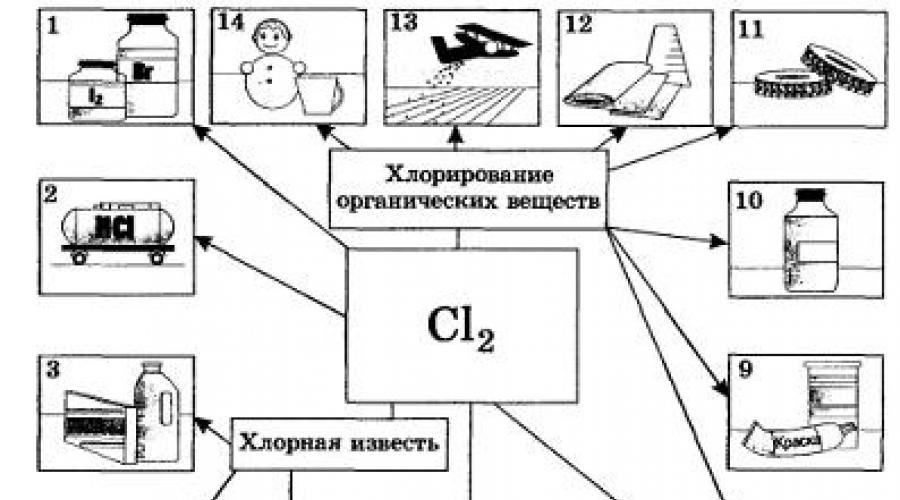
Xlor |
xlor o'z ichiga olgan organik birikmalar ishlab chiqarishda ishlatiladi (60-75%), noorganik moddalar(10-20%), tsellyuloza va gazlamalarni oqartirish uchun (5-15%), sanitariya ehtiyojlari va suvni zararsizlantirish (xlorlash) uchun. |
|
Brom |
brom analitik kimyoda bir qator noorganik va organik moddalarni olishda ishlatiladi. Brom birikmalari yonilg'i qo'shimchalari, pestitsidlar, olovni to'xtatuvchi moddalar sifatida va fotosuratda qo'llaniladi. Tarkibida brom borligi keng tarqalgan dorilar. Shuni ta'kidlash kerakki, "shifokor ovqatdan keyin bir osh qoshiq brom buyurdi" degan umumiy ibora, albatta, sof brom emas, balki natriy (yoki kaliy) bromidning suvli eritmasi buyurilganligini anglatadi. Bromid preparatlarining tinchlantiruvchi ta'siri ularning markaziy asab tizimidagi inhibisyon jarayonlarini kuchaytirish qobiliyatiga asoslanadi. |
|
Yod |
yod yuqori tozalikdagi titan (Ti), sirkoniy (Zr), gafniy (Hf), niobiy (Nb) va boshqa metallarni (metalllarni yodid bilan tozalash deb ataladi) olish uchun ishlatiladi. Yodidni qayta ishlash jarayonida aralashmalari bo'lgan asl metall uchuvchan yodidlar shakliga aylanadi, so'ngra hosil bo'lgan yodidlar issiq yupqa ipda parchalanadi. Ip oldindan tozalangan metalldan yasalgan bo'lib, u qayta ishlanadi. Uning harorati shunday tanlanganki, faqat tozalanayotgan metallning yodidi filamentda parchalanishi mumkin, qolgan yodidlar esa bug 'fazasida qoladi. |
TA'RIF
Galogenlar– VII A guruh elementlari – ftor (F), xlor (Cl), brom (Br) va yod (I).
Galogenlarning tashqi energiya darajasining elektron konfiguratsiyasi ns 2 np 5. Galogenlar energiya darajasini to'ldirishdan oldin faqat bitta elektronga ega bo'lmaganligi sababli, ORRda ular ko'pincha oksidlovchi moddalarning xususiyatlarini namoyish etadilar. Galogenlarning oksidlanish darajasi: “-1” dan “+7” gacha. Galogen guruhining yagona elementi ftor faqat bitta oksidlanish holatini "-1" ko'rsatadi va eng elektronegativ element hisoblanadi. Galogen molekulalari ikki atomli: F 2, Cl 2, Br 2, I 2.
Galogenlarning kimyoviy xossalari
Kimyoviy element atomi yadrosining zaryadining ortishi bilan, ya'ni. ftordan yodga o'tganda galogenlarning oksidlanish qobiliyati pasayadi, bu quyi halogenlarni gidrogal kislotalar va ularning tuzlaridan yuqoriroqlari bilan siqib chiqarish qobiliyati bilan tasdiqlanadi:
Br 2 + 2HI = I 2 + 2HBr;
Cl 2 + 2KBr = Br 2 + 2KCl.
Ftor eng katta kimyoviy faollikka ega. Ko'pchilik kimyoviy elementlar bilan ham xona harorati ftor bilan o'zaro ta'sir qiladi, chiqaradi katta miqdorda issiqlik. Hatto suv ftorda yonadi:
2H 2 O + 2F 2 = 4HF + O 2.
Erkin xlor ftorga qaraganda kamroq reaktivdir. Kislorod, azot va asil gazlar bilan bevosita reaksiyaga kirishmaydi. Ftor kabi boshqa barcha moddalar bilan o'zaro ta'sir qiladi:
2Fe + Cl 2 = 2FeCl 3;
2P + 5Cl 2 = 2PCl 5.
Xlor sovuqda suv bilan o'zaro ta'sir qilganda, teskari reaktsiya paydo bo'ladi:
Cl 2 + H 2 O↔HCl +HClO.
Reaksiya mahsulotlari aralashmasi xlorli suv deb ataladi.
Sovuqda xlor ishqorlar bilan o'zaro ta'sirlashganda, xloridlar va gipoxloritlar aralashmalari hosil bo'ladi:
Cl 2 + Ca(OH) 2 = Ca(Cl)OCl + H 2 O.
Xlorni issiq gidroksidi eritmasida eritganda quyidagi reaksiya sodir bo'ladi:
3Cl 2 + 6KOH = 5KCl + KClO 3 + 3H 2 O.
Brom, xlor kabi, suvda eriydi va u bilan qisman reaksiyaga kirishib, "bromli suv" deb ataladigan suvni hosil qiladi, yod esa suvda deyarli erimaydi.
Yod kimyoviy faolligi bilan boshqa galogenlardan sezilarli farq qiladi. Koʻpchilik nometallar bilan reaksiyaga kirishmaydi, faqat qizdirilganda metallar bilan sekin reaksiyaga kirishadi. Yodning vodorod bilan o'zaro ta'siri faqat kuchli isitish bilan sodir bo'ladi, bu reaktsiya endotermik va yuqori darajada qaytariladi:
H 2 + I 2 = 2HI - 53 kJ.
Galogenlarning fizik xossalari
No. ftor o'tkir hidli och sariq gazdir. Zaharli. Xlor och yashil gaz, xuddi ftor kabi, o'tkir hidga ega. Yuqori zaharli. Da yuqori qon bosimi va xona harorati osongina o'zgaradi suyuqlik holati. Brom - xarakterli yoqimsiz o'tkir hidli qizil-jigarrang og'ir suyuqlik. Suyuq brom, shuningdek, uning bug'lari juda zaharli hisoblanadi. Brom suvda yomon, qutbsiz erituvchilarda yaxshi eriydi. Yod to'q kulrang qattiq modda bo'lib, metall yaltiraydi. Yod bug'i binafsha rangga ega. Yod osongina sublimatsiya qiladi, ya'ni. suyuq holatni chetlab o'tib, qattiq holatdan gazsimon holatga aylanadi.
Galogenlarni ishlab chiqarish
Galogenlarni eritmalar yoki galogenid eritmalarini elektroliz qilish orqali olish mumkin:
MgCl 2 = Mg + Cl 2 (eritma).
Ko'pincha halogenlar gidrogal kislotalarning oksidlanish reaktsiyasi natijasida olinadi:
MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O;
K 2 Cr 2 O 7 + 14HCl \u003d 3Cl 2 + 2KCl + 2CrCl 3 + 7H 2 O;
2KMnO 4 +16HCl = 2MnCl 2 +5Cl 2 +8H 2 O +2KCl.
Galogenlarni qo'llash
Galogenlar turli xil mahsulotlarni ishlab chiqarish uchun xom ashyo sifatida ishlatiladi. Shunday qilib, ftor va xlor turli xil sintez uchun ishlatiladi polimer materiallar, ishlab chiqarishda xlor ham xom ashyo hisoblanadi xlorid kislotasi. Brom va yod topilgan keng qo'llanilishi tibbiyotda brom lak-bo'yoq sanoati tomonidan ham qo'llaniladi.
Muammoni hal qilishga misollar
MISOL 1
| Mashq qilish | Og'irligi 508 g bo'lgan yod hosil bo'lsa, kaliy yodid bilan reaksiyaga kirgan xlor hajmini (no) hisoblang. | ||||
| Yechim | Xlor va kaliy yodid o'rtasidagi reaksiya tenglamasini yozamiz: Cl 2 + 2KI = I 2 + 2KCl D.I. tomonidan kimyoviy elementlar jadvali yordamida hisoblangan yodning molyar massasi. Mendeleyev, teng - 254 g/mol. Hosil bo'lgan yod miqdorini topamiz: v(I 2) = m(I 2)/M(I 2) Galogenlar davriy jadvaldagi asil gazlarning chap tomonida joylashgan. Ushbu beshta zaharli metall bo'lmagan elementlar davriy jadvalning 7-guruhiga kiradi. Bularga ftor, xlor, brom, yod va astatin kiradi. Astatin radioaktiv bo'lib, faqat qisqa muddatli izotoplarga ega bo'lsa-da, u yod kabi harakat qiladi va ko'pincha halogen sifatida tasniflanadi. Galogen elementlar ettita valentlik elektronga ega bo'lganligi sababli, to'liq oktet hosil qilish uchun ularga faqat bitta qo'shimcha elektron kerak bo'ladi. Bu xususiyat ularni boshqa metall bo'lmagan guruhlarga qaraganda ko'proq reaktiv qiladi. umumiy xususiyatlarGalogenlar ikki atomli molekulalarni hosil qiladi (X2 turi, bu erda X halogen atomini bildiradi) - erkin elementlar shaklida galogenlar mavjudligining barqaror shakli. Ushbu diatomik molekulalarning aloqalari qutbsiz, kovalent va yagonadir. Galogenlarning kimyoviy xossalari ularni ko'pchilik elementlar bilan osongina birlashtirishga imkon beradi, shuning uchun ular tabiatda hech qachon birlashtirilmagan holda topilmaydi. Ftor eng faol halogen, eng kami esa astatin. Barcha galogenlar bir xil xossaga ega I guruh tuzlarini hosil qiladi. Bu birikmalarda galogenlar zaryadi -1 (masalan, Cl-, Br-) boʻlgan galogenid anionlari shaklida boʻladi. Tugashi -id galoid anionlari mavjudligini ko'rsatadi; masalan Cl- "xlorid" deb ataladi. Bundan tashqari, Kimyoviy xossalari halogenlar ularga oksidlovchi moddalar - oksidlovchi metallar sifatida harakat qilish imkonini beradi. Ko'pchilik kimyoviy reaksiyalar, unda galogenlar ishtirok etadi - suvli eritmada oksidlanish-qaytarilish. Galogenlar organik birikmalarda uglerod yoki azot bilan bitta bog' hosil qiladi, bu erda ularning oksidlanish darajasi (CO) -1 ga teng. Galogen atomi kovalent bog'langan vodorod atomi bilan almashtirilganda organik birikma, halo- prefiksi umumiy ma'noda yoki maxsus galogenlar uchun ftor-, xloro-, bromo-, yod- prefikslaridan foydalanish mumkin. Galogen elementlar qutbli kovalent yagona aloqalar bilan diatomik molekulalarni hosil qilish uchun o'zaro bog'lanishi mumkin. Xlor (Cl2) 1774 yilda kashf etilgan birinchi halogen bo'lib, undan keyin yod (I2), brom (Br2), ftor (F2) va astatin (At, oxirgi marta 1940 yilda kashf etilgan). "Galogen" nomi yunoncha hal- ("tuz") va -gen ("shakl qilish") ildizlaridan kelib chiqqan. Bu so'zlar birgalikda "tuz hosil qiluvchi" degan ma'noni anglatadi, bu galogenlarning tuzlar hosil qilish uchun metallar bilan reaksiyaga kirishishini ta'kidlaydi. Galit - natriy xlorid (NaCl) dan tashkil topgan tabiiy mineral bo'lgan tosh tuzining nomi. Va nihoyat, halogenlar kundalik hayotda qo'llaniladi - ftorid tish pastasida mavjud, xlor dezinfeksiya qiladi. ichimlik suvi, va yod qalqonsimon gormonlar ishlab chiqarishga yordam beradi. Kimyoviy elementlarFtor atom raqami 9 bo'lgan element bo'lib, F belgisi bilan belgilanadi. Ftor elementi birinchi marta 1886 yilda uni gidroftorik kislotadan ajratib olish orqali topilgan. Erkin holatda ftor ikki atomli molekula (F2) sifatida mavjud va er qobig'idagi eng ko'p galogendir. Ftor davriy jadvaldagi eng elektronegativ element hisoblanadi. Xona haroratida u och sariq rangli gazdir. Ftor ham nisbatan kichik atom radiusiga ega. Oksidlanish darajasi nolga teng bo'lgan elementar diatomik holatdan tashqari, CO -1 ga teng. Ftor juda reaktivdir va geliy (He), neon (Ne) va argondan (Ar) tashqari barcha elementlar bilan bevosita reaksiyaga kirishadi. H2O eritmasida gidroflorik kislota (HF) kuchsiz kislotadir. Ftor yuqori darajada elektronegativ bo'lsa-da, uning elektromanfiyligi kislotalikni aniqlamaydi; Ftorid ioni asosli (pH > 7) bo'lganligi sababli HF kuchsiz kislotadir. Bundan tashqari, ftor juda kuchli oksidlovchi moddalar ishlab chiqaradi. Masalan, ftor bilan reaksiyaga kirishishi mumkin inert gaz ksenon va kuchli oksidlovchi vosita ksenon diflorid (XeF2) hosil qiladi. Ftorid ko'p qo'llaniladi. Xlor - atom raqami 17 va kimyoviy belgisi Cl bo'lgan element. 1774 yilda uni xlorid kislotadan ajratib olish orqali kashf etilgan. Elementar holatda u ikki atomli Cl2 molekulasini hosil qiladi. Xlor bir nechta CO ga ega: -1, +1, 3, 5 va 7. Xona haroratida u och yashil gazdir. Ikki xlor atomi o'rtasida hosil bo'ladigan bog'lanish kuchsiz bo'lgani uchun Cl2 molekulasi birikmalar hosil qilish qobiliyatiga ega. Xlor metallar bilan reaksiyaga kirishib, xloridlar deb ataladigan tuzlarni hosil qiladi. Xlor ionlari dengiz suvida eng ko'p uchraydigan ionlardir. Xlorning ikkita izotopi ham bor: 35Cl va 37Cl. Natriy xlorid barcha xloridlarning eng keng tarqalgan birikmasidir. Brom - kimyoviy element atom raqami 35 va Br belgisi bilan. U birinchi marta 1826 yilda kashf etilgan. O'zining elementar shaklida brom ikki atomli molekula Br2. Xona haroratida u qizil-jigarrang suyuqlikdir. Uning CO lari -1, + 1, 3, 4 va 5. Brom yodga qaraganda faolroq, lekin xlorga qaraganda kamroq faol. Bundan tashqari, brom ikkita izotopga ega: 79Br va 81Br. Brom dengiz suvida erigan bromid tuzlari sifatida paydo bo'ladi. Orqada o'tgan yillar Dunyoda bromid ishlab chiqarish uning mavjudligi va uzoq saqlash muddati tufayli sezilarli darajada oshdi. Boshqa halogenlar singari, brom ham oksidlovchi moddadir va juda zaharli. Yod atom raqami 53 va I belgisiga ega kimyoviy elementdir. Yod oksidlanish darajalariga ega: -1, +1, +5 va +7. Ikki atomli molekula sifatida mavjud, I2. Xona haroratida u qattiq siyohrang. Yodning bitta barqaror izotopi bor - 127I. Birinchi marta 1811 yilda dengiz o'tlari va sulfat kislota yordamida kashf etilgan. Hozirgi vaqtda yod ionlarini dengiz suvida ajratib olish mumkin. Yod suvda unchalik erimasa ham, uning eruvchanligini alohida yodidlar yordamida oshirish mumkin. Yod organizmda muhim rol o'ynaydi, qalqonsimon bez gormonlarini ishlab chiqarishda ishtirok etadi. Astatin - atom raqami 85 va At belgisi bo'lgan radioaktiv element. Uning mumkin bo'lgan oksidlanish darajalari -1, +1, 3, 5 va 7. Ikki atomli molekula bo'lmagan yagona halogen. Oddiy sharoitlarda u qora metall qattiq moddadir. Astatin juda kam uchraydigan element, shuning uchun u haqida kam narsa ma'lum. Bundan tashqari, astatin juda ko'p qisqa muddat yarim yemirilish davri, bir necha soatdan oshmaydi. 1940 yilda sintez natijasida olingan. Astatin yodga o'xshaydi, deb ishoniladi. Metall xossalari bilan farqlanadi. Quyidagi jadvalda halogen atomlarining tuzilishi va elektronlarning tashqi qatlamining tuzilishi ko'rsatilgan. Elektronlarning tashqi qatlamining bunday tuzilishi galogenlarning fizik va kimyoviy xossalari o'xshashligini bildiradi. Biroq, bu elementlarni solishtirganda, farqlar ham kuzatiladi. Galogen guruhidagi davriy xususiyatlarJismoniy xususiyatlar oddiy moddalar halogenlar elementning atom soni ortishi bilan o'zgaradi. Yaxshiroq tushunish va aniqroq bo'lish uchun biz sizga bir nechta jadvallarni taklif qilamiz. Guruhning erish va qaynash nuqtalari molekulyar hajmining oshishi bilan ortadi (F 1-jadval. Galogenlar. Fizik xususiyatlari: erish va qaynash nuqtalari Yadro hajmi oshadi (F< Cl < Br < I < At), так как увеличивается число протонов и нейтронов. Кроме того, с каждым периодом добавляется всё больше уровней энергии. Это приводит к большей орбитали, и, следовательно, к увеличению радиуса атома. 2-jadval. Galogenlar. Fizik xossalari: atom radiuslari Agar tashqi valent elektronlar yadro yaqinida joylashmasa, ularni undan olib tashlash uchun ko'p energiya talab qilinmaydi. Shunday qilib, tashqi elektronni chiqarish uchun zarur bo'lgan energiya elementlar guruhining pastki qismida unchalik yuqori emas, chunki u erda ko'proq energiya darajalari mavjud. Bundan tashqari, yuqori ionlanish energiyasi elementning metall bo'lmagan sifatlarini namoyon etishiga olib keladi. Yod va displey astatin metall xossalarini namoyon qiladi, chunki ionlanish energiyasi kamayadi (At< I < Br < Cl < F). Jadval 3. Galogenlar. Fizik xossalari: ionlanish energiyasi Atomdagi valent elektronlar soni asta-sekin pastroq darajadagi energiya darajasining oshishi bilan ortadi. Elektronlar asta-sekin yadrodan uzoqlashadi; Shunday qilib, yadro va elektronlar bir-biriga tortilmaydi. Himoyalashning ortishi kuzatiladi. Shuning uchun elektron manfiylik davr ortishi bilan kamayadi (At< I < Br < Cl < F). Jadval 4. Galogenlar. Fizik xususiyatlari: elektronegativlik Atom hajmi ortib borishi bilan elektronning yaqinligi pasayadi (B< I < Br < F < Cl). Исключение – фтор, сродство которого меньше, чем у хлора. Это можно объяснить меньшим размером фтора по сравнению с хлором. Jadval 5. Galogenlarning elektronga yaqinligi Galogenlarning reaktivligi davr ortishi bilan kamayadi (At Galogen boshqa, kamroq elektron manfiy element bilan ikkilik birikma hosil qilganda, galogenid hosil bo'ladi. Vodorod galogenlar bilan reaksiyaga kirishib, HX shaklidagi galogenidlarni hosil qiladi: Vodorod galogenidlari suvda oson eriydi va gidrogal kislota (gidroflorik, xlorid, gidrobromik, gidroiyod) kislota hosil qiladi. Bu kislotalarning xossalari quyida keltirilgan. Kislotalar quyidagi reaksiya natijasida hosil boʻladi: HX (aq) + H2O (l) → X- (aq) + H3O+ (oq). Barcha galogen vodorodlar kuchli kislotalar hosil qiladi, HF dan tashqari. Hidrogal kislotalarning kislotaligi ortadi: HF Hidroflorik kislota uzoq vaqt davomida shisha va ba'zi noorganik ftoridlarni ishqalashi mumkin. HF ning eng zaif gidrogal kislotasi ekanligi noto'g'ri tuyulishi mumkin, chunki ftor eng yuqori elektronegativlikka ega. Biroq, H-F aloqasi juda kuchli, natijada juda zaif kislota hosil bo'ladi. Kuchli bog'lanish qisqa bog'lanish uzunligi va yuqori dissotsiatsiya energiyasi bilan belgilanadi. Barcha vodorod galogenidlari ichida HF eng qisqa bog'lanish uzunligiga va eng yuqori bog'lanishning dissotsilanish energiyasiga ega. Galogen okso kislotalar vodorod, kislorod va halogen atomlari bo'lgan kislotalardir. Ularning kislotaliligini tizimli tahlil qilish orqali aniqlash mumkin. Galogen okso kislotalar quyida keltirilgan: Ushbu kislotalarning har birida proton kislorod atomiga bog'langan, shuning uchun proton bog'lanish uzunligini taqqoslash bu erda foydali emas. Bu erda elektronegativlik asosiy rol o'ynaydi. Kislota faolligi markaziy atom bilan bog'langan kislorod atomlari soni bilan ortadi. Galogenlarning asosiy fizik xossalarini quyidagi jadvalda umumlashtirish mumkin. Galogenlarning rangi molekulalar tomonidan ko'rinadigan yorug'likning yutilishidan kelib chiqadi, bu esa elektronlarning qo'zg'alishiga olib keladi. Ftorid binafsha nurni yutadi va shuning uchun ochiq sariq rangda ko'rinadi. Yod esa sariq nurni yutadi va binafsha rangga o'xshaydi (sariq va binafsha ranglar bir-birini to'ldiruvchi ranglardir). Davr o'sishi bilan galogenlarning rangi quyuqroq bo'ladi. Yopiq idishlarda suyuq brom va qattiq yod bug'lari bilan muvozanatda bo'lib, rangli gaz shaklida kuzatilishi mumkin. Astatinning rangi noma'lum bo'lsa-da, kuzatilgan naqshga ko'ra, u yoddan (ya'ni, qora) quyuqroq deb taxmin qilinadi. Endi, agar sizdan: "Galogenlarning fizik xususiyatlarini tavsiflang" deb so'ralsa, siz aytadigan narsangiz bo'ladi. Oksidlanish soni ko'pincha halogen valentlik tushunchasi o'rniga ishlatiladi. Odatda, oksidlanish darajasi -1 ga teng. Ammo agar halogen kislorod yoki boshqa halogen bilan bog'langan bo'lsa, u boshqa holatlarni olishi mumkin: kislorod CO -2 ustunlik qiladi. Ikki xil halogen atomlari bir-biriga bog'langan bo'lsa, ko'proq elektronegativ atom ustunlik qiladi va CO -1 ni qabul qiladi. Masalan, yod xloridda (ICl) xlor CO -1 va yod +1 ga ega. Xlor yoddan ko'ra ko'proq elektronegativdir, shuning uchun uning CO -1 ga teng. Brom kislotasida (HBrO4) kislorod CO -8 (-2 x 4 atom = -8) ga ega. Vodorodning umumiy oksidlanish darajasi +1 ga teng. Ushbu qiymatlarni qo'shish CO -7 ni beradi. Murakkabning oxirgi CO si nolga teng bo'lishi kerakligi sababli, bromning CO si +7 ga teng. Qoidaning uchinchi istisnosi - elementar shakldagi halogenning oksidlanish darajasi (X2), bu erda uning CO nolga teng. Elektromanfiylik davr ortishi bilan ortadi. Shuning uchun ftor barcha elementlarning eng yuqori elektromanfiyligiga ega, bu uning davriy jadvaldagi holatidan dalolat beradi. Uning elektron konfiguratsiyasi 1s2 2s2 2p5. Agar ftor boshqa elektronga ega bo'lsa, eng tashqi p orbitallar to'liq to'ldiriladi va to'liq oktet hosil qiladi. Ftor yuqori elektromanfiylikka ega bo'lganligi sababli, u qo'shni atomdan elektronni osongina olishi mumkin. Bu holda ftor inert gazga (sakkiz valent elektronga ega) izoelektronik bo'lib, uning barcha tashqi orbitallari to'ldiriladi. Bu holatda ftor ancha barqaror. Tabiatda galogenlar anion holatida bo'ladi, shuning uchun erkin galogenlar elektroliz yoki oksidlovchi moddalar yordamida oksidlanish yo'li bilan olinadi. Masalan, xlor osh tuzi eritmasining gidrolizi natijasida hosil bo'ladi. Galogenlar va ularning birikmalaridan foydalanish xilma-xildir. TA'RIF Galogenlar– VIIA guruhi elementlari – ftor (F), xlor (Cl), brom (Br) va yod (I). Galogenlarning tashqi energiya darajasining elektron konfiguratsiyasi ns 2 np 5. Galogenlar energiya darajasini to'ldirishdan oldin faqat bitta elektronga ega bo'lmaganligi sababli, ORRda ular ko'pincha oksidlovchi moddalarning xususiyatlarini namoyish etadilar. Galogenlarning oksidlanish darajasi: “-1” dan “+7” gacha. Galogen guruhining yagona elementi ftor faqat bitta oksidlanish holatini "-1" ko'rsatadi va eng elektronegativ element hisoblanadi. Galogen molekulalari ikki atomli: F 2, Cl 2, Br 2, I 2. Kimyoviy element atomi yadrosining zaryadining ortishi bilan, ya'ni. ftordan yodga o'tganda galogenlarning oksidlanish qobiliyati pasayadi, bu quyi halogenlarni gidrogal kislotalar va ularning tuzlaridan yuqoriroqlari bilan siqib chiqarish qobiliyati bilan tasdiqlanadi: Br 2 + 2HI = I 2 + 2HBr Cl 2 + 2KBr = Br 2 + 2KCl No. ftor o'tkir hidli och sariq gazdir. Zaharli. Xlor och yashil gaz, xuddi ftor kabi, o'tkir hidga ega. Yuqori zaharli. Yuqori bosim va xona haroratida u osongina suyuq holatga aylanadi. Brom - xarakterli yoqimsiz o'tkir hidli qizil-jigarrang og'ir suyuqlik. Suyuq brom, shuningdek, uning bug'lari juda zaharli hisoblanadi. Brom suvda yomon, qutbsiz erituvchilarda yaxshi eriydi. Yod to'q kulrang qattiq modda bo'lib, metall yaltiraydi. Yod bug'i binafsha rangga ega. Yod osongina sublimatsiya qiladi, ya'ni. suyuq holatni chetlab o'tib, qattiq holatdan gazsimon holatga aylanadi. Galogenlarni eritmalar yoki galogenid eritmalarini elektroliz qilish orqali olish mumkin: MgCl 2 = Mg + Cl 2 (eritma) Ko'pincha halogenlar gidrogal kislotalarning oksidlanish reaktsiyasi natijasida olinadi: MnO 2 + 4HCl = MnCl 2 + Cl 2 +2H 2 O K 2 Cr 2 O 7 + 14HCl = 3Cl 2 + 2KCl +2CrCl 3 +7H 2 O 2KMnO 4 +16HCl = 2MnCl 2 +5Cl 2 +8H 2 O +2KCl Ftor eng katta kimyoviy faollikka ega. Ko'pgina kimyoviy elementlar, hatto xona haroratida ham, ftor bilan o'zaro ta'sir qiladi va katta miqdorda issiqlik chiqaradi. Hatto suv ftorda yonadi: 2H 2 O + 2F 2 = 4HF + O 2 Erkin xlor ftorga qaraganda kamroq reaktivdir. Kislorod, azot va asil gazlar bilan bevosita reaksiyaga kirishmaydi. Ftor kabi boshqa barcha moddalar bilan o'zaro ta'sir qiladi: 2Fe + Cl 2 = 2FeCl 3 2P + 5Cl 2 = 2PCl 5 Xlor sovuqda suv bilan o'zaro ta'sir qilganda, teskari reaktsiya paydo bo'ladi: Cl 2 + H 2 O↔HCl +HClO Reaksiya mahsulotlari aralashmasi xlorli suv deb ataladi. Sovuqda xlor ishqorlar bilan o'zaro ta'sirlashganda, xloridlar va gipoxloritlar aralashmalari hosil bo'ladi: Cl 2 + Ca(OH) 2 = Ca(Cl)OCl + H 2 O Xlorni issiq gidroksidi eritmasida eritganda quyidagi reaksiya sodir bo'ladi: 3Cl 2 + 6KOH=5KCl +KClO 3 +3H 2 O Brom, xlor kabi, suvda eriydi va u bilan qisman reaksiyaga kirishib, "bromli suv" deb ataladigan suvni hosil qiladi, yod esa suvda deyarli erimaydi. Yod kimyoviy faolligi bilan boshqa galogenlardan sezilarli farq qiladi. Koʻpchilik nometallar bilan reaksiyaga kirishmaydi, faqat qizdirilganda metallar bilan sekin reaksiyaga kirishadi. Yodning vodorod bilan o'zaro ta'siri faqat kuchli isitish bilan sodir bo'ladi, bu reaktsiya endotermik va yuqori darajada qaytariladi: H 2 + I 2 = 2HI - 53 kJ. MISOL 1 Cl 2 + 2KI = I 2 + 2KCl Hosil bo'lgan yod miqdorini topamiz: v(I 2)=m(I 2)/M(I 2) v(I 2)=508/254=2 mol Reaksiya tenglamasiga ko'ra, xlor moddasining miqdori. >> Kimyo: galogenlar ishlab chiqarish. Galogenlar va ularning birikmalarining biologik ahamiyati va qo'llanilishi Galogenlarni ishlab chiqarish
. Ftor va xlor eritmalar yoki ularning tuzlari eritmalarini elektroliz qilish orqali olinadi. Masalan, elektr | jarayoni Eritilgan natriy xloridning trolizini quyidagi tenglama bilan aks ettirish mumkin: Ammo agar vodorodni boshqa, qulayroq va arzonroq usullar bilan, masalan, tabiiy gazdan olish mumkin bo'lsa, natriy gidroksid deyarli faqat xlor kabi osh tuzining eritmasini elektroliz qilish orqali olinadi. Brom va yod sanoatda mos ravishda bromidlar va yodidlardan siljish reaktsiyasi natijasida ishlab chiqariladi. Galogenlarning biologik ahamiyati.
Ularning arizasi. Ko‘p markali tish pastalarining yorliqlarida ularning tarkibidagi ftorid borligini ko‘rsatib qo‘yganini sezmay qolamaysiz – albatta, erkin ftorid emas, balki uning birikmalari. Tish emali va suyaklarini qurishda ishtirok etadigan ushbu muhim komponent tufayli tish kariyesi kabi kasalliklarning oldini oladi. Bundan tashqari, ftor bezlar, mushaklar va asab hujayralarida metabolik jarayonlarda zarur element hisoblanadi. Ftor sanoat ishlab chiqarishida ham muhim ahamiyatga ega, uning asosiy iste'molchilari atom sanoati va elektrotexnikadir. Uning birikmasi Na3AlF6 (u nima deb ataladi?) alyuminiy ishlab chiqarish uchun ishlatiladi. Kundalik hayotda esa ftor o'z ichiga olgan plastmassa - Teflon nomi bilan atalgan teflon idishlari tobora ko'proq foydalanilmoqda. Xlor- kimyoviy elementlardan biri, ularsiz tirik organizmlarning mavjudligini tasavvur qilib bo'lmaydi. Uning asosiy shakli. tanaga natriy xlorid kiradi. U metabolizmni, soch o'sishini rag'batlantiradi, kuch va quvvat beradi. Ko'p NaCl qon plazmasida topiladi. Oshqozon shirasining bir qismi bo'lgan HC1 xlorid kislotasi ovqat hazm qilishda alohida rol o'ynaydi. 0,2% HCl bo'lmasa, oziq-ovqat hazm qilish jarayoni amalda to'xtaydi. Va deyarli barcha oziq-ovqat mahsulotlarida ma'lum miqdorda osh tuzi mavjud bo'lsa-da, odam har kuni ovqatga taxminan 20 g tuz qo'shishga majbur. Sanoatda foydalanish nuqtai nazaridan xlor barcha halogenlardan ancha yuqori. Xlor va uning birikmalari zig'ir va paxta matolari, qog'oz va boshqalarni oqartirish uchun zarurdir. Ayniqsa, uning ko'p qismi plastik, kauchuk, bo'yoq va erituvchilar ishlab chiqarish uchun organik sintezda iste'mol qilinadi (20-rasm). Qishloq xo'jaligi zararkunandalariga qarshi kurashda ko'plab xlorli birikmalar qo'llaniladi. Xlor ichimlik suvini zararsizlantirish uchun ko'p miqdorda iste'mol qilinadi, garchi salbiy oqibatlarga olib kelmasa ham (qaysi moddadan bu maqsadda foydalanish xavfsizroq?). Rangli metallurgiyada xlorlash yoʻli bilan rudalardan ayrim metallar (titan, niobiy, tantal) olinadi. Xlor kimyoviy urush agenti sifatida harbiy maqsadlarda ham foydalanishni topdi. Keyinchalik u boshqa, samaraliroq xlor o'z ichiga olgan zaharli moddalar bilan almashtirildi, masalan, fosgen COCl2. Xlor hayot va sog'liq uchun juda xavfli modda - dioksin tarkibida mavjud. Xlor birikmalari Yerning ozon qatlamining buzilishining sabablaridan biridir. Yana bir halogen, brom ham inson tanasi uchun juda muhimdir. Ushbu elementning birikmalari markaziy asab tizimining qo'zg'alish va inhibe qilish jarayonlarini tartibga soladi, shuning uchun asab kasalliklarini (uyqusizlik, isteriya, nevrasteniya va boshqalar) davolash uchun shifokorlar "brom" - brom o'z ichiga olgan dorilarni buyuradilar. Brom ba'zi o'simliklar, shu jumladan dengiz o'tlari tomonidan faol ravishda to'planadi. Sayyoramizdagi bromning katta qismi dengizda to'plangan va dengiz bromning asosiy yetkazib beruvchisi bo'lib xizmat qiladi. Hisob-kitoblarga ko'ra, har yili dengiz suvi bilan birga havoga taxminan 4 million tonna brom chiqariladi. Ko'rinib turibdiki, qirg'oqbo'yi hududlari havosidagi uning miqdori dengizdan uzoq hududlarga qaraganda har doim yuqori bo'ladi. Bu dengiz havosidan nafas olish juda foydali bo'lishining sabablaridan biridir. Brom, aniqrog'i kumush bromidi AgBr fotografiyada bir xil darajada muhim rol o'ynaydi. Fotosurat bilan shug'ullanadiganlar, ehtimol, fotografik qog'oz turlarining nomlarini darhol eslab qolishadi - "Uni-brom", "Brom-portret" va boshqalar. Fotografik qog'ozda jelatin yordamida unga qo'llaniladigan kumush bromid qatlami mavjud bo'lib, u ostida oson parchalanadi. yorug'lik ta'siri: 2AgBr = 2Ag + Br2 Va nihoyat, biz ko'rib chiqayotgan galogenlarning oxirgisi - yod - bu elementsiz inson yashay olmaydi: uning suv va oziq-ovqat etishmasligi qalqonsimon bez gormoni ishlab chiqarishni kamaytiradi va endemik guatrga olib keladi. Qalqonsimon gormonning tartibga soluvchi ta'siri mushaklarning uyg'onishi, yurak urishi, ishtaha, ovqat hazm qilish, miya funktsiyasi va inson temperamentini o'z ichiga oladi. Yod tanaga oziq-ovqat bilan kiradi: non, tuxum, sut, suv, dengiz o'tlari va nafas olayotganda havo (ayniqsa dengiz havosi). Yaralarni davolash uchun yod damlamasi deb ataladigan yodning spirtli eritmasi (5-10%) ishlatiladi. Yod ko'plab dorilar tarkibiga kiradi. Yodning asosiy iste'molchilari farmatsevtika va kimyo sanoati, shuningdek, fotosensitiv fotomateriallar ishlab chiqarishdir. 1. Eritmalar va tuz eritmalarini elektroliz qilish orqali galogenlarni olish. 2. Galogenlarning biologik ahamiyati. 3. Xlor va ftor, xlor va yod birikmalaridan foydalanish. Tarkibida 2% aralashma bo‘lgan 585 g natriy xloridni elektroliz qilish natijasida qanday hajmdagi xlor (no.) va qanday massa natriy olish mumkin? Oldingi masalada massasini aniqlagan natriydan necha gramm 40% li ishqor eritmasini olish mumkinligini hisoblang. Fransuz kimyogari Scheele xlorni marganets (IV) oksidning xlorid kislota bilan reaksiyasidan oldi. Bu reaksiya natijasida marganets (II) xlorid va suv ham hosil bo'ladi. Ushbu reaksiya uchun tenglamani yozing, oksidlanish-qaytarilish jarayonlarini ko'rib chiqing va marganets (IV) oksidi massasini va 100 litr xlor (n.o.) olish uchun zarur bo'lgan vodorod xlorid miqdorini hisoblang, agar uning unumi nazariy jihatdan mumkin bo'lganidan 95% bo'lsa. Galogenlarning inson hayotidagi ijobiy va salbiy ahamiyati haqida xabar tayyorlang. |
