Elektronning asosiy xossalari. Elektron nimadan iborat? Elektronning massasi va zaryadi. Elektronning asosiy va kvant xossalari
Shuningdek o'qing
Elektron - elementar zarracha bo'lib, u moddaning tuzilishidagi asosiy birliklardan biridir. Elektron zaryadi manfiy. Eng aniq o'lchovlar yigirmanchi asrning boshlarida Millikan va Ioffe tomonidan amalga oshirilgan.
Elektron zaryadi minus 1,602176487 (40)*10 -1 9 S ga teng.
Boshqa eng kichik zarralarning elektr zaryadi bu qiymat orqali o'lchanadi.
Elektron haqida umumiy tushuncha
Zarrachalar fizikasi elektronning bo'linmas va hech qanday tuzilishga ega emasligini aytadi. U elektromagnit va tortishish jarayonlarida ishtirok etadi va xuddi uning antizarrasi - pozitron kabi lepton guruhiga kiradi. Boshqa leptonlar orasida u eng engil vaznga ega. Agar elektronlar va pozitronlar to'qnashsa, bu ularning nobud bo'lishiga olib keladi. Bunday juftlik zarrachalarning gamma kvantidan kelib chiqishi mumkin.
Neytrinolarni o'lchashdan oldin elektron eng engil zarracha hisoblangan. Kvant mexanikasida u fermion sifatida tasniflanadi. Elektron magnit momentga ham ega. Agar unga pozitron ham kiritilgan bo'lsa, u holda pozitron musbat zaryadli zarrachaga bo'linadi va elektron manfiy zaryadli zarracha sifatida negatron deb ataladi.

Elektronlarning tanlangan xossalari
Elektronlar zarrachalar va to'lqinlarning xususiyatlariga ega bo'lgan leptonlarning birinchi avlodi sifatida tasniflanadi. Ularning har biri energiya, spin orientatsiyasi va boshqa parametrlarni o'lchash orqali aniqlanadigan kvant holatiga ega. Uning fermionlarga mansubligi bir vaqtning o'zida bir xil kvant holatida ikkita elektronga ega bo'lishning mumkin emasligi orqali aniqlanadi (Pauli printsipiga ko'ra).
U xuddi davriy kristall potentsialdagi kvazizarra bilan bir xil tarzda o'rganiladi, uning samarali massasi tinch holatda bo'lgan massadan sezilarli darajada farq qilishi mumkin.
Elektronlarning harakati orqali elektr toki, magnitlanish va termal emf paydo bo'ladi. Harakatdagi elektronning zaryadi magnit maydon hosil qiladi. Biroq, tashqi magnit maydon zarrachani to'g'ri yo'nalishdan buradi. Tezlashtirilganda elektron foton sifatida energiyani yutish yoki chiqarish qobiliyatiga ega bo'ladi. Uning ko'pligi elektron atom qobiqlaridan iborat bo'lib, ularning soni va holati kimyoviy xossalarini aniqlaydi.
Atom massasi asosan yadro protonlari va neytronlaridan iborat, elektronlar massasi esa umumiy atom massasining taxminan 0,06% ni tashkil qiladi. Elektr Kulon kuchi elektronni yadroga yaqin tuta oladigan asosiy kuchlardan biridir. Ammo atomlardan molekulalar yaratilganda va kimyoviy bog'lanishlar paydo bo'lganda, elektronlar hosil bo'lgan yangi bo'shliqda qayta taqsimlanadi.
Nuklonlar va adronlar elektronlarning paydo bo'lishida ishtirok etadilar. Radioaktiv xususiyatlarga ega izotoplar elektron chiqarishga qodir. Laboratoriya sharoitida bu zarralarni maxsus asboblarda o'rganish mumkin, masalan, teleskoplar plazma bulutlarida ulardan nurlanishni aniqlay oladi.

Ochilish
Elektronni nemis fiziklari 19-asrda nurlarning katod xossalarini oʻrganayotganlarida kashf qilishgan. Keyin boshqa olimlar uni alohida zarracha darajasiga ko'tarib, batafsilroq o'rganishga kirishdilar. Radiatsiya va boshqa tegishli fizik hodisalar o'rganildi.
Masalan, Tomson boshchiligidagi guruh elektronning zaryadini va katod nurining massasini hisoblab chiqdi, ularning aloqasi, ular topganidek, moddiy manbaga bog'liq emas.
Va Bekkerel minerallar o'z-o'zidan nurlanishni va ularning beta nurlari elektr maydonining ta'sirida burilishga qodirligini va massa va zaryad katod nurlari bilan bir xil munosabatni saqlab qolishini aniqladi.

Atom nazariyasi
Bu nazariyaga ko'ra, atom yadro va uning atrofida bulutda joylashgan elektronlardan iborat. Ular energiyaning ma'lum kvantlangan holatlarida bo'lib, ularning o'zgarishi fotonlarni yutish yoki chiqarish jarayoni bilan birga keladi.
Kvant mexanikasi
Yigirmanchi asrning boshlarida gipoteza ishlab chiqilgan bo'lib, unga ko'ra moddiy zarralar ham zarrachalarning, ham to'lqinlarning xususiyatlariga ega. Yorug'lik to'lqin (u de Broyl to'lqini deb ataladi) va zarrachalar (fotonlar) shaklida ham paydo bo'lishi mumkin.
Natijada, elektron to'lqinlarning tarqalishini tavsiflovchi mashhur Shredinger tenglamasi shakllantirildi. Ushbu yondashuv kvant mexanikasi deb ataladi. U vodorod atomidagi energiyaning elektron holatlarini hisoblash uchun ishlatilgan.
Elektronning asosiy va kvant xossalari
Zarracha fundamental va kvant xossalarini namoyon qiladi.
Asosiy bo'lganlarga massa (9,109 * 10 -31 kilogramm), elementar elektr zaryadi (ya'ni zaryadning minimal qismi) kiradi. Bugungi kunga qadar olib borilgan o'lchovlarga ko'ra, elektronda uning pastki tuzilishini ochib beradigan elementlar yo'q. Ammo ba'zi olimlar uni nuqtaga o'xshash zaryadlangan zarracha deb hisoblashadi. Maqolaning boshida ta'kidlanganidek, elektron elektr zaryadi -1,602 * 10 -19 S ni tashkil qiladi.

Elektron zarracha bo'lsa-da, bir vaqtning o'zida to'lqin bo'lishi mumkin. Ikki tirqish bilan o'tkazilgan tajriba uning ikkalasidan bir vaqtning o'zida o'tish imkoniyatini tasdiqlaydi. Bu bir vaqtning o'zida faqat bitta yoriqdan o'tish mumkin bo'lgan zarrachaning xususiyatlariga zid keladi.
Elektronlar bir xil fizik xususiyatlarga ega deb hisoblanadi. Shuning uchun ularning kvant mexanikasi nuqtai nazaridan qayta joylashishi tizim holatining o'zgarishiga olib kelmaydi. Elektron to'lqin funktsiyasi antisimmetrikdir. Shuning uchun, bir xil elektronlar bir xil kvant holatiga tushganda, uning eritmalari yo'qoladi (Pauli printsipi).
Elektronning o'ziga xos zaryadini (ya'ni nisbati) birinchi bo'lib 1897 yilda Tomson rasmda ko'rsatilgan tushirish trubkasi yordamida o'lchagan. 74.1. A anodidagi teshikdan chiqadigan elektron nurlar (katod nurlari; 85-§ ga qarang) tekis kondensator plitalari orasidan o'tib, lyuminestsent ekranga tegib, uning ustida yorug'lik nuqtasi hosil qildi.
Kondensator plitalariga kuchlanish qo'llash orqali deyarli bir xil elektr maydoni bilan nurga ta'sir qilish mumkin edi. Naycha elektromagnit qutblari orasiga qo'yilgan bo'lib, uning yordamida elektron yo'lining bir xil qismida elektrga perpendikulyar bir xil magnit maydon hosil qilish mumkin edi (bu maydonning maydoni 2-rasmda aylantirilgan). . 74.1 nuqtali doira bilan). Maydonlar o'chirilganda, nur O nuqtasida ekranga urildi. Maydonlarning har biri alohida-alohida nurning vertikal yo'nalishda siljishiga olib keldi. O'zgartirish qiymatlari oldingi paragrafda olingan (73.3) va (73.4) formulalar bo'yicha aniqlanadi.
Magnit maydonni yoqish va undan kelib chiqqan nur izining siljishini o'lchash orqali
![]()
Tomson elektr maydonini ham yoqdi va uning qiymatini shunday tanladiki, nur yana O nuqtasiga tegdi. Bu holda elektr va magnit maydonlar nurning elektronlariga bir vaqtning o'zida teng, lekin qarama-qarshi yo'naltirilgan kuchlar bilan ta'sir ko'rsatdi. Bunday holda, shart bajarildi
(74.1) va (74.2) tenglamalarni birgalikda yechish, Tomson ni hisoblab chiqdi.
Bush elektronlarning o'ziga xos zaryadini aniqlash uchun magnit fokuslash usulidan foydalangan. Ushbu usulning mohiyati quyidagicha. Faraz qilaylik, bir xil magnit maydonda maydon yo'nalishiga nisbatan simmetrik, bir xil tezlikda v bo'lgan bir oz ajralgan elektronlar nurlari ma'lum bir nuqtadan uchib chiqadi. Elektronlarni chiqarish yo'nalishlari B yo'nalishi bo'lgan kichik a burchaklarni hosil qiladi. 72-§da elektronlar bu holda spiral traektoriyalar bo'ylab harakatlanishi va bir vaqtning o'zida yakunlanishi aniqlandi.
![]()
ga teng masofada to'liq aylanish va maydon yo'nalishi bo'ylab siljish
![]()

A burchakning kichikligi tufayli turli elektronlar uchun masofalar (74.3) amalda bir xil va teng (kichik burchaklar uchun) bo'lib chiqadi. Shunday qilib, bir oz ajralgan nur elektron chiqarish nuqtasidan uzoqda joylashgan nuqtaga qaratiladi.
![]()
Bush tajribasida issiq katod K (74.2-rasm) chiqaradigan elektronlar K katod va A anod o'rtasida qo'llaniladigan potentsial farq U orqali tezlashtiriladi. Natijada ular u tezlikka ega bo'lib, uning qiymatini quyidagidan topish mumkin. munosabat
Keyin anoddagi teshikdan uchib chiqqan elektronlar solenoid ichiga kiritilgan evakuatsiya qilingan trubaning o'qi bo'ylab yo'naltirilgan tor nurni hosil qiladi. Solenoidning kirish qismida o'zgaruvchan kuchlanish qo'llaniladigan kondansatör o'rnatilgan. Kondensator tomonidan yaratilgan maydon nurning elektronlarini qurilmaning o'qidan vaqt o'tishi bilan o'zgarib turadigan a kichik burchaklarida buradi. Bu nurning "aylanishi" ga olib keladi - elektronlar turli spiral traektoriyalar bo'ylab harakatlana boshlaydi. Solenoidning chiqishiga lyuminestsent ekran o'rnatilgan. Agar biz B magnit induksiyasini tanlasak, kondansatördan ekrangacha bo'lgan masofa G shartni qondiradi.
(l - spiralning qadami, butun son), keyin elektron traektoriyalarining kesishish nuqtasi ekranga tushadi - elektron nurlar shu nuqtada fokuslanadi va ekranda o'tkir yorug'lik nuqtasini qo'zg'atadi. Agar (74.6) shart bajarilmasa, ekrandagi yorug'lik nuqtasi xira bo'ladi. (74.4), (74.5) va (74.6) tenglamalarni birgalikda yechib, topishimiz mumkin.
Turli usullar bilan olingan natijalarni hisobga olgan holda o'rnatilgan maxsus elektron zaryadining eng aniq qiymati tengdir
Qiymat (74.7) elektron zaryadining uning tinch massasiga nisbatini beradi. Tomson, Bush va shunga o'xshash boshqa tajribalarda zaryadning relativistik massaga nisbati tengligi aniqlandi.
![]()

Tomson tajribalarida elektron tezligi taxminan 0,1 s edi. Bunday tezlikda relativistik massa qolgan massadan 0,5% ga oshadi. Keyingi tajribalarda elektron tezligi juda yuqori qiymatlarga yetdi. Barcha holatlarda v ning ortishi bilan o'lchangan qiymatlarning pasayishi aniqlandi, bu formula (74.8) ga to'liq mos keladi.
Elektronning zaryadi 1909 yilda Millikan tomonidan katta aniqlik bilan aniqlangan. Millikan gorizontal joylashgan kondansatör plitalari orasidagi yopiq bo'shliqqa mayda yog' tomchilarini kiritgan (74.3-rasm). Chayqalganda, tomchilar elektrlashtirildi va ular kondansatkichdagi kuchlanishning qiymati va belgisini tanlash orqali harakatsiz joylashtirilishi mumkin edi.
Muvozanat sharoitda yuzaga keldi
bu erda tomchining zaryadi, P - tortishish va Arximed kuchining natijasi, ga teng.
![]() (74.10)
(74.10)
(- tomchilar zichligi, - uning radiusi, - havo zichligi).
Formulalardan (74.9) va (74.10) ni bilib, topish mumkin edi. Radiusni aniqlash uchun maydon bo'lmaganda bir xil tomchi tushish tezligi o'lchandi. Tomchining bir tekis harakati P kuchini qarshilik kuchi bilan muvozanatlash sharti bilan o'rnatiladi (1-jildning formulasiga (78.1) qarang; - havo yopishqoqligi):
![]() (74.11)
(74.11)
Tomchining harakati mikroskop yordamida kuzatilgan. O'lchov uchun mikroskopning ko'rish sohasida ko'rinadigan ikkita ip orasidagi masofani bosib o'tish uchun tomchilagi vaqt aniqlandi.
Tomchining muvozanatini aniq belgilash juda qiyin. Shuning uchun (74.9) shartga mos keladigan maydon o'rniga maydon yoqildi, uning ta'siri ostida tomchi past tezlikda yuqoriga qarab harakatlana boshladi. Ko'tarilishning barqaror tezligi P kuchi va umumiy quvvat kuchni muvozanatlashi sharti bilan aniqlanadi
P va tenglamadan (74.10), (74.11) va (74.12) chiqarib tashlab, biz uchun ifodani olamiz.
![]()
(Milliken tomchilarning o'lchamlari havo molekulalarining erkin yo'li bilan solishtirish mumkinligini hisobga olib, ushbu formulaga tuzatish kiritdi).

Shunday qilib, tomchining erkin tushish tezligini va uning ma'lum elektr maydonida ko'tarilish tezligini o'lchab, tomchining zaryadini topish mumkin edi e tezlikni zaryadning ma'lum bir qiymatida o'lchab, Millikan ionlanishni keltirib chiqardi plitalar orasidagi bo'shliqni rentgen nurlari bilan nurlantirish orqali havoning. Tomchiga yopishgan alohida ionlar uning zaryadini o'zgartirdi, buning natijasida tezlik ham o'zgardi. Yangi tezlik qiymatini o'lchagandan so'ng, plitalar orasidagi bo'shliq yana nurlantirildi va hokazo.
Millikan tomonidan har safar o'lchangan tomchining zaryadidagi o'zgarishlar va zaryadning o'zi bir xil qiymatning butun sonlari bo'lib chiqdi. Shunday qilib, elektr zaryadining diskretligi, ya'ni har bir zaryad bir xil o'lchamdagi elementar zaryadlardan tashkil topganligi tajribada isbotlangan.
Millikanning o'lchovlari va boshqa usullar bilan olingan ma'lumotlarini hisobga olgan holda o'rnatilgan elementar zaryadning qiymati tengdir.
IONLARNING FIZIKA ASOSLARI |
|||
VA YARIMOQCHI QURILMALAR |
|||
1.1. Elektronning xossalari |
|||
Elektron qurilmalardagi elektr maydoni tezlashadi yoki torso- |
|||
elektronlarning harakatiga ta'sir qiladi. Elektron e ichida joylashgan bo'lsin |
|||
intensivligi E bo'lgan elektr maydoni, F kuchi ta'sir qiladi (1.1-rasm). |
|||
F = - eE, |
|||
maydon kuchiga qarshi qaratilgan. |
|||
Nyutonning ikkinchi qonuniga ko'ra, F kuch ko'paytmaga teng |
|||
elektron massasi m tezlanish orqali elektronga F kuch bilan berilgan |
|||
intensivligi E bo'lgan maydonda: |
|||
F = ma. |
|||
(1.1) va (1.2) dan elektr tezlanishi |
|||
a = E e, |
|||
(1.3) tenglamadan ko'rinib turibdiki, c tufayli |
|||
elektr kuchlanishining o'zgarishi |
Guruch. 1.1. Bir jinsli elektron |
||
maydon o'zgarishlari tezlashadi |
elektr maydoni |
||
nieelektron. Bunga qo'chimcha, |
|||
maydon kuchi v 0 boshlang'ich tezlik yo'nalishiga tushganda |
elektron |
||
tezlashtirilgan harakat qiladi va eng yuqori tezlik va kinetikga ega bo'ladi |
|||
sayohatining oxirida energiya. |
|||
Ma'lum pozitsiyalarga asoslanib, elektronning v tezligini topamiz |
|||
fizika. Birinchidan, dala ishi elektr energiyasini unda harakatlantirishga majbur qiladi |
|||

A nuqtadan B nuqtagacha bo'lgan oqim zaryadning mahsulotidir |
|||
elektron e bu nuqtalarning potentsial farqiga: |
|||
W e = (− e )(U A - U B ). |
|||
U B > U A ekan, keyin |
|||
U A - U B = - U. |
|||
Shuning uchun ish |
|||
Biz = (e)(− U ) = eU. |
|||
Ikkinchidan, energiyani saqlash qonuniga ko'ra, biz sarflagan ish |
|||
elektronni harakatlantirish uchun maydon tomonidan induktsiya kinetik o'sishiga teng |
|||
Elektr maydonida harakatlanuvchi elektronning taroq energiyasi: |
|||
W = m (v 2 - v 2) / 2. |
|||
Dastlabki tezlikni v 0 = 0 olib, (5) dan qiymatni topamiz |
|||
terminal elektron tezligi |
|||
2 W e = |
2 U e. |
||
Elektron qurilmalardagi elektronlarning tezligi sezilarli darajada past - |
|||
yorug'lik tezligidan tezroq, shuning uchun miqdorlarning nisbati e / m ≈ e / m 0 |
|||
v ≈ 600 |
|||
(1.9) dan ko'rinib turibdiki, elektrda elektronning harakat tezligi |
|||
sk maydoni (km/s) faqat orasidagi potentsial farqga bog'liq |
|||
elektron bosib o'tgan yo'lning boshlang'ich va tugash nuqtalari va |
|||
yo'lning shakliga bog'liq emas. Ba'zan elektronning tezligi o'lchanadi |
|||
volt Masalan: elektronning tezligi 100 V. Demak, elektron |
|||
taxt 100 V potentsial farqidan o'tgandan keyin shunday tezlikka erishdi. |
|||
Agar elektron o'z harakatini tinch holatdan boshlasa, u |
|||
kuchlarga qarshi bir tekis tezlashtirilgan, to'g'ri chiziqli harakat qiladi |
|||
elektr maydon chiziqlari, maydondan energiyani yutish. Elektr |
|||
Elektron uchun elektr maydoni tezlashmoqda. |
|||
Agar dastlabki tezlik kuch yo'nalishiga to'g'ri kelsa |
|||
elektr maydon chiziqlari, elektron uchun bunday maydon torusdir |
|||
nam. Elektronning tezligi, elektronning energiyasi kamayadi |
|||
Rona ham kamayadi (dalaga qaytariladi). Agar |
|||

maydonning kattaligi imkon beradi, elektron to'xtaydi va keyin bu maydonning kuch chiziqlariga qarshi harakat qila boshlaydi.
Agar dastlabki tezlik elektr maydon chiziqlariga qarama-qarshi yo'naltirilgan bo'lsa, elektron uchun bunday maydon tezlashadi. Elektr maydoni musbat zaryadlarni maydon chiziqlari yo'nalishi bo'yicha harakatga keltiradi.
1.2. Elektron emissiya turlari
Qattiq jism yuzasidan elektron chiqarish hodisasi elektron emissiya, elektronlar manbai esa emitent deb ataladi. Elektronlarga tashqi energiya ta'sir qilish, ularning emitentdan chiqib ketishiga olib keladigan usullarga qarab, elektron emissiyasining bir necha turlari ajratiladi.
Termion emissiyasi emitentni isitish natijasida yuzaga keladi. Haroratning oshishi bilan qattiq panjaraning termal tebranishlari paydo bo'ladi. Ushbu termal qo'zg'alish energiyasi tufayli elektronlarning bir qismi emitentni tark etadi va emissiya oqimini hosil qiladi. Emitent harorati qanchalik baland bo'lsa, shuncha ko'p elektronlar bunday energiyaga ega bo'ladi, buning natijasida termion emissiya oqimi ortadi. Emissiya oqimi paydo bo'ladigan minimal harorat kritik deb ataladi. Bu emitent materialga bog'liq.
Ikkilamchi elektron emissiyasi - ikkilamchi elektr energiyasining emissiyasi
birlamchi elektronlar oqimi bilan nurlantirilganda emitent yuzasidan elektronlar. Ikkilamchi emitentga tushgan birlamchi elektron oqimi uning yuzasidan qisman aks etadi va qisman unga chuqur kirib boradi. Bu erda birlamchi elektronlar emitentning kristall panjarasining elektronlari bilan to'qnashadi va ularga energiyaning bir qismini berib, ularni hayajonlantiradi. Qo'zg'atilgan elektronlarning bir qismi tashqi muhitga qochib ketadi, bu elektronlar ikkinchi darajali;
Elektrostatik elektron emissiyasi (maydon emissiyasi)
yuqori intensivlikdagi (107 V/m) tashqi tezlashtiruvchi elektr maydoni ta'sirida qattiq yoki suyuq jism yuzasidan yuzaga keladi. Maydon kuchi qanchalik katta bo'lsa, maydon emissiya oqimi shunchalik katta bo'ladi.
Fotoelektron emissiyasi emitent yorug'lik bilan nurlanganda paydo bo'ladi. Ushbu turdagi emissiyaning samaradorligi to'lqin uzunligiga (teskari munosabat) va yorug'lik oqimining kattaligiga (to'g'ridan-to'g'ri munosabat) bog'liq.
Elektron asosiy zarra bo'lib, moddaning strukturaviy birliklaridan biridir. Tasnifga ko'ra, bu fermion (yarim butun spinli zarracha, fizik E. Fermi nomi bilan atalgan) va lepton (kuchli o'zaro ta'sirda ishtirok etmaydigan yarim butun spinli zarralar, to'rtta asosiydan biri) fizika bo'yicha). Barion boshqa leptonlar kabi nolga teng.
Yaqin vaqtlargacha elektron elementar, ya'ni bo'linmas, tuzilmasiz zarra deb hisoblangan bo'lsa, hozir olimlar boshqacha fikrda. Zamonaviy fiziklarning fikricha, elektron nimadan iborat?
Ismning tarixi
Hatto Qadimgi Yunonistonda ham tabiatshunoslar ilgari jun bilan ishqalangan kehribar kichik narsalarni o'ziga jalb qilishini, ya'ni elektromagnit xususiyatlarni namoyon qilishini payqashgan. Elektron o'z nomini yunon tilidan olingan bo'lib, "qahrabo" degan ma'noni anglatadi. Bu atama 1894 yilda J. Stouni tomonidan taklif qilingan, garchi zarraning o'zi 1897 yilda J. Tompson tomonidan kashf etilgan. Uni aniqlash qiyin edi, buning sababi uning past massasi va elektronning zaryadi kashfiyot tajribasida hal qiluvchi rol o'ynadi. Zarrachaning birinchi suratlarini Charlz Uilson hatto zamonaviy tajribalarda ham qo‘llaniladigan va uning nomi bilan atalgan maxsus kamera yordamida olgan.
Qizig'i shundaki, elektronni kashf qilishning zaruriy shartlaridan biri Benjamin Franklinning bayonotidir. 1749 yilda u gipotezani ishlab chiqdi, unga ko'ra elektr toki moddiy moddadir. Aynan uning ishida musbat va manfiy zaryadlar, kondansatör, razryad, batareya va elektr zarrachalari kabi atamalar birinchi marta qo'llanilgan. Elektronning solishtirma zaryadi manfiy, protonniki esa musbat deb hisoblanadi.
Elektronning kashfiyoti
1846 yilda "elektr atomi" tushunchasi nemis fizigi Vilgelm Veber tomonidan o'z asarlarida qo'llanila boshlandi. Maykl Faraday "ion" atamasini kashf qildi, uni hozir, ehtimol, hamma maktab davridan biladi. Elektr tokining tabiati haqidagi savolni nemis fizigi va matematigi Yuliy Plyuker, Jan Perren, ingliz fizigi Uilyam Kruks, Ernst Rezerford va boshqalar kabi ko'plab taniqli olimlar o'rganishgan.
Shunday qilib, Jozef Tompson o‘zining mashhur tajribasini muvaffaqiyatli yakunlab, atomdan kichikroq zarracha mavjudligini isbotlagunga qadar bu sohada ko‘plab olimlar ishlagan va agar ular bu ulkan ishni bajarmaganlarida kashfiyotni amalga oshirib bo‘lmas edi.

1906 yilda Jozef Tompson Nobel mukofotini oldi. Tajriba quyidagilardan iborat edi: katod nurlarining nurlari elektr maydonini yaratadigan parallel metall plitalardan o'tkazildi. Keyin ular bir xil yo'lni qilishlari kerak edi, lekin magnit maydonni yaratgan bobinlar tizimi orqali. Tompson aniqladiki, elektr maydon ta'sirida nurlar og'ishdi va magnit ta'sir ostida ham xuddi shunday kuzatildi, ammo katod nurlarining nurlari, agar ularga ushbu maydonlarning ikkalasi ham ma'lum nisbatlarda ta'sir qilsa, traektoriyalarini o'zgartirmaydi. zarrachalarning tezligiga bog'liq.
Hisob-kitoblardan so'ng, Tompson bu zarralarning tezligi yorug'lik tezligidan sezilarli darajada past ekanligini bilib oldi, bu ularning massasi borligini anglatadi. O'sha paytdan boshlab fiziklar materiyaning ochiq zarralari atomning bir qismi ekanligiga ishonishni boshladilar, keyinchalik u buni "atomning sayyoraviy modeli" deb atadi.
Kvant dunyosining paradokslari
Elektronning nimadan iboratligi haqidagi savol, hech bo'lmaganda, ilmiy rivojlanishning ushbu bosqichida juda murakkab. Buni ko'rib chiqishdan oldin, hatto olimlarning o'zlari ham tushuntirib bera olmaydigan kvant fizikasining paradokslaridan biriga murojaat qilishimiz kerak. Bu elektronning ikkitomonlama tabiatini tushuntiruvchi mashhur qo'sh tirqish tajribasi.
Uning mohiyati shundaki, zarrachalarni otgan "qurol" oldida vertikal to'rtburchaklar teshikli ramka mavjud. Uning orqasida zarba izlari kuzatiladigan devor bor. Shunday qilib, avval siz materiyaning o'zini qanday tutishini tushunishingiz kerak. Mashinaning tennis to'plarini qanday ishga tushirishini tasavvur qilishning eng oson yo'li. Ba'zi to'plar teshikka tushadi va devordagi belgilar bitta vertikal chiziq hosil qiladi. Agar siz bir oz masofada boshqa shunga o'xshash teshik qo'shsangiz, treklar mos ravishda ikkita chiziq hosil qiladi.
Bunday vaziyatda to'lqinlar boshqacha harakat qiladi. Agar devorda to'lqin bilan to'qnashuv izlari ko'rsatilsa, unda bitta teshik bo'lsa, bitta chiziq ham bo'ladi. Biroq, ikkita tirqish holatida hamma narsa o'zgaradi. Teshiklardan o'tadigan to'lqin yarmiga bo'linadi. Agar to'lqinlardan birining tepasi ikkinchisining pastki qismiga to'g'ri kelsa, ular bir-birini bekor qiladi va devorda interferentsiya naqsh (bir nechta vertikal chekkalar) paydo bo'ladi. To'lqinlar kesishgan joylar iz qoldiradi, lekin o'zaro bekor qilingan joylar qolmaydi.

Ajoyib kashfiyot
Yuqorida tasvirlangan tajriba yordamida olimlar dunyoga kvant va klassik fizika o‘rtasidagi farqni aniq ko‘rsatishlari mumkin. Devorga elektronlarni otishni boshlaganlarida, bu odatiy vertikal naqshni ko'rsatdi: ba'zi zarralar, xuddi tennis to'plari kabi, bo'shliqqa tushdi, ba'zilari esa tushmadi. Ammo ikkinchi teshik paydo bo'lganda hamma narsa o'zgardi. Bu devorda paydo bo'ldi, birinchi navbatda, fiziklar elektronlar bir-biriga aralashib, ularni bir vaqtning o'zida kiritishga qaror qilishdi. Biroq, bir necha soatdan keyin (harakatlanuvchi elektronlarning tezligi hali ham yorug'lik tezligidan ancha past) interferentsiya naqshlari yana paydo bo'la boshladi.
Kutilmagan burilish
Elektron, fotonlar kabi ba'zi boshqa zarralar bilan bir qatorda, to'lqin-zarracha dualligini ko'rsatadi ("kvant-to'lqin ikkiligi" atamasi ham qo'llaniladi). Xuddi u tirik va o'lik bo'lganidek, elektronning holati ham korpuskulyar, ham to'lqinli bo'lishi mumkin.
Biroq, ushbu tajribaning keyingi bosqichi yanada ko'proq sirlarni keltirib chiqardi: hamma narsa ma'lum bo'lgan asosiy zarracha aql bovar qilmaydigan ajablantirdi. Fiziklar zarrachalar qaysi yoriqdan o'tishini va qanday qilib to'lqin sifatida namoyon bo'lishini yozib olish uchun teshiklarga kuzatuv moslamasini o'rnatishga qaror qilishdi. Ammo kuzatish mexanizmi o'rnatilishi bilanoq devorda ikkita teshikka to'g'ri keladigan faqat ikkita chiziq paydo bo'ldi va hech qanday shovqin yo'q! "Kuzatuv" olib tashlanganidan so'ng, zarracha uni boshqa hech kim kuzatmayotganini bilgandek, yana to'lqin xususiyatlarini namoyon qila boshladi.
Boshqa nazariya
Fizik Born zarracha so'zning tom ma'noda to'lqinga aylanmasligini taklif qildi. Elektron ehtimollik to'lqinini o'z ichiga oladi; bu interferentsiya naqshini beradi. Ushbu zarralar superpozitsiya xususiyatiga ega, ya'ni ular ma'lum bir ehtimollik darajasi bilan har qanday joyda joylashgan bo'lishi mumkin, shuning uchun ular xuddi shunday "to'lqin" bilan birga bo'lishi mumkin.
Shunga qaramay, natija aniq: kuzatuvchining mavjudligining o'zi tajriba natijasiga ta'sir qiladi. Bu aql bovar qilmaydigan ko'rinadi, ammo bu bunday turdagi yagona misol emas. Ob'ekt alyuminiy folga eng yupqa bo'lagiga aylangandan so'ng, fiziklar materiyaning katta qismlarida ham tajriba o'tkazdilar. Olimlarning ta'kidlashicha, ba'zi o'lchovlarning shunchaki haqiqati ob'ektning haroratiga ta'sir qilgan. Ular hali bunday hodisalarning mohiyatini tushuntirib bera olmaydilar.

Tuzilishi
Ammo elektron nimadan iborat? Hozirgi vaqtda zamonaviy fan bu savolga javob bera olmaydi. Yaqin vaqtgacha u bo'linmas asosiy zarra hisoblanardi, ammo hozir olimlar uning kichikroq tuzilmalardan iboratligiga ishonishga moyil.
Elektronning o'ziga xos zaryadi ham elementar hisoblangan, ammo hozirda kasr zaryadiga ega bo'lgan kvarklar kashf etilgan. Elektron nimadan iboratligi haqida bir qancha nazariyalar mavjud.
Bugun siz olimlar elektronni bo'lishga muvaffaq bo'lganliklarini da'vo qiladigan maqolalarni ko'rishingiz mumkin. Biroq, bu faqat qisman to'g'ri.
Yangi tajribalar
O'tgan asrning saksoninchi yillarida sovet olimlari elektronni uchta kvazizarraga bo'lish mumkinligini taklif qilishgan. 1996 yilda uni spinon va xolonga ajratish mumkin bo'ldi va yaqinda fizik Van den Brink va uning jamoasi zarrachani spinon va orbitonga ajratdi. Biroq, bo'linish faqat maxsus sharoitlarda amalga oshirilishi mumkin. Tajriba juda past harorat sharoitida o'tkazilishi mumkin.
Elektronlar mutlaq nolga, ya'ni -275 daraja Selsiy bo'yicha "sovuganda" ular amalda to'xtab, bir zarrachaga qo'shilgandek, o'zaro materiyaga o'xshash narsani hosil qiladilar. Bunday sharoitda fiziklar elektronni tashkil etuvchi kvazizarralarni kuzatishga muvaffaq bo'lishadi.

Axborot tashuvchilar
Elektronning radiusi juda kichik, u 2,81794 ga teng. 10 -13 sm, lekin uning tarkibiy qismlari hajmi jihatidan ancha kichikroq ekanligi ma'lum bo'ldi. Elektron "bo'lingan" uchta qismning har biri bu haqda ma'lumotni olib yuradi. Orbiton, nomidan ko'rinib turibdiki, zarrachaning orbital to'lqini haqidagi ma'lumotlarni o'z ichiga oladi. Spinon elektronning aylanishi uchun javobgardir va xolon bizga zaryad haqida xabar beradi. Shunday qilib, fiziklar yuqori darajada sovutilgan moddadagi elektronlarning turli holatlarini alohida kuzatishlari mumkin. Ular xolon-spinon va spinon-orbiton juftlarini kuzatishga muvaffaq bo'lishdi, lekin butun uchlikni birga emas.
Yangi texnologiyalar
Elektronni kashf etgan fiziklar kashfiyot amaliyotga tatbiq etilishidan oldin bir necha o'n yillar kutishlari kerak edi. Hozirgi kunda texnologiyalar bir necha yil ichida foydalanishni topadi, shunchaki grafenni eslang - bir qatlamda uglerod atomlaridan iborat ajoyib material; Elektron bo'linishi qanday foydali bo'ladi? Olimlar, ularning fikricha, eng kuchli zamonaviy kompyuterlarning tezligidan bir necha o'n baravar yuqori tezlikni yaratishni bashorat qilmoqdalar.
Kvant kompyuter texnologiyasining siri nimada? Buni oddiy optimallashtirish deb atash mumkin. An'anaviy kompyuterda minimal, bo'linmaydigan ma'lumot bir oz. Va agar biz ma'lumotlarni vizual narsa deb hisoblasak, unda mashina uchun faqat ikkita variant mavjud. Bitda nol yoki bitta, ya'ni ikkilik kodning qismlari bo'lishi mumkin.
Yangi usul
Endi tasavvur qilaylik, bit ham nolni, ham birni o'z ichiga oladi - bu "kvant bit" yoki "tirsak". Oddiy o'zgaruvchilar rolini elektronning aylanishi o'ynaydi (u soat yo'nalishi bo'yicha yoki soat sohasi farqli ravishda aylanishi mumkin). Oddiy bitdan farqli o'laroq, bir tirsak bir vaqtning o'zida bir nechta funktsiyalarni bajarishi mumkin, shuning uchun ish tezligi oshadi, bu erda elektronning past massasi va zaryadi muhim emas;
Buni labirint misolida tushuntirish mumkin. Undan chiqish uchun siz juda ko'p turli xil variantlarni sinab ko'rishingiz kerak, ulardan faqat bittasi to'g'ri bo'ladi. An'anaviy kompyuter muammolarni tezda hal qilishi mumkin, ammo baribir bir vaqtning o'zida faqat bitta muammo ustida ishlashi mumkin. U barcha mumkin bo'lgan yo'llarni birma-bir bosib o'tadi va oxir-oqibat chiqish yo'lini topadi. Kvant kompyuteri tirsakning dualligi tufayli bir vaqtning o'zida ko'plab muammolarni hal qila oladi. U barcha mumkin bo'lgan variantlarni o'z navbatida emas, balki bir vaqtning o'zida ko'rib chiqadi, shuningdek, muammoni hal qiladi. Hozircha yagona qiyinchilik - bitta vazifani bajarish uchun ko'plab kvantlarni olish - bu yangi avlod kompyuterining asosi bo'ladi.

Ilova
Ko'pchilik kompyuterdan kundalik darajada foydalanadi. An'anaviy shaxsiy kompyuterlar hali ham bu vazifani a'lo darajada bajarmoqda, lekin minglab va ehtimol yuz minglab o'zgaruvchilarga bog'liq bo'lgan voqealarni bashorat qilish uchun mashina juda katta bo'lishi kerak. u oylik ob-havo prognozi, tabiiy ofat ma'lumotlarini qayta ishlash va bashorat qilish kabi ishlarni osonlik bilan hal qila oladi va bir necha atom o'lchamidagi protsessor bilan bir necha soniya ichida ko'plab o'zgaruvchilar bilan murakkab matematik hisoblarni amalga oshiradi. Shunday qilib, ehtimol, tez orada bizning eng kuchli kompyuterlarimiz qog'oz varag'i kabi nozik bo'ladi.

Sog'lom bo'lish
Kvant kompyuter texnologiyasi tibbiyotga katta hissa qo'shadi. Insoniyat ularning yordami bilan eng kuchli potentsialga ega bo'lgan nanomexanizmlarni yaratish imkoniyatiga ega bo'ladi, nafaqat butun tanani ichkaridan ko'rib, kasalliklarga tashxis qo'yish, balki jarrohlik aralashuvisiz tibbiy yordam ko'rsatish mumkin bo'ladi: eng kichik; mukammal kompyuterning "miyasi" bo'lgan robotlar barcha operatsiyalarni bajara oladi.
Kompyuter o'yinlari sohasida inqilob muqarrar. Muammolarni bir zumda hal qila oladigan kuchli mashinalar ajoyib darajada real grafikalar bilan o'yin o'ynashi mumkin va to'liq immersiv kompyuter dunyolari burchakda.
Moddaning tuzilishi.
Atomning tuzilishi.
Atom kimyoviy elementning eng kichik zarrasi, uning barcha kimyoviy xossalarining tashuvchisi. Atom kimyoviy jihatdan bo'linmasdir. Atomlar erkin holatda yoki bir xil element yoki boshqa element atomlari bilan birgalikda mavjud bo'lishi mumkin.
Hozirgi vaqtda atom va molekulyar massalarning birligi atom massasi 12 (izotop) bo'lgan uglerod atomi massasining 1/12 qismi sifatida qabul qilinadi. Bu birlik uglerod birligi deb ataladi.
Atomlarning massasi va hajmi. Avogadro raqami.
Gram atom, xuddi har qanday moddaning gramm molekulasi kabi, mos ravishda 6,023 10^23 atom yoki molekuladan iborat. Bu raqam Avogadro raqami (N0) deb ataladi. Shunday qilib, 55,85 g temir, 63,54 g mis, 29,98 g alyuminiy va boshqalarda Avogadro soniga teng atomlar soni mavjud.
Avogadro raqamini bilish, har qanday elementning bir atomining massasini hisoblash qiyin emas. Buning uchun bitta atomning gram-atom massasini 6,023 10^23 ga bo'lish kerak. Shunday qilib, vodorod atomining (1) massasi va uglerod atomining (2) massasi mos ravishda tengdir: 
Avogadro raqamiga asoslanib, atom hajmini aniqlash mumkin. Masalan, misning zichligi 8,92 g/sm^3, gram-atom massasi esa 63,54 g ni tashkil qiladi, bu bir gramm-atom mis hajmni egallaydi  , va bitta mis atomi uchun hajm mavjud
, va bitta mis atomi uchun hajm mavjud  .
.
Atom tuzilishi.
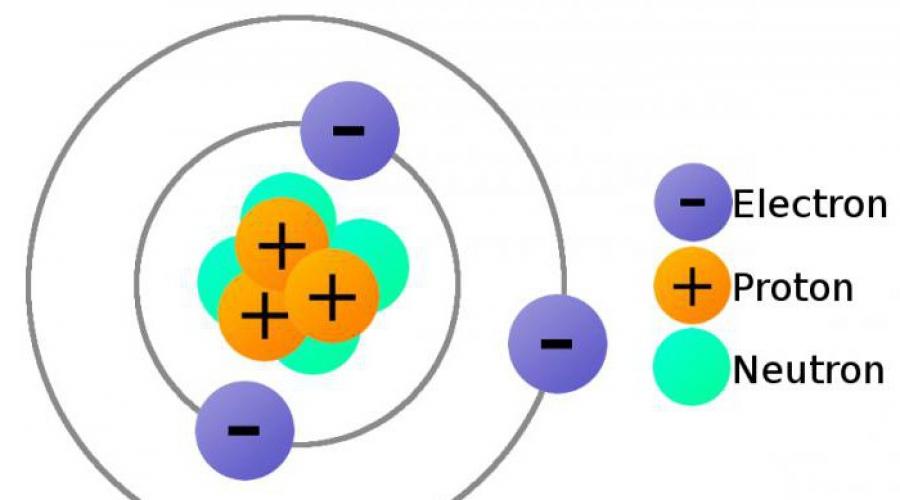
Atom murakkab shakllanish bo'lib, bir qancha mayda zarrachalardan iborat. Barcha elementlarning atomlari musbat zaryadlangan yadro va elektronlardan - juda kam massali manfiy zaryadlangan zarrachalardan iborat. Yadro atomning umumiy hajmining ahamiyatsiz qismini egallaydi. Atomning diametri sm, yadrosining diametri esa sm.
Atom yadrosining diametri atomning diametridan 100 000 marta kichik bo'lsa ham, atomning deyarli butun massasi uning yadrosida to'plangan. Bundan kelib chiqadiki, atom yadrolarining zichligi juda yuqori. Agar 1 sm3 atom yadrolarini yig'ish mumkin bo'lsa, unda uning massasi taxminan 116 million tonnani tashkil qiladi.
Yadro proton va neytronlardan iborat. Bu zarralar umumiy nomga ega - nuklonlar.
Proton- - massasi uglerod birligiga yaqin bo'lgan barqaror elementar zarracha. Proton zaryadi elektrod zaryadiga teng, lekin teskari belgi bilan. Agar elektronning zaryadi -1 deb qabul qilinsa, protonning zaryadi +1 ga teng. Proton - bu elektronga ega bo'lmagan vodorod atomidir.
Neytron- atom qobig'i, uning manfiy zaryadi yadroning musbat zaryadini undagi protonlar mavjudligi sababli qoplaydi.
Shunday qilib, atomdagi elektronlar soni uning yadrosidagi protonlar soniga teng.
Protonlar soni, neytronlar soni va atomning massa soni o'rtasidagi bog'liqlik tenglama bilan ifodalanadi: N=A-Z
Demak, har qanday element atomining yadrosidagi neytronlar soni uning massa soni va protonlar soni o'rtasidagi farqga teng.
Demak, massasi 226 ga teng radiy atomi yadrosidagi neytronlar soni N=A-Z=226-88=138
Elektronning massasi va zaryadi.
Kimyoviy birikmalarning hosil bo'lishi va yo'q qilinishining barcha kimyoviy jarayonlari ushbu birikmalarni tashkil etuvchi elementlar atomlarining yadrolarini o'zgartirmasdan sodir bo'ladi. Faqat elektron qobiqlar o'zgaradi. Shunday qilib, kimyoviy energiya elektronlar energiyasi bilan bog'liq. Kimyoviy birikmalarning hosil bo'lish va yo'q qilish jarayonlarini tushunish uchun umuman elektronning xususiyatlari va ayniqsa atomdagi elektronning xossalari va xatti-harakatlari haqida tasavvurga ega bo'lish kerak.
Elektron elementar manfiy elektr zaryadiga ega bo'lgan elementar zarracha, ya'ni mavjud bo'lishi mumkin bo'lgan eng kichik elektr miqdori. Elektronning zaryadi el ga teng. Art. birliklar yoki kulon. Elektronning qolgan massasi g ga teng, ya'ni. vodorod atomining massasidan 1837,14 marta kam. Elektronning massasi uglerod birligidir.
Borning atom modeli.
20-asr boshida M. Plank A. Eynshteyn yorug'likning kvant nazariyasini yaratdi, unga ko'ra yorug'lik yorug'lik zarralari tomonidan olib boriladigan energiyaning individual kvantlari oqimidir - fotonlar.
Energiya kvantining kattaligi(E) turli nurlanishlar uchun farq qiladi va tebranish chastotasiga proportsionaldir:
,
bu yerda h - Plank doimiysi.
M. Plank atomlar nurlanish energiyasini faqat alohida, aniq belgilangan qismlarda yutadi yoki chiqaradi, deb ko'rsatdi - kvant.
Klassik mexanika qonunini kvant nazariyasi bilan bogʻlashga urinib, daniyalik olim N. Bor vodorod atomidagi elektron faqat maʼlum - doimiy orbitalarda boʻlishi mumkin, radiusi butun sonlar kvadrati sifatida bir-biri bilan bogʻliq, deb hisobladi. ![]() Bu orbitalarni N. Bor statsionar deb atagan.
Bu orbitalarni N. Bor statsionar deb atagan.
Energiya faqat elektron uzoqroq orbitadan yadroga yaqinroq orbitaga o'tganda chiqariladi. Elektron yaqin orbitadan uzoqroq orbitaga o'tganda, energiya atom tomonidan so'riladi. ![]() , statsionar holatlardagi elektronlarning energiyalari qayerda.
, statsionar holatlardagi elektronlarning energiyalari qayerda.
Ei > Ek bo'lganda energiya chiqariladi.
Qachon Ei< Ек энергия поглощается.
Elektronlarning atomda taqsimlanishi muammosini hal qilish elementlarning chiziqli spektrlarini va ularning kimyoviy xossalarini o'rganishga asoslangan. Vodorod atomining spektri N. Bor nazariyasini deyarli to'liq tasdiqladi. Lekin N. Bor nazariyasi koʻp elektronli atomlarda spektral chiziqlarning kuzatilgan boʻlinishini va bu boʻlinishning magnit va elektr maydonlarida kuchayishini tushuntirib bera olmadi.
Elektronning to'lqin xossalari.
Klassik fizika qonunlari "zarracha" va "to'lqin" tushunchalarini bir-biriga qarama-qarshi qo'yadi. Kvant deb ataladigan zamonaviy fizika nazariyasi yoki to'lqinlar mexanikasi, kichik massali zarralar - mikrozarralarning harakati va o'zaro ta'siri klassik mexanika qonunlaridan farqli qonunlarga muvofiq sodir bo'lishini ko'rsatdi. Mikrozarracha bir vaqtning o'zida tanachalarning (zarralarning) ba'zi xususiyatlariga va to'lqinlarning ba'zi xususiyatlariga ega. Bir tomondan, elektron, proton yoki boshqa mikrozarracha, masalan, boshqa mikrozarracha bilan to'qnashganda, harakat qiladi va korpuskula kabi harakat qiladi. Boshqa tomondan, mikrozarracha harakat qilganda elektromagnit to'lqinlarga xos bo'lgan interferensiya va diffraktsiya hodisalari ochiladi.
Shunday qilib, elektronning (shuningdek, boshqa mikrozarralarning) xossalarida, uning harakat qonuniyatlarida materiya, substansiya va maydon mavjudligining sifat jihatidan farq qiluvchi ikki shaklining uzluksizligi va o‘zaro bog‘liqligi namoyon bo‘ladi. Mikrozarrachani oddiy zarracha yoki oddiy to'lqin sifatida ko'rib bo'lmaydi. Mikrozarracha to'lqin-zarracha ikkilikka ega.
Materiya va maydon o'rtasidagi munosabat haqida gapirganda, agar har bir moddiy zarracha ma'lum bir massaga ega bo'lsa, unda, aftidan, xuddi shu zarracha ham ma'lum bir to'lqin uzunligiga ega bo'lishi kerak degan xulosaga kelish mumkin. Massa va to'lqin o'rtasidagi munosabat haqida savol tug'iladi. 1924 yilda frantsuz fizigi Lui de Broyl har bir harakatlanuvchi elektron (va umuman, har bir harakatlanuvchi moddiy zarracha) to'lqin jarayoni bilan bog'liq, deb taklif qildi, uning to'lqin uzunligi , bu erda to'lqin uzunligi sm (m), h Plank doimiysi. , ga teng ![]() erg. sek (), m - zarracha massasi g (kg), - zarracha tezligi, sm/sek.
erg. sek (), m - zarracha massasi g (kg), - zarracha tezligi, sm/sek.
Bu tenglamadan ko'rinib turibdiki, tinch holatda bo'lgan zarracha cheksiz uzun to'lqin uzunligiga ega bo'lishi kerak va zarracha tezligi ortishi bilan to'lqin uzunligi kamayadi. Katta massali harakatlanuvchi zarrachaning to'lqin uzunligi juda kichik va uni hali tajriba yo'li bilan aniqlash mumkin emas. Shuning uchun biz faqat mikrozarrachalarning to'lqin xususiyatlari haqida gapiramiz. Elektron to'lqin xususiyatlariga ega. Bu shuni anglatadiki, uning atomdagi harakatini to'lqin tenglamasi bilan tasvirlash mumkin.
Elektron faqat klassik zarracha sifatidagi g'oyadan kelib chiqqan N. Bor tomonidan yaratilgan vodorod atomi tuzilishining sayyoraviy modeli elektronning bir qator xususiyatlarini tushuntirib bera olmaydi. Kvant mexanikasi shuni ko'rsatdiki, Quyosh atrofida sayyoralarning harakatiga o'xshash ma'lum orbitalarda elektronning yadro atrofida harakatlanishi g'oyasini asossiz deb hisoblash kerak.
To'lqinning xususiyatlariga ega bo'lgan elektron butun hajm bo'ylab harakatlanib, elektron bulutni hosil qiladi, bu bitta atomda joylashgan elektronlar uchun boshqa shaklga ega bo'lishi mumkin. Bu elektron bulutining atom hajmining u yoki bu qismidagi zichligi bir xil emas.
To'rt kvant soni bo'yicha elektronning xarakteristikasi.
Yadro sohasida elektronning harakatini belgilovchi asosiy xususiyat uning energiyasidir. Elektronning energiyasi, yorug'lik oqimi zarrasi - fotonning energiyasi kabi, hech qanday emas, balki faqat ma'lum diskret, uzluksiz yoki ular aytganidek, kvantlangan qiymatlarni oladi.
Harakatlanuvchi elektron kosmosda uch darajadagi harakat erkinligiga (uchta koordinata o'qiga to'g'ri keladi) va elektronning o'z atrofida aylanishini hisobga oladigan elektronning o'ziga xos mexanik va magnit momentlari mavjudligi sababli qo'shimcha bir erkinlik darajasiga ega. o'qi. Binobarin, atomdagi elektron holatining to'liq energetik xarakteristikasi uchun to'rtta parametrga ega bo'lish zarur va etarli. Ushbu parametrlar deyiladi kvant raqamlari. Kvant raqamlari, xuddi elektronning energiyasi kabi, hamma narsaga erisha olmaydi, faqat ma'lum qiymatlar. Kvant sonlarining qo'shni qiymatlari bittadan farq qiladi.
Bosh kvant soni n elektronning umumiy energiya zaxirasini yoki uning energiya darajasini tavsiflaydi. Bosh kvant soni 1 dan ga qadar butun sonlar qiymatlarini qabul qilishi mumkin. Yadro sohasida joylashgan elektron uchun asosiy kvant soni 1 dan 7 gacha qiymatlarni olishi mumkin (element joylashgan davriy tizimdagi davr soniga to'g'ri keladi). Energiya darajalari yoki asosiy kvant sonining qiymatlariga muvofiq raqamlar yoki harflar bilan belgilanadi:
n | |||||||
Darajani belgilash |
Agar, masalan, n=4 bo'lsa, u holda elektron atom yadrosidan hisoblangan to'rtinchi energiya darajasida yoki N darajasida.
Orbital kvant soni Ba'zan yon kvant soni deb ataladigan l elektronning ma'lum darajadagi turli energiya holatlarini tavsiflaydi. Spektral chiziqlarning nozik tuzilishi har bir energiya darajasining elektronlari pastki darajalarga guruhlanganligini ko'rsatadi. Orbital kvant soni elektronning atom yadrosiga nisbatan harakat qilgandagi burchak impulsi bilan bog'liq. Orbital kvant soni elektron bulutning shaklini ham aniqlaydi. Masalan, n=4, l=0, 1, 2, 3 bilan. l ning har bir qiymati ma'lum bir kichik darajaga mos keladi. Harf belgilari pastki darajalar uchun ishlatiladi. Demak, l=0, 1, 2, 3 bo'lganda elektronlar mos ravishda s-, p-, d-, f- pastki sathlarida bo'ladi. Turli pastki darajadagi elektronlar mos ravishda s-, p-, d-, f - elektronlar deb ataladi. Har bir energiya darajasi uchun mumkin bo'lgan pastki darajalar soni ushbu darajadagi soniga teng, lekin to'rtdan oshmaydi. Birinchi energiya darajasi (n=1) bitta s-kichik darajadan, ikkinchi (n=2), uchinchi (n=3) va toʻrtinchi (n=4) energiya darajalari mos ravishda ikkita (s, p), uchtadan iborat. (s , p, d) va to'rtta (s, p, d, f) pastki darajalar. To'rtdan ortiq pastki daraja bo'lishi mumkin emas, chunki l = 0, 1, 2, 3 qiymatlari hozirda ma'lum bo'lgan barcha 104 element atomlarining elektronlarini tavsiflaydi.
Agar l=0 (s-elektronlar) bo'lsa, elektronning atom yadrosiga nisbatan burchak impulsi nolga teng bo'ladi. Bu faqat elektron yadro atrofida emas, balki yadrodan chetga va orqaga oldinga siljiganida sodir bo'lishi mumkin. s-elektronning elektron buluti shar shakliga ega.
Magnit kvant soni- Elektronning burchak momenti uning magnit momenti bilan ham bog'liq. Magnit kvant soni elektronning magnit momentini tavsiflaydi. Magnit kvant soni elektronning magnit momentini tavsiflaydi va tanlangan yo'nalishga nisbatan yoki magnit maydon yo'nalishiga nisbatan elektron bulutining yo'nalishini ko'rsatadi. Magnit kvant soni har qanday musbat va manfiy butun qiymatlarni, jumladan, nolni ham, – l dan + l gacha bo‘lgan qiymatlarni qabul qilishi mumkin. Masalan, agar l=2 bo'lsa, u 2 l+1=5 qiymatga ega (-2, -1, 0, +1, +2). l=3 bo'lganda qiymatlar soni 2 l+1=7 (-3, -2, -1, 0, +1, +2, +3) bo'ladi. 2 l+1 ga teng bo'lgan magnit kvant sonining qiymatlari soni ma'lum bir pastki darajadagi elektronlar mavjud bo'lishi mumkin bo'lgan energiya holatlari sonidir. Demak, s-elektronlar faqat bitta holatga (2 l+1=1), p-elektronlar 3 ta holatga (2 l+1=3), d-, f-elektronlar mos ravishda 5 va 7 holatga ega. Energiya holatlari odatda energiya xujayralari tomonidan sxematik tarzda belgilanadi, ularni to'rtburchaklar, elektronlar esa bu hujayralardagi o'qlar sifatida tasvirlaydi.
Spin kvant soni- elektronning ichki harakatini xarakterlaydi - spin. Bu elektronning o'z o'qi atrofidagi harakatidan kelib chiqqan magnit momenti bilan bog'liq. Bu kvant soni faqat ikkita qiymatni qabul qilishi mumkin: + 1/2 va -1/2, elektron spinining magnit maydoni elektronning yadro atrofidagi harakati natijasida hosil bo'lgan magnit maydonga parallel yoki antiparallel yo'naltirilganligiga qarab.
Kvant raqamlarining qiymatlari bir xil bo'lgan ikkita elektron (juft): n, I, lekin qarama-qarshi yo'naltirilgan spinli (↓) juft yoki yolg'iz elektronlar deb ataladi. To'yinmagan spinli () elektronlar juftlashtirilmagan deb ataladi.
Pauli printsipi, eng kam energiya printsipi, Xund qoidasi.
Elektronlarning elementlar atomlarida taqsimlanishi uchta asosiy tamoyil bilan belgilanadi: Pauli printsipi, eng kam energiya printsipi va Xund qoidasi.
Pauli printsipi. Shveytsariya fizigi V. Pauli 1925 yilda atomlarning ko'p spektrlarini o'rganib, Pauli printsipi yoki taqiq deb ataladigan xulosaga keldi: "Atomning ikkita elektroni har jihatdan bir-biriga o'xshash bo'lishi taqiqlanadi" yoki bu Xuddi shu narsa, "atomda to'rtta kvant sonining qiymati bir xil bo'lgan ikkita elektron ham bo'lishi mumkin emas." Uch kvant sonining bir xil qiymatlari bilan tavsiflangan elektronlarning energiya holatlari: n, I va m1 odatda energiya xujayrasi bilan belgilanadi.
Pauli printsipiga ko'ra, energiya xujayrasi faqat qarama-qarshi spinli ikkita elektronga ega bo'lishi mumkin
Bitta energiya xujayrasida uchinchi elektronning mavjudligi ularning ikkitasida to'rtta kvant soni bir xil ekanligini anglatadi. Berilgan pastki darajadagi mumkin bo'lgan elektron holatlar soni (4-rasm) ushbu pastki daraja uchun magnit kvant soni qiymatlari soniga teng, ya'ni 21+ 1. Pauli printsipiga ko'ra, ushbu pastki darajadagi elektronlarning maksimal soni , 2 (21+ 1) bo'ladi. Shunday qilib, s pastki sathida 2 ta elektron mumkin; p pastki darajasida 6 ta elektron mavjud; d pastki darajasida 10 ta elektron mavjud; f pastki sathida 14 ta elektron mavjud. Har qanday darajadagi elektronlarning mumkin bo'lgan holatlari soni asosiy kvant sonining kvadratiga va ushbu darajadagi elektronlarning maksimal soniga teng.
Eng kam energiya printsipi.
Atomdagi elektronlarni joylashtirish ketma-ketligi ularning yadro bilan eng katta aloqasiga mos kelishi kerak, ya'ni elektron eng kam energiyaga ega bo'lishi kerak. Shuning uchun, agar pastki darajadagi elektron joylashgan bo'lsa, kamroq energiyaga ega bo'lgan joylar mavjud bo'lsa, elektron yuqori energiya darajasini egallashi shart emas.
Elektron energiyasi asosan asosiy n va orbital / kvant sonlarining qiymatlari bilan aniqlanganligi sababli, birinchi navbatda n va / kvant raqamlari qiymatlari yig'indisi kichikroq bo'lgan pastki darajalar to'ldiriladi. Misol uchun, 4s pastki darajadagi energiya zahirasi (n +/ = 4 +0 = 4) 3d (n + /= 3 + 2 = 5) dan kamroq; 5s (n + / = 5 + 0 = 5) 4d dan kam (n + / = 4 + 2 = 6); 5p(n + / = 5 +1 =6) 4f dan kam (n + 1 = 4+3 = 7). Agar ikkita daraja uchun n va / qiymatlarining yig'indisi teng bo'lsa, u holda birinchi navbatda kichikroq n qiymatiga ega bo'lgan pastki daraja to'ldiriladi, masalan, 3d, 4p, 5s pastki darajalarida n va / qiymatlarining yig'indisi. beshga teng bo'lsa, bu holda asosiy kvant sonining kichikroq qiymatlari bo'lgan pastki darajalar birinchi navbatda n, ya'ni quyidagi ketma-ketlikda to'ldiriladi: 3d-4r-5s.
Agar yaqin pastki darajalarning energiyalari bir-biridan juda kam farq qilsa, bu qoidadan ba'zi istisnolar mavjud. Shunday qilib, 5d pastki sathi 4f dan oldin bitta elektron 5dl bilan to'ldiriladi; 5f dan oldin 6d1-2.
Energiya darajalari va pastki darajalarni to'ldirish quyidagi ketma-ketlikda sodir bo'ladi: ls→2s→2p→3s→3p→4s→ 3d → 4p→ 5s → 4d → 5p→ 6s →(5dl) →4f→ 5d→6p→ 7s→ (6d1). - 2 )→5f→6d→7p
Hund qoidasi.
Berilgan kichik darajadagi elektronlar, birinchi navbatda, har biri alohida hujayrada, juftlashtirilmagan "bo'sh" elektronlar ko'rinishida, boshqacha qilib aytganda, I ning ma'lum bir qiymati uchun atomdagi elektronlar ularning umumiy spin soni bo'lishi uchun joylashgan Masalan, agar uchta p-hujayra uchta elektronni joylashtirishi kerak bo'lsa, ularning har biri shu tarzda alohida hujayrada joylashgan bo'ladi:
Atomlarning elektron formulalari va diagrammalar.
Ko'rib chiqilgan qoidalarni hisobga olgan holda, har qanday element atomlarida elektronlarning energiya darajalari va pastki darajalari bo'yicha taqsimlanishini tasavvur qilish oson. Atomdagi elektronlarning bunday taqsimlanishi elektron formulalar deb ataladigan shaklda yozilgan. Elektron formulalarda s, p, d, f harflari elektronlarning energiya pastki darajalarini bildiradi; Harflar oldidagi raqamlar ma'lum bir elektron joylashgan energiya darajasini ko'rsatadi va yuqori o'ngdagi indeks ma'lum bir pastki darajadagi elektronlar soni. Masalan, 5p3 yozuvi 3 ta elektronning beshinchi energiya darajasining p-kichik darajasida joylashganligini bildiradi.
Har qanday element atomining elektron formulasini tuzish uchun bu elementning davriy sistemadagi sonini bilish va atomdagi elektronlarning taqsimlanishini boshqaradigan asosiy tamoyillarga amal qilish kifoya.
Masalan, oltingugurt, kaltsiy, skandiy, temir va lantan atomlari uchun elektron formulalar yaratishingiz kerak. Davriy jadvaldan biz ushbu elementlarning raqamlarini aniqlaymiz, ular mos ravishda 16, 20, 21, 26, . Bu shuni anglatadiki, bu elementlar atomlarining energiya darajalari va pastki darajalari mos ravishda 16, 20, 21, 26, 57 elektronni o'z ichiga oladi. Pauli printsipiga va eng kam energiya printsipiga, ya'ni energiya darajalari va pastki darajalarni to'ldirish ketma-ketligiga rioya qilgan holda, ushbu elementlarning atomlari uchun elektron formulalar tuzish mumkin:

Atomning elektron qobig'ining tuzilishini energiya hujayralarida elektronlarning joylashishi diagrammasi shaklida ham tasvirlash mumkin.
Temir atomlari uchun bu sxema quyidagi shaklga ega:

Ushbu diagrammada Xund qoidasining amalga oshirilishi aniq ko'rsatilgan. 3d pastki darajasida hujayralarning maksimal soni (to'rtta) juftlashtirilmagan elektronlar bilan to'ldiriladi. Atomdagi elektron qobiq tuzilishining elektron formulalar va diagrammalar ko'rinishidagi tasviri elektronning to'lqin xususiyatlarini aniq aks ettirmaydi. Biroq, har bir s-, p-, d-, f-elektronning o'z elektron bulutiga ega ekanligini unutmaslik kerak. Elektron bulutining boshqa shakli elektronning atom fazosining ma'lum bir hududida bo'lish ehtimoli boshqacha ekanligini ko'rsatadi. m1 magnit kvant sonining qiymatiga qarab, elektron bulutning fazodagi yo'nalishi ham har xil bo'ladi.