Davriy sistemada Mn. Kimyoviy elementlarning davriy jadvali
Shuningdek o'qing
Insoniyat tarixida XIX asr ko'plab fanlar, jumladan kimyo ham isloh qilingan asrdir. Aynan shu davrda Mendeleyevning davriy tizimi va u bilan birga davriy qonun paydo bo'ldi. Aynan u asos bo'ldi zamonaviy kimyo. D.I.Mendeleyevning davriy tizimi - bu kimyoviy va fizik xususiyatlarning moddaning atomining tuzilishi va zaryadiga bog'liqligini belgilaydigan elementlarning tizimliligi.
Hikoya
Davriy davrning boshlanishi 17-asrning uchinchi choragida yozilgan "Elementlarning atom og'irligi bilan xossalarning o'zaro bog'liqligi" kitobi bilan asos solingan. U nisbatan taniqli bo'lgan asosiy tushunchalarni namoyish etdi kimyoviy elementlar(o'sha paytda ulardan faqat 63 tasi bor edi). Bundan tashqari, ularning ko'pchiligi atom massalari noto'g'ri aniqlangan. Bu D.I.Mendeleyevning kashfiyotiga katta xalaqit berdi.
Dmitriy Ivanovich o'z ishini elementlarning xususiyatlarini taqqoslashdan boshladi. Avvalo, u xlor va kaliy ustida ishladi va shundan keyingina ishqoriy metallar bilan ishlashga o'tdi. Kimyoviy elementlar tasvirlangan maxsus kartalar bilan qurollanib, u bir necha bor ushbu "mozaika" ni yig'ishga urinib ko'rdi: u kerakli kombinatsiyalar va gugurtlarni qidirish uchun uni stoliga qo'ydi.
Ko'p harakatlardan so'ng, Dmitriy Ivanovich nihoyat izlayotgan naqshni topdi va elementlarni davriy qatorlarga joylashtirdi. Natijada elementlar orasidagi bo'sh hujayralarni olgan olim barcha kimyoviy elementlar rus tadqiqotchilariga ma'lum emasligini va bu dunyoga kimyo sohasida hali berilmagan bilimlarni berishi kerakligini tushundi. salaflar.

Davriy jadval Mendeleevga tushida paydo bo'lgan va u elementlarni xotiradan to'plagan degan afsonani hamma biladi. yagona tizim. Bu, qo'pol qilib aytganda, yolg'on. Gap shundaki, Dmitriy Ivanovich juda uzoq vaqt ishladi va o'z ishiga diqqatini qaratdi va bu uni juda charchatdi. Mendeleyev elementlar tizimi ustida ishlayotganda bir marta uxlab qoldi. U uyg'onganida, u stolni tugatmaganini tushundi va aksincha, bo'sh hujayralarni to'ldirishda davom etdi. Uning tanishi, universitet o'qituvchisi Inostrantsev davriy jadval Mendeleev orzu qilgan deb qaror qildi va bu mish-mishni talabalari orasida tarqatdi. Bu gipoteza shunday paydo bo'ldi.
Shuhrat
Mendeleevning kimyoviy elementlari Dmitriy Ivanovich tomonidan 19-asrning uchinchi choragida (1869) yaratilgan davriy qonunning aksidir. Aynan 1869 yilda Rossiya kimyoviy hamjamiyatining yig'ilishida Mendeleevning ma'lum bir tuzilmani yaratish to'g'risidagi bildirishnomasi o'qib eshittirildi. Va o'sha yili "Kimyo asoslari" kitobi nashr etildi, unda Mendeleevning kimyoviy elementlarning davriy tizimi birinchi marta nashr etildi. Va kitobda " Tabiiy tizim elementlar va uning ochilmagan elementlarning sifatlarini ko’rsatish uchun ishlatilishi” D.I.Mendeleyev “davriy qonun” tushunchasini birinchi bo’lib qayd etgan.

Tuzilishi va elementlarni joylashtirish qoidalari
Davriy qonunni yaratishda dastlabki qadamlarni Dmitriy Ivanovich 1869-1871 yillarda qo'ygan, o'sha paytda u ushbu elementlarning xususiyatlarining ularning atom massasiga bog'liqligini aniqlash uchun ko'p ishlagan. Zamonaviy versiya ikki o'lchovli jadvalda jamlangan elementlarni ifodalaydi.
Jadvaldagi elementning o'rni ma'lum bir kimyoviy va fizik ma'noga ega. Jadvaldagi elementning joylashuvi bo'yicha siz uning valentligi nima ekanligini bilib olishingiz va boshqasini aniqlashingiz mumkin kimyoviy xususiyatlar. Dmitriy Ivanovich xususiyatlari o'xshash va farqli elementlar o'rtasida aloqa o'rnatishga harakat qildi.

U o'sha davrda ma'lum bo'lgan kimyoviy elementlarning tasnifini valentlik va atom massasiga asosladi. Mendeleyev elementlarning nisbiy xossalarini solishtirib, barcha ma’lum kimyoviy elementlarni bir sistemaga birlashtiradigan naqsh topishga harakat qildi. Ularni ortib borayotgan atom massalari asosida tartibga solib, u har bir qatorda davriylikka erishdi.
Tizimni yanada rivojlantirish
1969 yilda paydo bo'lgan davriy jadval bir necha marta takomillashtirildi. 1930-yillarda asil gazlarning paydo bo'lishi bilan elementlarning massaga emas, balki atom raqamiga yangi bog'liqligini aniqlash mumkin edi. Keyinchalik atom yadrolaridagi protonlar sonini aniqlash mumkin bo'ldi va bu elementning atom raqamiga to'g'ri kelishi ma'lum bo'ldi. 20-asr olimlari elektron energiyani o'rganishdi, bu davriylikka ham ta'sir qiladi. Bu elementlarning xususiyatlari haqidagi g'oyalarni tubdan o'zgartirdi. Bu nuqta Mendeleev davriy jadvalining keyingi nashrlarida o'z aksini topdi. Elementlarning xossalari va xususiyatlarining har bir yangi kashfiyoti jadvalga organik ravishda mos keladi.
Mendeleyev davriy sistemasining xarakteristikasi
Davriy jadval davrlarga bo'linadi (gorizontal joylashgan 7 qator), ular o'z navbatida katta va kichikga bo'linadi. Davr ishqoriy metalldan boshlanadi va metall bo'lmagan xususiyatlarga ega element bilan tugaydi.
Dmitriy Ivanovichning jadvali vertikal ravishda guruhlarga bo'lingan (8 ustun). Davriy jadvaldagi ularning har biri ikkita kichik guruhdan, ya'ni asosiy va ikkilamchi guruhdan iborat. Koʻp bahs-munozaralardan soʻng D.I.Mendeleyev va uning hamkasbi U.Ramseyning taklifiga koʻra, nol deb ataladigan guruhni joriy etishga qaror qilindi. U inert gazlarni (neon, geliy, argon, radon, ksenon, kripton) o'z ichiga oladi. 1911-yilda olimlar F.Soddidan davriy sistemada izotoplar deb ataladigan ajratilmaydigan elementlarni joylashtirish taklif qilindi - ular uchun alohida hujayralar ajratildi.

Davriy tizimning to'g'riligi va aniqligiga qaramay, ilmiy jamoatchilik uzoq vaqt davomida bu kashfiyotni tan olishni xohlamadi. Ko'pgina buyuk olimlar D.I.Mendeleevning ishini masxara qilishgan va hali kashf etilmagan elementning xususiyatlarini oldindan aytib bo'lmaydi, deb hisoblashgan. Ammo taxmin qilingan kimyoviy elementlar (va bular, masalan, skandiy, galiy va germaniy) kashf etilgandan so'ng, Mendeleyev tizimi va uning davriy qonuni kimyo faniga aylandi.
Zamonaviy davrdagi jadval
Mendeleyevning elementlar davriy tizimi atom-molekulyar fanga oid koʻpgina kimyoviy va fizik kashfiyotlarning asosi hisoblanadi. Zamonaviy kontseptsiya element aynan buyuk olim tufayli shakllangan. Mendeleyev davriy tizimining paydo bo'lishi haqidagi g'oyalar tubdan o'zgarishlarga olib keldi turli xil ulanishlar Va oddiy moddalar Oh. Olimlar tomonidan davriy jadvalning yaratilishi kimyo va unga aloqador barcha fanlarning rivojlanishiga katta ta’sir ko‘rsatdi.
Elementlarning davriy jadvalini hammangiz ko‘rgan bo‘lsangiz kerak. Ehtimol, u sizni hali ham orzularingizda ta'qib qilishi mumkin yoki u hozircha devorni bezatgan vizual fondir. maktab sinfi. Biroq, tasodifiy ko'rinadigan hujayralar to'plamida ko'rganimizdan ham ko'proq narsa bor.
Davriy jadval (yoki PT, biz buni ushbu maqola davomida vaqti-vaqti bilan chaqiramiz) va uni tashkil etuvchi elementlar siz hech qachon taxmin qilmagan xususiyatlarga ega. Jadval yaratishdan tortib, unga yakuniy elementlarni qo‘shishgacha ko‘pchilik bilmaydigan o‘nta faktni keltiramiz.
10. Mendeleyev yordam oldi
Davriy jadval 1869-yilda, soqolli Dimitriy Mendeleev tomonidan tuzilganidan beri qo'llanila boshlandi. Ko'pchilik Mendeleev bu stol ustida ishlagan yagona odam deb o'ylaydi va shu tufayli u asrning eng yorqin kimyogari bo'ldi. Biroq, uning sa'y-harakatlariga ushbu ulkan elementlar to'plamini to'ldirishga muhim hissa qo'shgan bir qancha evropalik olimlar yordam berdi.
Mendeleev ota sifatida mashhur davriy jadval, lekin uni tuzganida, jadvalning barcha elementlari allaqachon ochiq emas edi. Qanday qilib bu mumkin bo'ldi? Olimlar aqldan ozganliklari bilan mashhur...
9. Oxirgi qo'shilgan elementlar

Ishoning yoki ishonmang, davriy jadval 1950-yillardan beri deyarli o'zgarmadi. Biroq, 2016 yil 2 dekabrda bir vaqtning o'zida to'rtta yangi element qo'shildi: nihonium (element No 113), moskovium (element No 115), tennessin (element No 117) va oganesson (element No 118). Ushbu yangi elementlar o'z nomlarini faqat 2016 yil iyun oyida oldi, chunki ular PTga rasman qo'shilishidan oldin besh oylik ko'rib chiqish kerak edi.
Uchta element olingan shaharlar yoki shtatlar nomi bilan atalgan, Oganesson esa rus yadro fizigi Yuriy Oganesyan sharafiga ushbu elementni olishga qo'shgan hissasi uchun nomlangan.
8. Qaysi harf jadvalda yo'q?

Lotin alifbosida 26 ta harf mavjud va ularning har biri muhim ahamiyatga ega. Biroq, Mendeleev buni sezmaslikka qaror qildi. Jadvalga qarang va ayting-chi, qaysi harf omadsiz? Maslahat: tartibda qidiring va topgan har bir harfdan keyin barmoqlaringizni buking. Natijada, siz "yo'qolgan" harfni topasiz (qo'lingizda barcha o'n barmog'ingiz bo'lsa). Siz taxmin qildingizmi? Bu 10-raqamli harf, "J" harfi.
Ularning aytishicha, "bir" yolg'iz odamlarning soni. Xo'sh, "J" harfini yolg'izlarning harfi deb atashimiz kerakmi? Ammo bir qiziq fakt: 2000-yilda Qo‘shma Shtatlarda tug‘ilgan o‘g‘il bolalarning ko‘pchiligiga shu harf bilan boshlangan ismlar berilgan. Shunday qilib, bu maktub e'tibordan chetda qolmadi.
7. Sintezlangan elementlar

Siz allaqachon bilganingizdek, davriy jadvalda 118 ta element mavjud. Laboratoriyada ushbu 118 ta elementdan qanchasi olinganligini taxmin qila olasizmi? Hamma narsadan umumiy ro'yxat V tabiiy sharoitlar faqat 90 ta elementni topish mumkin.
Sizningcha, sun'iy ravishda yaratilgan 28 ta element juda ko'pmi? Xo'sh, mening so'zimni qabul qiling. Ular 1937 yildan beri sintez qilingan va olimlar buni bugungi kunda ham davom ettirmoqdalar. Ushbu elementlarning barchasini jadvalda topishingiz mumkin. 95 dan 118 gacha elementlarga qarang, bu elementlarning barchasi bizning sayyoramizda topilmaydi va laboratoriyalarda sintez qilingan. Xuddi shu narsa 43, 61, 85 va 87 raqamli elementlarga ham tegishli.
6. 137-element

20-asrning o'rtalarida Richard Feynman ismli mashhur olim hammani hayratda qoldiradigan baland ovozda bayonot berdi. ilmiy dunyo sayyoramizdan. Uning fikricha, agar biz 137-elementni qachondir kashf qilsak, undagi proton va neytronlar sonini aniqlay olmaymiz. 1/137 raqami diqqatga sazovordir, chunki u elektronning fotonni yutish yoki chiqarish ehtimolini tavsiflovchi nozik struktura konstantasining qiymatidir. Nazariy jihatdan, №137 elementda 137 ta elektron va fotonni yutish ehtimoli 100 foiz bo'lishi kerak. Uning elektronlari yorug'lik tezligida aylanadi. Bundan ham hayratlanarlisi shundaki, 139-elementning elektronlari mavjud bo'lishi uchun yorug'lik tezligidan tezroq aylanishi kerak.
Hali fizikadan charchadingizmi? 137 raqami fizikaning uchta muhim sohasini birlashtirganini bilish sizni qiziqtirishi mumkin: yorug'lik tezligi nazariyasi, kvant mexanikasi va elektromagnetizm. 1900-yillarning boshidan beri fiziklar 137 raqami Buyuk fiziklarning asosi bo'lishi mumkinligini taxmin qilishdi. yagona nazariya, bu yuqoridagi uchta sohani o'z ichiga oladi. Tan olish kerak, bu NUJ va Bermud uchburchagi haqidagi afsonalar kabi aql bovar qilmaydigan darajada eshitiladi.
5. Ismlar haqida nima deya olasiz?

Elementlarning deyarli barcha nomlari ma'lum ma'noga ega, garchi bu darhol aniq bo'lmasa ham. Yangi elementlarning nomlari o'zboshimchalik bilan berilmaydi. Men faqat xayolimga kelgan birinchi so'z bilan elementni nomlagan bo'lardim. Masalan, "kerflump". Menimcha yomon emas.
Odatda, element nomlari beshta asosiy toifadan biriga kiradi. Birinchisi mashhur olimlarning ismlari, klassik versiya- Eynshteyn. Bundan tashqari, elementlar birinchi qayd qilingan joylarga qarab o'z nomlarini olishlari mumkin, masalan, germaniy, ameritsiy, galliy va boshqalar. qo'shimcha variant sayyoralarning nomlaridan foydalaniladi. Uran elementi birinchi marta Uran sayyorasi kashf etilganidan ko'p o'tmay topilgan. Elementlar mifologiya bilan bog'liq nomlarga ega bo'lishi mumkin, masalan, qadimgi yunon titanlari nomi bilan atalgan titan va momaqaldiroq xudosi nomidagi toriy mavjud (yoki "qasoskor" yulduzi, siz nimani afzal ko'rishingizga qarab).
Va nihoyat, elementlarning xususiyatlarini tavsiflovchi nomlar mavjud. Argon yunoncha "argos" so'zidan kelib chiqqan bo'lib, "dangasa" yoki "sekin" degan ma'noni anglatadi. Nomi bu gaz faol emasligini ko'rsatadi. Brom - nomi yunoncha so'zdan kelib chiqqan yana bir element. "Bromos" "xush hid" degan ma'noni anglatadi va u brom hidini juda yaxshi tasvirlaydi.
4. Jadvalni yaratish "evrika momenti" edimi?

Agar sevsangiz karta o'yinlari, unda bu fakt siz uchun. Mendeleev qandaydir tarzda barcha elementlarni tartibga solish va buning uchun tizimni topishi kerak edi. Tabiiyki, toifalar jadvalini yaratish uchun u solitairega murojaat qildi (yaxshi, yana nima?) Mendeleev har bir elementning atom og'irligini alohida kartaga yozib qo'ydi va keyin o'zining ilg'or solitaire o'yinini joylashtirishni boshladi. U elementlarni o'ziga xos xususiyatlariga ko'ra joylashtirdi va keyin ularni atom og'irligiga qarab har bir ustunga joylashtirdi.
Ko'pchilik oddiy solitaire o'ynay olmaydi, shuning uchun bu solitaire o'yini ta'sirli. Keyingi nima? Ehtimol, kimdir shaxmat yordamida astrofizikada inqilob qiladi yoki galaktikaning chekkasiga etib borishga qodir raketa yaratadi. Mendeleev oddiy o'yin kartalari bilan bunday ajoyib natijaga erishganini hisobga olsak, bunda g'ayrioddiy narsa bo'lmaydi.
3. Baxtsiz asil gazlar

Argonni koinotimiz tarixidagi eng dangasa va eng sekin element sifatida qanday tasniflaganimizni eslaysizmi? Aftidan, Mendeleevni ham xuddi shunday tuyg'ular bosib olgan. 1894 yilda sof argon birinchi marta olinganida, u jadvalning hech bir ustuniga to'g'ri kelmadi, shuning uchun olim yechim izlash o'rniga, uning mavjudligini shunchaki inkor etishga qaror qildi.
Bundan ham ajablanarlisi shundaki, argon dastlab bu taqdirga duchor bo'lgan yagona element emas edi. Argondan tashqari yana beshta element tasniflanmagan. Bu radon, neon, kripton, geliy va ksenonga ta'sir qildi va hamma ularning mavjudligini shunchaki rad etdi, chunki Mendeleev jadvalda ular uchun joy topa olmadi. Bir necha yillik qayta guruhlash va qayta tasniflashdan so'ng, bu elementlar (deb ataladi inert gazlar) haqiqatan ham mavjud deb tan olingan munosib klubga qo'shilish baxtiga muyassar bo'ldi.
2. Atom sevgisi

O'zini romantik deb hisoblaydiganlar uchun maslahat. Davriy jadvalning qog'oz nusxasini oling va barcha murakkab va nisbatan keraksiz o'rta ustunlarni kesib oling, shunda siz 8 ta ustun bilan qolasiz (jadvalning "qisqa" shaklini olasiz). Uni IV guruhning o'rtasiga katlayın - va siz qaysi elementlar bir-biri bilan birikma hosil qilishi mumkinligini bilib olasiz.
Katlanganda "o'padigan" elementlar barqaror birikmalar hosil qila oladi. Ushbu elementlar bir-birini to'ldiruvchi elektron tuzilmalarga ega va bir-biri bilan birlashadi. Va agar bu Romeo va Juliet yoki Shrek va Fiona kabi haqiqiy sevgi bo'lmasa, men sevgi nima ekanligini bilmayman.
1. Uglerod qoidalari

Karbon o'yinning markazida bo'lishga harakat qilmoqda. Siz uglerod haqida hamma narsani bilasiz deb o'ylaysiz, lekin bu siz tushunganingizdan ko'ra muhimroq emas; U barcha ma'lum birikmalarning yarmidan ko'pida mavjudligini bilasizmi? Va barcha tirik organizmlar vaznining 20 foizi uglerod ekanligi haqida nima deyish mumkin? Bu juda g'alati, lekin o'zingizni tuting: tanangizdagi har bir uglerod atomi bir vaqtlar fraktsiyaning bir qismi bo'lgan karbonat angidrid atmosferada. Uglerod nafaqat sayyoramizning super elementi, balki butun koinotdagi to'rtinchi eng keng tarqalgan elementdir.
Agar davriy jadval partiya bilan taqqoslansa, u holda uglerod uning asosiy mezbonidir. Va u hamma narsani to'g'ri tashkil qilishni biladigan yagona odamga o'xshaydi. Xo'sh, boshqa narsalar qatori, bu barcha olmoslarning asosiy elementidir, shuning uchun uning barcha intruzivligi uchun u ham porlaydi!
1869-yil mart oyida Dmitriy Mendeleyev tomonidan kimyoviy elementlarning davriy sistemasining ochilishi kimyoda haqiqiy yutuq bo‘ldi. Rossiyalik olim kimyoviy elementlar haqidagi bilimlarni tizimlashtirishga va ularni maktab o'quvchilari hali ham kimyo darslarida o'rganishlari kerak bo'lgan jadval shaklida taqdim etishga muvaffaq bo'ldi. Davriy jadval ushbu murakkab va qiziqarli fanning jadal rivojlanishi uchun asos bo'ldi va uning kashf etilishi tarixi afsonalar va afsonalar bilan qoplangan. Ilm-fanga qiziquvchilarning barchasi uchun Mendeleev davriy elementlar jadvalini qanday kashf etgani haqidagi haqiqatni bilish qiziq bo'ladi.
Davriy jadvalning tarixi: hammasi qanday boshlangan
Ma'lum kimyoviy elementlarni tasniflash va tizimlashtirishga urinishlar Dmitriy Mendeleyevdan ancha oldin qilingan. Dobereyner, Nyulands, Meyer va boshqalar kabi mashhur olimlar o'zlarining elementlar tizimini taklif qilishdi. Biroq, kimyoviy elementlar va ularning to'g'ri atom massalari to'g'risida ma'lumotlar yo'qligi sababli, taklif qilingan tizimlar to'liq ishonchli emas edi.
Davriy jadvalning kashf etilishi tarixi 1869 yilda, rus olimi Rossiya kimyo jamiyati yig'ilishida hamkasblariga o'zining kashfiyoti haqida gapirib bergan paytdan boshlanadi. Olim tomonidan taklif qilingan jadvalda kimyoviy elementlar molekulyar og'irligining kattaligi bilan ta'minlangan xossalariga qarab joylashtirilgan.
Davriy jadvalning qiziqarli xususiyati, shuningdek, kelajakda olim tomonidan bashorat qilingan ochiq kimyoviy elementlar (germaniy, galiy, skandiy) bilan to'ldirilgan bo'sh hujayralar mavjudligi edi. Davriy sistema kashf etilgandan beri unga ko'p marta qo'shimchalar va o'zgartirishlar kiritilgan. Shotlandiya kimyogari Uilyam Ramsay bilan birgalikda Mendeleev jadvalga bir guruh inert gazlarni (nol guruhi) qo'shdi.
Keyinchalik, Mendeleev davriy sistemasi tarixi boshqa fan - fizikadagi kashfiyotlar bilan bevosita bog'liq edi. Davriy elementlar jadvali ustidagi ishlar hozirgi kungacha davom etmoqda va zamonaviy olimlar kashf etilishi bilan yangi kimyoviy elementlarni qo'shib boradilar. Dmitriy Mendeleev davriy tizimining ahamiyatini ortiqcha baholash qiyin, chunki u tufayli:
- Allaqachon kashf etilgan kimyoviy elementlarning xossalari haqidagi bilimlar tizimlashtirildi;
- Yangi kimyoviy elementlarning kashf etilishini bashorat qilish mumkin bo'ldi;
- Fizikaning atom fizikasi va yadro fizikasi kabi tarmoqlari rivojlana boshladi;
Davriy qonun bo'yicha kimyoviy elementlarni tasvirlashning ko'plab variantlari mavjud, ammo eng mashhur va keng tarqalgan variant - bu hamma uchun tanish bo'lgan davriy jadval.
Davriy jadvalning yaratilishi haqidagi afsonalar va faktlar
Davriy jadvalning kashf etilishi tarixidagi eng keng tarqalgan noto'g'ri tushuncha - olim uni tushida ko'rgan. Darhaqiqat, Dmitriy Mendeleevning o'zi bu afsonani rad etib, davriy qonun haqida ko'p yillar davomida o'ylaganligini aytdi. Kimyoviy elementlarni sistemalashtirish uchun ularning har birini alohida kartochkaga yozgan va ularni bir-biriga o'xshash xususiyatlariga qarab qatorlar qilib bir necha marta birlashtirgan.
Olimning "bashoratli" orzusi haqidagi afsonani Mendeleevning qisqa uyqu bilan uzilib qolgan kunlar davomida kimyoviy elementlarni tizimlashtirish ustida ishlaganligi bilan izohlash mumkin. Biroq, faqat olimning mashaqqatli mehnati va tabiiy iste'dodi uzoq kutilgan natijani berdi va Dmitriy Mendeleevga jahon miqyosida shuhrat keltirdi.
Maktabda va ba'zan universitetda ko'plab talabalar davriy jadvalni yodlashga yoki hech bo'lmaganda taxminan navigatsiya qilishga majbur bo'lishadi. Buning uchun inson nafaqat ega bo'lishi kerak yaxshi xotira, balki mantiqiy fikrlash, elementlarni alohida guruhlar va sinflarga bog'lash. Jadvalni o'rganish BrainApps dasturida o'qish orqali miyasini doimo yaxshi holatda saqlaydigan odamlar uchun eng osondir.
Maktabga borgan har bir kishi o'qishi kerak bo'lgan majburiy fanlardan biri kimyo ekanligini eslaydi. Siz uni yoqtirishingiz yoki yoqtirmasligingiz mumkin - bu muhim emas. Va, ehtimol, bu fan bo'yicha ko'p bilimlar allaqachon unutilgan va hayotda ishlatilmaydi. Biroq, har bir kishi, ehtimol, D.I.Mendeleevning kimyoviy elementlar jadvalini eslaydi. Ko'pchilik uchun u har bir kvadratda kimyoviy elementlarning nomlarini ko'rsatadigan ma'lum harflar yozilgan ko'p rangli jadval bo'lib qoldi. Ammo bu erda biz kimyo haqida gapirmaymiz va yuzlab narsalarni tasvirlaymiz kimyoviy reaksiyalar va jarayonlar, lekin biz sizga davriy jadvalning birinchi navbatda qanday paydo bo'lganini aytib beramiz - bu hikoya har qanday odam uchun va, albatta, qiziqarli va foydali ma'lumotlarga chanqoq bo'lganlar uchun qiziqarli bo'ladi.
Bir oz fon
1668 yilda taniqli irland kimyogari, fizigi va ilohiyotchisi Robert Boyl kimyoga oid ko'plab afsonalar yo'q qilingan va ajralmas kimyoviy elementlarni izlash zarurligini muhokama qilgan kitobini nashr etdi. Olim, shuningdek, atigi 15 elementdan iborat ularning ro'yxatini ham keltirdi, lekin ko'proq elementlar bo'lishi mumkin degan fikrni tan oldi. Bu nafaqat yangi elementlarni izlashda, balki ularni tizimlashtirishda ham boshlang'ich nuqta bo'ldi.
Yuz yil o'tgach, frantsuz kimyogari Antuan Lavuazye 35 ta elementni o'z ichiga olgan yangi ro'yxat tuzdi. Ulardan 23 tasi keyinchalik ajralmas ekanligi aniqlandi. Ammo yangi elementlarni izlash butun dunyo olimlari tomonidan davom ettirildi. VA asosiy rol Bu jarayonda mashhur rus kimyogari Dmitriy Ivanovich Mendeleev muhim rol o'ynadi - u birinchi bo'lib elementlarning atom massasi va ularning tizimdagi joylashuvi o'rtasida bog'liqlik bo'lishi mumkinligi haqidagi farazni ilgari surdi.
Mashaqqatli mehnat va kimyoviy elementlarni taqqoslash tufayli Mendeleev elementlar o'rtasidagi bog'liqlikni aniqlay oldi, ularda ular bitta bo'lishi mumkin va ularning xossalari oddiy narsa emas, balki vaqti-vaqti bilan takrorlanadigan hodisani ifodalaydi. Natijada, 1869 yil fevral oyida Mendeleev birinchi davriy qonunni ishlab chiqdi va mart oyida Rossiya kimyo jamiyatiga kimyo tarixchisi N. A. Menshutkin tomonidan "Elementlarning atom og'irligi bilan xossalarning aloqasi" ma'ruzasi taqdim etildi. Keyin, o'sha yili Germaniyaning "Zeitschrift fur Chemie" jurnalida Mendeleevning nashri va 1871 yilda yana bir nemis jurnali "Annalen der Chemie" olimning uning kashfiyotiga bag'ishlangan yangi keng qamrovli nashrini nashr etdi.
Davriy jadvalni yaratish

1869 yilga kelib, asosiy g'oya Mendeleev tomonidan allaqachon shakllantirilgan va juda qisqa vaqt ichida, lekin uzoq vaqt davomida u nima ekanligini aniq ko'rsatadigan biron bir tartibli tizimga rasmiylashtira olmadi. Hamkasbi A.A. Inostrantsev bilan suhbatlarning birida u hatto uning boshida hamma narsa ishlab chiqilganligini aytdi, lekin u hamma narsani stolga qo'ya olmadi. Shundan so'ng, Mendeleevning tarjimai holiga ko'ra, u uyqu uchun tanaffuslarsiz uch kun davom etgan stolida mashaqqatli ishlay boshladi. Ular elementlarni jadvalga joylashtirishning har xil usullarini sinab ko'rdilar, shuningdek, o'sha paytda fan barcha kimyoviy elementlar haqida hali bilmaganligi sababli ishni murakkablashtirdi. Ammo, shunga qaramay, jadval hali ham yaratilgan va elementlar tizimlashtirilgan.
Mendeleev tushi haqidagi afsona
Ko'pchilik D.I.Mendeleev o'z stoli haqida orzu qilgan hikoyani eshitgan. Ushbu versiya yuqorida aytib o'tilgan Mendeleevning hamkasbi A. A. Inostrantsev tomonidan faol ravishda tarqatilgan. kulgili hikoya bu bilan u shogirdlarini xushnud etdi. Uning so'zlariga ko'ra, Dmitriy Ivanovich uxlab yotgan va tushida barcha kimyoviy elementlar joylashtirilgan stolini aniq ko'rgan. to'g'ri tartibda. Bundan keyin talabalar hatto 40° aroq ham xuddi shunday topilgan, deb hazil qilishdi. Ammo uyqu bilan hikoya qilish uchun hali ham haqiqiy shartlar mavjud edi: yuqorida aytib o'tilganidek, Mendeleev stolda uxlamasdan va dam olmasdan ishladi va Inostrantsev bir marta uni charchagan va charchagan holda topdi. Kun davomida Mendeleev qisqa dam olishga qaror qildi va oradan biroz vaqt o'tgach, u to'satdan uyg'ondi va darhol bir varaq qog'ozni oldi va ustiga tayyor stol chizdi. Ammo olimning o'zi bu voqeani tush bilan rad etib: "Men bu haqda yigirma yildan beri o'yladim va siz o'ylaysiz: men o'tirgan edim va birdan ... tayyor bo'ldi". Shunday qilib, tushning afsonasi juda jozibali bo'lishi mumkin, ammo stolni yaratish faqat mashaqqatli mehnat orqali mumkin edi.

Keyingi ish
1869 yildan 1871 yilgacha bo'lgan davrda Mendeleev ilmiy jamoatchilik moyil bo'lgan davriylik g'oyalarini ishlab chiqdi. Va biri muhim bosqichlari bu jarayon Tizimdagi har qanday element boshqa elementlarning xossalari bilan solishtirganda uning xususiyatlarining umumiyligiga asoslanib, ega bo'lishi kerak degan tushuncha mavjud edi. Shunga asoslanib, shuningdek, shisha hosil qiluvchi oksidlarning o'zgarishi bo'yicha tadqiqotlar natijalariga tayangan holda, kimyogar ba'zi elementlarning, shu jumladan uran, indiy, berilliy va boshqalarning atom massalari qiymatlariga tuzatishlar kiritishga muvaffaq bo'ldi.
Mendeleev, albatta, jadvalda qolgan bo'sh hujayralarni tezda to'ldirishni xohladi va 1870 yilda u fanga noma'lum bo'lgan kimyoviy elementlarning tez orada kashf etilishini, atom massalari va xossalarini hisoblab chiqishini bashorat qildi. Ulardan birinchisi galiy (1875-yilda topilgan), skandiy (1879-yilda topilgan) va germaniy (1885-yilda topilgan). Keyin bashoratlarni amalga oshirish davom etdi va yana sakkizta yangi element topildi, jumladan: poloniy (1898), reniy (1925), texnetiy (1937), fransiy (1939) va astatin (1942-1943). Aytgancha, 1900 yilda D.I.Mendeleev va shotlandiyalik kimyogari Uilyam Ramsay jadvalga nol guruhining elementlarini ham kiritish kerak degan xulosaga kelishdi - 1962 yilgacha ular inert gazlar, keyin esa - asil gazlar.
Davriy jadvalni tashkil etish
D.I.Mendeleyev jadvalidagi kimyoviy elementlar massasining ortishiga qarab qatorlar bo‘yicha joylashtirilgan va ulardagi elementlar o‘xshash xususiyatlarga ega bo‘lishi uchun qatorlar uzunligi tanlangan. Misol uchun, radon, ksenon, kripton, argon, neon va geliy kabi asil gazlar boshqa elementlar bilan reaksiyaga kirishish qiyin, shuningdek, past kimyoviy reaktivlikka ega, shuning uchun ular o'ng ustunda joylashgan. Va chap ustundagi elementlar (kaliy, natriy, lityum va boshqalar) boshqa elementlar bilan yaxshi reaksiyaga kirishadi va reaktsiyalarning o'zi portlovchi hisoblanadi. Oddiy qilib aytganda, har bir ustun ichida elementlar bir ustundan ikkinchisiga o'zgarib turadigan o'xshash xususiyatlarga ega. 92-songacha bo'lgan barcha elementlar tabiatda uchraydi va 93-sondan boshlanadi sun'iy elementlar, bu faqat laboratoriya sharoitida yaratilishi mumkin.
Dastlabki versiyada davriy tizim faqat tabiatda mavjud bo'lgan tartibning aksi sifatida tushunilgan va nima uchun hamma narsa shunday bo'lishi kerakligi haqida hech qanday tushuntirishlar yo'q edi. Va faqat u paydo bo'lganda kvant mexanikasi, jadvaldagi elementlar tartibining haqiqiy ma'nosi aniq bo'ldi.
Ijodiy jarayondagi darslar
Qanday darslar haqida gapirish ijodiy jarayon D.I.Mendeleyev tomonidan davriy sistemani yaratishning butun tarixidan ajratib olish mumkin, bu borada ingliz tadqiqotchisining fikrlarini misol qilib keltirishimiz mumkin ijodiy fikrlash Grem Uolles va frantsuz olimi Anri Puankare. Keling, ularga qisqacha to'xtalib o'tamiz.
Puankare (1908) va Grem Uolles (1926) tadqiqotlariga ko'ra, ijodiy fikrlashning to'rtta asosiy bosqichi mavjud:
- Tayyorgarlik- asosiy muammoni shakllantirish bosqichi va uni hal qilishning birinchi urinishlari;
- Inkubatsiya- jarayondan vaqtincha chalg'itadigan bosqich, ammo muammoning echimini topish bo'yicha ishlar ongsiz darajada amalga oshiriladi;
- Insight– intuitiv yechim joylashgan bosqich. Bundan tashqari, bu yechim muammoga mutlaqo aloqasi bo'lmagan vaziyatda topilishi mumkin;
- Imtihon- yechimni sinovdan o'tkazish va amalga oshirish bosqichi, bunda ushbu yechim sinovdan o'tkaziladi va uning keyingi rivojlanishi mumkin.
Ko'rib turganimizdek, o'z jadvalini yaratish jarayonida Mendeleev intuitiv ravishda ushbu to'rt bosqichni aniq kuzatib bordi. Buning qanchalik samarali ekanligi natijalar bilan baholanishi mumkin, ya'ni. jadval yaratilganligi bilan. Va uning yaratilishi nafaqat kimyo fani uchun, balki butun insoniyat uchun katta qadam bo'lganini hisobga olsak, yuqoridagi to'rt bosqichni ikkala amalga oshirish uchun ham qo'llash mumkin. kichik loyihalar, va global rejalarni amalga oshirish uchun. Esda tutish kerak bo'lgan asosiy narsa shundaki, biz ularni tushida ko'rishni qanchalik xohlamasin va qancha uxlamasak ham, o'z-o'zidan biron bir kashfiyot, muammoning yagona echimi topilmaydi. Biror narsa ishlab chiqilishi uchun kimyoviy elementlar jadvalini yaratish yoki yangi marketing rejasini ishlab chiqish muhim emas, siz ma'lum bilim va ko'nikmalarga ega bo'lishingiz, shuningdek, o'z potentsialingizdan mohirona foydalanishingiz va qattiq ishlashingiz kerak.
Ishlaringizda muvaffaqiyatlar va rejalaringizni muvaffaqiyatli amalga oshirishingizni tilab qolamiz!
Hatto maktabda ham, kimyo darslarida o'tirganimizda ham, sinf yoki kimyoviy laboratoriya devoridagi stolni eslaymiz. Ushbu jadvalda insoniyatga ma'lum bo'lgan barcha kimyoviy elementlarning tasnifi, Yer va butun koinotni tashkil etuvchi asosiy komponentlar mavjud. Keyin biz bu haqda o'ylay olmadik davriy jadval eng buyuklaridan biri ekanligi shubhasiz ilmiy kashfiyotlar, bu bizning asosimizdir zamonaviy bilim kimyo haqida.
D. I. Mendeleyev tomonidan kimyoviy elementlarning davriy tizimi
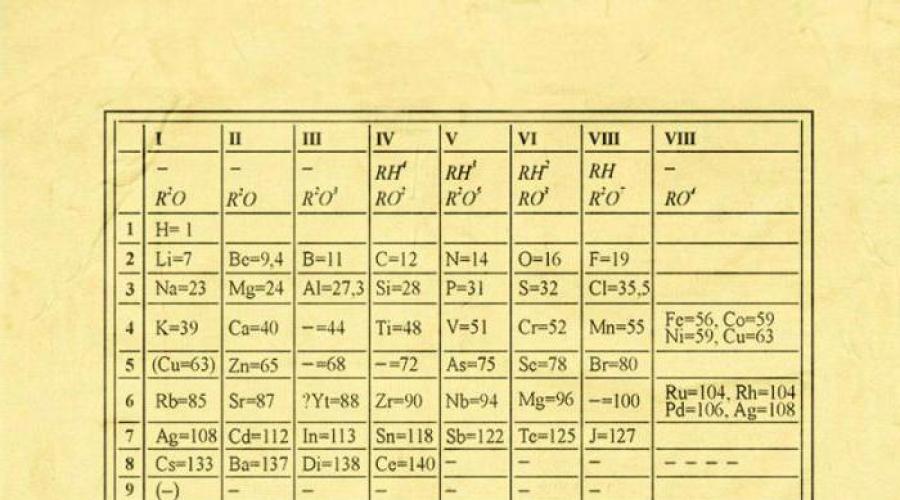
Bir qarashda, uning g'oyasi aldamchi darajada oddiy ko'rinadi: tartibga solish kimyoviy elementlar atomlarining og'irligini oshirish tartibida. Bundan tashqari, ko'p hollarda bu kimyoviy va jismoniy xususiyatlar Har bir element jadvaldagi oldingi elementiga o'xshaydi. Bu naqsh birinchi elementlardan tashqari barcha elementlar uchun paydo bo'ladi, chunki ularning oldida atom og'irligi bo'yicha ularga o'xshash elementlar yo'q. Aynan shu xususiyatning kashfiyoti tufayli biz devor taqvimiga o'xshab jadvalga elementlarning chiziqli ketma-ketligini joylashtirishimiz va shu bilan juda ko'p sonli kimyoviy elementlarni aniq va izchil shaklda birlashtira olamiz. Albatta, bugungi kunda elementlar tizimini tartibga solish uchun atom raqami (protonlar soni) tushunchasidan foydalanamiz. Bu deb atalmishni hal qilishga yordam berdi texnik muammo"Bir juft almashtirish" davriy jadval ko'rinishida tub o'zgarishlarga olib kelmadi.
IN davriy jadval barcha elementlar atom raqami, elektron konfiguratsiyasi va takrorlanuvchi kimyoviy xossalari asosida tartiblangan. Jadvaldagi qatorlar nuqtalar, ustunlar esa guruhlar deb ataladi. 1869-yilga borib taqaladigan birinchi jadval bor-yoʻgʻi 60 ta elementni oʻz ichiga olgan boʻlsa, endi jadvalni bugungi kunda bizga maʼlum boʻlgan 118 ta elementni sigʻdirish uchun kattalashtirish kerak edi.
Mendeleyev davriy sistemasi nafaqat elementlarni, balki ularning eng xilma-xil xususiyatlarini ham tizimlashtiradi. Ko'pgina savollarga (nafaqat imtihon savollariga, balki ilmiy savollarga ham) to'g'ri javob berish uchun kimyogarning ko'z oldida davriy jadval bo'lishi etarli.
1M7iKKVnPJE YouTube identifikatori yaroqsiz.
Davriy qonun
Ikkita formulalar mavjud davriy qonun kimyoviy elementlar: klassik va zamonaviy.
Klassik, uning kashfiyotchisi D.I. Mendeleev: oddiy jismlarning xossalari, shuningdek, elementlar birikmalarining shakllari va xossalari davriy ravishda elementlarning atom og'irliklarining qiymatlariga bog'liq.
Zamonaviy: oddiy moddalarning xossalari, shuningdek elementlar birikmalarining xossalari va shakllari davriy ravishda elementlar atomlari yadrosining zaryadiga (tartib raqami) bog'liq.
Davriy qonunning grafik tasviri elementlarning davriy tizimi bo'lib, u ifodalaydi tabiiy tasnif kimyoviy elementlar atomlarining zaryadlariga qarab elementlar xossalarining muntazam o'zgarishiga asoslangan. Elementlarning davriy jadvalining eng keng tarqalgan tasvirlari D.I. Mendeleyev shakllari qisqa va uzun.

Davriy sistemaning guruhlari va davrlari
Guruhlarda davriy sistemada vertikal qatorlar deyiladi. Guruhlarda elementlar atribut bo'yicha birlashtiriladi eng yuqori daraja oksidlarda oksidlanish. Har bir guruh asosiy va ikkinchi darajali kichik guruhlardan iborat. Asosiy kichik guruhlarga kichik davrlar elementlari va bir xil xususiyatlarga ega bo'lgan katta davrlar elementlari kiradi. Yon kichik guruhlar faqat katta davrlar elementlaridan iborat. Asosiy va ikkilamchi kichik guruhlar elementlarining kimyoviy xossalari sezilarli darajada farqlanadi.
Davr atom (atom) raqamlarining ortib borayotgan tartibida joylashgan gorizontal qator elementlar deb ataladi. Davriy tizimda yettita davr mavjud: birinchi, ikkinchi va uchinchi davrlar kichik deb ataladi, ular mos ravishda 2, 8 va 8 elementni o'z ichiga oladi; qolgan davrlar katta deyiladi: toʻrtinchi va beshinchi davrlarda 18 ta element, oltinchida 32 ta, yettinchida (hali tugallanmagan) 31 ta element mavjud. Har bir davr, birinchisidan tashqari, ishqoriy metall bilan boshlanadi va noiloj gaz bilan tugaydi.
Seriya raqamining jismoniy ma'nosi kimyoviy element: atom yadrosidagi protonlar soni va atrofida aylanadigan elektronlar soni atom yadrosi, elementning tartib raqamiga teng.
Davriy jadvalning xossalari
Shuni eslatib o'tamiz guruhlar davriy sistemada vertikal qatorlar deb ataladi va kimyoviy xossalari asosiy va ikkilamchi kichik guruhlarning elementlari sezilarli darajada farqlanadi.
Kichik guruhlardagi elementlarning xususiyatlari tabiiy ravishda yuqoridan pastga qarab o'zgaradi:
- kuchayib bormoqda metall xossalari va metall bo'lmaganlar zaiflashadi;
- atom radiusi ortadi;
- element hosil qilgan asoslar va kislorodsiz kislotalarning mustahkamligi oshadi;
- elektromanfiylik pasayadi.
Geliy, neon va argondan tashqari barcha elementlar kislorod birikmalarini hosil qiladi, faqat sakkizta kislorodli birikmalar mavjud. Davriy jadvalda ular ko'pincha tasvirlangan umumiy formulalar, elementlarning oksidlanish darajasini oshirish tartibida har bir guruh ostida joylashgan: R 2 O, RO, R 2 O 3, RO 2, R 2 O 5, RO 3, R 2 O 7, RO 4, bu erda R belgisi bu guruhning elementini bildiradi. Yuqori oksidlarning formulalari guruhning barcha elementlariga taalluqlidir, istisno holatlar bundan mustasno, elementlar guruh raqamiga teng oksidlanish darajasini ko'rsatmaydi (masalan, ftor).
R 2 O tarkibidagi oksidlar kuchli asos xossalarini namoyon qiladi va ularning asosliligi RO tarkibidagi oksidlar (BeO dan tashqari) atom soni ortishi bilan ortadi; RO 2, R 2 O 5, RO 3, R 2 O 7 tarkibidagi oksidlar kislotali xususiyatga ega bo'lib, ularning kislotaligi atom sonining ortishi bilan ortadi.
IV guruhdan boshlab asosiy kichik guruhlarning elementlari gazsimon vodorod birikmalarini hosil qiladi. Bunday birikmalarning to'rtta shakli mavjud. Ular asosiy kichik guruhlarning elementlari ostida joylashgan va RH 4, RH 3, RH 2, RH ketma-ketligidagi umumiy formulalar bilan ifodalanadi.
RH 4 birikmalari tabiatda neytraldir; RH 3 - zaif asosli; RH 2 - ozgina kislotali; RH - kuchli kislotali xususiyat.
Shuni eslatib o'tamiz davr atom (atom) raqamlarining ortib borayotgan tartibida joylashgan gorizontal qator elementlar deb ataladi.
Elementning seriya raqami ortib borayotgan davr ichida:
- elektromanfiylik oshadi;
- metall xususiyatlari pasayadi, metall bo'lmagan xususiyatlar ortadi;
- atom radiusi kamayadi.

Davriy jadval elementlari
Ishqoriy va ishqoriy yer elementlari
Bularga davriy sistemaning birinchi va ikkinchi guruhlari elementlari kiradi. Ishqoriy metallar birinchi guruhdan - yumshoq metallar, kumush rangli, pichoq bilan kesish oson. Ularning barchasi tashqi qobig'ida bitta elektronga ega va mukammal reaksiyaga kirishadi. Ishqoriy tuproq metallari ikkinchi guruhdan ham kumush rangga ega. Ikki elektron tashqi sathga joylashtiriladi va shunga ko'ra, bu metallar boshqa elementlar bilan kamroq ta'sir qiladi. Ishqoriy metallar bilan solishtirganda, ishqoriy tuproq metallari yuqori haroratlarda eriydi va qaynaydi.
Matnni ko‘rsatish/yashirish
Lantanidlar (noyob yer elementlari) va aktinidlar
Lantanidlar- dastlab noyob minerallarda topilgan elementlar guruhi; shuning uchun ularning nomi "noyob yer" elementlari. Keyinchalik ma'lum bo'ldiki, bu elementlar dastlab o'ylangandek kam emas va shuning uchun lantanidlar nomi noyob yer elementlariga berilgan. Lantanidlar va aktinidlar elementlarning asosiy jadvali ostida joylashgan ikkita blokni egallaydi. Ikkala guruhga ham metallar kiradi; barcha lantanidlar (prometiydan tashqari) radioaktiv emas; aktinidlar, aksincha, radioaktivdir.
Matnni ko‘rsatish/yashirish
Galogenlar va asil gazlar
Galogenlar va asil gazlar davriy jadvalning 17 va 18-guruhlariga guruhlangan. Galogenlar metall bo'lmagan elementlardir, ularning barchasi tashqi qobig'ida ettita elektronga ega. IN asil gazlar Barcha elektronlar tashqi qobiqda, shuning uchun ular birikmalar hosil bo'lishida deyarli qatnashmaydi. Bu gazlar "olijanob" gazlar deb ataladi, chunki ular kamdan-kam hollarda boshqa elementlar bilan reaksiyaga kirishadi; ya'ni ular an'anaviy ravishda jamiyatdagi boshqa odamlardan chetlangan zodagon tabaqa vakillarini nazarda tutadi.
Matnni ko‘rsatish/yashirish
O'tish metallari
O'tish metallari davriy sistemada 3-12 guruhlarni egallaydi. Ularning aksariyati zich, qattiq, yaxshi elektr va issiqlik o'tkazuvchanligiga ega. Ularning valentlik elektronlari (ular yordamida ular boshqa elementlar bilan bog'langan) bir nechta elektron qobiqlarda joylashgan.
Matnni ko‘rsatish/yashirish
| O'tish metallari |
| Scandium Sc 21 |
| Titan Ti 22 |
| Vanadiy V 23 |
| Chrome Cr 24 |
| Marganets Mn 25 |
| Temir Fe 26 |
| Cobalt Co 27 |
| Nikel Ni 28 |
| Mis Cu 29 |
| Rux Zn 30 |
| Ytriy Y 39 |
| Zirkonyum Zr 40 |
| Niobiy Nb 41 |
| Molibden Mo 42 |
| Technetium Tc 43 |
| Rutenium Ru 44 |
| Rodiy Rh 45 |
| Palladiy Pd 46 |
| Silver Ag 47 |
| Kadmiy CD 48 |
| Lutetiy Lu 71 |
| Gafniy Hf 72 |
| Tantal Ta 73 |
| Volfram W 74 |
| Rhenium Re 75 |
| Osmium Os 76 |
| Iridium Ir 77 |
| Platinum Pt 78 |
| Oltin Au 79 |
| Simob Hg 80 |
| Lourens Lr 103 |
| Ruterfordiy Rf 104 |
| Dubnium Db 105 |
| Seaborgium Sg 106 |
| Borium Bh 107 |
| Hassiy Hs 108 |
| Meitnerium Mt 109 |
| Darmshtadt Ds 110 |
| Rg 111 rentgen nurlari |
| Copernicium Cn 112 |
Metalloidlar
Metalloidlar davriy sistemaning 13-16-guruhlarini egallaydi. Bor, germaniy va kremniy kabi metalloidlar yarim o'tkazgichlar bo'lib, ularni tayyorlash uchun ishlatiladi kompyuter chiplari va to'lovlar.
Matnni ko‘rsatish/yashirish
O'tishdan keyingi metallar
Elementlar chaqirildi o'tishdan keyingi metallar, davriy sistemaning 13-15-guruhlariga kiradi. Metalllardan farqli o'laroq, ular porlashi yo'q, lekin mat rangga ega. O'tish metallari bilan solishtirganda, o'tishdan keyingi metallar yumshoqroq va ko'proq past harorat erish va qaynash, yuqori elektromanfiylik. Ularning boshqa elementlarni biriktiradigan valentlik elektronlari faqat tashqi elektron qavatda joylashgan. O'tishdan keyingi metall guruhining elementlari juda ko'p yuqori harorat qaynash nuqtasi metalloidlarga qaraganda.
Endi davriy jadval va boshqalar haqida video tomosha qilib, bilimlaringizni mustahkamlang.
Zo'r, bilim yo'lida birinchi qadam qo'yildi. Endi siz davriy jadvalga ko'proq yoki kamroq yo'naltirilgansiz va bu siz uchun juda foydali bo'ladi, chunki Mendeleevning davriy tizimi bu ajoyib fanning asosidir.