Atomning sayyoraviy modelini kim taklif qilgan. Atom tuzilishining yadroviy modelini kim taklif qilgan? Atom tuzilishining yadro modeli va uning diagrammasi
Atom tuzilishining birinchi modellaridan biri taklif qilindi J. Tomson 1904 yilda atom elektronlar tebranuvchi "musbat elektr dengizi" sifatida tasavvur qilingan. Elektr neytral atom elektronlarining umumiy manfiy zaryadi uning umumiy musbat zaryadiga teng edi.
Ruterford tajribasi
Tomson gipotezasini tekshirish va boshqalar aniq ta'rif atom tuzilishi E. Ruterford sochilish bo'yicha bir qator tajribalar uyushtirdi α -nozik metall plitalari bo'lgan zarralar - folga. 1910 yilda Ruterford talabalari Hans Geiger Va Ernest Marsden portlash tajribalarini o'tkazdi α - mayda zarralar metall plitalar. Ular buni eng ko'p topdilar α -zarralar folga orqali traektoriyasini o'zgartirmasdan o'tadi. Va agar biz Tomsonning atom modelining to'g'riligini qabul qilsak, bu ajablanarli emas edi.
Manba α - radiatsiya qo'rg'oshin kubiga burg'ulangan kanal bilan joylashtirildi, shunda oqim olish mumkin edi. α -ma'lum bir yo'nalishda uchadigan zarralar. Alfa zarralari ikki marta ionlangan geliy atomlari ( 2+ emas). Ular +2 musbat zaryadga ega va massasi elektronning massasidan deyarli 7350 marta katta. Sink sulfid bilan qoplangan ekranga chiqish, α -zarralar uning porlashiga sabab bo'ldi va lupa yordamida har biri urilganda ekranda paydo bo'ladigan alohida miltillashlarni ko'rish va hisoblash mumkin edi. α -zarralar. Nurlanish manbai va ekran o'rtasida folga qo'yildi. Ekrandagi chaqnashlardan sochlanishni aniqlash mumkin edi α -zarralar, ya'ni. metall qatlamidan o'tayotganda ularning asl yo'nalishdan og'ishi haqida.
Ko'pchilik ekanligi ma'lum bo'ldi α -zarralar folga qalinligi yuz minglab atom diametrlariga to'g'ri kelsa-da, yo'nalishini o'zgartirmasdan folga orqali o'tadi. Lekin ba'zilari α -zarrachalar hali ham chetga chiqdi kichik burchaklar, va vaqti-vaqti bilan α -zarralar o'z harakat yo'nalishini keskin o'zgartirdi va hatto (100 000 dan 1 tasi) katta to'siqga duch kelgandek orqaga tashlandi. Bunday keskin og'ish holatlari α -zarralarni lupa yordamida ekranni yoy bo‘ylab harakatlantirish orqali kuzatish mumkin edi.
Ushbu tajriba natijalaridan quyidagi xulosalar chiqarish mumkin:
- Atomda qandaydir "to'siq" mavjud bo'lib, uni yadro deb atashgan.
- Yadro musbat zaryadga ega (aks holda musbat zaryadlangan). α -zarralar orqaga qaytarilmaydi).
- Yadro atomning o'lchamiga nisbatan juda kichik o'lchamlarga ega (faqat kichik bir qismi α -zarralar harakat yo'nalishini o'zgartirdi).
- Yadro massaga nisbatan katta massaga ega α -zarralar
Rezerford tajriba natijalarini taklif qilish orqali tushuntirdi atomning "sayyoraviy" modeli, bu uni quyosh tizimiga o'xshatgan. Sayyoraviy modelga ko'ra, atomning markazida kattaligi taxminan 100 000 marta bo'lgan juda kichik yadro mavjud. kichikroq o'lchamlar atomning o'zi. Bu yadro atomning deyarli butun massasini o'z ichiga oladi va musbat zaryadga ega. Elektronlar yadro atrofida harakat qiladi, ularning soni yadro zaryadiga qarab belgilanadi. Elektron harakatining tashqi traektoriyasini aniqlaydi tashqi o'lchamlar atom. Atomning diametri 10 -8 sm, yadro diametri esa 10 -13 ÷10 -12 sm ga teng.
Ko'proq to'lov atom yadrosi, kuchliroq u undan uzoqlashadi α -zarracha, kuchli og'ish holatlari tez-tez sodir bo'ladi α -metall qatlamdan o'tuvchi zarralar, harakatning dastlabki yo'nalishidan. Shuning uchun, eksperimentlarni tarqatish α -zarralar nafaqat atom yadrosining mavjudligini aniqlashga, balki uning zaryadini aniqlashga ham imkon beradi. Ruterfordning tajribalaridan allaqachon yadro zaryadi (elektron zaryad birliklarida ifodalangan) davriy jadvaldagi elementning seriya raqamiga son jihatdan teng ekanligi ma'lum bo'ldi. Bu tasdiqlandi G. Mozili 1913 yilda elementning rentgen nurlari spektridagi ma'lum chiziqlar to'lqin uzunliklari va uning atom raqami o'rtasida oddiy bog'liqlikni o'rnatgan va D. Chadwick, u 1920 yilda bir qator elementlarning atom yadrolarining zaryadlarini sochish yo'li bilan katta aniqlik bilan aniqlagan. α -zarralar
Davriy tizimdagi elementning seriya raqamining jismoniy ma'nosi aniqlandi: seriya raqami elementning atom yadrosining musbat zaryadini ifodalovchi eng muhim doimiysi bo'lib chiqdi. Atomning elektr neytralligidan kelib chiqadiki, yadro atrofida aylanadigan elektronlar soni elementning atom raqamiga teng.
Bu kashfiyot davriy sistemadagi elementlarning joylashishini yangi asoslab berdi. Shu bilan birga, u Mendeleyev tizimidagi aniq qarama-qarshilikni ham yo'q qildi - atom massasi yuqori bo'lgan ba'zi elementlarning atom massasi past bo'lgan elementlardan (tellur va yod, argon va kaliy, kobalt va nikel) oldinda bo'lgan holati. Ma'lum bo'lishicha, bu erda hech qanday qarama-qarshilik yo'q, chunki elementning tizimdagi o'rni atom yadrosining zaryadi bilan belgilanadi. Tellur atomining yadro zaryadi 52 ga, yod atominiki esa 53 ga teng ekanligi eksperimental ravishda aniqlandi; shuning uchun tellur katta bo'lishiga qaramay atom massasi, yod oldida turishi kerak. Xuddi shu tarzda, argon va kaliy, nikel va kobalt yadrolarining zaryadlari ushbu elementlarning tizimdagi joylashish ketma-ketligiga to'liq mos keladi.
Demak, atom yadrosining zaryadi elementning xossalari va davriy sistemadagi o'rni bog'liq bo'lgan asosiy miqdordir. Shunung uchun Mendeleyevning davriy qonuni hozirgi vaqtda quyidagicha shakllantirilishi mumkin:
Elementlarning xossalari va ular hosil qiladigan oddiy va murakkab moddalar davriy ravishda elementlar atomlari yadrosining zaryadiga bog'liq.
Elementlarning seriya raqamlarini ularning atomlari yadrolarining zaryadlari asosida aniqlash ularni aniqlashga imkon berdi. umumiy soni davriy jadvaldagi tartib raqami 1 bo'lgan vodorod va o'sha paytda elementlar davriy jadvalining oxirgi a'zosi hisoblangan uran (atom raqami 92) o'rtasida joylashadi. Atom tuzilishi nazariyasi yaratilganda, 43, 61, 72, 75, 85 va 87-o'rinlar bo'sh qoldi, bu esa hali ochilmagan elementlarning mavjudligini ko'rsatdi. Darhaqiqat, 1922 yilda gafniy elementi topildi, bu 72; keyin 1925 yilda - bo'lib o'tgan renium 75. Qolgan to'rttasini egallashi kerak bo'lgan elementlar bepul o'rindiqlar jadvallar radioaktiv bo'lib chiqdi va tabiatda topilmadi, lekin ular sun'iy ravishda olingan. Yangi elementlar texnetiy (seriya raqami 43), prometiy (61), astatin (85) va fransiy (87) deb nomlandi. Hozirgi vaqtda vodorod va uran orasidagi davriy jadvalning barcha hujayralari to'ldirilgan. Biroq, uning o'zi davriy jadval to'liq emas.
Atom spektrlari
Sayyoraviy model atom tuzilishi nazariyasidagi asosiy qadam edi. Biroq, ba'zi jihatlarda u qat'iy tasdiqlangan faktlarga zid edi. Keling, ikkita bunday qarama-qarshilikni ko'rib chiqaylik.
Birinchidan, Rezerford nazariyasi atomning barqarorligini tushuntirib bera olmadi. Musbat zaryadlangan yadro atrofida aylanayotgan elektron, tebranuvchi elektr zaryadi kabi, yorug'lik to'lqinlari shaklida elektromagnit energiya chiqarishi kerak. Ammo yorug'lik chiqarish orqali elektron o'z energiyasining bir qismini yo'qotadi, bu elektronning aylanishi bilan bog'liq markazdan qochma kuch va elektronning yadroga elektrostatik tortishish kuchi o'rtasidagi muvozanatga olib keladi. Muvozanatni tiklash uchun elektron yadroga yaqinlashishi kerak. Shunday qilib, doimiy ravishda elektromagnit energiya chiqaradigan va spiral bo'ylab harakatlanadigan elektron yadroga yaqinlashadi. Butun energiyasini tugatgandan so'ng, u yadroga "tushishi" kerak va atom mavjud bo'lishni to'xtatadi. Ushbu xulosa barqaror shakllanish bo'lgan va juda uzoq vaqt davomida halokatsiz mavjud bo'lishi mumkin bo'lgan atomlarning haqiqiy xususiyatlariga zid keladi.
Ikkinchidan, Rezerford modeli atom spektrlarining tabiati haqida noto'g'ri xulosalar chiqarishga olib keldi. Issiq qattiq yoki suyuq jism chiqaradigan yorug'lik shisha yoki kvarts prizmasidan o'tkazilganda, prizma orqasida joylashgan ekranda uzluksiz spektr deb ataladigan narsa kuzatiladi, uning ko'rinadigan qismi barcha ranglarni o'z ichiga olgan rangli chiziqdir. kamalak. Bu hodisa issiq qattiq yoki suyuq jismning nurlanishi turli chastotali elektromagnit to'lqinlardan iborat ekanligi bilan izohlanadi. Turli chastotali to'lqinlar prizma tomonidan turlicha sinadi va ustiga tushadi turli joylar ekran. Chastotalar to'plami elektromagnit nurlanish modda tomonidan chiqariladigan emissiya spektri deyiladi. Boshqa tomondan, moddalar ma'lum chastotalarning nurlanishini o'zlashtiradi. Ikkinchisining birikmasi moddaning yutilish spektri deyiladi.
Spektrni olish uchun prizma o'rniga difraksion panjaradan foydalanish mumkin. Ikkinchisi shisha plastinka bo'lib, uning yuzasida bir-biridan juda yaqin masofada (1 mm ga 1500 zarbagacha) nozik parallel zarbalar qo'llaniladi. Bunday panjaradan o'tib, yorug'lik parchalanadi va prizma yordamida olingan spektrga o'xshash spektr hosil qiladi. Diffraktsiya har qanday to'lqin harakati uchun xosdir va yorug'likning to'lqin tabiatining asosiy dalillaridan biri bo'lib xizmat qiladi.
Qizdirilganda modda nurlar (radiatsiya) chiqaradi. Agar nurlanish bitta to'lqin uzunligiga ega bo'lsa, u monoxromatik deb ataladi. Ko'pgina hollarda radiatsiya bir nechta to'lqin uzunliklari bilan tavsiflanadi. Radiatsiya monoxromatik komponentlarga parchalanganda radiatsiya spektri olinadi, bu erda uning alohida komponentlari spektral chiziqlar sifatida ifodalanadi.
Erkin yoki zaif bog'langan atomlardan (masalan, gazlar yoki bug'larda) nurlanish natijasida olingan spektrlar atom spektrlari deb ataladi.
Qattiq jismlar yoki suyuqliklar tomonidan chiqariladigan nurlanish har doim uzluksiz spektrni beradi. Issiq gazlar va bug'lar tomonidan chiqariladigan radiatsiya, qattiq va suyuqliklarning nurlanishidan farqli o'laroq, faqat ma'lum to'lqin uzunliklarini o'z ichiga oladi. Shuning uchun, ekrandagi uzluksiz chiziq o'rniga, siz qorong'u bo'shliqlar bilan ajratilgan bir qator individual rangli chiziqlarni olasiz. Ushbu liniyalarning soni va joylashuvi issiq gaz yoki bug'ning tabiatiga bog'liq. Shunday qilib, kaliy bug'i uchta chiziqdan iborat spektrni hosil qiladi - ikkita qizil va bitta binafsha; kaltsiy bug'ining spektrida bir nechta qizil, sariq va yashil chiziqlar va boshqalar mavjud.
Qattiq jismlar yoki suyuqliklar tomonidan chiqariladigan nurlanish har doim uzluksiz spektrni beradi. Issiq gazlar va bug'lar tomonidan chiqariladigan radiatsiya, qattiq va suyuqliklarning nurlanishidan farqli o'laroq, faqat ma'lum to'lqin uzunliklarini o'z ichiga oladi. Shuning uchun, ekrandagi uzluksiz chiziq o'rniga, siz qorong'u bo'shliqlar bilan ajratilgan bir qator individual rangli chiziqlarni olasiz. Ushbu liniyalarning soni va joylashuvi issiq gaz yoki bug'ning tabiatiga bog'liq. Shunday qilib, kaliy bug'i uchta chiziqdan iborat spektrni beradi - ikkita qizil va bitta binafsha; kaltsiy bug'ining spektrida bir nechta qizil, sariq va yashil chiziqlar va boshqalar mavjud.
Bunday spektrlar chiziqli spektrlar deb ataladi. Gaz atomlari chiqaradigan yorug'lik chiziqli spektrga ega ekanligi aniqlandi, unda spektral chiziqlar ketma-ket birlashtirilishi mumkin.
Har bir seriyada chiziqlarning joylashishi ma'lum bir naqshga mos keladi. Alohida chiziqlarning chastotalarini tavsiflash mumkin Balmer formulasi:
Har bir element atomlari faqat shu elementga xos bo'lgan to'liq aniq spektrni berishi va tegishli spektral chiziqlarning intensivligi yuqori bo'lsa, olingan namunadagi elementning tarkibi qanchalik yuqori bo'lsa, sifatni aniqlashda keng qo'llaniladi. moddalar va materiallarning miqdoriy tarkibi. Ushbu tadqiqot usuli deyiladi spektral tahlil.
Atom tuzilishining sayyoraviy modeli vodorod atomlari emissiyasining chiziqli spektrini, ketma-ket spektral chiziqlar kombinatsiyasini tushuntirib bera olmadi. Yadro atrofida aylanadigan elektron uning tezligini doimiy ravishda o'zgartirib, yadroga yaqinlashishi kerak. U chiqaradigan yorug'likning chastotasi uning aylanish chastotasi bilan belgilanadi va shuning uchun doimiy ravishda o'zgarishi kerak. Bu shuni anglatadiki, atomning emissiya spektri uzluksiz, uzluksiz bo'lishi kerak. Ushbu modelga ko'ra, atomning nurlanish chastotasi mexanik tebranish chastotasiga teng bo'lishi yoki uning ko'paytmasi bo'lishi kerak, bu Balmer formulasiga to'g'ri kelmaydi. Shunday qilib, Ruterford nazariyasi barqaror atomlarning mavjudligini ham, ularning chiziqli spektrlarining mavjudligini ham tushuntirib bera olmadi.
Yorug'likning kvant nazariyasi
1900 yilda M. Plank qizdirilgan jismning radiatsiya chiqarish qobiliyatini faqat nurlanish energiyasi jismlar tomonidan doimiy ravishda emas, balki diskret ravishda chiqariladi va so'riladi deb faraz qilish orqali miqdoriy jihatdan to'g'ri tavsiflanishi mumkinligini ko'rsatdi. alohida qismlarda - kvantlar. Shu bilan birga, energiya E Har bir bunday qism radiatsiya chastotasi deb ataladigan munosabat bilan bog'liq Plank tenglamalari:
Plankning o'zi uzoq vaqt yorug'likning kvantlar tomonidan emissiyasi va yutilishi nurlanishning o'zi emas, balki har qanday energiyaga ega bo'lgan va shuning uchun doimiy ravishda so'rilishi mumkin bo'lgan nurlanishning o'ziga xos xususiyati deb hisoblardi. Biroq, 1905 yilda Eynshteyn, fotoelektrik effekt hodisasini tahlil qilib, elektromagnit (nurlanish) energiya faqat kvantlar shaklida mavjud degan xulosaga keldi va shuning uchun nurlanish bo'linmaydigan moddiy "zarralar" (fotonlar) oqimi bo'lib, uning energiyasi tomonidan belgilanadi Plank tenglamasi.

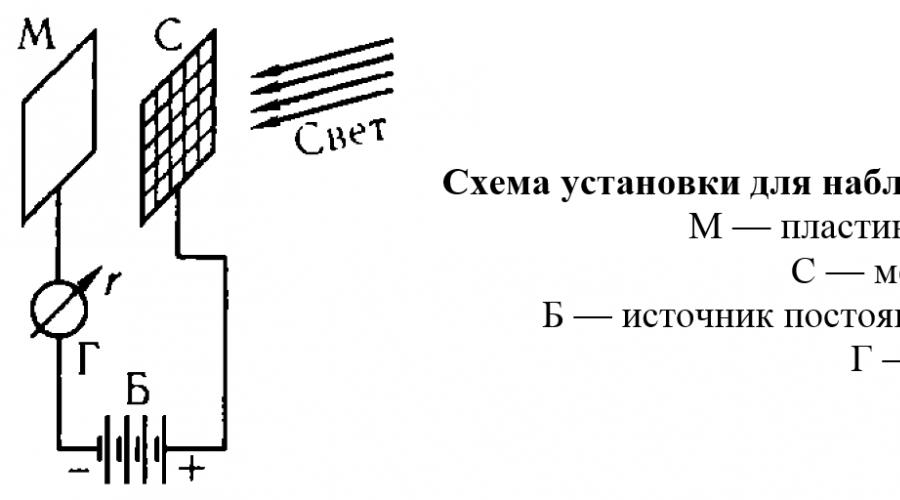
Fotoelektrik effekt metallning unga tushgan yorug'lik ta'sirida elektronlar chiqarishidir. Bu hodisa 1888-1890 yillarda batafsil o‘rganilgan. A. G. Stoletov. Agar siz o'rnatishni vakuumga joylashtirsangiz va uni yozuvga qo'llasangiz M salbiy potentsial, keyin kontaktlarning zanglashiga olib keladigan oqim kuzatilmaydi, chunki plastinka va panjara orasidagi bo'shliqda elektr tokini o'tkazishga qodir zaryadlangan zarralar yo'q. Lekin plastinka yorug'lik manbai bilan yoritilganda, galvanometr oqimning paydo bo'lishini aniqlaydi (fototok deb ataladi), uning tashuvchilari metalldan yorug'lik orqali chiqariladigan elektronlardir.
Ma'lum bo'lishicha, yorug'lik intensivligi o'zgarganda, faqat metall tomonidan chiqarilgan elektronlar soni o'zgaradi, ya'ni. fototokning kuchi. Ammo maksimal kinetik energiya metalldan chiqarilgan har bir elektron yorug'lik intensivligiga bog'liq emas, balki faqat metallga tushadigan yorug'lik chastotasi o'zgarganda o'zgaradi. To'lqin uzunligining oshishi bilan (ya'ni chastotaning pasayishi bilan) metall chiqaradigan elektronlarning energiyasi kamayadi va keyin har bir metallga xos bo'lgan to'lqin uzunligida fotoelektr effekti yo'qoladi va hatto juda ko'p ko'rinmaydi. yuqori yorug'lik intensivligi. Shunday qilib, qizil yoki to'q sariq rangli yorug'lik bilan yoritilganda, natriy fotoelektrik ta'sir ko'rsatmaydi va faqat 590 nm dan kam to'lqin uzunligida (sariq nur) elektronlarni chiqara boshlaydi; litiyda fotoelektr effekti undan ham pastroqda aniqlanadi to'lqin uzunliklari, 516 nm dan boshlab (yashil chiroq); va ko'rinadigan yorug'lik ta'sirida platinadan elektronlarning chiqarilishi umuman sodir bo'lmaydi va faqat platina ultrabinafsha nurlar bilan nurlanganda boshlanadi.
Fotoelektrik effektning bu xususiyatlari yorug'likning klassik to'lqin nazariyasi nuqtai nazaridan mutlaqo tushunarsizdir, unga ko'ra ta'sir faqat (ma'lum bir metall uchun) aniqlanishi kerak. energiya miqdori, vaqt birligida metall yuzasi tomonidan so'riladi, lekin metallga tushgan radiatsiya turiga bog'liq bo'lmasligi kerak. Biroq, agar nurlanish juda o'ziga xos energiyaga ega bo'lgan alohida qismlardan, fotonlardan iborat deb hisoblasak, xuddi shu xususiyatlar oddiy va ishonchli tushuntirish oladi.
Aslida, metalldagi elektron metall atomlari bilan bog'langan, shuning uchun uni yirtib tashlash uchun ma'lum energiya sarflash kerak. Agar foton kerakli miqdordagi energiyaga ega bo'lsa (va fotonning energiyasi nurlanish chastotasi bilan belgilanadi), u holda elektron chiqariladi va fotoelektr effekti kuzatiladi. Metall bilan o'zaro ta'sir qilish jarayonida foton o'z energiyasini elektronga to'liq beradi, chunki fotonni qismlarga bo'linib bo'lmaydi. Fotonning energiyasi qisman elektron va metall o'rtasidagi bog'lanishni buzishga va qisman elektronga harakatning kinetik energiyasini berishga sarflanadi. Shuning uchun metalldan urilgan elektronning maksimal kinetik energiyasi foton energiyasi va elektronning metall atomlari bilan bog'lanish energiyasi o'rtasidagi farqdan katta bo'lishi mumkin emas. Binobarin, vaqt birligida metall yuzasiga tushadigan fotonlar sonining ko'payishi bilan (ya'ni, yorug'lik intensivligining oshishi bilan) faqat metalldan chiqarilgan elektronlar soni ortadi, bu esa fototokning oshishiga olib keladi. , lekin har bir elektronning energiyasi oshmaydi. Agar foton energiyasi elektronni chiqarish uchun zarur bo'lgan minimal energiyadan kam bo'lsa, fotoelektr effekti metallga tushgan fotonlarning har qanday soni uchun kuzatilmaydi, ya'ni. har qanday yorug'lik intensivligida.
Yorug'likning kvant nazariyasi, rivojlangan Eynshteyn, nafaqat fotoeffektning xususiyatlarini, balki yorug'likning kimyoviy ta'sirining qonuniyatlarini ham tushuntira oldi, haroratga bog'liqlik qattiq jismlarning issiqlik sig'imlari va boshqa bir qator hodisalar. Bu atomlar va molekulalarning tuzilishi haqidagi g'oyalarni ishlab chiqishda juda foydali bo'ldi.
Kimdan kvant nazariyasi yorug'lik, bundan kelib chiqadiki, foton parchalanishga qodir emas: u metallning elektroni bilan bir butun sifatida o'zaro ta'sir qiladi va uni plastinkadan urib yuboradi; umuman olganda, u fotografik plyonkaning yorug'likka sezgir moddasi bilan o'zaro ta'sir qiladi, bu uning ma'lum bir nuqtada qorayishiga olib keladi va hokazo. Shu ma'noda foton o'zini zarracha kabi tutadi, ya'ni. korpuskulyar xossalarini namoyon qiladi. Biroq, foton to'lqin xususiyatlariga ham ega: bu yorug'lik tarqalishining to'lqinli tabiatida, fotonning interferentsiya va diffraktsiya qobiliyatida namoyon bo'ladi. Foton atamaning klassik ma'nosida zarrachadan farq qiladi, chunki uning kosmosdagi aniq pozitsiyasi, har qanday to'lqinning aniq pozitsiyasi kabi, aniqlanmaydi. Ammo u "klassik" to'lqindan qismlarga bo'linish qobiliyatidan ham farq qiladi. Korpuskulyar va to'lqin xususiyatlarini birlashtirgan holda, foton, aniq aytganda, na zarracha, na to'lqin - u korpuskulyar-to'lqinli ikkilik bilan tavsiflanadi.
Leksiya: Atomning sayyoraviy modeli
Atom tuzilishi
Har qanday moddaning tuzilishini aniqlashning eng aniq usuli bu spektral tahlildir. Elementning har bir atomining nurlanishi faqat individualdir. Biroq, spektral tahlil qanday sodir bo'lishini tushunishdan oldin, biz har qanday element atomi qanday tuzilishga ega ekanligini tushunamiz.
Atomning tuzilishi haqidagi birinchi taxminni J. Tomson keltirgan. Bu olim uzoq vaqt atomlarni o'rgangan. Bundan tashqari, u elektronni kashf etgan - buning uchun u olgan Nobel mukofoti. Tomson taklif qilgan model haqiqatga hech qanday aloqasi yo'q edi, lekin u Rezerfordning atom tuzilishini o'rganishida juda kuchli turtki bo'lib xizmat qildi. Tomson tomonidan taklif qilingan model "mayiz pudingi" deb nomlangan.

Tomson atom manfiy elektr zaryadli qattiq shar ekanligiga ishongan. Buning o'rnini qoplash uchun elektronlar mayiz kabi to'pga aralashtiriladi. Elektronlarning umumiy zaryadi butun yadro zaryadiga to'g'ri keladi, bu esa atomni neytral qiladi.
Atomning tuzilishini o'rganish davomida ular barcha atomlar mavjudligini aniqladilar qattiq moddalar topshirmoq tebranish harakatlari. Va siz bilganingizdek, har qanday harakatlanuvchi zarracha to'lqinlarni chiqaradi. Shuning uchun har bir atom o'z spektriga ega. Biroq, bu bayonotlar Tomson modeliga hech qanday tarzda kiritilmagan.
Ruterford tajribasi
Tomson modelini tasdiqlash yoki rad etish uchun Ruterford ma'lum bir element atomini alfa zarrachalari bilan bombardimon qilish tajribasini taklif qildi. Ushbu tajriba natijasida zarrachaning o'zini qanday tutishini ko'rish muhim edi.
Alfa zarralari radiyning radioaktiv parchalanishi natijasida topilgan. Ularning oqimlari alfa nurlari edi, ularning har bir zarrasi musbat zaryadga ega edi. Ko'plab tadqiqotlar natijasida alfa zarrasi elektronlari yo'q geliy atomiga o'xshashligi aniqlandi. Mavjud bilimlardan foydalanib, biz alfa zarrasi geliy yadrosi ekanligini bilamiz, o'sha paytda Ruterford uni geliy ionlari deb hisoblagan.
Har bir alfa zarrachasi juda katta energiyaga ega edi, buning natijasida u yuqori tezlikda ko'rib chiqilayotgan atomlar tomon ucha oladi. Shuning uchun tajribaning asosiy natijasi zarrachaning burilish burchagini aniqlash edi.
Tajribani o'tkazish uchun Ruterford foydalangan yupqa folga oltindan yasalgan. U yuqori tezlikdagi alfa zarralarini unga qaratdi. U ushbu tajriba natijasida barcha zarralar folga orqali va ozgina og'ishlar bilan uchib o'tishini taxmin qildi. Biroq, aniq bilish uchun u o'z shogirdlariga bu zarralarning katta og'ishlari bor-yo'qligini tekshirishni buyurdi.

Tajriba natijasi barchani hayratda qoldirdi, chunki ko'p zarralar nafaqat juda katta burchak bilan og'ishdi - ba'zi bir og'ish burchaklari 90 darajadan oshdi.
Bu natijalar hammani hayratda qoldirdi, Ruterford xuddi snaryadlar yo'liga qog'oz varaq qo'yilgandek tuyuldi, bu esa alfa zarrachaning ichkariga kirib ketishiga imkon bermadi, natijada u ortga qaytdi.
Agar atom haqiqatan ham qattiq bo'lsa, unda bir oz bo'lishi kerak edi elektr maydoni, bu zarrachani sekinlashtirdi. Biroq, maydonning kuchi uni to'liq to'xtatish uchun etarli emas edi, aksincha, uni orqaga tashlash. Bu Tomson modelining rad etilganligini anglatadi. Shunday qilib, Ruterford yangi model ustida ishlay boshladi.
Ruterford modeli
Bunday eksperimental natijaga erishish uchun musbat zaryadni kichikroq hajmda to'plash kerak, natijada elektr maydoni kattaroq bo'ladi. Maydon potentsial formulasidan foydalanib, aniqlash mumkin talab qilinadigan o'lcham alfa zarrachani teskari yo'nalishda surishi mumkin bo'lgan ijobiy zarracha. Uning radiusi maksimal bo'lishi kerak 10-15 m. Shuning uchun ham Rezerford atomning sayyoraviy modelini taklif qildi.

Ushbu model bir sababga ko'ra shunday nomlangan. Gap shundaki, atomning ichida quyosh sistemasidagi Quyoshga o'xshash musbat zaryadlangan yadro mavjud. Elektronlar sayyoralar singari yadro atrofida aylanadi. Quyosh tizimi shunday tuzilganki, sayyoralar tortishish kuchlari tomonidan Quyoshga tortiladi, biroq ularni o'z orbitasida ushlab turadigan mavjud tezlik natijasida ular Quyosh yuzasiga tushmaydi. Xuddi shu narsa elektronlar bilan sodir bo'ladi - Kulon kuchlari elektronlarni yadroga tortadi, lekin aylanish tufayli ular yadro yuzasiga tushmaydi.
Tomsonning taxminlaridan biri mutlaqo to'g'ri bo'lib chiqdi - elektronlarning umumiy zaryadi yadro zaryadiga to'g'ri keladi. Biroq, kuchli o'zaro ta'sirlar natijasida elektronlar o'z orbitasidan chiqib ketishi mumkin, buning natijasida zaryad kompensatsiyalanmaydi va atom musbat zaryadlangan ionga aylanadi.
Juda muhim ma'lumotlar Atomning tuzilishiga kelsak, atomning deyarli butun massasi yadroda to'plangan. Masalan, vodorod atomida faqat bitta elektron mavjud bo'lib, uning massasi yadro massasidan bir yarim ming marta kam.
| | |
Atomning tarixiy modellari1 fan taraqqiyotining ma'lum bir davriga mos keladigan bilim darajalarini aks ettiradi.
Atom modellarini yaratishning birinchi bosqichi uning tuzilishi bo'yicha eksperimental ma'lumotlarning yo'qligi bilan tavsiflanadi.
Olimlar mikrodunyo hodisalarini tushuntirib, klassik mexanika qonunlariga tayangan holda makrodunyoda oʻxshashlik izladilar.
Kimyoviy atomizmning yaratuvchisi J. Dalton (1803) bir xil kimyoviy elementning atomlari bir xil sferik mayda, shuning uchun bo'linmas zarralardir, deb faraz qilgan.
Frantsuz fizigi Jan Baptiste Perren (1901) "sayyoraviy" modelni taxmin qilgan modelni taklif qildi. Ushbu modelga ko'ra, atomning markazida musbat zaryadlangan yadro joylashgan bo'lib, uning atrofida manfiy zaryadlangan elektronlar Quyosh atrofidagi sayyoralar kabi ma'lum orbitalarda harakat qiladi. Perrin modeli olimlarning e'tiborini tortmadi, chunki u atomning miqdoriy emas, balki faqat sifat ko'rsatkichlarini berdi (7-rasmda bu atom yadrosining zaryadi va elektronlar soni o'rtasidagi nomuvofiqlik bilan ko'rsatilgan).
1902 yilda ingliz fizigi Uilyam Tomson (Kelvin) atomning musbat zaryadlangan sferik zarracha sifatidagi g'oyasini ishlab chiqdi, uning ichida manfiy zaryadlangan elektronlar tebranadi (energiya chiqaradi va yutadi). Kelvin elektronlar soni sferaning musbat zaryadiga teng ekanligiga e'tibor qaratdi, shuning uchun umuman atomda hech qanday yo'l yo'q. elektr zaryadi(7-rasm).
Bir yil o'tgach, nemis fizigi Filipp Lenard modelni taklif qildi, unga ko'ra atom ichi bo'sh shar bo'lib, uning ichida elektr dipollari (dinamidlar) mavjud. Ushbu dipollar egallagan hajm sfera hajmidan sezilarli darajada kamroq va atomning asosiy qismi to'ldirilmagan bo'lib chiqadi.
Yapon fizigi Gontaro (Hantaro) Nagaoki (1904) g‘oyalariga ko‘ra, atomning markazida musbat zaryadlangan yadro joylashgan bo‘lib, elektronlar yadro atrofida fazoda Saturn sayyorasining halqalarini eslatuvchi tekis halqalarda harakat qiladi. (bu model "Saturn" atomi deb nomlangan). Ko'pgina olimlar Nagaokaning g'oyalariga e'tibor berishmadi, garchi ular atom orbitalining zamonaviy g'oyasi bilan bir xil bo'lsa ham.
Ko'rib chiqilmagan modellarning hech biri (7-rasm) qanday xususiyatlarni tushuntirib bermadi kimyoviy elementlar ularning atomlarining tuzilishi bilan bog'liq.
Guruch. 7. Atomning ayrim tarixiy modellari
1907 yilda J. J. Tomson atom tuzilishining statik modelini taklif qildi, u atomni musbat elektr zaryadlangan, manfiy zaryadlangan elektronlar teng taqsimlangan sferik zarra sifatida ifodalaydi ( model"puding", 7-rasm).
Matematik hisob-kitoblar shuni ko'rsatdiki, atomdagi elektronlar konsentrik joylashgan halqalarda joylashgan bo'lishi kerak. Tomson juda muhim xulosaga keldi: kimyoviy elementlarning xususiyatlarining davriy o'zgarishi sababi ularning atomlarining elektron tuzilishining o'ziga xos xususiyatlari bilan bog'liq. Shu tufayli Tomsonning atom modeli zamondoshlari tomonidan yuqori baholandi. Biroq, u ba'zi hodisalarni, masalan, a-zarrachalarning metall plastinkadan o'tganda sochilishini tushuntirib bermadi.
Tomson atom haqidagi fikrlariga asoslanib, a-zarrachalarning oʻrtacha chetlanishini hisoblash formulasini chiqardi va bu hisob bunday zarrachalarning katta burchak ostida sochilish ehtimoli nolga yaqin ekanligini koʻrsatdi. Biroq, oltin folga ustiga tushayotgan taxminan sakkiz ming a-zarradan biri 90° dan katta burchakka burilishi eksperimental tarzda isbotlangan. Bu faqat kichik burchaklardagi og'ishlarni qabul qilgan Tomson modeliga zid edi.
Ernest Ruterford 1911 yilda eksperimental ma'lumotlarni jamlab, atom tuzilishining "sayyoraviy" (ba'zan "yadro" deb ataladi) modelini taklif qildi, unga ko'ra atom massasining 99,9% va uning musbat zaryadi juda kichik bir atomda to'plangan. yadro va yadro zaryadiga teng bo'lgan manfiy zaryadli elektronlar sayyoralar kabi uning atrofida aylanadi. quyosh sistemasi 1 (7-rasm).
Rezerford o'z shogirdlari bilan birgalikda atom tuzilishini o'rganish imkonini beradigan tajribalar o'tkazdi (8-rasm). Radioaktiv nurlanish manbai 1 dan yupqa metall (oltin) folga 2 yuzasiga musbat zaryadlangan zarralar oqimi (a-zarrachalar) yo'naltirildi. Ularning yo'li bo'ylab lyuminestsent ekran 3 o'rnatildi, bu a-zarrachalarning keyingi harakat yo'nalishini kuzatish imkonini berdi.

Guruch. 8. Rezerford tajribasi
Aniqlanishicha, a-zarrachalarning aksariyati folga orqali deyarli yo‘nalishini o‘zgartirmagan holda o‘tgan. Faqat bir nechta zarrachalar (o'rtacha o'n mingdan biri) burilib, deyarli teskari yo'nalishda uchib ketishdi. Atom massasining katta qismi musbat zaryadlangan yadroda to`plangan, shuning uchun a zarrachalar juda ko`p og`ishgan degan xulosaga keldi (9-rasm).

Guruch. 9. A-zarrachalarning atom yadrosi tomonidan sochilishi
Atomda harakatlanuvchi elektronlar elektromagnetizm qonunlariga muvofiq energiya chiqarishi va uni yo'qotib, qarama-qarshi zaryadlangan yadroga tortilishi va shuning uchun unga "tushishi" kerak. Bu atomning yo'q bo'lib ketishiga olib kelishi kerak, ammo bu sodir bo'lmagani uchun bu model etarli emas degan xulosaga keldi.
20-asr boshlarida nemis fizigi Maks Plank va nazariy fizik Albert Eynshteyn yorugʻlikning kvant nazariyasini yaratdilar. Bu nazariyaga ko'ra, yorug'lik kabi nurlanish energiyasi doimiy ravishda emas, balki alohida qismlarda (kvanta) chiqariladi va so'riladi. Bundan tashqari, energiya kvantining kattaligi turli nurlanishlar uchun bir xil emas va tebranish chastotasiga proportsionaldir. elektromagnit to'lqin: E = hn, bu erdah – Plank doimiysi, 6,6266·10 –34 J·s ga teng, n – nurlanish chastotasi. Bu energiya yorug'lik zarralari tomonidan olib boriladi - fotonlar.
Klassik mexanika va kvant nazariyasi qonunlarini sun'iy ravishda birlashtirishga urinib, daniyalik fizigi Nils Bor 1913 yilda atomning Rezerford modelini atomdagi elektronlar energiyasining keskin (diskret) o'zgarishi haqidagi ikkita postulat bilan to'ldirdi. Bor vodorod atomidagi elektron faqat juda aniq pozitsiyalarda joylashgan bo'lishi mumkinligiga ishongan. statsionar orbitalar, ularning radiuslari kvadrat shaklida bir-biriga bog'langan natural sonlar (1 2: 2 2: 3 2: ... :n 2). Elektronlar atom yadrosi atrofida statsionar orbitalarda harakatlanadi. Atom barqaror holatda qoladi, energiyani yutmaydi va chiqarmaydi - bu Borning birinchi postulati. Ikkinchi postulatga ko'ra, energiya emissiyasi faqat elektron atom yadrosiga yaqinroq orbitaga o'tganda sodir bo'ladi. Elektron uzoqroq orbitaga o'tganda, energiya atom tomonidan so'riladi. Ushbu model 1916 yilda nemis nazariyasi fizigi Arnold Sommerfeld tomonidan takomillashtirilgan bo'lib, u elektronlar bo'ylab harakatlanishini ta'kidladi. elliptik orbitalar.
Sayyora modeli o'zining ravshanligi va Bor postulatlari tufayli uzoq vaqt davomida atom va molekulyar hodisalarni tushuntirish uchun ishlatilgan. Biroq, atomdagi elektronning harakatini, atomning barqarorligi va xususiyatlarini sayyoralar harakati va Quyosh tizimining barqarorligidan farqli ravishda klassik mexanika qonunlari bilan tasvirlab bo'lmasligi ma'lum bo'ldi. Bu mexanika Nyuton qonunlariga asoslanadi va uni oʻrganish predmeti makroskopik jismlarning yorugʻlik tezligiga nisbatan kichik tezlikda harakatlanishi hisoblanadi. Atom tuzilishini tavsiflash uchun 1920-yillarda nazariy fiziklar: frantsuz Lui de Broyl, nemislar Verner tomonidan ishlab chiqilgan mikrozarrachalarning ikkilamchi korpuskulyar-to'lqinli tabiati haqidagi kvant (to'lqin) mexanikasi tushunchalarini qo'llash kerak. Geyzenberg va Ervin Shredinger, ingliz Pol Dirak va boshqalar.
1924 yilda Lui de Broyl elektronning to'lqin xossalariga ega ekanligini faraz qildi (birinchi printsip kvant mexanikasi) va uning to'lqin uzunligini hisoblash formulasini taklif qildi. Atomning barqarorligi undagi elektronlar orbitalarda emas, balki yadro atrofidagi fazoning atom orbitallari deb ataladigan muayyan hududlarida harakatlanishi bilan izohlanadi. Elektron atomning deyarli butun hajmini egallaydi va uning markazida joylashgan "yadroga tusha olmaydi".
1926 yilda Shredinger L. de Broylning elektronning to'lqin xossalari haqidagi g'oyalarini rivojlantirishni davom ettirib, simli tebranish tenglamasiga o'xshash matematik tenglamani empirik ravishda tanladi, uning yordamida elektronning bog'lanish energiyasini hisoblash mumkin. turli energiya darajasidagi atom. Bu tenglama kvant mexanikasining asosiy tenglamasiga aylandi.
Elektronning to'lqin xususiyatlarining kashf etilishi makrodunyo haqidagi bilimlarning mikrodunyo ob'ektlariga tarqalishi noqonuniy ekanligini ko'rsatdi. 1927 yilda Geyzenberg ma'lum bir tezlikka ega bo'lgan elektronning fazodagi aniq o'rnini aniqlashning iloji yo'qligini aniqladi, shuning uchun atomdagi elektronning harakati haqidagi g'oyalar tabiatda ehtimollikdir (kvant mexanikasining ikkinchi printsipi).
Atomning kvant mexanik modeli (1926) atomning holatini matematik funktsiyalar orqali tasvirlaydi va geometrik ifodaga ega emas (10-rasm). Bu model atom strukturasining dinamik tabiatini va elektronning zarracha kattaligi masalasini ko'rib chiqmaydi. Elektronlar ma'lum energiya darajalarini egallaydi va boshqa darajalarga o'tishda energiya chiqaradi yoki yutadi. Shaklda. 10 ta energiya sathi sxematik tarzda atom yadrosidan turli masofalarda joylashgan konsentrik halqalar shaklida tasvirlangan. Oklar energiya darajalari orasidagi elektronlarning o'tishini va bu o'tishlarga hamroh bo'lgan fotonlarning emissiyasini ko'rsatadi. Diagramma sifat jihatidan ko'rsatilgan va energiya darajalari orasidagi haqiqiy masofalarni aks ettirmaydi, ular bir-biridan o'nlab marta farq qilishi mumkin.
1931 yilda amerikalik olim Gilbert Uayt birinchi marta atom orbitallarining grafik tasvirini va atomning "orbital" modelini taklif qildi (10-rasm). Atom orbital modellari elektron zichligi kontseptsiyasini aks ettirish va atomdagi yadro yoki molekuladagi atom yadrolari tizimi atrofida manfiy zaryadning tarqalishini ko'rsatish uchun ishlatiladi.

Guruch. 10. Tarixiy va zamonaviy modellar atom
1963 yilda amerikalik rassom, haykaltarosh va muhandis Kennet Snelson atom elektron qobiqlarining "halqa-chekka modeli" ni taklif qildi (10-rasm), bu atomdagi elektronlarning barqaror elektron qobiqlari bo'ylab miqdoriy taqsimlanishini tushuntiradi. Har bir elektron halqa magniti (yoki magnit momentga ega bo'lgan elektr toki bilan yopiq halqa) sifatida modellashtirilgan. Ring magnitlari bir-birini tortadi va nosimmetrik halqa shakllarini hosil qiladi - halqa. Magnitlarda ikkita qutbning mavjudligi cheklovni keltirib chiqaradi mumkin bo'lgan variantlar halqa shaklidagi birikmalar. Barqaror elektron qobiqlarning modellari ularning magnit xususiyatlarini hisobga olgan holda tuzilgan halqalarning eng nosimmetrik shakllaridir.
Elektronda spinning mavjudligi (5-bo'limga qarang) atomda barqaror elektron qobiqlarning paydo bo'lishining asosiy sabablaridan biridir. Elektronlar qarama-qarshi spinli juftliklar hosil qiladi. Elektron juftining yoki to'ldirilgan atom orbitalining halqa tomonli modeli ikkita halqadir. parallel tekisliklar atom yadrosining qarama-qarshi tomonlarida. Atom yadrosi yaqinida bir nechta juft elektronlar joylashganida, halqa elektronlari o'zaro orientatsiya qilishga majbur bo'lib, elektron qobiq hosil qiladi. Bunday holda, bir-biriga yaqin joylashgan halqalar mavjud turli yo'nalishlar magnit elektr uzatish liniyalari, bu bilan belgilanadi turli ranglar elektronlarni ifodalovchi halqalar.
Model tajribasi shuni ko'rsatadiki, barcha mumkin bo'lgan halqali modellarning eng barqarori 8 ta halqali modeldir. Geometrik jihatdan model xuddi shar shaklidagi atom 8 qismga bo'lingan (uch marta yarmiga bo'lingan) va har bir qismga bittadan halqa-elektron joylashtirilgandek tuzilgan. Ring-check modellarida ikkita rangdagi halqalar qo'llaniladi: qizil va ko'k, ular elektronning ijobiy va salbiy spinini aks ettiradi.
"To'lqin qirrali model" (10-rasm) atomning har bir elektroni butun sonli to'lqinlarni o'z ichiga olgan "to'lqin" halqasi bilan ifodalanganligi bilan farqi bilan "halqali" modelga o'xshaydi (taklif qilinganidek). L. de Brogli).
Ushbu atom modelidagi elektron qobiqdagi elektronlarning o'zaro ta'siri ko'k va qizil "to'lqin" halqalarining aloqa nuqtalarining doimiy to'lqinlar tugunlari bilan mos kelishi bilan ko'rsatilgan.
Atom modellari mavjud bo'lish huquqiga va qo'llanilishi chegaralariga ega. Atomning har qanday modeli - bu atom haqidagi bilimlarning ma'lum bir qismini soddalashtirilgan shaklda aks ettiruvchi taxminiy. Ammo modellarning hech biri atom yoki uning tarkibiy qismlarining xususiyatlarini to'liq aks ettirmaydi.
Bugungi kunda ko'plab modellar faqat tarixiy qiziqish uyg'otadi. Mikrodunyodagi ob'ektlarning modellarini qurishda olimlar bevosita kuzatilishi mumkin bo'lgan narsalarga tayandilar. Perrin va Rezerford (Quyosh tizimining tuzilishi bilan o'xshashlik), Nagaoka (Saturn sayyorasiga o'xshash narsa) va Tomson ("mayiz pudingi") modellari shunday paydo bo'ldi. Ba'zi g'oyalar bekor qilindi (Lenardning dinamik modeli), boshqalari biroz vaqt o'tgach qayta ko'rib chiqildi, lekin yangi, yuqori nazariy darajada: Perrin va Kelvin modellari Rezerford va Tomson modellarida ishlab chiqildi. Atomning tuzilishi haqidagi g'oyalar doimiy ravishda takomillashtirilmoqda. Zamonaviy "kvant mexanikasi" modeli qanchalik to'g'ri ekanligini vaqt ko'rsatadi. Shuning uchun spiralning yuqori qismida bilim yo'lini anglatuvchi savol belgisi qo'yiladi (7-rasm).
Atomlar moddaning eng kichik zarralari ekanligi haqidagi g'oya birinchi marta qadimgi Yunonistonda paydo bo'lgan. Biroq, faqat ichida XVIII oxiri asrda, A.Lavoisier, M.V.Lomonosov va boshqalar kabi olimlarning ishlari tufayli atomlarning haqiqatda mavjudligi isbotlangan. Biroq, o'sha kunlarda hech kim ularning ichki tuzilishi qanday ekanligi bilan qiziqmadi. Olimlar hali ham atomlarni barcha moddalarni tashkil etuvchi bo'linmas "qurilish bloklari" deb bilishgan.
Atomning tuzilishini tushuntirishga urinishlar
Yadro modelini birinchi bo'lib taklif qilgan olim kim? Bu zarralarning modelini yaratishga birinchi urinish J.Tomsonga tegishli edi. Biroq, uni to'liq ma'noda muvaffaqiyatli deb atash mumkin emas. Zero, Tomson atom sferik va elektr neytral sistema ekanligiga ishongan. Shu bilan birga, olim musbat zaryad bu sharning butun hajmi bo'ylab bir tekis taqsimlangan va uning ichida manfiy zaryadlangan yadro bor deb taxmin qildi. Olimning atomning ichki tuzilishini tushuntirishga bo'lgan barcha urinishlari muvaffaqiyatsiz tugadi. Tomson o'z nazariyasini ilgari surganidan bir necha yil o'tgach, atom tuzilishining yadroviy modelini taklif qilgan kishi Ernest Ruterforddir.

Tadqiqotlar tarixi
1833 yilda elektrolizni tadqiq qilib, Faraday elektrolitlar eritmasidagi oqim zaryadlangan zarralar yoki ionlar oqimi ekanligini aniqlay oldi. Ushbu tadqiqotlar asosida u ionning minimal zaryadini aniqlay oldi. Shuningdek, fizikada ushbu yo'nalishning rivojlanishida mahalliy kimyogar D.I.Mendeleev muhim rol o'ynadi. Aynan u barcha atomlar bir xil tabiatga ega bo'lishi mumkinligi haqidagi savolni birinchi marta ilmiy doiralarda ko'targan. Ko'ramizki, atom tuzilishining Rezerford yadro modeli birinchi marta taklif qilinishidan oldin, turli xil olimlar tomonidan bir xil darajada muhim tajribalar o'tkazilgan. Ular materiya tuzilishining atom nazariyasini ilgari surdilar.

Birinchi tajribalar
Ruterford haqiqatan ham ajoyib olim, chunki uning kashfiyotlari materiya tuzilishini tushunishda inqilob qildi. 1911 yilda u tajriba o'rnatishga muvaffaq bo'ldi, uning yordamida tadqiqotchilar atomning sirli chuqurliklarini ko'rib chiqishga va uning ichki tuzilishi nimadan iboratligi haqida tasavvurga ega bo'lishdi. Birinchi tajribalar olim tomonidan boshqa tadqiqotchilar ko'magida amalga oshirildi Asosiy rol ochilishda u hali ham Ruterfordga tegishli edi.

Tajriba
Foydalanish tabiiy buloqlar radioaktiv nurlanish tufayli Ruterford alfa zarralari oqimini chiqaradigan qurol yasashga muvaffaq bo'ldi. Bu qo'rg'oshindan yasalgan quti edi, uning ichida radioaktiv modda bor edi. Qurolda barcha alfa zarralarini etakchi ekranga urish imkonini beruvchi uyasi bor edi. Ular faqat teshik orqali uchib chiqishlari mumkin edi. Ushbu radioaktiv zarrachalar nurining yo'lida yana bir nechta ekranlar bor edi.
Ular oldindan belgilangan yo'nalishdan chetga chiqqan zarralarni ajratib olishdi. Ruterford nishon sifatida ishlatilgan yupqa varaq oltin folgadan. Zarrachalar bu varaqga tushganidan so'ng, ular harakatlarini davom ettirdilar va oxir-oqibat ushbu nishonning orqasida o'rnatilgan lyuminestsent ekranga tegdilar. Alfa zarralari bu ekranga tushganda, miltillashlar qayd etildi, ulardan olim folga bilan to'qnashganda qancha zarrachalar asl yo'nalishdan og'ishganligi va bu og'ishning kattaligi qancha ekanligini aniqlashi mumkin edi.

Oldingi tajribalardan farqlari
Atom tuzilishining yadroviy modelini kim taklif qilganiga qiziqqan maktab o'quvchilari va talabalar bilishlari kerak: shunga o'xshash tajribalar Ruterforddan oldin ham fizikada o'tkazilgan. Ularning asosiy fikr; asosiy g'oya zarrachalarning dastlabki traektoriyadan chetlanishlaridan imkon qadar ko'proq yig'ish edi qo'shimcha ma'lumot atomning tuzilishi haqida. Bu tadqiqotlarning barchasi fanda ma'lum miqdordagi ma'lumotlarning to'planishiga olib keldi va bu haqda o'ylashga sabab bo'ldi ichki tuzilishi eng kichik zarralar.
20-asrning boshlarida olimlar atomda manfiy zaryadli elektronlar borligini bilishgan. Ammo ko'pchilik tadqiqotchilar orasida atomning ichki qismi ko'proq manfiy zaryadlangan zarrachalar bilan to'ldirilgan to'rga o'xshaydi, degan fikr hukmron edi. Shunga o'xshash tajribalar bizga ko'p ma'lumotlarni olish imkonini berdi - masalan, aniqlash geometrik o'lchamlar atomlar.
Ajoyib taxmin
Ruterford o'zidan oldingilarning hech biri alfa zarralari o'z traektoriyasidan juda katta burchak ostida og'ishini aniqlashga harakat qilmaganligini payqadi. Olimlar orasida ba'zan "mayiz pudingi" deb ataladigan oldingi model (chunki bu modelga ko'ra, atomdagi elektronlar pudingdagi mayiz kabi taqsimlanadi) oddiygina atom ichidagi strukturaning zich tarkibiy qismlarining mavjudligiga imkon bermadi. Olimlarning hech biri bu variantni ko'rib chiqishdan bezovta qilmagan. Tadqiqotchi o'z shogirdidan o'rnatishni traektoriyadan zarrachalarning katta og'ishlari qayd qilinadigan tarzda qayta jihozlashni so'radi - faqat bu imkoniyatni istisno qilish uchun. Ba'zi zarralar 180 graduslik burchak ostida tarqalib ketgani ma'lum bo'lganda, olim ham, uning shogirdi ham hayratda qolganini tasavvur qiling.
Atomning ichida nima bor?
Biz atom tuzilishining yadroviy modelini kim taklif qilganini va bu olimning tajribasi qanday ekanligini bilib oldik. O'sha paytda Ruterfordning tajribasi haqiqiy yutuq edi. U atomning ichida massaning katta qismi juda zich moddada joylashgan degan xulosaga kelishga majbur bo'ldi. Atom tuzilishining yadro modelining diagrammasi juda oddiy: ichida musbat zaryadlangan yadro mavjud.
Elektronlar deb ataladigan boshqa zarralar bu yadro atrofida aylanadi. Qolganlari kamroq zichlikdagi bir necha buyurtmalardir. Atom ichidagi elektronlarning joylashishi xaotik emas - zarralar energiya ortishi tartibida joylashtirilgan. Tadqiqotchi atomlarning ichki qismlarini yadro deb atagan. Olim kiritgan nomlar bugungi kunda ham fanda qo‘llanilmoqda.
Darsga qanday tayyorgarlik ko'rish kerak?
Atom tuzilishining yadroviy modelini kim taklif qilganiga qiziqqan maktab o'quvchilari darsda qo'shimcha bilimlarni ko'rsatishlari mumkin. Misol uchun, siz Rezerford o'z tajribalaridan ancha keyin o'z kashfiyotiga o'xshatishni yoqtirganligi haqida gapirishingiz mumkin. Isyonchilar uchun qurol-aslahalar Afrikaning janubiy mamlakatiga kontrabanda yo'li bilan olib kelinmoqda, ular paxta toyalarida saqlanadi. Agar butun poyezd shu to‘plamlar bilan to‘ldirilgan bo‘lsa, bojxonachilar xavfli yuklar qayerda joylashganligini qanday aniqlashlari mumkin? Bojxona xodimi balyalarga o'q otishni boshlashi mumkin va o'qlar qayerda rikoshetlanadi, bu qurol joylashgan joyda. Ruterford uning kashfiyoti aynan shunday qilinganligini ta'kidladi.
Sinfda ushbu mavzu bo'yicha javob berishga tayyorlanayotgan maktab o'quvchilari uchun quyidagi savollarga javob tayyorlash tavsiya etiladi:
1. Atom tuzilishining yadroviy modelini kim taklif qilgan?
2. Tajribaning maqsadi nima edi?
3. Yadro modelining boshqa modellardan farqi.

Rezerford nazariyasining ahamiyati
Ruterford o'z tajribalaridan chiqargan radikal xulosalar uning ko'plab zamondoshlarini ushbu modelning haqiqatiga shubha qilishiga olib keldi. Hatto Ruterfordning o'zi ham bundan mustasno emas edi - u tadqiqot natijalarini kashfiyotdan ikki yil o'tgach nashr etdi. Mikrozarrachalarning harakatlanishi haqidagi klassik g'oyalarni asos qilib olib, u atom tuzilishining yadroviy sayyora modelini taklif qildi. Umuman olganda, atom neytral zaryadga ega. Sayyoralar Quyosh atrofida aylanayotgani kabi elektronlar ham yadro atrofida harakat qiladi. Bu harakat Coulomb kuchlari tufayli sodir bo'ladi. Ayni paytda Ruterford modeli sezilarli o'zgarishlarga duch keldi, ammo olimning kashfiyoti bugungi kunda ham o'z ahamiyatini yo'qotmaydi.
Atomning sayyoraviy modeli 1910 yilda E. Rezerford tomonidan taklif qilingan. U alfa zarralari yordamida atom tuzilishi bo'yicha birinchi tadqiqotlarini o'tkazdi. Tarqatish tajribalari natijasida olingan natijalarga asoslanib, Rezerford atomning barcha musbat zaryadlari uning markazidagi mayda yadroda to'planganligini taklif qildi. Boshqa tomondan, manfiy zaryadlangan elektronlar uning qolgan hajmi bo'ylab taqsimlanadi.
Bir oz fon
Atomlarning mavjudligi haqidagi birinchi ajoyib taxminni qadimgi yunon olimi Demokrit aytgan. O'shandan beri atomlarning mavjudligi, ularning birikmalari atrofimizdagi barcha moddalarni keltirib chiqaradigan g'oya fan odamlarining tasavvurini tark etmadi. Uning turli vakillari vaqti-vaqti bilan unga murojaat qilishgan, ammo 19-asr boshlariga qadar ularning konstruktsiyalari eksperimental ma'lumotlar bilan tasdiqlanmagan gipoteza edi.
Nihoyat, 1804 yilda, atomning sayyoraviy modeli paydo bo'lishidan yuz yildan ko'proq vaqt oldin, ingliz olimi Jon Dalton uning mavjudligiga dalil keltirdi va uning birinchi miqdoriy xarakteristikasi bo'lgan atom og'irligi tushunchasini kiritdi. O'zidan oldingilar singari, u atomlarni materiyaning mayda bo'laklari, hatto undan ham kichikroq zarrachalarga bo'linib bo'lmaydigan qattiq sharlar kabi tasavvur qilgan.
Elektronning kashf etilishi va atomning birinchi modeli
Deyarli bir asr o'tdi, nihoyat, kech XIX asrda ham birinchi bo'lib ingliz J. J. Tomson kashf etgan subatomik zarracha, manfiy zaryadlangan elektron. Atomlar elektr neytral bo'lganligi sababli, Tomson ular butun hajmi bo'ylab tarqalgan elektronlar bilan musbat zaryadlangan yadrodan iborat bo'lishi kerak deb o'yladi. Asoslangan turli natijalar 1898 yilda eksperimental ravishda olingan, ba'zan "puddingdagi olxo'ri" deb ataladigan o'zining atom modelini taklif qildi, chunki undagi atom musbat zaryadlangan suyuqlik bilan to'ldirilgan shar shaklida bo'lib, unga "olxo'rilar" kabi elektronlar kiritilgan. puding”. Bunday sharsimon modelning radiusi taxminan 10 -8 sm bo'lgan suyuqlikning umumiy musbat zaryadi quyidagi rasmda ko'rsatilganidek, elektronlarning manfiy zaryadlari bilan nosimmetrik va teng ravishda muvozanatlangan.
Ushbu model modda qizdirilganda yorug'lik chiqarishni boshlashini qoniqarli tarzda tushuntirdi. Garchi bu atom nima ekanligini tushunishga birinchi urinish bo'lsa ham, keyinchalik Ruterford va boshqalar tomonidan o'tkazilgan tajribalar natijalarini qondira olmadi. Tomson 1911 yilda uning modeli a-nurlarining eksperimental ravishda kuzatilgan tarqalishi qanday va nima uchun sodir bo'lishiga oddiygina javob bera olmasligiga rozi bo'ldi. Shuning uchun u tashlab yuborildi va atomning yanada rivojlangan sayyoraviy modeli bilan almashtirildi.
Atom qanday tuzilgan?
Ernest Ruterford unga Nobel mukofotini taqdim etgan radioaktivlik hodisasini tushuntirib berdi, ammo uning fanga eng katta hissasi keyinroq atom ham xuddi Quyoshni oʻrab turganidek, elektronlar orbitalari bilan oʻralgan zich yadrodan iborat ekanligini aniqlaganida boʻldi. sayyoralarning orbitalari.

Atomning sayyoraviy modeliga ko'ra, uning massasining katta qismi kichik (butun atomning o'lchamiga nisbatan) yadroda to'plangan. Elektronlar yadro atrofida aql bovar qilmaydigan tezlikda harakatlanadi, ammo atomlar hajmining katta qismi bo'sh joydir.
Yadroning kattaligi shunchalik kichikki, uning diametri atomnikidan 100 000 marta kichikdir. Yadroning diametri Ruterford tomonidan 10 -13 sm, atomning o'lchamidan farqli o'laroq - 10 -8 sm, yadrodan tashqarida elektronlar uning atrofida aylanadi yuqori tezliklar, natijada protonlar va elektronlar orasidagi elektrostatik tortishish kuchlarini muvozanatlashtiradigan markazdan qochma kuchlar paydo bo'ladi.
Ruterford tajribalari
Atomning sayyoraviy modeli 1911 yilda, keyin paydo bo'lgan mashhur tajriba oltin folga bilan, bu uning tuzilishi haqida ba'zi fundamental ma'lumotlarni olish imkonini berdi. Rezerfordning atom yadrosini ochish yo'li yaxshi misol fanda ijodkorlikning roli. Uning izlanishlari 1899 yilda, ba'zi elementlar har qanday narsaga kirib keta oladigan musbat zaryadlangan zarrachalar chiqarishini aniqlagandan so'ng boshlangan. U bu zarralarni alfa (a) zarrachalar deb atadi (biz ular geliy yadrolari ekanligini endi bilamiz). Barcha yaxshi olimlar singari, Ruterford ham qiziquvchan edi. U atomning tuzilishini o‘rganish uchun alfa zarrachalaridan foydalanish mumkinmi, deb hayron bo‘ldi. Ruterford juda yupqa oltin folga varag'iga alfa zarralari nurini yo'naltirishga qaror qildi. U oltinni tanladi, chunki uni 0,00004 sm gacha yupqa qilib yasash mumkin edi, u oltin folga varag'i orqasiga alfa zarralari urilganda porlab turadigan ekran qo'ydi. U folga orqali o'tgandan keyin alfa zarralarini aniqlash uchun ishlatilgan. Ekrandagi kichik yoriq manbadan chiqqandan keyin alfa zarracha nurlarining folga yetib borishiga imkon berdi. Ulardan ba'zilari folga orqali o'tishi va bir xil yo'nalishda harakat qilishda davom etishi kerak, boshqa qismi folga sakrab tushishi va ostida aks etishi kerak. o'tkir burchaklar. Quyidagi rasmda eksperimental dizaynni ko'rishingiz mumkin.

Ruterford tajribasida nima sodir bo'ldi?
J. J. Tomsonning atom modeliga asoslanib, Rezerford oltin atomlarining butun hajmini to'ldiruvchi musbat zaryadning uzluksiz hududlari folga orqali o'tayotganda barcha alfa zarrachalarining traektoriyalarini burish yoki egishini taxmin qildi.
Biroq, alfa zarralarining katta qismi go'yo u erda bo'lmagandek, oltin folga orqali to'g'ridan-to'g'ri o'tib ketdi. Ular bo'sh joydan o'tayotganga o'xshardi. Ulardan faqat bir nechtasi boshida kutilganidek, to'g'ri yo'ldan og'ishadi. Quyida mos keladigan yo'nalishda tarqalgan zarrachalar sonining tarqalish burchagiga nisbatan grafigi keltirilgan.

Ajablanarlisi shundaki, zarrachalarning kichik bir qismi xuddi basketbol to'pi kabi orqa taxtadan sakrab tushdi. Ruterford bu og'ishlar alfa zarralari va atomning musbat zaryadlangan komponentlari o'rtasidagi to'g'ridan-to'g'ri to'qnashuvlar natijasi ekanligini tushundi.
Yadro markaziy o'rinni egallaydi
Folgadan aks ettirilgan alfa zarralarining kichik foiziga asoslanib, biz atomning barcha musbat zaryadi va deyarli barcha massasi bitta kichik maydonda to'plangan, atomning qolgan qismi esa asosan bo'sh joy degan xulosaga kelishimiz mumkin. Rezerford konsentrlangan musbat zaryad maydonini yadro deb atadi. U bashorat qildi va tez orada uning tarkibida musbat zaryadlangan zarralar borligini aniqladi va ularni protonlar deb atadi. Ruterford neytronlar deb ataladigan neytral atom zarralari mavjudligini bashorat qilgan, ammo ularni aniqlay olmadi. Biroq, uning shogirdi Jeyms Chadvik ularni bir necha yil o'tgach kashf etdi. Quyidagi rasmda uran atomi yadrosining tuzilishi ko'rsatilgan.

Atomlar musbat zaryadlangan ogʻir yadrolardan iborat boʻlib, ular atrofida aylanuvchi manfiy zaryadlangan oʻta yengil elektron zarrachalar bilan oʻralgan boʻlib, shunday tezlikda mexanik markazdan qochma kuchlar ularning yadroga elektrostatik tortishishlarini shunchaki muvozanatlashtiradi va shu munosabat bilan, goʻyoki, atomning barqarorligi taʼminlanadi. .
Ushbu modelning kamchiliklari
Ruterfordning asosiy g'oyasi kichik atom yadrosi g'oyasi bilan bog'liq. Elektron orbitalari haqidagi taxmin sof gipoteza edi. U elektronlarning yadro atrofida qayerda va qanday aylanishini aniq bilmas edi. Shuning uchun Rezerfordning sayyoraviy modeli elektronlarning orbitalarda taqsimlanishini tushuntirmaydi.
Bundan tashqari, Rezerford atomining barqarorligi faqat kinetik energiyani yo'qotmasdan, orbitalarda elektronlarning uzluksiz harakati bilan mumkin edi. Ammo elektrodinamik hisoblar shuni ko'rsatdiki, elektronlarning har qanday egri chiziqli traektoriyalar bo'ylab harakati tezlik vektori yo'nalishining o'zgarishi va mos keladigan tezlanishning paydo bo'lishi bilan muqarrar ravishda nurlanish bilan birga keladi. elektromagnit energiya. Bunday holda, energiyaning saqlanish qonuniga ko'ra, elektronning kinetik energiyasi nurlanishga juda tez sarflanishi kerak va u quyidagi rasmda sxematik ko'rsatilgandek yadroga tushishi kerak.

Ammo bu sodir bo'lmaydi, chunki atomlar barqaror shakllanishdir. Hodisa modeli va eksperimental ma'lumotlar o'rtasida fanga xos bo'lgan qarama-qarshilik paydo bo'ldi.
Ruterforddan Nils Borgacha
Oldinga keyingi katta qadam atom tarixi 1913 yilda daniyalik olim Nils Bor atomning batafsil modeli tavsifini e'lon qilganida sodir bo'ldi. U elektronlar joylashishi mumkin bo'lgan joylarni aniqroq belgilab berdi. Garchi olimlar keyinchalik murakkabroq atom konstruksiyalarini ishlab chiqsalar ham, Borning atomning sayyoraviy modeli asosan to'g'ri edi va uning aksariyati bugungi kunda ham qabul qilinmoqda. Uning ko'pi bor edi foydali ilovalar, masalan, turli kimyoviy elementlarning xossalarini, ularning nurlanish spektrining tabiatini va atomning tuzilishini tushuntirish uchun ishlatiladi. Sayyoraviy model va Bor modeli fizikada yangi yo'nalish - mikrodunyo fizikasining paydo bo'lishini belgilovchi eng muhim bosqichlar edi. Bor 1922 yilda atom tuzilishini tushunishimizga qo'shgan hissasi uchun fizika bo'yicha Nobel mukofotini oldi.
Bor atom modeliga qanday yangilik keltirdi?
Bor hali yoshligida Angliyadagi Ruterford laboratoriyasida ishlagan. Elektron tushunchasi Rezerford modelida yaxshi rivojlanmaganligi sababli, Bor diqqatini ularga qaratdi. Natijada atomning sayyoraviy modeli sezilarli darajada yaxshilandi. Borning 1913 yilda nashr etilgan "Atomlar va molekulalarning tuzilishi to'g'risida" maqolasida shakllantirgan postulatlarida shunday deyilgan:
1. Elektronlar yadro atrofida faqat undan belgilangan masofalarda harakatlana oladi, ular ega bo’lgan energiya miqdori bilan aniqlanadi. U bu sobit darajalarni energiya darajalari yoki elektron qobiqlar deb atadi. Bor ularni har birining markazida yadro bo'lgan konsentrik sharlar sifatida tasavvur qildi. Bunday holda, kamroq energiyaga ega bo'lgan elektronlar ko'proq topiladi past darajalar, yadroga yaqinroq. Ko'proq energiyaga ega bo'lganlar ko'proq topiladi yuqori darajalar, yadrodan uzoqroqda.
2. Agar elektron ma'lum (ma'lum daraja uchun juda aniq) energiyani o'zlashtirsa, u keyingi, yuqori energiya darajasiga o'tadi. Aksincha, agar u bir xil miqdordagi energiyani yo'qotsa, u o'zining dastlabki darajasiga qaytadi. Biroq, elektron ikki energiya darajasida mavjud bo'lolmaydi.
Bu fikr chizma bilan tasvirlangan.

Elektronlar uchun energiya qismlari
Borning atom modeli aslida ikkitasining birikmasidir turli fikrlar: Yadro atrofida aylanadigan elektronlar bilan Rezerfordning atom modeli (asosan atomning Bor-Ruterford sayyoraviy modeli) va nemis olimi Maks Plankning 1901 yilda nashr etilgan materiya energiyasini kvantlash g'oyasi. Kvant (in koʻplik- kvant) bo'ladi minimal miqdor modda tomonidan so'rilishi yoki chiqarilishi mumkin bo'lgan energiya. Bu energiya miqdorini diskretlashtirishning o'ziga xos bosqichidir.
Agar energiya suv bilan taqqoslansa va siz uni stakan shaklida materiyaga qo'shmoqchi bo'lsangiz, siz shunchaki doimiy oqimga suv quya olmaysiz. Buning o'rniga, uni kichik miqdorda, masalan, choy qoshiqda qo'shishingiz mumkin. Bor, agar elektronlar faqat ma'lum miqdordagi energiyani o'zlashtira olsa yoki yo'qotsa, ular o'z energiyasini faqat ma'lum miqdorda o'zgartirishi kerak deb hisoblardi. Shunday qilib, ular yadro atrofida faqat energiyaning kvantlangan o'sishiga mos keladigan qat'iy energiya darajalarini egallashi mumkin.
Shunday qilib, Bor modelidan atomning tuzilishi nima ekanligini tushuntirish uchun kvant yondashuvi paydo bo'ladi. Sayyora modeli va Bor modeli klassik fizikadan mikrodunyo fizikasi, jumladan, atom fizikasining asosiy quroli bo‘lgan kvant fizikasiga qadar o‘ziga xos qadamlar edi.