Ts diagrammasidagi izbarik jarayon. Muhandislik hisoblarida suv bug'ining TS-, Pv- va hs-holat diagrammalaridan foydalanish. a) Izoxorik jarayon
Shuningdek o'qing
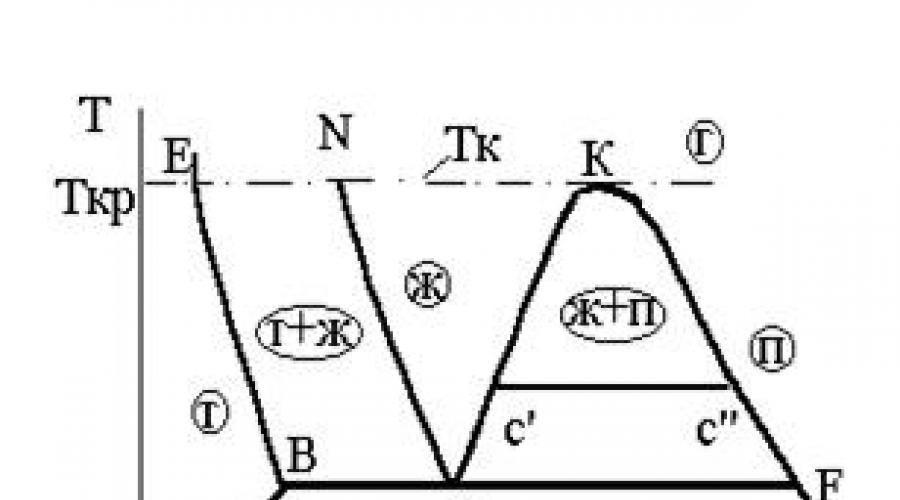
3.3-rasmda P – V koordinatalarida fazalar diagrammasi, T – S koordinatalarida esa 3.4-rasmda ko‘rsatilgan.

3.3-rasm. Faza P-V diagrammasi 3.4-rasm. Bosqich T-S diagrammasi
Belgilar:
t + l - qattiq va suyuqlikning birgalikdagi muvozanat mintaqasi
t + p - qattiq va bug'ning muvozanatli birgalikda yashash hududi
l + n - suyuqlik va bug'ning muvozanatli birga yashash mintaqasi
Agar P - T diagrammasida ikki fazali holatlarning maydonlari egri chiziqlar sifatida tasvirlangan bo'lsa, P - V va T - S diagrammalari ba'zi maydonlardir.
AKF chizig'i chegara egri chizig'i deb ataladi. U, o'z navbatida, pastki chegara egri chizig'iga (AK bo'limi) va yuqori chegara egri chizig'iga (KF bo'limi) bo'linadi.
3.3 va 3.4-rasmlarda uchta ikki fazali holatning hududlari uchrashadigan BF chizig'i 3.1 va 3.2-rasmlardagi kengaytirilgan uchlik T nuqtasidir.
Bug'lanish kabi doimiy haroratda sodir bo'ladigan modda erib ketganda, qattiq va suyuq fazalarning muvozanatli ikki fazali aralashmasi hosil bo'ladi. Ikki fazali aralashmaning tarkibidagi suyuqlik fazasining solishtirma hajmining qiymatlari 3.3-rasmda AN egri chizig'idan, qattiq fazaning o'ziga xos hajmining qiymatlari esa BE egri chizig'idan olingan. .
AKF konturi bilan chegaralangan hudud ichida modda ikki fazaning aralashmasidan iborat: qaynoq suyuqlik (L) va quruq to'yingan bug' (P).
Hajmning qo'shimchaliligi tufayli bunday ikki fazali aralashmaning o'ziga xos hajmi formula bilan aniqlanadi
![]()
Maxsus entropiya:
![]()
Maxsus nuqtalar fazali diagrammalar
Uch nuqta
Uchlik nuqta - bu uch fazaning muvozanat egri chiziqlari yaqinlashadigan nuqta. 3.1 va 3.2-rasmlarda bu T nuqta.
Qattiq holatda ba'zi sof moddalar, masalan, oltingugurt, uglerod va boshqalar agregatsiya holati bir necha fazaga ega (modifikatsiyalar).
Suyuq va gazsimon holatda hech qanday o'zgarishlar yo'q.
(1.3) tenglamaga muvofiq, bir komponentli termal deformatsiya tizimida bir vaqtning o'zida uchdan ortiq faza muvozanatda bo'lishi mumkin emas.
Agar moddaning qattiq holatda bir nechta modifikatsiyalari bo'lsa, u holda jami moddaning jami fazalari uchtadan oshadi va bunday moddada bir nechta uch nuqta bo'lishi kerak. Misol tariqasida, 3.5-rasmda agregatsiyaning qattiq holatida ikkita modifikatsiyaga ega bo'lgan moddaning P-T faza diagrammasi ko'rsatilgan.

3.5-rasm. Faza PT diagrammasi
ikkita kristalli moddalar
qanday bosqichlar
Belgilar:
I - suyuq faza;
II - gazsimon faza;
III 1 va III 2 - agregatsiyaning qattiq holatidagi o'zgarishlar
(kristal fazalar)
T 1 uchlik nuqtasida quyidagilar muvozanatda: gazsimon, suyuq va kristall faza III 2. Bu nuqta Asosiy uch nuqta.
T2 uchlik nuqtasida quyidagilar muvozanatda bo'ladi: suyuq va ikkita kristall faza.
T3 uchlik nuqtasida gazsimon va ikkita kristall faza muvozanatda.
Suvning beshta kristalli modifikatsiyasi (fazalari) ma'lum: III 1, III 2, III 3, III 5, III 6.
Oddiy muz kristal faza III 1 bo'lib, boshqa modifikatsiyalar minglab MPa juda yuqori bosimlarda hosil bo'ladi.
Oddiy muz 204,7 MPa bosim va 22 0 S haroratgacha mavjud.
Qolgan modifikatsiyalar (fazalar) suvdan ko'ra muz zichroqdir. Ushbu muzlardan biri "issiq muz" 2000 MPa bosimda + 80 0 S haroratgacha kuzatilgan.
Termodinamik parametrlar asosiy uch nuqtali suv quyidagi:
T tr = 273,16 K = 0,01 0 S;
P tr = 610,8 Pa;
Vtr = 0,001 m 3 / kg.
Erish egri anomaliyasi () faqat oddiy muz uchun mavjud.
Kritik nuqta
P – V faza diagrammasidan (3.3-rasm) ko’rinib turibdiki, bosim ortishi bilan qaynayotgan suyuqlik (V") va quruq to’yingan bug (V"")ning solishtirma hajmlari orasidagi farq asta-sekin kamayadi va K nuqtada ga teng bo’ladi. nol Bu holat kritik deb ataladi va K nuqtasi moddaning kritik nuqtasidir.
Pk, Tk, Vk, Sk – moddaning kritik termodinamik parametrlari.
Masalan, suv uchun:
P k = 22,129 MPa;
Tc = 374,14 0 S;
V k = 0,00326 m 3 / kg
Kritik nuqtada suyuq va gazsimon fazalarning xossalari bir xil bo'ladi.
T – S faza diagrammasidan (3.4-rasm) kelib chiqqan holda, kritik nuqtada gorizontal faza o'tish chizig'i (C" - C") ostidagi maydon sifatida tasvirlangan bug'lanish issiqligi qaynab turgan suyuqlikdan quruq to'yingan bug'ga aylanadi. nol.
P - V faza diagrammasidagi Tk izotermasi uchun K nuqtasi (3.3-rasm) burilish nuqtasidir.
K nuqtadan o'tuvchi Tk izotermasi yakuniy ikki fazali hududning izotermasi, ya'ni. suyuq faza hududini gazsimon hududdan ajratib turadi.
Tk dan yuqori haroratlarda izotermalarda endi fazaviy o‘tishlarni ko‘rsatuvchi to‘g‘ri kesimlar ham, Tk izotermasi uchun xarakterli burilish nuqtasi ham bo‘lmaydi, balki asta-sekin ideal gaz izotermalariga yaqin shakldagi silliq egri chiziqlar shaklini oladi.
"Suyuqlik" va "gaz" (bug ') tushunchalari ma'lum darajada shartli, chunki suyuqlik va gazdagi molekulalarning o'zaro ta'siri bor umumiy naqshlar, faqat miqdoriy jihatdan farqlanadi. Bu tezisni 3.6-rasmda ko’rsatish mumkin, bunda gazsimon fazaning E nuqtasidan suyuqlik fazasining L nuqtasiga o’tish EFL traektoriyasi bo’ylab K kritik nuqtani chetlab o’tish orqali amalga oshiriladi.

3.6-rasm. Ikki fazali o'tish variantlari
gazsimon fazadan suyuq fazaga
AD chizig'i bo'ylab C nuqtada o'tganda, modda ikki fazaga bo'linadi va keyin modda asta-sekin gazsimon (bug ') fazadan suyuq fazaga o'tadi.
C nuqtasida moddaning xossalari keskin o'zgaradi (P - V faza diagrammasida fazaga o'tishning C nuqtasi fazaga o'tish chizig'iga (C" - C") aylanadi).
EFL chizig'i bo'ylab harakatlanayotganda, gazning suyuqlikka aylanishi doimiy ravishda sodir bo'ladi, chunki EFL chizig'i TCning bug'lanish egri chizig'i bilan hech qanday joyda kesishmaydi, bu erda modda bir vaqtning o'zida ikki faza: suyuq va gazsimon shaklda mavjud. Binobarin, EFL chizig'i bo'ylab o'tayotganda, modda ikki fazaga parchalanmaydi va bir fazali bo'lib qoladi.
Kritik harorat Tc ikki fazaning muvozanatli birga yashashi uchun cheklovchi haroratdir.
dagi termodinamik jarayonlarga nisbatan murakkab tizimlar T k ning ushbu klassik lakonik ta'rifini quyidagicha kengaytirish mumkin:
Kritik harorat Tc - bu termodinamik jarayonlar mintaqasining pastki harorat chegarasi bo'lib, unda bosim va haroratning har qanday o'zgarishi ostida "gaz-suyuq" moddaning ikki fazali holatining paydo bo'lishi mumkin emas. Ushbu ta'rif 3.7 va 3.8-rasmlarda tasvirlangan. Bu raqamlardan kelib chiqadiki, bu hudud cheklangan kritik harorat, faqat moddaning gaz holatini (gaz fazasini) qamrab oladi. Bug 'deb ataladigan moddaning gazsimon holati bu hududga kiritilmagan.


Guruch. 3.7. Kritik ta'rifiga 3.8-rasm
harorat
Ushbu raqamlardan kelib chiqadiki, kritik harorat bilan cheklangan bu soyali maydon faqat moddaning gaz holatini (gaz fazasi) qamrab oladi. Bug 'deb ataladigan moddaning gazsimon holati bu hududga kiritilmagan.
Tanqidiy nuqta tushunchasidan foydalanib, dan mumkin umumiy tushuncha"Materaning gazsimon holati" "bug '" tushunchasini ta'kidlaydi.
Steam - bu kritik haroratdan past harorat oralig'idagi moddaning gazsimon fazasi.
Termodinamik jarayonlarda texnologik chiziq bug'lanish egri chizig'i TC yoki sublimatsiya egri chizig'i 3 bilan kesishganda, gazsimon faza har doim dastlab bug' bo'ladi.
Kritik bosim P k - bu bosim bo'lib, undan yuqori bo'lgan moddani bir vaqtning o'zida va muvozanatli ikkita fazaga ajratish har qanday haroratda mumkin emas: suyuqlik va gaz.
Murakkab tizimlardagi termodinamik jarayonlarga nisbatan P k ning ushbu klassik ta'rifi batafsilroq shakllantirilishi mumkin:
Kritik bosim P k - bu termodinamik jarayonlar mintaqasining pastki bosim chegarasi bo'lib, unda bosim va haroratning har qanday o'zgarishi ostida "gaz-suyuq" moddaning ikki fazali holatining paydo bo'lishi mumkin emas. Kritik bosimning bu ta'rifi 3.9-rasmda ko'rsatilgan. va 3.10. Bu raqamlardan kelib chiqadiki, kritik bosim bilan chegaralangan bu hudud nafaqat gaz fazasining Pk izobar ustida joylashgan qismini, balki Tk izotermasi ostida joylashgan suyuqlik fazasining qismini ham qamrab oladi.
Superkritik mintaqa uchun kritik izoterma shartli ravishda suyuqlik-gazning ehtimoliy (shartli) chegarasi sifatida qabul qilinadi.


3.9-rasm Kritik ta'rifga qarab - 3.10-rasm. Tanqidiy ta'rifga
bosimning bosimi kim
Agar o'tish bosimi kritik nuqtadagi bosimdan ancha katta bo'lsa, u holda modda qattiq (kristallik) holatdan to'g'ridan-to'g'ri gaz holatiga o'tadi va uni chetlab o'tadi. suyuqlik holati.
Bu anomal moddaning P-T faza diagrammalarida aniq ko'rinmaydi (3.6, 3.7, 3.9-rasmlar), chunki ular diagrammaning yuqori bosimda bir nechta kristalli modifikatsiyaga (va shunga mos ravishda bir nechta uch nuqtaga) ega bo'lgan moddaning yana normal xususiyatlarga ega bo'lgan qismini ko'rsatmaydi.
Oddiy materiyaning P - T fazali diagrammasi bo'yicha, rasm. 3.11 qattiq fazadan to'g'ridan-to'g'ri gazsimon fazaga o'tish jarayoni A "D" ko'rinishida ko'rsatilgan.

Guruch. 3.11. Oddiy holatga o'tish
moddalarni qattiq fazadan darhol ichiga oladi
P>Ptr da gazsimon
Suyuq fazani chetlab o'tib, moddaning qattiq fazadan bug 'fazasiga o'tishi faqat P da belgilanadi.<Р тр. Примером такого перехода, называемого сублимацией, является процесс АD на рис 3.11.
Kritik harorat juda oddiy molekulyar-kinetik talqinga ega.
Gazni suyultirish jarayonida erkin harakatlanuvchi molekulalarning suyuqlik tomchisiga birikmasi faqat o'zaro tortishish kuchlari ta'sirida sodir bo'ladi. T>T k bo'lganda kinetik energiya ikki molekulaning nisbiy harakati bu molekulalarning tortishish energiyasidan kattaroqdir, shuning uchun suyuqlik tomchilarining paydo bo'lishi (ya'ni, ikki fazaning birgalikda mavjudligi) mumkin emas.
Faqat bug'lanish egri chiziqlari kritik nuqtalarga ega, chunki ular ikkita muvozanatning birgalikda mavjudligiga to'g'ri keladi izotropik Fazalar: suyuq va gazsimon. Erish va sublimatsiya chiziqlari muhim nuqtalarga ega emas, chunki ular fazalardan biri (qattiq) bo'lsa, materiyaning bunday ikki fazali holatlariga mos keladi anizotrop.
Superkritik mintaqa
P-T fazasi diagrammasida bu kritik nuqtadan o'ngda va yuqorida joylashgan, taxminan to'yinganlik egri chizig'ini aqliy ravishda davom ettirish mumkin bo'lgan mintaqadir.
Zamonaviy to'g'ridan-to'g'ri oqimda bug 'qozonlari bug'lanish superkritik mintaqada sodir bo'ladi.


3.12-rasm. 3.13-rasmdagi fazali o'tish. Subkritikda fazali o'tish
subkritik va o'ta tanqidiy va o'ta tanqidiy hududlar P-V diagrammalar
hududlar R-T diagrammalar
Superkritik mintaqadagi termodinamik jarayonlar bir qator o'ziga xos xususiyatlar bilan sodir bo'ladi.
Keling, subkritik mintaqada AS izobarik jarayonini ko'rib chiqaylik, ya'ni. da . A nuqtasi moddaning suyuq fazasiga to'g'ri keladi, u Tn haroratga erishilganda bug'ga aylana boshlaydi. Bu fazaga o’tish 3.12-rasmdagi B nuqtaga va 3.13-rasmdagi B“B”” segmentiga to’g’ri keladi.TK to’yinganlik egri chizig’idan o’tganda moddaning xossalari keskin o’zgaradi.S nuqta moddaning gazsimon fazasiga to’g’ri keladi.
Keling, bosimdagi A "S" izobar jarayonini ko'rib chiqaylik. A" nuqtada modda suyuq fazada, S nuqtasida esa - gazsimon fazada, ya'ni. turli fazali holatlarda. Ammo A nuqtadan S ga o'tishda xususiyatlarning keskin o'zgarishi kuzatilmaydi: moddaning xususiyatlari doimiy va asta-sekin o'zgaradi. A"S" chizig'idagi moddaning xossalarining bunday o'zgarish tezligi har xil: u A" va S" nuqtalari yaqinida kichik bo'lib, o'ta kritik mintaqaga kirganda keskin ortadi. Superkritik mintaqadagi har qanday izobarda siz nuqtalarni ko'rsatishingiz mumkin maksimal tezlik o'zgarishlar: moddaning hajm kengayishining harorat koeffitsienti, entalpiya, ichki energiya, yopishqoqlik, issiqlik o'tkazuvchanligi va boshqalar.
Shunday qilib, superkritik mintaqada fazaviy o'tishlarga o'xshash hodisalar rivojlanadi, ammo "suyuqlik - gaz" moddasining ikki fazali holati kuzatilmaydi. Bundan tashqari, superkritik mintaqaning chegaralari xiralashgan.
P da<Р к, т.е. в докритической области, на фазовое превращение «жидкость - пар» требуется затратить скрытую теплоту парообразования, которая является как бы «тепловым барьером» между жидкой и паровой фазами.
Superkritik mintaqada shunga o'xshash narsa kuzatiladi. 3.14-rasmda P>P k da o'ziga xos izobar issiqlik sig'imi o'zgarishining tipik tasviri ko'rsatilgan.

3.14-rasm. Maxsus izobarik
superkritikda issiqlik sig'imi
bosim.
Q r = S r dT bo'lgani uchun, u holda Sr(T) egri chiziq ostidagi maydon suyuqlikni (A’ nuqta) o'ta kritik bosimda gazga (S' nuqta) aylantirish uchun zarur bo'lgan issiqlikdir. A'M S' nuqtali chiziq Sr ning haroratga odatiy bog'liqligini ko'rsatadi subkritik hududlar.
Shunday qilib, o'ta kritik mintaqadagi C p (T) egri chizig'idagi maksimal, ya'ni moddani isitish uchun qo'shimcha issiqlik sarfini bildiradi, bu mintaqada suyuqlik va gaz o'rtasidagi "issiqlik to'sig'i" sifatida ham xuddi shunday vazifalarni bajaradi.
Tadqiqotlar shuni ko'rsatdiki, maksimal pozitsiyalar  mos kelmasin, bu superkritik mintaqada suyuqlik va bug 'o'rtasida bitta chiziq yo'qligini ko'rsatadi. Unda faqat keng va loyqa zona mavjud bo'lib, u erda suyuqlikning bug'ga aylanishi eng intensiv sodir bo'ladi.
mos kelmasin, bu superkritik mintaqada suyuqlik va bug 'o'rtasida bitta chiziq yo'qligini ko'rsatadi. Unda faqat keng va loyqa zona mavjud bo'lib, u erda suyuqlikning bug'ga aylanishi eng intensiv sodir bo'ladi.
Ushbu transformatsiyalar eng intensiv ravishda kritik bosimdan (Pc) oshmaydigan bosimlarda sodir bo'ladi. Bosim ortishi bilan suyuqlikning bug'ga aylanishi hodisalari silliqlashadi va yuqori bosimlarda juda zaif namoyon bo'ladi.
Shunday qilib, P>P k da bir vaqtning o'zida va muvozanatda suyuq faza, gazsimon faza va ba'zi bir oraliq faza mavjud, lekin birga bo'lolmaydi. Ushbu oraliq bosqich ba'zan deyiladi metafaza , u suyuqlik va gazning xususiyatlarini birlashtiradi.
Superkritik mintaqada termodinamik parametrlar, termofizik xarakteristikalar va xarakterli funktsiyalarning keskin o'zgarishi tufayli ularning xatolari eksperimental aniqlash bu mintaqada subkritik bosimlarga qaraganda o'n baravar ko'proq.
Ideal gaz izoprotsesslari- parametrlardan biri o'zgarishsiz qoladigan jarayonlar.
1. Izoxorik jarayon . Charlz qonuni. V = konst.
Izoxorik jarayon qachon sodir bo'ladigan jarayon deb ataladi doimiy hajm V. Ushbu izoxorik jarayonda gazning xatti-harakati bo'ysunadi Charlz qonuni :
Gaz massasi va uning molyar massasining doimiy hajmi va doimiy qiymatlarida gaz bosimining unga nisbati mutlaq harorat doimiy bo'lib qoladi: P/T= const.
Izoxorik jarayonning grafigi PV- diagramma deyiladi izoxora . Izoxorik jarayonning grafigini bilish foydalidir RT- Va VT-diagrammalar (1.6-rasm). Izohor tenglamasi:
P 0 0 °C da bosim bo'lsa, a gaz bosimining harorat koeffitsienti 1/273 deg -1 ga teng. Bunday qaramlikning grafigi Rt-diagramma 1.7-rasmda ko'rsatilgan shaklga ega.

Guruch. 1.7
2. Izobarik jarayon. Gey-Lyusak qonuni. R= const.
Izobar jarayon - doimiy bosim P da sodir bo'ladigan jarayon . Izobarik jarayon davomida gazning xatti-harakati bo'ysunadi Gey-Lyusak qonuni:
Doimiy bosim va gaz massasi va uning molyar massasining doimiy qiymatlarida gaz hajmining uning mutlaq haroratiga nisbati doimiy bo'lib qoladi: V/T= const.
Izobar jarayonning grafigi VT- diagramma deyiladi izobar . Izobarik jarayonning grafiklarini bilish foydalidir PV- Va RT-diagrammalar (1.8-rasm).

Guruch. 1.8
Izobar tenglamasi:
Bu erda a =1/273 ° -1 - volumetrik kengayishning harorat koeffitsienti. Bunday qaramlikning grafigi Vt diagramma 1.9-rasmda ko'rsatilgan shaklga ega.

Guruch. 1.9
3. Izotermik jarayon. Boyl-Mariot qonuni. T= const.
Izotermik jarayon qachon sodir bo'ladigan jarayondir doimiy harorat T.
Izotermik jarayon davomida ideal gazning xatti-harakati bo'ysunadi Boyl-Mariot qonuni:
Doimiy haroratda va gaz massasi va uning molyar massasining doimiy qiymatlarida gaz hajmi va bosimining mahsuloti doimiy bo'lib qoladi: PV= const.
Izotermik jarayonning grafigi PV- diagramma deyiladi izoterm . Izotermik jarayonning grafiklarini bilish foydalidir VT- Va RT-diagrammalar (1.10-rasm).

Guruch. 1.10
Izotermiya tenglamasi:
| (1.4.5) |
4. Adiabatik jarayon(izentropik):
Adiabatik jarayon - bu issiqlik almashinuvisiz sodir bo'ladigan termodinamik jarayon muhit.
5. Politropik jarayon. Gazning issiqlik sig'imi doimiy bo'lib qoladigan jarayon. Politropik jarayon yuqorida sanab o'tilgan barcha jarayonlarning umumiy holatidir.
6. Avogadro qonuni. Xuddi shu bosim va bir xil haroratlarda teng hajmdagi turli xil ideal gazlar mavjud bir xil raqam molekulalar. Bitta savdo markazida turli moddalar N A o'z ichiga oladi=6,02·10 23 molekulalar (Avogadro raqami).
7. Dalton qonuni. Ideal gazlar aralashmasining bosimi uning tarkibidagi gazlarning qisman P bosimlarining yig'indisiga teng:
| (1.4.6) |
Qisman bosim Pn - ma'lum bir gazning o'zi butun hajmni egallaganida ko'rsatadigan bosim.
Da ![]() , gaz aralashmasi bosimi.
, gaz aralashmasi bosimi.
Bosqich pv - diagramma suyuqlik va bug'dan tashkil topgan tizim suv va bug'ning o'ziga xos hajmlarining bosimga nisbatan grafigidir.
Suvni haroratda qoldiring 0 0 S va ma'lum bosim r ma'lum hajmni egallaydi v 0 (NS segmenti) . Butun egri chiziq AE suvning o'ziga xos hajmining haroratdagi bosimga bog'liqligini ifodalaydi 0 0 S. Chunki suv egri chiziq bo'lgan deyarli siqilmaydigan moddadir AE ordinata o'qiga deyarli parallel. Agar doimiy bosimda suvga issiqlik berilsa, uning harorati ko'tariladi va uning solishtirma hajmi ortadi. Ba'zi haroratda ts suv qaynaydi va uning o'ziga xos hajmi v' nuqtada A' berilgan bosimda maksimal qiymatiga etadi. Bosim ortishi bilan qaynayotgan suyuqlikning harorati ortadi ts va hajmi v' ham ortadi. Bog'liqlik grafigi v' bosimga nisbatan egri chiziq bilan ifodalanadi AK Bu suyuqlik chegarasi egri chizig'i deb ataladi. Egri chiziqning xarakteristikasi quruqlik darajasidir x=0. Doimiy bosim ostida keyingi issiqlik ta'minoti bo'lsa, bug'lanish jarayoni boshlanadi. Shu bilan birga, suv miqdori kamayadi, bug 'miqdori ortadi. Nuqtada bug'lanish tugallanganda IN' bug 'quruq va to'yingan bo'ladi. Quruq to'yingan bug'ning o'ziga xos hajmi belgilanadi v''.
Agar bug'lanish jarayoni doimiy bosimda sodir bo'lsa, unda uning harorati o'zgarmaydi va jarayon A'B' ham izobarik, ham izotermikdir. Nuqtalarda A' Va B' modda bir fazali holatda bo'ladi. Oraliq nuqtalarda modda suv va bug 'aralashmasidan iborat. Bu jismlarning aralashmasi deyiladi ikki fazali tizim.
Maxsus hajm syujeti v'' bosimga nisbatan egri chiziq bilan ifodalanadi KV, bug' chegarasi egri chizig'i deb ataladi.
Agar quruq to'yingan bug'ga doimiy bosimda issiqlik berilsa, uning harorati va hajmi ortadi va quruq to'yingan bug' quruq to'yingan bug'dan o'ta qizigangacha o'tadi (nuqta). D). Ikkala egri AK Va HF diagrammani uch qismga bo'ling. Suyuqlik chegarasi egri chizig'ining chap tomonida AK Nol izotermasidan oldin suyuqlik mintaqasi mavjud. Egri chiziqlar o'rtasida AK Va HF suv va quruq bug 'aralashmasidan tashkil topgan ikki fazali tizim mavjud. O'ngdan HF va nuqtadan yuqoriga TO tananing haddan tashqari qizib ketgan bug 'yoki gaz holati mavjud. Ikkala egri AK Va HF bir nuqtada birlashadi TO, kritik nuqta deb ataladi.
Kritik nuqta uchlik nuqtadan boshlanadigan suyuqlik-bug 'fazasi o'tishning yakuniy nuqtasidir. Kritik nuqtadan yuqorida, ikki fazali holatda moddaning mavjudligi mumkin emas. Hech qanday bosim miqdori kritik darajadan yuqori haroratlarda gazni suyuq holatga aylantira olmaydi.
Suv uchun kritik nuqta parametrlari:
t k =374,12 0 S; v k =0,003147 m 3 /kg;
r k =22,115 MPa; i k =2095,2 kJ/kg
s k =4,424 kJ/(kg K).
Jarayon p =const p–V , i–S Va T–S diagrammalar.

Yoniq - diagramma To'yingan bug' mintaqasidagi izobar suyuqlik bug'ining chegara egri chiziqlarini kesib o'tuvchi to'g'ri chiziq bilan ifodalanadi. Issiqlik nam bug'ga berilganda, uning quruqlik darajasi oshadi va u (doimiy haroratda) quruq bug'ga, keyingi issiqlik bilan esa - o'ta qizib ketgan bug'ga aylanadi. O'ta qizib ketgan bug' mintaqasidagi izobar konveks tarzda pastga yo'naltirilgan egri chiziqdir.

Yoniq pv - diagramma izobarik jarayon gorizontal to'g'ri chiziq segmenti bilan tasvirlangan, u nam bug' mintaqasida bir vaqtning o'zida izotermik jarayonni ham tasvirlaydi.

Yoniq Ts - diagramma ho'l bug' mintaqasida izobar to'g'ri gorizontal chiziq bilan, o'ta qizib ketgan bug' mintaqasida esa pastga qarab egri konveks bilan tasvirlangan. Hisoblash uchun barcha kerakli miqdorlarning qiymatlari to'yingan va qizib ketgan bug'lar jadvallaridan olingan.
Bug'ning o'ziga xos ichki energiyasining o'zgarishi:
Ta'minlangan issiqlikning o'ziga xos miqdori:
Qachon bo'lsa q berilgan va ikki fazali holatlar mintaqasida joylashgan ikkinchi nuqtaning parametrlarini topish talab qilinadi, ho'l bug'ning entalpiyasi uchun formula qo'llaniladi:
Jarayon T=const suv bug'i. Tasvirni qayta ishlash p–V , i–S Va T–S diagrammalar.
Izotermik jarayon.

Yoniq - diagramma ho'l bug' mintaqasida izoterm izobarga to'g'ri keladi va to'g'ri qiya chiziqdir. Haddan tashqari qizib ketgan bug 'hududida izoterm yuqoriga qarab qavariq bilan egri chiziq shaklida tasvirlangan.
1) Termodinamikada ular muvozanat jarayonlarini o'rganish uchun keng qo'llaniladi. pv- abscissa o'qi o'ziga xos hajm, ordinata o'qi esa bosim bo'lgan diagramma. Termodinamik tizimning holati ikkita parametr bilan aniqlanganligi sababli, u holda PV– diagrammada u nuqta bilan ifodalangan. Rasmda 1-band tizimning dastlabki holatiga, 2-band yakuniy holatga va 1-2-chiziq ishchi suyuqlikning v 1 dan v 2 gacha kengayish jarayoniga mos keladi. Ovozning cheksiz o'zgarishi uchun dv soyali vertikal chiziqning maydoni pdv = dl ga teng, shuning uchun 1-2 jarayonning ishi jarayon egri chizig'i, x o'qi va ekstremal ordinatalar bilan cheklangan maydon bilan tasvirlangan. Shunday qilib, hajmni o'zgartirish ishi diagrammadagi jarayon egri chizig'i ostidagi maydonga ekvivalentdir PV.

2) TS diagrammasidagi muvozanat holati harorat va entropiya qiymatlariga mos keladigan koordinatali nuqtalar bilan ifodalanadi. Bu diagrammada harorat ordinata o'qi bo'ylab, harorat esa abscissa o'qi bo'ylab chizilgan. entropiya.
Ishchi suyuqlik holatini dastlabki holat 1 dan oxirgi holat 2 ga o'zgartirishning teskari termodinamik jarayoni TS diagrammasida ushbu nuqtalar orasidan o'tadigan uzluksiz egri chiziq bilan tasvirlangan. Abdc maydoni TdS=dq ga teng, ya'ni. teskari jarayonda tizim tomonidan qabul qilingan yoki chiqarilgan issiqlikning elementar miqdorini ifodalaydi. Egri chiziq ostidagi maydon TS− diagramma, tizimga berilgan yoki undan chiqarilgan issiqlikni ifodalaydi. Shunung uchun TS− Diagramma termal diagramma deb ataladi.

Gaz jarayonlari TS- diagrammasida.
1. Izotermik jarayon.
Izotermik jarayonda T=const. Shunung uchun T.S.−diagrammada u abtsissa o'qiga parallel to'g'ri chiziq sifatida tasvirlangan.
2. Adiabatik jarayon
Adiabatik jarayonda q=0 Va dq=0, va natijada dS=0.
Shuning uchun adiabatik jarayonda S=const va ichida T.S.−diagrammada adiabatik jarayon o‘qga parallel bo‘lgan to‘g‘ri chiziq shaklida tasvirlangan T. Chunki adiabatik jarayonda S=const, keyin adiabatik qaytar jarayonlar izentropik deb ham ataladi. Adiabatik siqish paytida ishchi suyuqlikning harorati ko'tariladi va kengayish vaqtida u pasayadi. Shuning uchun 1-2 jarayon siqish jarayoni, 2-1 jarayon esa kengayish jarayonidir.
Izokorik jarayon uchun V=const, dV=0. Doimiy issiqlik quvvatida - ko'rinishi T.S.- diagramma. Har qanday nuqtada jarayon egri chizig'ining subtangenti haqiqiy issiqlik sig'imining qiymatini aniqlaydi REZYUME. Agar egri chiziq pastga qarab qavariq bo'lsa, subtangent ijobiy bo'ladi.
4. Izobarik jarayon
Izobarik jarayonda bosim doimiy bo'ladi p=const.
Da p=const bilan bo'lgani kabi V=const Izobar - logarifmik egri chiziq bo'lib, chapdan o'ngga ko'tariladi va pastga qarab qavariq.
Har qanday nuqtada 1-2 egri chizig'ining subtangenti haqiqiy issiqlik sig'imi qiymatlarini beradi C p.
Termodinamik jarayon (issiqlik jarayoni) - termodinamik tizimning makroskopik holatining o'zgarishi. Agar tizimning dastlabki va oxirgi holatlari orasidagi farq cheksiz kichik bo'lsa, unda bunday jarayon elementar (cheksiz kichik) deb ataladi.
Issiqlik jarayoni sodir bo'ladigan tizim ishchi suyuqlik deb ataladi.
Issiqlik jarayonlarini muvozanatli va muvozanatsiz bo'lish mumkin. Muvozanat jarayoni - bu tizim orqali o'tadigan barcha holatlar muvozanat holati bo'lgan jarayon. Bunday jarayon taxminan o'zgarishlar juda sekin sodir bo'lgan hollarda amalga oshiriladi, ya'ni jarayon kvazistatikdir.
Issiqlik jarayonlarini qaytariladigan va qaytarilmaydiganlarga bo'lish mumkin. Qaytariladigan jarayon - bu barcha bir xil oraliq holatlar orqali qarama-qarshi yo'nalishda amalga oshirilishi mumkin.
Issiqlik jarayonlarining turlari:
Adiabatik jarayon - atrof-muhit bilan issiqlik almashinuvisiz. atrof-muhit;
Izoxorik jarayon - doimiy hajmda sodir bo'ladi;
Izobarik jarayon - doimiy bosimda sodir bo'ladi;
Izotermik jarayon - doimiy haroratda sodir bo'ladi;
Izoentropik jarayon - doimiy entropiyada sodir bo'ladi;
Izentalpik jarayon - doimiy entalpiyada sodir bo'ladi;
Politropik jarayon - doimiy issiqlik sig'imida sodir bo'ladi.
Mendeleyev-Klayperon tenglamasi (ideal gaz holat tenglamasi):
PV = nRT, bu erda n - gazning mollari soni, P - gaz bosimi, V - gaz hajmi, T - gaz harorati, R - universal gaz doimiysi
Ideal gazning izoprotsesslari. Ularning surati P - V diagrammalar.
1) Izobarik jarayon p = const, V/T = const



2) Izoxorik jarayon V = const, p/T = const



3) Izotermik jarayon T = const, pV = const



Termodinamik jarayonlar. Mendeleyev-Klapeyron tenglamasi. Ideal gazning izoprotsesslari. Ularning R-dagi suratiVdiagrammalar.
Termodinamik jarayonlar. Ishchi suyuqlikning o'zgaruvchan holatlari to'plamiga termodinamik jarayon deyiladi.
Ideal gaz - termodinamikada o'rganiladigan xayoliy gaz bo'lib, unda molekulalararo tortishish va itarilish kuchlari mavjud emas va molekulalarning o'zi moddiy nuqtalar, hajmi yo'q. Ko'pgina haqiqiy gazlar o'zlarining fizik xususiyatlariga ko'ra ideal gazga juda yaqin.
Termodinamikaning asosiy jarayonlari:
izoxorik, doimiy hajmda oqadigan;
izobarik doimiy bosim ostida oqadigan;
izotermik, doimiy haroratda yuzaga kelgan;
adiabatik, unda atrof-muhit bilan issiqlik almashinuvi yo'q;
Izoxorik jarayon

Izoxorik jarayonda shart qondiriladi v= const.
Ideal gazning holat tenglamasidan ( pv=RT) quyidagicha:
p/T=R/v= const,
ya'ni gaz bosimi uning mutlaq haroratiga to'g'ridan-to'g'ri proportsionaldir:
p 2 /p 1 =T 2 /T 1 .
Izoxorik jarayonda kengayish ishi nolga teng ( l= 0), chunki ishchi suyuqlik hajmi o'zgarmaydi (D v= const).
1-2 da jarayonda ishchi suyuqlikka beriladigan issiqlik miqdori cv
q=cv(T 2 -T 1 ).
Chunki l= 0, keyin termodinamikaning birinchi qonuni D asosida u=q, ya'ni ichki energiyaning o'zgarishini quyidagi formula bilan aniqlash mumkin:
Δ u=cv(T 2 -T 1 ).
Izoxorik jarayonda entropiyaning o'zgarishi quyidagi formula bilan aniqlanadi:
s 2 -s 1 = Δ s = cv ln( p 2 /p 1 ) = cv ln( T 2 /T 1 ).
Izobarik jarayon

Doimiy bosimda sodir bo'ladigan jarayonga izobarik deyiladi. p= const. Ideal gazning holat tenglamasidan kelib chiqadi:
v/ T=R/ p=const
v 2 /v 1 =T 2 /T 1 ,
ya'ni izobar jarayonda gaz hajmi uning mutlaq haroratiga proporsional bo'ladi.
Ish quyidagiga teng bo'ladi:
l=p(v 2 –v 1 ).
Chunki pv 1 =RT 1 Va pv 2 =RT 2 , Bu
l=R(T 2 – T 1 ).
da issiqlik miqdori cp= const formula bilan aniqlanadi:
q=cp(T 2 – T 1 ).
Entropiyaning o'zgarishi quyidagilarga teng bo'ladi:
s 2 -s 1 = Δ s = cp ln( T 2 /T 1 ).
Izotermik jarayon

Izotermik jarayonda ishchi suyuqlikning harorati doimiy bo'lib qoladi T= const, shuning uchun:
pv = RT= const
p 2 / p 1 =v 1 / v 2 ,
ya'ni bosim va hajm bir-biriga teskari proportsionaldir, shuning uchun izotermik siqish paytida gaz bosimi ortadi, kengayganda esa kamayadi.
Jarayonning ishi quyidagilarga teng bo'ladi:
l=RT ln( v 2 –v 1 ) =RT ln( p 1 -p 2 ).
Harorat doimiy bo'lgani uchun izotermik jarayonda ideal gazning ichki energiyasi doimiy bo'lib qoladi (D u= 0) va ishchi suyuqlikka berilgan barcha issiqlik to'liq kengaytirish ishiga aylanadi:
q=l.
Izotermik siqilish vaqtida ishchi suyuqlikdan issiqlik siqilish uchun sarflangan ishga teng miqdorda chiqariladi.
Entropiya o'zgarishi:
s 2 -s 1 = Δ s=R ln( p 1 /p 2 ) =R ln( v 2 /v 1 ).
Adiabatik jarayon

Adiabatik - bu atrof-muhit bilan issiqlik almashinuvisiz sodir bo'ladigan gaz holatini o'zgartirish jarayoni. d.dan beri q= 0 bo'lsa, adiabatik jarayon uchun termodinamikaning birinchi qonuni tenglamasi quyidagi ko'rinishga ega bo'ladi:
d u+p d v= 0
Δ u+l= 0,
shuning uchun
Δ u= -l.
Adiabatik jarayonda kengayish ishi faqat gazning ichki energiyasini sarflash orqali amalga oshiriladi va tashqi kuchlar ta'sirida yuzaga keladigan siqilish paytida ular tomonidan bajarilgan barcha ishlar gazning ichki energiyasini oshirishga ketadi. .
Adiabatik jarayonda issiqlik sig'imini quyidagicha belgilaymiz c do'zax va holat d q= 0, biz buni quyidagicha ifodalaymiz:
d q=c jahannam d T= 0.
Bu holat adiabatik jarayondagi issiqlik sig'imi nolga teng ekanligini ko'rsatadi ( c jahannam = 0).
Ma'lumki
Bilanp/cv =k
va adiabatik jarayonning (adiabatik) egri chizig'ining tenglamasi p, v- diagramma quyidagicha ko'rinadi:
pvk= const.
Ushbu ifodada k deyiladi adiabatik indeks(Puasson nisbati ham deyiladi).
Ayrim gazlar uchun adiabatik indeks k qiymatlari:
k havo = 1,4
k qizdirilgan bug '= 1,3
k ichki yonish dvigatellarining chiqindi gazlari = 1,33
k to'yingan nam bug' = 1,135
Oldingi formulalardan quyidagicha:
l= - Δ u = cv(T 1 – T 2 );
i 1 - men 2 = cp(T 1 – T 2 ).
Adiabatik jarayonning texnik ishi ( l techn) jarayonning boshi va oxiri entalpiyalari orasidagi farqga teng ( i 1 - men 2 ).
Ishchi suyuqlikda ichki ishqalanishsiz sodir bo'ladigan adiabatik jarayon deyiladi izentropik. IN T, s-diagrammada u vertikal chiziq sifatida tasvirlangan.
Odatda, haqiqiy adiabatik jarayonlar ishtirokida sodir bo'ladi ichki ishqalanish ishchi suyuqlikda, buning natijasida issiqlik doimo chiqariladi, bu esa ishchi suyuqlikning o'ziga beriladi. Bunday holda d s> 0 va jarayon chaqiriladi haqiqiy adiabatik jarayon.
Mendeleyev-Klapeyron tenglamasi
Gazlar ko'pincha reaktivlar va mahsulotlardir kimyoviy reaksiyalar. Oddiy sharoitlarda ularni bir-biri bilan reaksiyaga kirishish har doim ham mumkin emas. Shuning uchun siz odatdagidan boshqa sharoitlarda gazlarning mol sonini qanday aniqlashni o'rganishingiz kerak.
Buning uchun ular foydalanadilar ideal gaz holati tenglamasi(Klapeyron-Mendeleyev tenglamasi deb ham ataladi):
PV = n RT
Qayerda n- gazning mollari soni;
P - gaz bosimi (masalan, in atm;
V – gaz hajmi (litrda);
T – gaz harorati (kelvinlarda);
R – gaz doimiysi (0,0821 l atm/mol K).
Masalan, 2,6 litrli kolbada 2,3 bosimda kislorod mavjud atm va harorat 26 o S. Savol: kolbada nechta mol O 2 bor?
Gaz qonunidan biz kerakli miqdordagi mollarni topamiz n:
Biz haroratni Selsiy gradusidan Kelvinga aylantirishni unutmasligimiz kerak: (273 o C + 26 o C) = 299 K. Umuman olganda, bunday hisob-kitoblarda xatolikka yo'l qo'ymaslik uchun siz qiymatlarning o'lchamini diqqat bilan kuzatib borishingiz kerak. Klapeyron-Mendeleyev tenglamasiga almashtirildi. Agar bosim mm da berilgan bo'lsa simob, keyin uni nisbati asosida atmosferaga aylantirishingiz kerak: 1 atm= 760 mm Hg. Art. Paskallarda (Pa) berilgan bosim 101325 Pa = 1 ekanligiga asoslanib, atmosferaga ham aylantirilishi mumkin. atm.
16-chipta
Molekulyar kinetik nazariyaning asosiy tenglamasini chiqarish. Molekulaning erkinlik darajalari soni. Erkinlik darajalari bo'yicha energiya taqsimoti qonuni.
MKTning asosiy tenglamasini chiqarish.



Molekulaning erkinlik darajalari soni. Erkinlik darajalari bo'yicha energiya taqsimoti qonuni.


17-chipta.
Termodinamikaning birinchi qonuni. Gaz hajmi o'zgarganda ishlaydi. Gazning izotermik kengayish ishini hisoblang.
Issiqlik miqdori, tizim tomonidan qabul qilingan, o'zining ichki energiyasini o'zgartirish va tashqi kuchlarga qarshi ishni bajarish uchun ketadi
Tizimning bir holatdan ikkinchi holatga oʻtish jarayonida uning ichki energiyasining oʻzgarishi tashqi kuchlar ishi va tizimga oʻtkazilgan issiqlik miqdori yigʻindisiga teng, yaʼni u faqat boshlangʻich va oxirgi holatga bogʻliq. tizimning va bu o'tishning qanday amalga oshirilishiga bog'liq emas. Tsiklik jarayonda ichki energiya o'zgarmaydi.





Gazning izotermik kengayishi paytida ish jarayon grafigi ostidagi rasmning maydoni sifatida hisoblanadi.


18-chipta.
Ideal gazning issiqlik sig'imi.
Agar issiqlik almashinuvi natijasida tanaga ma'lum miqdorda issiqlik o'tkazilsa, u holda tananing ichki energiyasi va uning harorati o'zgaradi. 1 kg moddani 1 K ga qizdirish uchun zarur bo'lgan Q issiqlik miqdori moddaning solishtirma issiqlik sig'imi c deyiladi. c = Q / (mDT).
bu erda M - moddaning molyar massasi.
Shu tarzda aniqlangan issiqlik sig'imi moddaning aniq tavsifi emas. Termodinamikaning birinchi qonuniga ko'ra, tananing ichki energiyasining o'zgarishi nafaqat olingan issiqlik miqdoriga, balki tananing bajargan ishiga ham bog'liq. Issiqlik uzatish jarayoni amalga oshirilgan sharoitlarga qarab, tananing ishlashi mumkin edi turli ishlar. Shuning uchun jismga bir xil miqdordagi issiqlik uzatilishi uning ichki energiyasida va shunga mos ravishda haroratda turli xil o'zgarishlarga olib kelishi mumkin.
Issiqlik sig'imini aniqlashdagi bu noaniqlik faqat gazsimon moddalar uchun xosdir. Suyuqlik va qattiq jismlar qizdirilganda ularning hajmi deyarli o'zgarmaydi va kengayish ishi nolga teng bo'ladi. Shuning uchun, tana tomonidan qabul qilingan barcha issiqlik miqdori uning ichki energiyasini o'zgartirish uchun ketadi. Suyuqliklardan farqli o'laroq va qattiq moddalar, issiqlik uzatish jarayonida gaz uning hajmini sezilarli darajada o'zgartirishi va ishni bajarishi mumkin. Shuning uchun gazsimon moddaning issiqlik sig'imi termodinamik jarayonning tabiatiga bog'liq. Odatda gazlar issiqlik sig'imining ikkita qiymati hisobga olinadi: C V - izoxorik jarayondagi molyar issiqlik sig'imi (V = const) va C p - izobarik jarayondagi molyar issiqlik sig'imi (p = const).
Doimiy hajmdagi jarayonda gaz hech qanday ish qilmaydi: A = 0. 1 mol gaz uchun termodinamikaning birinchi qonunidan kelib chiqadi.
Bu yerda DV - 1 mol ideal gazning harorati DT ga o'zgarganda uning hajmining o'zgarishi. Bu quyidagilarni nazarda tutadi:
bu yerda R universal gaz doimiysi. p = const uchun
Shunday qilib, C p va C V molyar issiqlik sig'imlari o'rtasidagi munosabatni ifodalovchi munosabatlar quyidagi ko'rinishga ega (Mayer formulasi):
|
C p = C V + R. |
Doimiy bosimli jarayonda gazning molyar issiqlik sig'imi C p har doim doimiy hajmli jarayondagi molyar issiqlik sig'imi C V dan katta bo'ladi.
Doimiy bosim va doimiy hajmli jarayonlardagi issiqlik sig'imlarining nisbati termodinamikada muhim rol o'ynaydi. U yunoncha g harfi bilan belgilanadi.
19-chipta.
Karno sikli. Issiqlik va sovutish mashinalari. Karno siklining samaradorligi.
Termodinamikada Karno sikli yoki Karno jarayoni ikki adiabatik va ikkita izotermik jarayondan tashkil topgan qaytuvchi aylana jarayondir. Karno jarayonida termodinamik tizim bajaradi mexanik ish va issiqlikni doimiy, lekin har xil haroratga ega bo'lgan ikkita termal rezervuar bilan almashtiradi. Ko'proq tank yuqori harorat isitgich deb ataladi va past harorat bilan - muzlatgich.
Karno sikli frantsuz olimi va muhandisi Sadi Karno sharafiga nomlangan bo'lib, u buni birinchi bo'lib o'zining "On" inshosida tasvirlab bergan. harakatlantiruvchi kuch olov va bu kuchni rivojlantirishga qodir mashinalar haqida" 1824 yilda.
Qaytariladigan jarayonlar faqat cheksiz kichik tezlikda sodir bo'lishi mumkinligi sababli, Karno siklidagi issiqlik dvigatelining kuchi nolga teng. Haqiqiy issiqlik dvigatellarining kuchi nolga teng bo'lishi mumkin emas, shuning uchun haqiqiy jarayonlar ideal qaytariladigan Karno jarayoniga faqat katta yoki kamroq aniqlik darajasida yaqinlasha oladi. Karno siklida issiqlik dvigateli issiqlikni ish siklidagi maksimal va minimal haroratlari mos ravishda Karno siklidagi isitgich va sovutgichning haroratiga to‘g‘ri keladigan barcha issiqlik dvigatellarining maksimal rentabellikdagi ishiga aylantiradi.
Mayli issiqlik dvigateli Tn haroratli isitgich, Tx va haroratli muzlatgichdan iborat ishlaydigan suyuqlik.
Karno tsikli to'rtta qaytariladigan bosqichdan iborat bo'lib, ulardan ikkitasi doimiy haroratda (izotermik) va ikkitasi doimiy entropiyada (adiabatik) sodir bo'ladi. Shuning uchun Karno siklini koordinatalarda ifodalash qulay T (harorat) Va S (entropiya).
1. Izotermik kengayish(1-rasmda - A→B jarayoni). Jarayonning boshida ishchi suyuqlik Tn haroratiga, ya'ni isitgichning haroratiga ega. Keyin tanani izotermik (doimiy haroratda) o'tkazadigan isitgich bilan aloqa qiladi. issiqlik miqdori Q. Shu bilan birga ishchi suyuqlikning hajmi ortadi, u mexanik ishlarni bajaradi va uning entropiyasi ortadi.
2. Adiabatik kengayish(1-rasmda - jarayon B→C). Ishchi suyuqlik isitgichdan uziladi va atrof-muhit bilan issiqlik almashinuvisiz kengayishda davom etadi. Bunday holda, tana harorati sovutgich harorati Tx ga tushadi, tana mexanik ishlarni bajaradi va entropiya doimiy bo'lib qoladi.
3. Izotermik siqilish(1-rasmda - jarayon B→G). Tn haroratiga ega bo'lgan ishchi suyuqlik muzlatgich bilan aloqa qiladi va ta'sir ostida izotermik siqishni boshlaydi. tashqi kuch, sovutgichga issiqlik miqdorini berish Q. Ish tanada bajariladi, uning entropiyasi kamayadi.
4. Adiabatik siqilish(1-rasmda - jarayon G→A). Ishchi suyuqlik muzlatgichdan uziladi va tashqi kuch ta'sirida atrof-muhit bilan issiqlik almashinuvisiz siqiladi. Shu bilan birga, uning harorati isitgichning haroratiga ko'tariladi, tanada ish olib boriladi, uning entropiyasi doimiy bo'lib qoladi.
Teskari Karno sikli
IN sovutish moslamalari va issiqlik nasoslarining termodinamiği ko'rib chiqmoqdalar teskari Karno tsikli, quyidagi bosqichlardan iborat: ish tufayli adiabatik siqilish (1-rasmda - B→B jarayoni); issiqlikni ko'proq isitiladigan termal rezervuarga o'tkazish bilan izotermik siqilish (1-rasmda - jarayon B→A); adiabatik kengayish (1-rasmda - jarayon A→G); sovuqroq termal rezervuardan issiqlikni olib tashlash bilan izotermik kengayish (1-rasmda - jarayon G→V).


20-chipta.
Termodinamikaning ikkinchi qonuni. Entropiya. Termodinamikaning uchinchi qonuni.
Termodinamikaning ikkinchi qonuni- sodir bo'lishi mumkin bo'lgan jarayonlarning yo'nalishiga cheklovlar qo'yadigan jismoniy printsip termodinamik tizimlar.
Termodinamikaning ikkinchi qonuni deb atalmishni taqiqlaydi ikkinchi turdagi doimiy harakatlanuvchi mashinalar, buni ko'rsatmoqda samaradorlik birga teng bo'lishi mumkin emas, chunki dumaloq jarayon uchun muzlatgichning harorati mutlaq nolga teng bo'lishi mumkin emas (nol haroratga ega bo'lgan nuqtadan o'tadigan yopiq tsiklni qurish mumkin emas).
Termodinamikaning ikkinchi qonuni postulat, klassika doirasida isbotlab bo'lmaydi termodinamika. U eksperimental faktlarni umumlashtirish asosida yaratilgan va ko'plab eksperimental tasdiqlarni oldi.
PostulatKlauzius : "Diraviy jarayon mumkin emas, uning yagona natijasi issiqlikni kamroq isitiladigan jismdan ko'proq isitiladigan tanaga o'tkazishdir" (bu jarayon deyiladi Klauzius jarayoni).
PostulatTomson (Kelvin) : "Diraviy jarayon mumkin emas, uning yagona natijasi issiqlik rezervuarini sovutish orqali ish ishlab chiqarish bo'ladi"(bu jarayon deyiladi Tomson jarayoni).
Izolyatsiya qilingan tizimning entropiyasi kamayishi mumkin emas" (kamaymaydigan entropiya qonuni ).
Ushbu formula entropiya g'oyasiga asoslanadi davlat funktsiyalari tizimi, bu ham taxmin qilinishi kerak.
Maksimal entropiyaga ega bo'lgan holatda, makroskopik qaytarilmas jarayonlar (va Klauzius postulati tufayli issiqlik uzatish jarayoni har doim qaytarib bo'lmaydigan) mumkin emas.
Termodinamikaning uchinchi qonuni (Nernst teoremasi) - xulq-atvorni belgilaydigan jismoniy printsip entropiya yaqinlashganda harorat Kimga mutlaq nol. biri hisoblanadi postulatlar termodinamika, eksperimental ma'lumotlarning muhim miqdorini umumlashtirish asosida qabul qilingan.
Termodinamikaning uchinchi qonuni quyidagicha ifodalanishi mumkin:
"Entropiyaning ortishi mutlaq nol harorat tizimning muvozanat holatidan qat'iy nazar, cheklangan chegaraga intiladi..
Termodinamikaning uchinchi qonuni faqat muvozanat holatlariga taalluqlidir.
Chunki, termodinamikaning ikkinchi qonuniga asoslanib, entropiya faqat ixtiyoriy qo'shimcha konstantagacha aniqlanishi mumkin (ya'ni, entropiyaning o'zi emas, balki faqat uning o'zgarishi aniqlanadi). Entropiyani aniq aniqlash uchun termodinamikaning uchinchi qonunidan foydalanish mumkin. Bunda mutlaq nol haroratda muvozanat tizimining entropiyasi nolga teng deb hisoblanadi.
Termodinamikaning uchinchi qonuni entropiyaning mutlaq qiymatini topishga imkon beradi, buni klassik termodinamika doirasida amalga oshirish mumkin emas (termodinamikaning birinchi va ikkinchi qonunlari asosida).
Termodinamik entropiya S, ko'pincha oddiygina chaqiriladi entropiya, - jismoniy miqdor, tasvirlash uchun ishlatiladi termodinamik tizim, asosiylaridan biri termodinamik kattaliklar. Entropiya bu davlat funktsiyasi va keng qo'llaniladi termodinamika, shu jumladan kimyoviy.

