Benzol va ozon reaksiya tenglamasi. Kimyo fanidan maktab olimpiadalari. Benzolning fizik xossalari
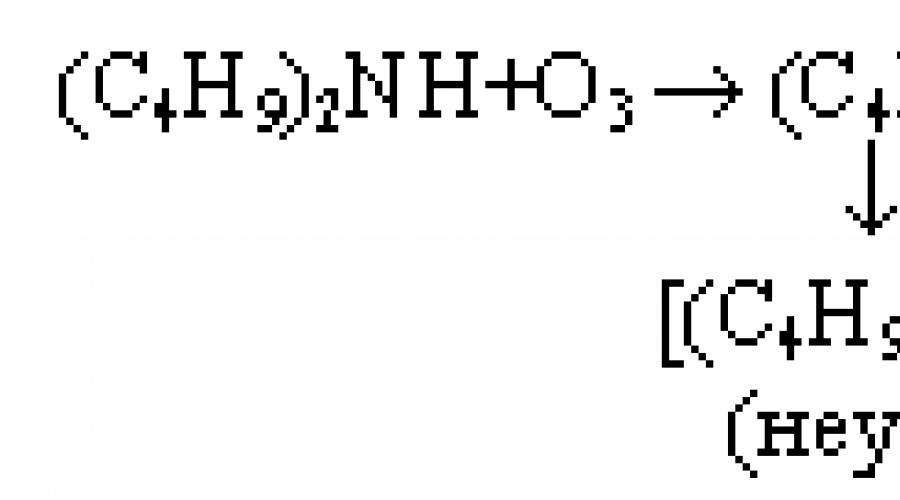
Shuningdek o'qing
Maktab o'quvchilari uchun Butunrossiya kimyo olimpiadasi - 2004 yil
"Tanlov bo'yicha vazifalar"
FIZIKK KIMYO
Vazifa 1.
"Bir yil oldin ular begunoh aytganidek -
Ha, o'tgan asr oldin."
(Baxit Kenjeev)
"1880 yil boshida Viktor Meyer juda yuqori haroratlarda galogenlarning bug' zichligi bo'yicha juda qiziqarli tajribalarni boshladi. Keyin tajribalar Crafts tomonidan takrorlandi. Ularning natijasi shundaki, muhim harorat diapazonlari uchun normal ko'rinadigan galogenlarning bug' zichligi, harorat ko'tarilganda kichikroq bo'ladi, turli galogenidlar uchun farq qiladi.
| Harorat | Zichlik xlorli bug ' | Zichlik brom jufti | Zichlik yod juftligi |
| 440 o dan past | 2,45 | 5,52 | 8,78 |
| 440 o | normal | normal | 8,72 |
| 900 o | normal | normal | 8,11 |
| 1200 o | normal | 4,5 | 6,07 |
| 1400 o - 1500 o | 2,02 | 3,5 | 5,31 |
Halojen bug'lari zichligining kuzatilgan pasayishi gazlarning ko'rsatilgan haroratlarda kengayish koeffitsientlarining sezilarli o'zgarishiga bog'liq emasligini hisobga olsak, taqdim etilgan ma'lumotlarni tushuntirish mumkin..."
(N.Menshutkinning "Kimyoviy qarashlarning rivojlanishi haqidagi esse", Sankt-Peterburg, 1888. 301-302-betlar).
1. Galogenlar uchun "bug 'zichligi" ning bunday sezilarli o'zgarishini qanday izohlash mumkin?
2. "Bug 'zichligi" ni aniqlashda xatolikni taxmin qiling (nisbiy %).
3. Belgilangan haroratlarda (mol fraktsiyalari) yod uchun "bug '" tarkibini hisoblang.
4. I - I (kJ/mol) bog'lanish energiyasini hisoblang.
5. Yodning erish va qaynash temperaturalarini (o C) aniqlang va 43,7 o S da yod ustidagi bug bosimi 1 mm Hg (133,32 Pa) bo lsa, yodning panjara energiyasini hisoblang; 10 mm Hg Art. 77,0 o da; 100 mm Hg 122,4 o; 400 mm Hg da 162,8 o.
Vazifa 2.
HX- eng kuchli organik kislotalardan birini quyidagi sxema bo'yicha olish mumkin:
Diagrammada ko'rsatilgan ulanishlar tarkibi haqida ma'lumot:
Modda |
|||||
So'nggi paytlarda erituvchilarda molekulyar ftordan foydalanishga qiziqish ortdi. Bunda F 2 ning oksidlanish faolligini probirkaga turli moddalar kiritish orqali nazorat qilish mumkin. Kislota HX o‘xshash birikmalarga ishora qiladi. Uning ishtirokidagi taxminiy jarayonlar:
Molekulyar ftor uchun Nernst tenglamasi quyidagi ko'rinishga ega:
Ishlatilgan erituvchilar (eritma): CH 3 CO 2 H, HCO 2 H, CF 3 CH 2 OH, CH 3 OH, CF 3 CO 2 H.
1. Chizmadagi noma’lum moddalarni aniqlang va reaksiya tenglamalarini yozing.
2. Ftor (C 1) va kislota (C 2) ning umumiy konsentratsiyasi doimiy (C 1) deb faraz qilsak.<0,5С 2):
a) E 0 ni E 0 (F 2 /F -) va K a (HF) shaklida ifodalang. (E 0 =E 0 (F 2 ,H + /HF), E=E(F 2 ,H + /HF) ni qo‘yaylik).
b) Agar pH (C 2, C 1, solv) ma'lum bo'lsa, E ni C 2 va C 1 funksiyasi sifatida ifodalang.
(Ruxsat etilgan taxminlar bizga K 1 -K 3siz bajarishga imkon beradi.)
3. Eritmaga (p2) qo‘shilgan (C 3): a) BF 3 (C 3).<0,5C 1);
б) NaX(C 3 <
5. Tegishli erituvchi ftorning eritmaga o'tishida doimiy potentsialni saqlab qoladi va F 2 bilan faqat maqsadli mahsulotdan osongina ajratiladigan birikmalar hosil qiladi. Ro'yxatdan mos erituvchini taklif qiling va asoslang.
6. F 2 ni laboratoriya sharoitida elektrolizga murojaat qilmasdan olishning bir usulini taklif qiling.
7.Nega tajriba davomida ftorning potensialini aniq aniqlash mumkin emas?
Vazifa 3.
Benzolning ozonlanishi
Ozonlanish reaksiyasi organik kimyoda turli toifadagi birikmalarni sintez qilish va toʻyinmagan birikmalarning tuzilishini aniqlash uchun qoʻllaniladi.
Benzolning ozonlanishi metilxloridda -80 o S da sodir bo'ladi. Bu reaksiyani kinetik sxema bilan tasvirlash mumkin:
1) A 1, A 2, A 3 ozonidlarning tuzilish formulalarini yozing. A 3 rux bilan qaytarilganda qanday modda hosil bo'ladi?
2) Ozonidlarni olishning yana bir usuli - bu turdagi digidroksi peroksidlarning suvsizlanishi.
fosforik angidrid. Ko'rsatilgan digidroperoksiddan mono-, di- va poliozonidlarni olish sxemalarini yozing.
Eng xilma-xil tuzilishdagi peroksid birikmalariga sifatli reaktsiyalardan biri ularning efir eritmalarining 60% sulfat kislotadagi titanil sulfat eritmasi bilan o'zaro ta'siridir.
3) Analitik signal nima va u nimadan kelib chiqadi?
Yuqoridagi kinetik sxemani ko'rib chiqing. Faraz qilaylik, ozon umumiy tenglamaga nisbatan bir oz ortiqcha olinadi.
4) a) bitta grafikda A 1, A 2, A 3 moddalar konsentratsiyasining vaqtga bog‘liqligini ko‘rsating. k 1
k 2 k 3 .
b) Bitta grafikda A 1 kontsentratsiyasining vaqtga bog'liqligini ikki holatda tasvirlang: 1) k 1 << k 2 ;
2) k 1 k 2. c) Ikki yaqinlikdan qaysi biri - (b1) yoki (b2) - to'g'riroq? Nega?
d) A 1 va A 2 oraliq moddalarning konsentrasiyalari statsionar bo‘lishi sharti bilan A 3 ning hosil bo‘lish tezligini ozon va benzol konsentrasiyalari bo‘yicha ifodalang. Reaksiyaning umumiy tartibi qanday?
Ozon-kislorod aralashmasini eritma orqali doimiy ravishda o'tkazish orqali eritmadagi ozon konsentratsiyasini doimiy ravishda ushlab turish mumkin. Keling, bu sharoitda reaktsiyaning kinetikasini ko'rib chiqaylik.
5) a) A 1 va A 2 konsentrasiyalari statsionar bo‘lishi sharti bilan A 3 ning hosil bo‘lish tezligini ozon va benzol konsentrasiyalari bo‘yicha ifodalang. Reaksiyaning umumiy tartibi qanday?
b) Benzolning dastlabki konsentratsiyasi ikki barobarga oshirilganda uning yarim aylanma vaqti necha marta o‘zgaradi?
v) (5a) dan kinetik tenglamani yeching va A 3 mahsulot konsentratsiyasining vaqtga bog'liqligini toping. Benzol va ozonning dastlabki kontsentratsiyasini 0 va 0 deb belgilang.
Vazifa 4.
Benzoil peroksid (BP) va dinitril 2,2"-dimetil-2,2"-azodipropanoik kislota (2,2"-azo-bis-izobutironitril, AIBN) radikal zanjirli jarayonlarning standart tashabbuskorlari bo'lib, ozgina bo'lsa ham gomolitik tarzda oson parchalanadi. haroratni oshirish, inert erituvchilarda parchalanish uchun aktivlanish energiyasi PB uchun 129 kJ/mol va AIBN uchun 130 kJ/mol, Arrhenius tenglamasida preeksponent (). k = A e - E a/ RT) A= PB uchun 10 14,5 s -1 va AIBN uchun 10 15,0 s -1. Emirilish 1-tartibda sodir bo'ladi.
Savol va topshiriqlar.
1. PB va AIBN formulalarini va ularning inert erituvchida parchalanish reaksiya tenglamalarini yozing. Qanday mahsulotlar hosil bo'lishi mumkin? Ularga nom bering.
2. Azo birikmalardagi C–N va N=N bog‘lari ancha kuchli (mos ravishda 295 va 420 kJ/mol). Nima uchun AIBN qizdirilganda osongina radikallar hosil qiladi?
3. Tajribalardan birida ko‘k rangli AIBN eritmasini parchalash vaqtida 1 minut ichida 0,5 ml gaz (xona harorati va 735 mm bosimda o‘lchanadi), reaksiya tugagandan so‘ng esa 1,250 l. bu gaz chiqarilgan, xuddi shu sharoitda o'lchangan. Eksperimental sharoitda AIBN yemirilish tezligi konstantasini hisoblang (uning vaqtini soniyalarda ko'rsating).
4. 25 o S haroratda AIBN ning eritmada 0,1% ga parchalanishi uchun zarur bo’lgan vaqtni hamda yarim yemirilish davrini hisoblang. Qaysi haroratda AIBN 5 soat ichida 50% ga parchalanadi?
5. AIBN parchalanishining issiqlik effektini baholang. Uning portlovchi parchalanishi mumkinmi va agar shunday bo'lsa, qanday sharoitlarda? Azot molekulasidagi uchlik bog'lanishning uzilish energiyasi 945 kJ/mol; C-C bog'lanish energiyasi 340 kJ/mol deb qabul qilinadi.
6. Tadqiqotlarning birida qaynayotgan benzolda PB ning dastlabki parchalanish tezligi o'lchandi. Agar olingan ma'lumotlarga ko'ra, biz 1-darajali reaksiya farazi ostida parchalanish tezligi konstantasini hisoblasak, shu tarzda hisoblangan konstanta PB ning boshlang'ich konsentratsiyasiga bog'liq ekani ma'lum bo'ladi:
Ushbu natijalarni tushuntirish uchun PB parchalanishining bimolekulyar reaktsiyasi parallel ravishda sodir bo'lishi mumkinligi taklif qilindi. Eksperimental ma'lumotlarga asoslanib, PB ning monomolekulyar parchalanish tezligining haqiqiy konstantasini hisoblang (grafik usuldan foydalanish tavsiya etiladi).
7. AIBN parchalanishi ksilenda 108 o C da 2,6-dimetil- ishtirokida olib borilganda. P-benzoxinon, olingan eritmaning elektron paramagnit rezonans (EPR) spektri barqaror erkin radikallar mavjudligini ko'rsatdi; Spektrdagi 0,573 mT (millitesla) bo'linishi bilan teng masofada joylashgan 7 ta chiziq radikalda 6 ta ekvivalent proton mavjudligini va har bir chiziqning uchtaga bo'linishi (ular orasidagi masofa 0,137 mT) ikkitadan mavjudligini ko'rsatdi. ekvivalent protonlar (T.L.Simandi va boshq., European Polymer Journal, 1989, jild 25, pp.501-507). Ushbu ma'lumotlardan foydalanib, hosil bo'lgan radikalning strukturasini chizing va uni ESR ma'lumotlari bilan tasdiqlang (spektrdagi bo'linish ma'lum atomdagi juftlanmagan elektronning zichligiga proportsionaldir). Hosil bo‘lgan radikallarning barqarorligini tushuntiring. Nima uchun mualliflar maqolani ko'rsatilgan jurnalda chop etishdi deb o'ylaysiz?
Eslatma. 1-darajali reaktsiya uchun konsentratsiyaning vaqtga bog'liqligi: Bilan
= Bilan o e –kt yoki ln( c o/ c)
= kt. Gaz doimiy R= 8,31 J/(mol K).
KIMYO VA HAYOT
Vazifa 1.
Galich ko'li (Kostroma viloyati, xaritaga qarang) tubi ancha loyqalangan, uzunligi 25 km, kengligi 5 km, o'rtacha chuqurligi 1,5 m, suv almashinuv kursi ~ yiliga bir marta. Ko'lga bir nechta daryolar quyiladi, ulardan eng ko'plari (agar bu ayanchli oqimlar haqida gapiradigan bo'lsak) Srednyaya va Chelsma. Ko'l daryosidan tushadi. Vyoksa. Galich shahri koʻlda joylashgan (20 ming aholi, avtokran zavodi, teri zavodi, novvoyxona, poyabzal va kiyim-kechak fabrikasi bor).
Suv namunalari to'rtta nuqtadan olingan (xaritaga qarang). Namunalar 2003 yil 3 avgustdan 8 avgustgacha olindi. Tahlil natijalari jadvalda keltirilgan.
| Nuqta | ||||
| Harorat | ||||
| pH | ||||
| Shaffoflik, sm | ||||
| Rang, grad | ||||
| Umumiy ishqoriylik, mm | ||||
| Erkin ishqoriylik, mm | ||||
| Qattiqlik (Ca 2+ + Mg 2+), mM | ||||
| Kaltsiy, mM | ||||
| Xloridlar, mM | ||||
| O 2, to'yinganlik% |
Eslatma: erkin ishqoriylik - pH>8,2 ni beradigan asoslar konsentratsiyasi, umumiy ishqoriylik - xlorid kislota bilan titrlash mumkin bo'lgan barcha asoslarning konsentratsiyasi. Umumiy va erkin ishqoriylik o'rtasidagi farq odatda bikarbonatlarga bog'liq.
Natijalar shuni ko'rsatadiki, birinchidan, ko'ldagi suvning pH darajasi g'ayritabiiy darajada yuqori, ikkinchidan, ko'lda tuzlarning konsentratsiyasi uni oziqlantiradigan daryolarga qaraganda taxminan 3 baravar kam. Ikkala fakt uchun ikkita tushuntirish taklif qilindi. Birinchisi: shahar aholisi kiyimlarini faol yuvishadi, bu esa natriy karbonat va fosfatning ko'lga kirib, suvni gidroksidi va kaltsiyni magniy bilan bog'lashiga olib keladi. Ikkinchidan: ko'nchilik zavodi tarkibida ohak bo'lgan oqava suvni ko'lga chiqaradi.
1. Birinchi va ikkinchi gipoteza bo'yicha ko'lni oziqlantiruvchi daryolarga nisbatan ko'lda kationlar va anionlar konsentratsiyasining pasayishiga olib keladigan reaksiya tenglamalarini keltiring. Tenglamalarni ion shaklida yozing.
2. Galich ko'lida tuz konsentratsiyasining kamayishi uni to'ydiradigan daryolar bilan solishtirganda mahalliy (faqat shahar ichida) yoki butun ko'lda? Javobingizni bir jumla bilan asoslang.
3.Qaysi faktlar pH ortishi haqidagi birinchi gipotezaga mos kelmaydi?
4.Qaysi faktlar pH ortishi haqidagi ikkinchi gipotezaga mos kelmaydi?
5.Tuz konsentratsiyasining kamayishi haqidagi ikkinchi gipotezaga qanday faktlar to'g'ri kelmaydi?
Ko'lda tuz konsentratsiyasining uni oziqlantiradigan daryolarga nisbatan kamayishi tabiiy sabablarga ko'ra sodir bo'lganligi haqidagi faraz ham mavjud.
6.Buning sababi nima bo'lishi mumkin? Tegishli reaksiya tenglamasini yozing.
7.Qanday qilib loy tahlili bu gipotezani tasdiqlash yoki rad etishi mumkin?
8. Bu moddalarning yiliga yotqizilgan qatlamining qalinligini hisoblang, agar faqat ular yotqizilgan deb hisoblasak va ularning zichligi taxminan 2000 g/dm3?
Malumot uchun: K a (H 2 O+CO 2) = 4,5? 10 -7 , K a (HCO 3 -) = 4,8? 10 -11, K a (H 2 PO 4 -) = 6,2? 10 -8, K a (HPO 4 2-) = 5,0? 10 -13, PR(CaCO 3) = 4? 10 -9, PR(MgCO 3) = 2? 10 -5, PR(Ca 3 (PO 4) 2) = 2? 10 -29.
Vazifa 2.
Hasharotlar, odatda, odamlar kabi, o'z ko'zlari yordamida atrofdagi dunyoda turmush o'rtog'ini qidirish uchun juda kichikdir. Shu maqsadda ular maxsus moddalar - jinsiy jalb qiluvchi moddalar yoki feromonlarni chiqaradilar. Ayol kapalak tomonidan chiqarilgan bir necha milligramm feromon o'nlab kilometr masofadan yuzlab erkaklarni jalb qilish uchun etarli. Bunda feromon strukturasidagi mayda oʻzgarishlar (qoʻsh C=C bogʻlanish holati yoki stereoizomerligi, xiral molekulaning boshqa stereoizomeridan foydalanish va boshqalar) butunlay boshqa turdagi hasharotlarning oʻziga tortilishiga olib kelishi mumkin. turlari yoki o'z turlarining individlarini quvib chiqarish uchun.
Ma'lumki, urg'ochi zaytun chivinlari Bacroceraoleae juftlash orqali erkaklarni jalb qilish A, va urg'ochi erkaklar - ulanish yordamida B. Bu birikmalarga suyultirilgan kislota eritmasi bilan ishlov berilsa, bir xil modda hosil bo'ladi IN, bu haqda quyidagilar ma'lum:
a) tarkibida 27,6% kislorod va 62,1% uglerod bor, fosforli pentabromid bilan ishlov berilganda 71,75% bromli D birikmasiga aylanadi;
b) katalitik miqdorlar ishtirokida qizdirilganda juft-toluensulfon kislotasi (TsOH) osonlik bilan birikmalar aralashmasiga aylanadi A Va B;
v) transformatsiyalar zanjiri natijasida:
birikmaga aylanishi mumkin Z, Grignard reaktivining bir ekvivalenti bilan reaksiyaga kirishganda ikkita spirt aralashmasi hosil bo'ladi.
Mumkin bo'lgan ulanish tuzilmalarini aniqlang A - Z va bu yerda berilgan reaksiyalar tenglamalarini yozing
Vazifa 3.
Immobilizatsiyalangan fermentlar
Fermentlar oqsil tabiatining biologik katalizatorlaridir. Turli xil biotexnologik jarayonlarda fermentlardan foydalanish uchun ko'pincha fermentni mos erimaydigan tashuvchiga mahkamlash (immobilizatsiya qilish) kerak (immobilizatsiya qilingan asl fermentni mahalliy ferment deb ataymiz).
A. Immobilizatsiyalangan fermentlarni tayyorlash.
Fermentlarni immobilizatsiya qilish uchun odatda fiziologik sharoitda yuqori reaktiv bo'lmagan amino, gidroksil yoki karboksil guruhlarini o'z ichiga olgan tashuvchilar ishlatiladi. Shuning uchun ferment va tashuvchi o'rtasida kovalent bog'lanish hosil bo'lganda, birinchi navbatda ikkinchisini faollashtirish kerak. Faollashtiruvchi reagentlarning bir turi suksinik kabi dialdegidlardir
OHC-(CH2)2-CHO.
1. Suksinik aldegid kislotali muhitda polivinil spirt bilan reaksiyaga kirishganda yuzaga keladigan reaksiyalarni yozing. Keyinchalik ommaviy axborot vositalarini ko'rsatish uchun quyidagi belgidan foydalaning:
2. Tashuvchi bilan kovalent bog‘langan fermentning unumini kamaytiradigan polivinil spirt bilan suksinli aldegid o‘rtasidagi yon reaksiya tenglamasini yozing.
3. Suksinik aldegid bilan faollashgan tashuvchi va ferment (pH = 8) orasidagi reaksiyani yozing. Diagrammada o'zaro ta'sir qiladigan fermentning funktsional guruhini ko'rsating. Fermentni ko'rsatish uchun belgidan foydalaning:
4. Qaysi aminokislotalar qoldiqlarining yon guruhlarida reaksiya boradi? Ushbu aminokislotalarning yon radikallarining arzimas nomlari va formulalarini keltiring.
5. 4-savolga javobda ko'rsatilganlardan tashqari yana qaysi ferment guruhi faollashgan tashuvchi bilan o'zaro ta'sir qilishi mumkin?
6. Ferment-tashuvchi bog'lanish hosil bo'lgan pH hududlarini ko'rsating:
a) barqaror
b) beqaror
Ferment-tashuvchi bog'ning barqarorligini oshirish uchun 1-savolda tasvirlangan reaktsiya natijasida hosil bo'lgan tizim natriy borgidrid bilan ishlanadi.
7. Ushbu reaksiyaning diagrammasini keltiring. Bu yerda V max = k 2 [E] 0 va K M = (k 2 + k -1)/ k 1
Immobilizatsiya k2 katalitik doimiysi va KM Michaelis doimiysi qiymatlariga ta'sir qilishi mumkin, bu fermentning ma'lum bir substrat bilan bog'lanish samaradorligini tavsiflaydi. Immobilizatsiyalangan fermentlar bilan kataliz ikki rejimda sodir bo'lishi mumkin:
kinetik, bunda kuzatilgan tezlik fermentning katalitik xususiyatlari bilan belgilanadi;
diffuziya, bunda kuzatiladigan reaksiya tezligi diffuziya bilan boshqariladi (ya'ni substratning fermentga ta'minlanish tezligi bilan aniqlanadi).
Immobilizatsiyalangan fermentga ega bo'lgan tizimni ko'rib chiqaylik, bunda rejimning o'zgarishi substrat konsentratsiyasida [S] 0 ga teng, masalan.
8. Grafikda ikki tomonlama teskari koordinatalar deb ataladigan (1/v dan 1/[S] 0) ushbu tizim uchun substrat konsentratsiyasi diapazonida [S] 0, ex / 2 dan 10 gacha bo'lgan bog'liqlik turini chizing. [S] 0, masalan. Abtsissada substrat konsentrasiyalariga [S] 0.ex /2, [S] 0.ex va 10[S] 0.ex mos keladigan nuqtalarni belgilang. Kinetik rejimga mos keladigan qaramlik "1" raqami bilan, diffuziya rejimi uchun esa "2" raqami bilan belgilanadi.
9. Kinetik rejim holatiga bog'liqlikni davom ettirib, abscissa va ordinata o'qida kesilgan segmentlarning uzunliklarini ikki tomonlama o'zaro koordinatalarda ko'rsating (8-savolga javobdan olingan grafik). Hisob-kitoblarni bering.
Polielektrolit tayanchlarida immobilizatsiya tizimdagi protonlarning tarqalishiga ta'sir qilishi mumkin, bu esa fermentning katalitik faolligining (va shunga mos ravishda reaktsiya tezligining) pH ga bog'liqligini o'zgartirishga olib keladi (bundan keyin bu bog'liqlikni pH profili deb ataymiz. ). Ba'zi mahalliy fermentlar uchun pH profili klassik qo'ng'iroq shaklidagi ko'rinishga ega bo'lsin (pastga qarang).
10. Koordinatalarda (pH ning v) nativ fermentga mos keladigan pH profillarini (har bir filialni 1 bilan belgilang), polianion tashuvchida immobilizatsiya qilingan bir xil fermentni (har bir shoxchani 2 bilan belgilang) va immobilizatsiya qilingan bir xil fermentni ko'rsating. polikatyonik tashuvchi (har bir filialni 3 raqami bilan belgilang). Immobilizatsiya hech qanday ta'sir ko'rsatmaydi deb taxmin qiling:
a) pH optimumida (qo'ng'iroqning eng yuqori nuqtasida) fermentativ reaktsiya tezligi bo'yicha;
b) pH profilining shakli bo'yicha.
(ORGANIK KIMYO)
Qo'shilish reaktsiyalari
Umuman, qoʻsh bogʻlanishdagi qoʻshilish reaksiyalarini quyidagicha ifodalash mumkin: Bu sxema boʻyicha uglerod-uglerod qoʻsh bogʻlanishlariga quyidagilar qoʻshilishi mumkin: vodorod (H2), galogenlar (Cl2, Br2, ClBr, SP), suv ( H20), vodorod galogenidlari (HC1, HBr, HI), sulfat kislota (H2S04), kislorod (02) va boshqalar. Katta...(ORGANIK KIMYO)
Harries ozonlanish reaktsiyasi
Ozon 03 er-xotin bog'lanish joyiga osongina qo'shilib, tsiklik peroksidlarni hosil qiladi - ozopidlar: Ozonidlar juda beqaror va osongina portlaydi. Odatda ular izolyatsiya qilinmaydi, lekin ishlab chiqarilgandan so'ng darhol suv bilan parchalanadi: Vodorod peroksid hosil bo'lgan aldegidlarni karboksilik kislotalarga oksidlaydi: Ozonlanish...(ORGANIK KIMYO)
Benzolning tuzilishi
Benzol va uning gomologlari bilan bog'liq barcha mavjud ma'lumotlarni taqqoslab, benzolning tuzilishini quyidagicha ko'rsatish mumkin. Benzoldagi barcha uglerod atomlari holatda sp2- gibridlanish. Ularning har biri uchta oddiy c-bog'larni (ikkita C-C va bitta burchakli C-H) hosil qiladi.(ORGANIK KIMYO)
Metan-uglevodorod aralashmalari va metan gomologlarining qisman gaz-fazali oksidlanishi
Haqiqiy tabiiy gazlar, shu jumladan kimyoviy jarayonlarda ishlatiladigan gazlar tarkibida turli xil uglevodorodlarning aralashmalari, asosan metan gomologlari mavjud. Kimyoviy bog'lanish kuchidagi katta farq tufayli metanning hatto eng yaqin gomologlari ham reaktivlik va boshqa bir qator narsalarda undan juda farq qiladi...Metan va uning gomologlarining sintez gaziga qisman oksidlanishining kinetik tahlili
So'nggi paytlarda metanni sintez gaziga oksidlovchi aylantirishning katalitik usullari bilan bir qatorda gaz fazali qisman oksidlanish bir qator sanoat jarayonlarida, ayniqsa vodorod ishlab chiqarish bo'yicha kichik ixcham zavodlarda qo'llanila boshlandi. Biroq, tez-tez ishlatiladigan termodinamik hisoblash usullari ...(ORGANIK KIMYO: METANNING OKSIDATIV TRANSFORMASIYALARI)
Ozonning turli aromatik birikmalar bilan reaksiya tezligi (-40) - (-20) ° S harorat oralig'idagi reaksiyalari bimolekulyar qonunga bo'ysunadi. Benzol uchun reaksiyaning aktivlanish energiyasi 50 kJ/mol ni tashkil qiladi va jarayonning tezligi muhitning qutbliligi ortishi yoki kislota katalizatorlari ishtirokida sezilarli darajada oshadi.
Ozonning aromatik uglevodorodlar bilan CCl4 da t = 20°C da reaksiyaga kirishishining ba'zi kinetik parametrlari va ozonning boshlang'ich konsentratsiyasi O3 = 10-4¸10-6 mol/l, mos ravishda stoxiometrik koeffitsient bo'yicha ma'lumotlarni taqdim qilaylik; tezlik konstantasi - k, l/mol×s; uchun: benzol - 3; 6 × 10-2; naftalin - 2; 2.4; fenantren - 1; 0,8×102; piren - 2; 0,8×102; polinaftalin - 1,6×103; antratsen - 3; 5×103 (birinchi bosqich) va 43 (ikkinchi bosqich). Birinchi ozon molekulasi qo'shilgandan so'ng, benzol va naftalin o'rtasidagi konjugatsiya buziladi va keyingi reaktsiyalar ancha oson kechadi. Turli birikmalarning ozon bilan reaksiya tezligi konstantalarini solishtirish shuni ko'rsatadiki, aromatik birikmalar olefinlarga qaraganda ancha sekinroq reaksiyaga kirishadi va reaksiya tezligi konstantalari ketma-ketlikda oshadi: benzol< нафталин < фенантрен < пирен < антрацен. Озониды бензола и нафталина - вступают в характерные реакции с HI, NaOH, NH2OH·HCl, подвергаются термическому разложению с образованием пары: альдегид + кислота, а также способны к образованию полимеров.
Oldin qo‘shilgan ozonning qo‘shni C=C bog‘lanish reaksiyalari yo‘nalishi bo‘yicha mumkin bo‘lgan induktiv ta’sirini baholashni naftalin metoksigidroperoksidlarining parchalanish mahsulotlari tarkibiga qarab ko‘rib chiqish mumkin: qizdirilganda oraliq mahsulotlar mos ravishda metil efirga aylanadi. ftalik kislota semialdegid va dimetil ftalat va oraliq mahsulotlar aralashmasi 80% gacha o'z ichiga oladi. Shunday qilib, oldingi reaktsiya aktida hosil bo'lgan ozonid tsiklining induktiv ta'siri birinchi ozon molekulasi biriktirilgan joydan eng uzoqda joylashgan uglerod atomida bipolyar ionning imtiyozli shakllanishida namoyon bo'ladi.
Ozonning aromatik halqaga ta'sir qilmasdan reaksiyalari oksidlanish jarayonlarida yoki erkin radikallar ta'sirida o'rnini bosuvchi moddalar aromatik halqaga qaraganda osonroq reaksiyaga kirishishi ma'lum printsipga asoslanadi. Masalan, CH3 o'rinbosarlari qatoridagi almashtirilgan benzollar uchun tezlik konstantalari< CH3-CH2 < (CH3)2 CH - растут симбатно с увеличением числа реакционноспособных атомов водорода в заместителе и уменьшением прочности C-H связи.
Alkil aromatik birikmalar ozon bilan ikki usulda reaksiyaga kirishishi mumkin: zanjir oksidlanish mexanizmi orqali gidroperoksidlar hosil bo‘lishi va ozonidlarning hosil bo‘lishi. Bundan tashqari, birinchi yo'nalish ustunlik qiladi, ikkinchisi emas. Radikal mexanizm bilan kechadigan reaktsiya peroksid radikallarining bir-biri bilan o'zaro ta'siridan kelib chiqqan alkilbenzollar orqali ozon o'tganda sodir bo'ladigan kuchli xemiluminesans bilan tasdiqlanadi.
Ozon antratsenga taʼsir qilganda asosiy reaksiya mahsuloti antraxinon boʻlib, uning miqdori 20÷80% gacha oʻzgarib turadi va antraxinon unumi erituvchining tabiatiga bogʻliq boʻlib, sirka kislotada ortib, CCl4 ga tushadi. Ikkinchi mahsulot (18÷67% rentabellik bilan) ftalik kislota - C6H5(COOH)2, 4,3-naftalindikarbon kislotasi - C12H10(COOH)2 ning chiqishi (6÷8)% ni tashkil qiladi. Ma'lumki, antrasen kislorod bilan oson oksidlanadi, yuqori hosilda antrakinon hosil qiladi. Polikarbonatlar va alkil aromatik uglevodorodlarning ozon bilan oksidlanishida bir xil turdagi jarayonlar kuzatiladi.
Shunday qilib, ozonning aromatik uglevodorodlar bilan reaksiyalarida aromatik yadroning C=C bog‘lariga ozon qo‘shilishining ikki turi topiladi: 1) ozon molekulasining uchta kislorodi ham saqlanib qoladi va ozonidlar hosil bo‘ladi, ular tarkibida ko‘p bo‘ladi. olefin ozonidlari bilan keng tarqalgan; 2) yangi birikma molekulasida uchtadan bitta atom saqlanib qoladi.
Ozonning aromatik uglevodorodlar bilan reaksiyasidan quyidagi sintezlarda foydalanish mumkin:
1) fenantrendan difen kislotasini olish:
2) ftalik dialdegid va ftalik kislota olish (AS 240700 SSSR, 1969, BI № 13), naftalin bilan mumkin bo'lgan beshta ozon molekulasidan dastlabki ikkita ozon molekulasini qo'shish orqali, shundan so'ng reaksiya juda sekinlashadi:
3) reaktsiya bo'yicha quyi gomolog - benzol asosida glikoksalat kislotasini (AS 235759 SSSR, 1969, BI No 6) olish:
1.6. Ozonning aminlar, oltingugurt va organoelement birikmalari bilan reaksiyalari,
shuningdek polimerlar
Ozon aminlar, masalan, uchinchi darajali aminlar bilan reaksiyaga kirishganda, amin oksidlari yuqori rentabellikda hosil bo'ladi (patent 437566 Angliya, 1935), shuningdek nitroksil radikallari va boshqa birikmalar (ular O3 dan kauchukni yo'q qilishning modifikatorlari va ingibitorlari sifatida ishlatiladi). ). O3 ning uchinchi, ikkilamchi va birlamchi aminlar bilan o'zaro ta'sirining reaktsiya sxemalari murakkab va ko'plab parallel va ketma-ket reaktsiyalarni o'z ichiga oladi. Masalan, ozonning xloroformdagi tributilamin bilan reaksiyasi natijasida 40 dan ortiq oraliq va yakuniy reaksiya mahsuloti ajralib chiqdi. Ozonning aminlar bilan reaksiya kinetikasi bimolekulyar qonunga bo'ysunadi va erituvchining tabiatiga bog'liq.
I. O3 ning uchinchi darajali aminlar bilan oʻzaro taʼsiri quyidagi sxema bilan ifodalanadi.
1) R3N: + O=O+-O–→ R3N+-O-O-O– (O3 ning aldegidlar, toʻyingan uglevodorodlar bilan koʻp bogʻlangan reaksiyasiga oʻxshash mahsulot hosil qilish uchun aminga qoʻshiladi);
2) R3N+-O-OO–→ R3N → O + O2; (amin oksidlarining hosil bo'lishi);
3) R2N-(O-O-O-)-C(H2)-RI®R2N=CH-(HO-O-O-)-R®R2N-CHOHRI + O2 (yoki R2N-CH(-O-O-OH)-RI) (keladi) o'rnini bosuvchi moddalarning oksidlanishi).
Amin oksidlarining chiqishi xlorli uglevodorodlar va spirtlar (CCl4, xloroform, metilenxlorid) ko'rinishidagi erituvchilarda maksimal bo'ladi. Shuningdek, reaksiya haroratini pasaytirish (<25 ºС) благоприятно сказывается на выходе оксидов аминов. Использование n-пентана уменьшает выход почти в 10 раз. Например, при озонировании трибутиламина в метаноле образуются (в %): (C4H9)3N → 0÷53; C4H9N=CH-C3H7 → 2; C4H9NCH=0 → 3; C4H9NCH=CHC2H5 → 11; (C4H9)2NH → 9; C4H9NCOC3H7 → 6.
II. O3 ning ikkilamchi aminlar bilan reaktsiyasi aminning tuzilishiga qarab, asosiy reaktsiya mahsuloti bo'lishi yoki sezilarli miqdorda bo'lishi mumkin bo'lgan nitroksid radikallarining hosil bo'lishiga olib keladi. Aromatik aminlar va n-fenilendiamin hosilalari nitroksil radikallarini ayniqsa oson hosil qiladi. Masalan, ozonning triasetonamin, ya'ni hosil bo'lgan nitroksil radikali (2,2,6,6-tetrometil-4-oksopiperidoksil) bilan reaksiyasi juda barqaror va xona haroratida sezilarli o'zgarishlarsiz bir necha oy davom etadi. Ko'pgina aromatik aminlar antiozonantlar bo'lib, kauchuk mahsulotlarini ozonning qarishidan himoya qilish uchun ishlatiladi.
Ozonning ikkilamchi aminlar bilan reaktsiyasini quyidagi sxema bo'yicha ko'rsatish mumkin (O3 ning pentandagi di-tert-butilaminga ta'siri, t = -120 ºS):

III. Ozonning birlamchi aminlar bilan o'zaro ta'sirining asosiy mahsulotlari nitro birikmalari va ammoniy asoslaridir. Ularning nisbiy tarkibi asosan erituvchining tabiatiga bog'liq. Uglevodorodlardan xlor o'z ichiga olgan erituvchilarga o'tganda nitrobirikmalarning unumi kamayadi, ammo ammoniy tuzlarining unumi ortadi, ya'ni erituvchi molekulasi reaksiyaga kirishadi.
O3 ning birlamchi amin bilan o'zaro ta'sir qilish sxemasi odatda tenglama bilan ifodalanishi mumkin:
C4H9NH2 + O3 → C4H9NO2 + O2.
Yakuniy nitro birikmasini hosil qilish uchun 3 ta ozon molekulasini iste'mol qilish kerak. Taqqoslash uchun, suvli eritmalarda ozonning ammiak bilan reaksiya tezligi konstantasi (k = 39 l/mol) aminlarnikidan sezilarli darajada past (masalan, anilin uchun - t = 20 ºC da k = 2,5 103).
Tributiltiokarbamid va uning analoglarining ozon bilan reaktsiyasining asosiy bosqichlari soddalashtirilgan diagramma bilan ifodalanishi mumkin:
Nitroksil radikallari eng oson reaksiyaga kirishadi. 1 mol ozonni singdirib, ular asosan nitro birikmalarga aylanadi.
Ozon oltingugurt birikmalari, masalan, sulfidlar (R-(–S–)n-R), tiokarbamidlar va tiosemikarbazidlar (R-(R)-C=S) bilan reaksiyaga kirishganda, reaksiyalar asosan oltingugurt atomida sodir boʻladi. Disulfidlar va polisulfidlar bilan reaksiyani amalga oshirish uchun uglerod tetraxloriddagi eritma ishlatiladi. Bunday holda, dastlabki sulfidlar ozon bilan juda oson reaksiyaga kirishadi, tezlik konstantasi k = 103 l/mol s, fenollarga yaqin va alkil o'rnini bosuvchi moddalarda -CH2- guruhining oksidlanish tezligidan sezilarli darajada yuqori. Reaksiyaning birinchi bosqichining asosiy mahsuloti sulfoksiddir (=S=O), keyinchalik u sulfongacha oksidlanishi mumkin (=S(=O)2), lekin ancha past tezlikda (50÷100 marta). Dimetil sulfid (CH3-S-CH3) misolida ozonning sulfidlar bilan o'zaro ta'sir qilish tezligi konstantalari - 1,5 103 l / mol s, oltingugurt (S8) - 5,5 va etil spirti (CH3CH2OH) - 10. Bundan tashqari. , qatordagi organik oltingugurt birikmalarining reaktivligining pasayishi kuzatiladi: R-S-R, R-(S)2-RS8.
Ozon shuningdek organoelement birikmalari bilan o'zaro ta'sir qiladi, masalan, kremniy:
(C2H5)3Si-CH2-CH3+O3 ® (C2H5)3Si-CH-(OO·)-CH3 + OH·®(C2H5)3SiOOH + O=CH-CH3
yoki ikkinchi reaksiyaga ko'ra: ® (C2H5)3Si-(-O-O-O)-CH2 ® (C2H5)3SiO2 + OOCH2CH3.
Ozon polimer materiallarga ta'sir qilganda, makromolekulaning asosiy zanjirida C=C bog'larini o'z ichiga olgan elastomerlarga (masalan, kauchuklar) ayniqsa kuchli ta'sir ko'rsatiladi. O3 toʻyingan uglevodorod zanjiri boʻlgan polimerlarga, ayniqsa ularning eritmalariga (t=20 ºC da CCl4 da) taʼsir qilganda molekulyar ogʻirlikning pasayishi va kislorod oʻz ichiga olgan funksional guruhlarning (kislotalar, ketonlar va peroksidlar) toʻplanishi kuzatiladi. Asosiy zanjirdagi fenil halqalarni o'z ichiga olgan polimerlar ozon bilan eng sekin reaksiyaga kirishadi, polisiklik (polinaftilenlar, poliatrasenlar) yoki geteroatomli polimerlar (polikarbonat) esa ancha oson reaksiyaga kirishadi. Toʻyingan uglevodorod zanjiriga ega boʻlgan polimerlar qatorida reaksiya tezligi poliizobutilendan poliviniltsiklogeksangacha oshadi, shu bilan birga zanjir uzilishlar sonining kamayishi kuzatiladi. Polibutadien va poliizopren eng katta tezlik konstantasiga ega va ular reaksiya hodisasi uchun eng kichik yorilish soniga ega. Ayrim polimerlar oddiy erituvchilarda (masalan, polietilen) erimaydi. Ozonlanish polistirolni termik-oksidlovchi destruktsiya sxemasidan farq qiladi, chunki past haroratlar va radikallar hosil bo'lishining yuqori sur'atlari zanjirli jarayonlarning ulushi reaktsiya balansida 15-20% ni tashkil etadigan sharoitlarni yaratadi va mahsulotlarning asosiy qismi. peroksi radikallarining parchalanishi paytida hosil bo'ladi. Kislotalar reaksiya mahsulotlarining kichik qismini tashkil qiladi va fenoksi radikallari yoki ularning o'zgarishi mahsulotlarining oksidlanishi natijasida ham, aromatik ozonidlarning yo'q qilinishi natijasida ham hosil bo'lishi mumkin. Ozonning boshqa polimerlarga (polietilen, poliviniltsiklogeksan) ta'siri peroksid radikallarining hosil bo'lishi bilan birga keladi. O3 (masalan, kauchuklar) ta'sirida to'yinmagan polimerlarning yo'q qilinishi monomerlar kabi, ya'ni C=C bog'lari bo'ylab sodir bo'ladi.
UDC 541.13: 669.871.4
D.S. Gurov, A.V. Darovskix, A.G. Mikov, V.I. Skudaev
Perm milliy tadqiqot politexnika universiteti
BENZOL OZONLASHTIRISH MAHSULOTLARINING IQ SPEKTRIMI
Benzolni ozonlash jarayoni IQ spektroskopiya yordamida o'rganildi. Ozonlash mahsulotlarida C-H va C=0 bog'lanishlari bo'ylab tebranishlar bilan bog'liq bo'lgan yangi yutilish zonalarining paydo bo'lishi aniqlandi. Erimaydigan benzol ozonidlarining hosil bo'lishi kuzatildi. Jarayonning mumkin bo'lgan yo'nalishlari haqida taxminlar qilingan.
Aromatik uglevodorodlar, ulardan biri benzol, turli materiallar, plastmassalar, bo'yoqlar, dori-darmonlar, o'simliklarni himoya qilish vositalari, portlovchi moddalar, farmatsevtika va boshqalar ishlab chiqarish uchun xom ashyo bo'lib xizmat qiladi.Shu bilan birga, benzol va uning hosilalari. ushbu materiallarni ishlab chiqaruvchi korxonalar chiqindilarida zararli komponentlar sifatida mavjud. Benzolning ozon bilan reaksiyasi ozonlash mahsulotlarini olish uchun ham, chiqindilarni yo'q qilish uchun ham qiziqish uyg'otadi.
Ma'lumki, ozon HMnO4, H2O2, OsO4 va boshqalar kabi oksidlovchi moddalarning ta'siriga chidamli. Ozon bilan o'zaro ta'sirlashganda ozonidlar hosil bo'ladi, ular sink katalizatorida suv ishtirokida glyoksalga parchalanadi. Suyuq fazada uglevodorodlarning oksidlanish jarayoni dastlabki bosqichda gidroperoksidlar hosil bo'lishi bilan zanjir mexanizmi bo'yicha davom etadi. Ozonlanishning benzol tarkibi taxminan 30% bo'lgan xom ko'mir benzolining tarkibiy tarkibining o'zgarishiga ta'sirini o'rganish bo'yicha ish nashr etildi, ammo undan benzolning o'zi bilan nima sodir bo'lishi aniq emas.
Benzolni ozonlash pufakchali reaktorda amalga oshirildi. 20 mm diametrli shisha reaktorga 30 ml benzol quyilib, kislorod o'tkazadigan ozonizatorda ozon olindi. Ozon-kislorod aralashmasining hajmli oqim tezligi 1,5% (0,61 mol / m) ozon konsentratsiyasida 100 ml / min edi. Jarayon 25 ° C haroratda amalga oshirildi, mahsulot namunalari shprits yordamida olindi va 100 ml eritma uchun 5 ml namuna nisbatida uglerod tetrakloridida eritildi.
tanasi Namuna eritmasi doimiy suyuqlik qatlami qalinligi 0,171 mm bo'lgan KBg oynalari bo'lgan suyuq kyuvetaga joylashtirildi va IQ spektri qayd etildi.
Jarayon oxirida eritma yuzasida va reaktor devorlarida och sariq rangli cho'kma topildi, bu ko'rinishidan benzol ozonidlari aralashmasi edi.
Rasmda ozonlashdan oldingi benzol spektrlari va ozonlash mahsulotlari namunalari ko'rsatilgan.
To'lqin soni, sm-1
Guruch. Benzol eritmasi va uning tetrakloriddagi ozonlanish mahsulotlarining IQ spektrlari. Ozonlanish vaqti, h: 1 - 0; 2 - 2
1550 sm-1 dan yuqori mintaqadagi uglerod tetraklorid IR nurlanishini o'zlashtirmaydi. Benzol mintaqada 3000 dan 3050 sm-1 gacha yutadi. Ozonlanish jarayonida mahsulotlarning spektrlarida 2900 sm-1 to'lqinli tasma paydo bo'ladi, bu diapazonning 3000 sm-1 benzol bandiga nisbatan nisbiy intensivligi vaqt o'tishi bilan ortadi: 0,5 soatdan keyin - 0,05, 1 soatdan keyin; - 0,09 , 1,5 soatdan keyin - 0,12, 2 soatdan keyin -
0,15, 2,5 soatdan keyin - 0,16. Adabiyotlarga ko'ra, bu bandni halqa bilan bog'lanmagan guruhdagi benzolning oksidlanish mahsulotlarida CH yoki O-H bog'idagi tebranishlar bilan bog'lash mumkin. Ikkinchi
Sezilarli darajada ortib borayotgan intensivlik va to'lqin soni 1700 sm-1 bo'lgan yana bir yangi chiziq karbonil yoki karboksil guruhidagi C=0 qo'sh bog'lanishdagi tebranishlar bilan bog'liq bo'lishi mumkin. Demak, benzolni ozonlash maxsulotlarida karboksilik kislotalar, angidridlar, aldegidlar va ketonlar aralashmasi bo'lishini kutish mumkin.
Benzolning 25 ° C da ozon bilan, shuningdek U205 katalizatorida 400 ° C da kislorod bilan o'zaro ta'sir qilish jarayonining asosiy sxemasi sifatida malein kislotasi va uning angidrid aralashmasi hosil bo'lishi mumkin:
Tadqiqot shuni ko'rsatdiki, ko'plab oksidlovchi moddalarga chidamli bo'lgan benzol halqasi oddiy haroratda ozon tomonidan yo'q qilinadi.
Adabiyotlar ro'yxati
1. Berezin D.B., Berezin B.D., Zamonaviy organik kimyo kursi. - M.: Oliy maktab, 2001. - 768 b.
2. Razumovskiy S.D., Zaikov G.E. Ozon va uning organik birikmalar bilan reaksiyalari. - M.: Nauka, 1974. - 322 b.
3. Emanuel N.M., Denisov E.T., Mayzus Z.K. Suyuq fazada uglevodorod oksidlanishining zanjirli reaksiyalari. - M.: Nauka, 1965. - 280 b.
4. Semenova S.A., Patrakov Yu.F. Ozonlanishning xom ko'mir benzolining tarkibiy tarkibining o'zgarishiga ta'siri // Zhurn. adj. kimyo. - 2007. - T. 80, nashr. 5. - 871-875-betlar.
5. Ioffe B.V., Kostikov R.R., Razin V.V. Organik birikmalarning tuzilishini aniqlashning fizik usullari: darslik. Kimyo uchun qo'llanma. universitetlar / ed. B.V. Ioffe. - M.: Oliy maktab, 1984. - 336 b.
Benzol halqasi ishtirokida aromatik birikmalar kiradigan turli reaktsiyalar orasida, birinchi navbatda, yuqorida muhokama qilingan almashtirish reaktsiyalari e'tiborni tortadi. Bu ular kutganlarga zid bo'lganligi sababli sodir bo'ladi. Masalan, benzolga xos bo'lgan to'yinmaganlik darajasi bilan qo'shilish reaktsiyalari ushbu uglevodorodga ko'proq xos bo'lishi kerak edi. Muayyan sharoitlarda bu sodir bo'ladi benzol va boshqa arenlar vodorod atomlari, galogenlar, ozon va qo'shilishi mumkin bo'lgan boshqa reagentlar;
11.5.5. Gidrogenatsiya. Gidrogenlash katalizatorlari (platina, palladiy, nikel) ishtirokida benzol va uning gomologlari vodorod qo'shib, tegishli siklogeksanlarga aylanadi. Shunday qilib, benzol nikel katalizatorida 100-200 0 C va 105 atm haroratda vodorodlanadi:
Arenlarning gidrogenlanishi alkenlarga nisbatan ikkita xususiyatga ega. Birinchidan, arenlar reaktivlik jihatidan alkenlardan sezilarli darajada past. Benzolni gidrogenlash shartlari bilan taqqoslash uchun siklogeksen allaqachon 25 0 C va 1,4 atm bosimda siklogeksanga gidrogenlanganligini ta'kidlaymiz. Ikkinchidan, benzol yoki qo'shilmaydi, yoki bir vaqtning o'zida uchta vodorod molekulasini biriktiradi. Benzolni gidrogenlash orqali siklogeksen yoki siklogeksadien kabi qisman gidrogenlash mahsulotlarini olish mumkin emas.
Gidrogenlash jarayonida bu xususiyatlar, benzol halqasiga qo'shilish reaktsiyalarining alohida holati, benzolning tuzilishi bilan bog'liq. Siklogeksanga aylantirilganda benzol aromatik tizim bo'lishni to'xtatadi. Siklogeksan 150,73 kJ ko'proq energiya (rezonans energiyasi) o'z ichiga oladi va benzolga qaraganda kamroq barqarordir. Benzol termodinamik jihatdan kamroq barqaror holatga o'tishga moyil emasligi aniq. Bu alkenlarga nisbatan benzolning vodorodga nisbatan past reaktivligini tushuntiradi. Aromatik tizimga ulanish faqat ishtirok etish bilan mumkin R-benzol halqasining yagona elektron bulutining elektronlari. Qo'shish jarayoni boshlangandan so'ng, tizim aromatik bo'lishni to'xtatadi va natijada energiyaga boy va yuqori reaktiv zarracha paydo bo'ladi, u ota-arenaga qaraganda qo'shilishga ko'proq tayyor.
11.5.6. Galogenlash. Galogenning benzol bilan o'zaro ta'sirining natijasi tajriba sharoitlariga bog'liq. Katalitik galogenlanish o'rnini bosuvchi mahsulotlar hosil bo'lishiga olib keladi. Ma'lum bo'lishicha, ultrabinafsha nurlanish arenlarning benzol halqasiga galogen atomlarini qo'shishni boshlaydi. Benzolning o'zi yorug'likda 6 ta xlor atomini qo'shib, 9 fazoviy izomerning aralashmasi bo'lgan geksaxlorotsiklogeksanga aylanadi.
Bu izomerlardan biri, ularda 3 ta xlor eksenel, yana 3 tasi ekvatorial bog'lanish (g-izomer, geksaxloran) samarali insektitsid, zararli hasharotlarga qarshi kurashuvchi vosita bo'lib chiqdi. Geksaxloran biosferada juda barqaror bo'lib chiqdi va issiq qonli hayvonlarning yog 'to'qimalarida to'planishga qodir va shuning uchun hozirda ishlatilmaydi.
Qo'shimcha reaktsiyalarda galogenlarga nisbatan reaktivligi jihatidan benzol alkenlardan sezilarli darajada past. Masalan, uglerod tetraxloriddagi xlor va brom, hatto xona haroratida qorong'uda, siklogeksenga qo'shiladi. Bunday sharoitda benzol reaksiyaga kirishmaydi. Bu faqat ultrabinafsha nurlar ostida sodir bo'ladi.
11.5.7. Ozonlash. Ozonlanish, benzol to'yinmagan birikma sifatida qo'shilish reaktsiyasiga kirishi mumkinligini ko'rsatadigan yana bir misol. Benzolni ozonlash va triozonid gidroliz mahsulotlarini o'rganish 1904 yilda amalga oshirilgan ( Harries)
Ozonlash bilan qiziqarli natijalarga erishildi O-ksilen (1941, Vibo). Gap shundaki, ozonlanish mahsulotlarining tarkibi benzol halqasidagi qo‘sh bog‘lanish holatiga bog‘liq. Benzol halqasining uglerodlari o'rtasida qo'sh bog'lanishga ega bo'lgan 1-struktura metil o'rnini bosuvchi ozonidning ozonlanishi va gidrolizlanishi natijasida 2 molekula metilglioksal va bir molekula glyoksal beradi.
Alternativ tuzilma II Uchun O-ksilol 2 molekula glyoksal va bir molekula diatsetil hosil qiladi.