Davriy jadvalda 14. Kimyoviy elementlarning davriy jadvali
Shuningdek o'qing
Xususiyatlari kimyoviy elementlar ularni tegishli guruhlarga birlashtirishga imkon beradi. Bu printsip asosida yaratilgan davriy jadval, bu mavjud moddalar haqidagi g'oyani o'zgartirdi va bizga yangi, ilgari noma'lum elementlarning mavjudligini taxmin qilish imkonini berdi.
Bilan aloqada
Mendeleyev davriy sistemasi
Kimyoviy elementlarning davriy jadvali 19-asrning ikkinchi yarmida D.I.Mendeleyev tomonidan tuzilgan. Bu nima va u nima uchun? U barcha kimyoviy elementlarni atom massasini oshirish tartibida birlashtiradi va ularning barchasi xossalari davriy ravishda o'zgarib turadigan tarzda joylashtirilgan.
Mendeleyev davriy sistemasini birlashtirdi yagona tizim ilgari oddiygina alohida moddalar deb hisoblangan barcha mavjud elementlar.
Uni o'rganish asosida yangilari bashorat qilingan va keyinchalik sintez qilingan. kimyoviy moddalar. Ushbu kashfiyotning fan uchun ahamiyatini ortiqcha baholab bo'lmaydi, u o'z vaqtidan sezilarli darajada oldinda edi va ko'p o'n yillar davomida kimyoning rivojlanishiga turtki berdi.
An'anaviy ravishda "qisqa", "uzun" va "qo'shimcha uzun" deb ataladigan uchta eng keng tarqalgan stol varianti mavjud. ». Asosiy stol uzun stol deb hisoblanadi, u rasman tasdiqlangan. Ularning orasidagi farq elementlarning joylashishi va davrlarning uzunligi.
Davr nima
Tizim 7 ta davrni o'z ichiga oladi. Ular grafik jihatdan gorizontal chiziqlar sifatida taqdim etiladi. Bunday holda, nuqta bir yoki ikkita qatorga ega bo'lishi mumkin, ular qatorlar deb ataladi. Har bir keyingi element yadro zaryadini (elektronlar sonini) bittaga oshirish bilan avvalgisidan farq qiladi.
Oddiy qilib aytganda, davr davriy jadvalning gorizontal qatoridir. Ularning har biri metalldan boshlanadi va u bilan tugaydi inert gaz. Aslida, bu davriylikni yaratadi - elementlarning xususiyatlari bir davrda o'zgaradi, keyingi davrda yana takrorlanadi. Birinchi, ikkinchi va uchinchi davrlar to'liq emas, ular kichik deb ataladi va mos ravishda 2, 8 va 8 elementni o'z ichiga oladi. Qolganlari to'liq, ularning har birida 18 ta element mavjud.
Guruh nima
Guruh - bu vertikal ustun, bir xil elektron tuzilishga ega yoki oddiyroq aytganda, bir xil yuqori qiymatga ega elementlarni o'z ichiga oladi. Rasmiy tasdiqlangan uzun jadval 18 ta guruhni o'z ichiga oladi, ular gidroksidi metallar bilan boshlanadi va asil gazlar bilan tugaydi.
Har bir guruhning o'z nomi bor, bu elementlarni qidirish yoki tasniflashni osonlashtiradi. Kuchlanish metall xossalari yuqoridan pastga yo'nalishdagi elementdan qat'iy nazar. Bu atom orbitalari sonining ko'payishi bilan bog'liq - ular qancha ko'p bo'lsa, elektron bog'lanishlar shunchalik zaiflashadi, bu esa kristall panjarani yanada aniqroq qiladi.
Davriy jadvaldagi metallar
 Jadvaldagi metallar Mendeleevning soni ustunlik qiladi, ularning ro'yxati juda keng. Ular xarakterlanadi umumiy xususiyatlar, xususiyatlariga ko'ra ular heterojen bo'lib, guruhlarga bo'linadi. Ulardan ba'zilari fizik ma'noda metallar bilan juda kam o'xshashliklarga ega, boshqalari esa faqat bir soniya ichida mavjud bo'lishi mumkin va tabiatda mutlaqo topilmaydi (hech bo'lmaganda sayyorada), chunki ular yaratilgan, aniqrog'i hisoblangan va laboratoriya sharoitida, sun'iy ravishda tasdiqlangan. Har bir guruh o'ziga xos xususiyatlarga ega, nomi boshqalardan sezilarli darajada farq qiladi. Bu farq ayniqsa birinchi guruhda yaqqol namoyon bo'ladi.
Jadvaldagi metallar Mendeleevning soni ustunlik qiladi, ularning ro'yxati juda keng. Ular xarakterlanadi umumiy xususiyatlar, xususiyatlariga ko'ra ular heterojen bo'lib, guruhlarga bo'linadi. Ulardan ba'zilari fizik ma'noda metallar bilan juda kam o'xshashliklarga ega, boshqalari esa faqat bir soniya ichida mavjud bo'lishi mumkin va tabiatda mutlaqo topilmaydi (hech bo'lmaganda sayyorada), chunki ular yaratilgan, aniqrog'i hisoblangan va laboratoriya sharoitida, sun'iy ravishda tasdiqlangan. Har bir guruh o'ziga xos xususiyatlarga ega, nomi boshqalardan sezilarli darajada farq qiladi. Bu farq ayniqsa birinchi guruhda yaqqol namoyon bo'ladi.
Metalllarning joylashishi
Metalllarning davriy jadvaldagi o'rni qanday? Elementlar o'sish tartibida joylashtirilgan atom massasi yoki elektronlar va protonlar soni. Ularning xossalari vaqti-vaqti bilan o'zgarib turadi, shuning uchun jadvalda birma-bir asosda toza joylashtirish yo'q. Metalllarni qanday aniqlash mumkin va buni davriy jadval yordamida qilish mumkinmi? Savolni soddalashtirish uchun maxsus texnika ixtiro qilindi: shartli ravishda elementlarning birlashmasida Bordan Poloniusga (yoki Astatusga) diagonal chiziq chiziladi. Chapdagilar metallar, o'ngdagilari esa metall bo'lmaganlar. Bu juda oddiy va ajoyib bo'lardi, ammo istisnolar mavjud - Germanium va Antimon.
 Ushbu "metodologiya" o'ziga xos hiyla-nayrangdir, u faqat yodlash jarayonini soddalashtirish uchun ixtiro qilingan. Aniqroq ifodalash uchun buni esga olish kerak metall bo'lmaganlar ro'yxati faqat 22 ta elementdan iborat, Shuning uchun, savolga javob berib, davriy jadvalda nechta metal bor?
Ushbu "metodologiya" o'ziga xos hiyla-nayrangdir, u faqat yodlash jarayonini soddalashtirish uchun ixtiro qilingan. Aniqroq ifodalash uchun buni esga olish kerak metall bo'lmaganlar ro'yxati faqat 22 ta elementdan iborat, Shuning uchun, savolga javob berib, davriy jadvalda nechta metal bor?
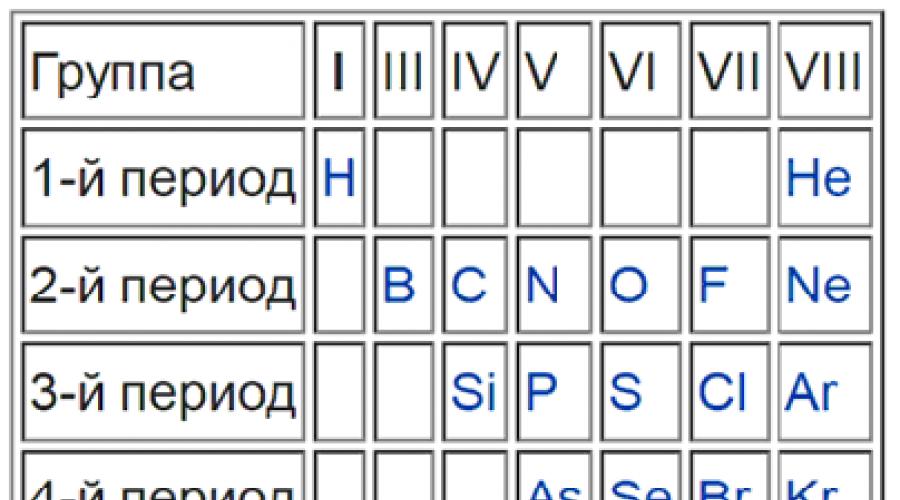
Rasmda siz qaysi elementlarning metall bo'lmaganligini va ular jadvalda guruhlar va davrlar bo'yicha qanday joylashtirilganligini aniq ko'rishingiz mumkin.
Umumiy jismoniy xususiyatlar
Metalllarning umumiy fizik xususiyatlari mavjud. Bularga quyidagilar kiradi:
- Plastik.
- Xarakterli yorqinlik.
- Elektr o'tkazuvchanligi.
- Yuqori issiqlik o'tkazuvchanligi.
- Simobdan tashqari hammasi qattiq holatda.
Shuni tushunish kerakki, metallarning xossalari ularning kimyoviy tarkibiga qarab juda farq qiladi jismoniy mohiyati. Ulardan ba'zilari atamaning oddiy ma'nosida metallarga deyarli o'xshamaydi. Misol uchun, simob alohida o'rin egallaydi. Oddiy sharoitlarda u mavjud suyuqlik holati, kristall panjaraga ega emas, uning mavjudligi boshqa metallar o'z xususiyatlariga ega. Bu holda ikkinchisining xususiyatlari shartli bo'lib, simob o'zining kimyoviy xususiyatlariga ko'ra ularga o'xshashdir.
Qiziqarli! Birinchi guruh elementlari, ishqoriy metallar, in sof shakl turli birikmalarda topilganda yuzaga kelmaydi.
Tabiatda mavjud bo'lgan eng yumshoq metall seziy bu guruhga tegishli. U, boshqa ishqoriy moddalar kabi, ko'proq tipik metallar bilan kam umumiylikka ega. Ba'zi manbalarning ta'kidlashicha, aslida eng yumshoq metall kaliy bo'lib, uni bahslash yoki tasdiqlash qiyin, chunki u yoki boshqa element o'z-o'zidan mavjud emas - kimyoviy reaktsiya natijasida chiqarilganda ular tezda oksidlanadi yoki reaksiyaga kirishadi.
Metalllarning ikkinchi guruhi - ishqoriy tuproq metallari asosiy guruhlarga ancha yaqin. "Ishqoriy er" nomi qadimgi davrlardan kelib chiqqan bo'lib, oksidlar bo'shashgan, maydalangan tuzilishga ega bo'lganligi uchun "er" deb atalgan. 3-guruhdan boshlangan metallar ko'proq yoki kamroq tanish (kundalik ma'noda) xususiyatlarga ega. Guruh soni ortishi bilan metallar miqdori kamayadi
Davriy jadvalning 115-elementi - moskoviy - Mc belgisi va atom raqami 115 bo'lgan o'ta og'ir sintetik element. U birinchi marta 2003 yilda Qo'shma institutda rus va amerikalik olimlarning qo'shma jamoasi tomonidan olingan. yadroviy tadqiqotlar(JINR) Dubna, Rossiya. 2015 yil dekabr oyida Xalqaro qo'shma ishchi guruhi tomonidan to'rtta yangi elementlardan biri sifatida tan olingan ilmiy tashkilotlar IUPAC/IUPAP. 2016 yil 28 noyabrda u JINR joylashgan Moskva viloyati sharafiga rasman nomlangan.
Xarakterli
Davriy sistemaning 115-elementi nihoyatda radioaktiv moddadir: uning eng barqaror izotopi moskoviy-290 ning yarim yemirilish davri atigi 0,8 soniyani tashkil qiladi. Olimlar moskoviyni vismutga o'xshash bir qator xususiyatlarga ega bo'lmagan o'tish metali sifatida tasniflashadi. Davriy jadvalda u 7-davr p-blokining transaktinid elementlariga kiradi va vismutning og'irroq gomologi kabi o'zini tutishi tasdiqlanmagan bo'lsa-da, eng og'ir pniktojen (azot kichik guruh elementi) sifatida 15-guruhga kiritilgan. .
Hisob-kitoblarga ko'ra, element engilroq gomologlarga o'xshash ba'zi xususiyatlarga ega: azot, fosfor, mishyak, surma va vismut. Shu bilan birga, u ulardan bir nechta muhim farqlarni ko'rsatadi. Bugungi kunga qadar 100 ga yaqin moskovium atomlari sintez qilingan, ular mavjud massa raqamlari 287 dan 290 gacha.

Jismoniy xususiyatlar
Davriy sistemaning 115-elementi moskoviyning valentlik elektronlari uchta pastki qavatga bo'linadi: 7s (ikki elektron), 7p 1/2 (ikki elektron) va 7p 3/2 (bir elektron). Ularning dastlabki ikkitasi nisbiy jihatdan barqarorlashgan va shuning uchun o'zini asil gazlar kabi tutadi, ikkinchisi esa nisbiy jihatdan beqarorlashgan va kimyoviy o'zaro ta'sirlarda oson ishtirok etishi mumkin. Shunday qilib, moskoviumning birlamchi ionlanish potentsiali taxminan 5,58 eV bo'lishi kerak. Hisob-kitoblarga ko'ra, moskovium taxminan 13,5 g / sm 3 zichlikdagi yuqori atom og'irligi tufayli zich metall bo'lishi kerak.
Taxminiy dizayn xususiyatlari:
- Faza: qattiq.
- Erish nuqtasi: 400 ° C (670 ° K, 750 ° F).
- Qaynash nuqtasi: 1100 ° C (1400 ° K, 2000 ° F).
- Erishishning solishtirma issiqligi: 5,90-5,98 kJ/mol.
- Bug'lanish va kondensatsiyalanishning solishtirma issiqligi: 138 kJ/mol.

Kimyoviy xossalari
Davriy sistemaning 115-elementi kimyoviy elementlarning 7p qatorida uchinchi oʻrinda turadi va davriy sistemada 15-guruhning eng ogʻir aʼzosi boʻlib, vismutdan pastda joylashgan. Moskoviumning suvli eritmadagi kimyoviy o'zaro ta'siri Mc + va Mc 3+ ionlarining xususiyatlari bilan belgilanadi. Birinchisi, ehtimol, oson gidrolizlanadi va galogenlar, siyanidlar va ammiak bilan ionli aloqalar hosil qiladi. Muskoviy (I) gidroksid (McOH), karbonat (Mc 2 CO 3), oksalat (Mc 2 C 2 O 4) va ftorid (McF) suvda eritilishi kerak. Sulfid (Mc 2 S) erimaydigan bo'lishi kerak. Xlorid (McCl), bromid (McBr), yodid (McI) va tiosiyanat (McSCN) ozgina eriydigan birikmalardir.
Moscovium (III) ftorid (McF 3) va tiosonid (McS 3) suvda erimaydi (mos keladigan vismut birikmalariga o'xshash). Xlorid (III) (McCl 3), bromid (McBr 3) va yodid (McI 3) oson eriydi va McOCl va McOBr (shuningdek, vismutga o'xshash) kabi oksogalidlarni hosil qilish uchun oson gidrolizlanishi kerak. Moskovium (I) va (III) oksidlari bir xil oksidlanish darajalariga ega va ularning nisbiy barqarorligi asosan qaysi elementlar bilan reaksiyaga kirishishiga bog'liq.
Noaniqlik
Davriy sistemaning 115-elementi eksperimental ravishda faqat bir marta sintez qilinganligi sababli uning aniq xarakteristikalari muammoli. Olimlar nazariy hisob-kitoblarga tayanib, ularni o'xshash xususiyatlarga ega bo'lgan barqarorroq elementlar bilan solishtirishlari kerak.
2011 yilda ularning xususiyatlarini o'rganish uchun "tezlatgichlar" (kaltsiy-48) va "maqsadlar" (amerikan-243 va plutoniy-244) o'rtasidagi reaktsiyalarda nihonium, flerovium va moskovium izotoplarini yaratish bo'yicha tajribalar o'tkazildi. Biroq, "maqsadlar" qo'rg'oshin va vismutning aralashmalarini o'z ichiga olgan va shuning uchun nuklon o'tkazish reaktsiyalarida vismut va poloniyning ba'zi izotoplari olingan, bu tajribani murakkablashtirdi. Shu bilan birga, olingan ma'lumotlar olimlarga kelajakda vismut va poloniyning moskovium va jigarmoriy kabi og'ir gomologlarini batafsilroq o'rganishga yordam beradi.

Ochilish
Davriy jadvalning 115-elementining birinchi muvaffaqiyatli sintezi hamkorlik Rossiya va Amerika olimlari 2003 yil avgust oyida Dubnadagi JINRda. Yadro fizigi Yuriy Oganesyan boshchiligidagi guruhga mahalliy mutaxassislardan tashqari Lourens Livermor milliy laboratoriyasidagi hamkasblar ham kirdi. Tadqiqotchilar 2004-yil 2-fevralda Physical Review jurnalida U-400 siklotronida ameritsiy-243 ni kaltsiy-48 ionlari bilan bombardimon qilishgan va yangi moddaning toʻrt atomini (bitta 287 Mk yadro va uchta 288 Mk yadro) olganliklari haqida maʼlumot chop etishdi. Bu atomlar nihonium elementiga taxminan 100 millisekundda alfa zarrachalarini chiqarish orqali parchalanadi (parchalanadi). 2009-2010 yillarda moskoviumning ikkita og'irroq izotopi, 289 Mc va 290 Mc, topilgan.
Dastlab, IUPAC yangi elementning kashf etilishini ma'qullay olmadi. Boshqa manbalardan tasdiqlash kerak edi. Keyingi bir necha yil ichida keyingi tajribalar qo'shimcha baholandi va Dubna jamoasining 115-elementni topgani haqidagi da'vosi yana bir bor ilgari surildi.
2013-yil avgust oyida Lund universiteti va Darmshtadtdagi (Germaniya) og‘ir ion instituti tadqiqotchilari guruhi Dubnada olingan natijalarni tasdiqlovchi 2004-yilgi tajribani takrorlaganliklarini e’lon qilishdi. Keyingi tasdiqlash 2015 yilda Berklida ishlaydigan olimlar guruhi tomonidan nashr etilgan. 2015 yil dekabr oyida qo'shma ishchi guruhi IUPAC/IUPAP ushbu elementning kashf etilishini tan oldi va kashfiyotda Rossiya-Amerika tadqiqotchilar guruhiga ustuvor ahamiyat berdi.

Ism
1979 yilda IUPAC tavsiyasiga ko'ra, davriy jadvalning 115-elementini "ununpentium" deb nomlashga va uni tegishli UUP belgisi bilan belgilashga qaror qilindi. O'shandan beri bu nom kashf etilmagan (lekin nazariy jihatdan bashorat qilingan) elementga nisbatan keng qo'llanilgan bo'lsa-da, u fizika hamjamiyatida qo'lga kiritilmadi. Ko'pincha, moddani shunday deb atashgan - element № 115 yoki E115.
2015-yil 30-dekabrda yangi elementning kashfiyoti Xalqaro sof va amaliy kimyo ittifoqi tomonidan tan olingan. Yangi qoidalarga ko'ra, kashfiyotchilar yangi moddaga o'z nomini taklif qilish huquqiga ega. Dastlab davriy jadvalning 115-elementini fizik Pol Langevin sharafiga "langevinium" deb nomlash rejalashtirilgan edi. Keyinchalik Dubnalik olimlar jamoasi, variant sifatida, kashfiyot qilingan Moskva viloyati sharafiga "Moskva" nomini taklif qilishdi. 2016 yil iyun oyida IUPAC tashabbusni ma'qulladi va 2016 yil 28 noyabrda "moscovium" nomini rasman tasdiqladi.
Davriy qonun D.I. Mendeleyev va kimyoviy elementlarning davriy tizimi Unda bor katta ahamiyatga ega kimyo rivojlanishida. Keling, 1871 yilga qaytaylik, kimyo professori D.I. Mendeleev ko'p sinovlar va xatolar orqali shunday xulosaga keldi "... elementlarning xossalari va shuning uchun ular hosil qiladigan oddiy va murakkab jismlarning xususiyatlari vaqti-vaqti bilan ularning atom og'irligiga bog'liqdir." Elementlar xossalarining o'zgarishi davriyligi yadro zaryadining ortishi bilan tashqi elektron qatlamning elektron konfiguratsiyasining davriy takrorlanishi tufayli yuzaga keladi.
Davriy qonunning zamonaviy shakllantirilishi bu .. mi:
"Kimyoviy elementlarning xususiyatlari (ya'ni, ular hosil qiladigan birikmalarning xossalari va shakli) vaqti-vaqti bilan kimyoviy elementlar atomlari yadrosining zaryadiga bog'liq."
Mendeleyev kimyodan dars berar ekan, har bir elementning individual xossalarini eslab qolish o‘quvchilarga qiyinchilik tug‘dirishini tushundi. U elementlarning xossalarini eslab qolishni osonlashtiradigan tizimli usulni yaratish usullarini izlay boshladi. Natija bo'ldi tabiiy stol, keyinchalik u nomi bilan tanildi davriy.
Bizning zamonaviy jadvalimiz davriy jadvalga juda o'xshaydi. Keling, buni batafsil ko'rib chiqaylik.
Mendeleev jadvali
Mendeleyev davriy tizimi 8 guruh va 7 davrdan iborat.
Jadvalning vertikal ustunlari deyiladi guruhlar . Har bir guruh ichidagi elementlar o'xshash kimyoviy va jismoniy xususiyatlar. Bu xuddi shu guruhning elementlari tashqi qatlamning o'xshash elektron konfiguratsiyasiga ega ekanligi bilan izohlanadi, ulardagi elektronlar soni guruh raqamiga teng. Bunday holda, guruh bo'linadi asosiy va ikkilamchi kichik guruhlar.
IN Asosiy kichik guruhlar valentlik elektronlari tashqi ns- va np-kichik darajalarda joylashgan elementlarni o'z ichiga oladi. IN Yon kichik guruhlar valentlik elektronlari tashqi ns-pastki sathda va ichki (n - 1) d-pastki (yoki (n - 2) f-pastki daraja) joylashgan elementlarni o'z ichiga oladi.
Barcha elementlar davriy jadval , qaysi kichik darajadagi (s-, p-, d- yoki f-) valentlik elektronlari tasniflanishiga qarab: s-elementlar (I va II guruhlarning asosiy kichik guruhlari elementlari), p-elementlar (asosiy kichik guruhlarning elementlari III). - VII guruhlar), d-elementlar (yon kichik guruhlarning elementlari), f-elementlar (lantanidlar, aktinidlar).
Elementning eng yuqori valentligi (O, F, mis kichik guruhi va sakkizinchi guruh elementlari bundan mustasno) u joylashgan guruh soniga teng.
Asosiy va ikkilamchi kichik guruhlarning elementlari uchun yuqori oksidlar (va ularning gidratlari) formulalari bir xil. Asosiy kichik guruhlarda vodorod birikmalarining tarkibi ushbu guruhdagi elementlar uchun bir xil bo'ladi. Qattiq gidridlar I - asosiy kichik guruhlarning elementlarini tashkil qiladi. III guruh, va IV - VII guruhlar gazsimon vodorod birikmalarini hosil qiladi. EN 4 tipidagi vodorod birikmalari ko'proq neytral birikmalar, EN 3 asoslar, H 2 E va NE kislotalardir.
Jadvalning gorizontal qatorlari deyiladi davrlar. Davrlardagi elementlar bir-biridan farq qiladi, lekin ularning umumiy tomoni shundaki, oxirgi elektronlar bir xil energiya darajasida ( bosh kvant sonin- xuddi shu ).
Birinchi davr boshqalardan faqat 2 ta element mavjudligi bilan farq qiladi: vodorod H va geliy He.
Ikkinchi davrda 8 ta element (Li - Ne) mavjud. Ishqoriy metall bo'lgan lityum Li davrni boshlaydi va asil gaz neon Ne uni yopadi.
Uchinchi davrda xuddi ikkinchi davrdagi kabi 8 ta element (Na - Ar) mavjud. Davr ishqoriy metall natriy Na bilan boshlanadi va asil gaz argon Ar uni yopadi.
To'rtinchi davr 18 elementni o'z ichiga oladi (K - Kr) - Mendeleev uni birinchi katta davr deb belgilagan. Shuningdek, u ishqoriy metall Kaliy bilan boshlanadi va inert gaz kriptoni Kr bilan tugaydi. Katta davrlar tarkibiga o'tish elementlari kiradi (Sc - Zn) - d- elementlar.
Beshinchi davrda, to'rtinchisiga o'xshash, 18 ta element (Rb - Xe) mavjud va uning tuzilishi to'rtinchisiga o'xshaydi. Shuningdek, u ishqoriy metall rubidiy Rb bilan boshlanadi va inert gaz ksenon Xe bilan tugaydi. Katta davrlar tarkibiga o'tish elementlari kiradi (Y - Cd) - d- elementlar.
Oltinchi davr 32 ta elementdan (Cs - Rn) iborat. 10 dan tashqari d-elementlar (La, Hf - Hg) u 14 qatorni o'z ichiga oladi f-elementlar (lantanidlar) - Ce - Lu
Ettinchi davr tugamadi. U frank Fr bilan boshlanadi, u oltinchi davr kabi allaqachon topilgan 32 ta elementni (Z = 118 elementgacha) o'z ichiga oladi deb taxmin qilish mumkin.
Interaktiv davriy jadval
Agar qarasangiz davriy jadval va bordan boshlanib, poloniy va astatin o'rtasida tugaydigan xayoliy chiziq chizamiz, keyin barcha metallar chiziqning chap tomonida, metall bo'lmaganlar esa o'ngda bo'ladi. Ushbu chiziqqa darhol qo'shni elementlar metall va metall bo'lmagan xususiyatlarga ega bo'ladi. Ular metalloidlar yoki yarim metallar deb ataladi. Bular bor, kremniy, germaniy, mishyak, surma, tellur va poloniydir.
Davriy qonun
Mendeleev Davriy qonunning quyidagi formulasini berdi: “oddiy jismlarning xossalari, shuningdek, elementlar birikmalarining shakllari va xossalari, shuning uchun ular hosil qiladigan oddiy va murakkab jismlarning xossalari davriy ravishda ularning atom og'irligiga bog'liq. ”
To'rtta asosiy davriy naqsh mavjud:
Oktet qoidasi barcha elementlar eng yaqin asil gazning sakkiz elektronli konfiguratsiyasiga ega bo'lish uchun elektron olish yoki yo'qotish moyilligini bildiradi. Chunki Asil gazlarning tashqi s- va p-orbitallari to'liq to'ldirilganligi sababli ular eng barqaror elementlardir.
Ionizatsiya energiyasi atomdan elektronni olib tashlash uchun zarur bo'lgan energiya miqdori. Oktet qoidasiga ko'ra, davriy jadval bo'ylab chapdan o'ngga harakatlanayotganda, elektronni olib tashlash uchun ko'proq energiya talab qilinadi. Shuning uchun stolning chap tomonidagi elementlar elektronni yo'qotishga moyil bo'lib, o'ng tomondagi elementlar esa elektronni olishga moyil bo'ladi. Inert gazlar eng yuqori ionlanish energiyasiga ega. Guruh bo'ylab pastga siljiganingizda ionlanish energiyasi kamayadi, chunki Past energiya darajasidagi elektronlar yuqori energiya darajasidagi elektronlarni qaytarish qobiliyatiga ega. Bu hodisa deyiladi himoya effekti. Bu ta'sir tufayli tashqi elektronlar yadro bilan kamroq bog'langan. Davr bo'ylab harakatlanayotganda, ionlanish energiyasi chapdan o'ngga silliq ravishda ortadi.

Elektron yaqinligi- gazsimon holatdagi moddaning atomi qo'shimcha elektron olganida energiyaning o'zgarishi. Guruh bo'ylab pastga siljiganida, elektron yaqinlik skrining effekti tufayli kamroq salbiy bo'ladi.

Elektromanfiylik- u bilan bog'langan boshqa atomdan elektronlarni qanchalik kuchli jalb qilishning o'lchovi. Ichkariga kirishda elektronegativlik kuchayadi davriy jadval chapdan o'ngga va pastdan yuqoriga. Shuni esda tutish kerakki, asil gazlar elektronegativlikka ega emas. Shunday qilib, eng elektronegativ element ftordir.

Ushbu tushunchalarga asoslanib, keling, atomlar va ularning birikmalarining xossalari qanday o'zgarishini ko'rib chiqaylik davriy jadval.
Shunday qilib, davriy bog'liqlikda atomning elektron konfiguratsiyasi bilan bog'liq bo'lgan xususiyatlari mavjud: atom radiusi, ionlanish energiyasi, elektronegativlik.
Keling, atomlar va ularning birikmalarining joylashuviga qarab xususiyatlarining o'zgarishini ko'rib chiqaylik kimyoviy elementlarning davriy jadvali.
Atomning metall bo'lmaganligi ortadi davriy jadvalda harakatlanayotganda chapdan o'ngga va pastdan yuqoriga. Shu tufayli oksidlarning asosiy xossalari pasayadi, va kislotali xususiyatlar bir xil tartibda ortadi - chapdan o'ngga va pastdan yuqoriga harakat qilganda. Bundan tashqari, oksidlarning kislotali xususiyatlari kuchliroq bo'lsa, uni hosil qiluvchi elementning oksidlanish darajasi shunchalik yuqori bo'ladi.
Chapdan o'ngga davr bo'yicha asosiy xususiyatlar gidroksidlar asosiy kichik guruhlarda, yuqoridan pastga, poydevorning mustahkamligi kuchayadi; Bundan tashqari, agar metall bir nechta gidroksid hosil qila olsa, u holda metallning oksidlanish darajasining oshishi bilan, asosiy xususiyatlar gidroksidlar zaiflashadi.
Davr bo'yicha chapdan o'ngga kislorod o'z ichiga olgan kislotalarning kuchi ortadi. Bir guruh ichida yuqoridan pastgacha harakat qilganda, kislorod o'z ichiga olgan kislotalarning kuchi pasayadi. Bunda kislotaning kuchi kislota hosil qiluvchi elementning oksidlanish darajasi oshishi bilan ortadi.
Davr bo'yicha chapdan o'ngga kislorodsiz kislotalarning kuchi ortadi. Bir guruh ichida yuqoridan pastgacha harakatlanayotganda kislorodsiz kislotalarning kuchi ortadi.
Kategoriyalar,Hammasi qanday boshlandi?
Ko'plab taniqli kimyogarlar XIX-XX asrlarning boshi asrlar davomida, uzoq vaqtdan beri jismoniy va Kimyoviy xossalari ko'pgina kimyoviy elementlar bir-biriga juda o'xshash. Masalan, kaliy, litiy va natriy barcha faol metallar bo'lib, ular suv bilan reaksiyaga kirishganda, bu metallarning faol gidroksidlarini hosil qiladi; Xlor, ftor, brom vodorod bilan birikmalarida bir xil valentlikni I ga teng ko'rsatdi va bu birikmalarning barchasi kuchli kislotalardir. Ushbu o'xshashlikdan uzoq vaqtdan beri barcha ma'lum kimyoviy elementlarni guruhlarga birlashtirish mumkin va har bir guruhning elementlari ma'lum bir to'plamga ega bo'lishi mumkin degan xulosaga kelishdi. fizik va kimyoviy xususiyatlar. Biroq, ko'pincha bunday guruhlar turli olimlar tomonidan turli elementlardan noto'g'ri tuzilgan va uzoq vaqt Ko'pchilik elementlarning asosiy xususiyatlaridan birini - ularning atom massasini e'tiborsiz qoldirdi. Bu e'tiborga olinmadi, chunki bor edi va boshqacha turli elementlar, ya'ni uni guruhlarga birlashtirish uchun parametr sifatida ishlatib bo'lmaydi. Faqatgina istisno frantsuz kimyogari Aleksandr Emil Shankurtua edi, u barcha elementlarni tartibga solishga harakat qildi. uch o'lchovli model spiral chiziq bo'ylab, lekin uning ishi ilmiy jamoatchilik tomonidan tan olinmadi va model katta hajmli va noqulay bo'lib chiqdi.
Ko'pgina olimlardan farqli o'laroq, D.I. Mendeleev atom massasini oldi (o'sha kunlarda u hali ham "Atom og'irligi" edi). asosiy parametr elementlarni tasniflashda. Dmitriy Ivanovich o'z versiyasida elementlarni atom og'irliklarining ortib borayotgan tartibida joylashtirdi va bu erda elementlarning ma'lum oraliqlarida ularning xossalari davriy ravishda takrorlanadigan naqsh paydo bo'ldi. To'g'ri, istisno qilish kerak edi: ba'zi elementlar almashtirildi va atom massalarining o'sishiga mos kelmadi (masalan, tellur va yod), lekin ular elementlarning xususiyatlariga mos keldi. Atom-molekulyar ta'limotning keyingi rivojlanishi bunday yutuqlarni oqladi va bu tartibga solishning haqiqiyligini ko'rsatdi. Bu haqda ko'proq "Mendeleevning kashfiyoti nima" maqolasida o'qishingiz mumkin.
Ko'rib turganimizdek, ushbu versiyadagi elementlarning joylashishi biz uning zamonaviy shaklida ko'rib turganimizdek bir xil emas. Birinchidan, guruhlar va davrlar almashtiriladi: gorizontal guruhlar, vertikal davrlar, ikkinchidan, unda qandaydir tarzda juda ko'p guruhlar mavjud - bugungi kunda qabul qilingan o'n sakkiz o'rniga o'n to'qqizta.
Biroq, atigi bir yil o'tgach, 1870 yilda Mendeleev tuzildi yangi variant jadval, biz uchun allaqachon ko'proq taniqli: shunga o'xshash elementlar vertikal ravishda joylashtirilgan, guruhlarni tashkil qiladi va 6 ta davr gorizontal holatda joylashgan. Ayniqsa, diqqatga sazovor narsa shundaki, jadvalning birinchi va ikkinchi versiyalarida ham ko'rish mumkin uning o'tmishdoshlarida bo'lmagan muhim yutuqlar: jadval Mendeleevning fikriga ko'ra, hali kashf etilmagan elementlar uchun joylarni ehtiyotkorlik bilan qoldirgan. Muvofiq bo'sh ish o'rinlari Ular savol belgisi bilan ko'rsatilgan va ularni yuqoridagi rasmda ko'rishingiz mumkin. Keyinchalik tegishli elementlar haqiqatda topildi: Galiy, Germaniy, Skandiy. Shunday qilib, Dmitriy Ivanovich nafaqat elementlarni guruhlar va davrlarga tizimlashtirdi, balki yangi, hali ma'lum bo'lmagan elementlarning kashf etilishini ham bashorat qildi.
Keyinchalik, o'sha davr kimyosining ko'plab dolzarb sirlarini hal qilgandan so'ng - yangi elementlarning kashf etilishi, Uilyam Ramsay ishtirokida bir guruh asil gazlar ajratilishi, Didimiy umuman mustaqil element emasligining aniqlanishi, lekin ikkita boshqasining aralashmasi - tobora ko'proq yangi va yangi stol variantlari, ba'zan hatto jadvalsiz ko'rinishga ega. Lekin biz bu yerda ularning hammasini keltirmaymiz, faqat buyuk olimning hayoti davomida shakllangan yakuniy variantini taqdim etamiz.

Atom og'irliklaridan yadro zaryadiga o'tish.
Afsuski, Dmitriy Ivanovich atom tuzilishining sayyoraviy nazariyasini ko'rish uchun yashamadi va Ruterford tajribalarining g'alabasini ko'rmadi, garchi uning kashfiyotlari bilan yangi davr davriy qonun va butun davriy tizimning rivojlanishida. Eslatib o'taman, Ernest Rezerford o'tkazgan tajribalardan elementlarning atomlari musbat zaryadlangan atom yadrosi va manfiy zaryadlangan elektronlar yadro atrofida aylanadi. O'sha paytda ma'lum bo'lgan barcha elementlarning atom yadrolarining zaryadlarini aniqlagandan so'ng, ular davriy jadvalda yadro zaryadiga mos ravishda joylashganligi ma'lum bo'ldi. Va davriy qonun olingan yangi ma'no, endi u shunday eshitila boshlaydi:
“Kimyoviy elementlarning xossalari, shuningdek, ular hosil qilgan shakl va xossalari oddiy moddalar va birikmalar davriy ravishda ularning atomlari yadrolarining zaryadlarining kattaligiga bog'liq bo'ladi.
Endi nima uchun ba'zi engilroq elementlarni Mendeleev o'zlarining og'irroq o'tmishdoshlari orqasiga qo'yganligi aniq bo'ldi - butun gap shundaki, ular yadrolarining zaryadlari bo'yicha shunday tartiblangan. Masalan, tellur yoddan og'irroq, lekin jadvalda avvalroq sanab o'tilgan, chunki uning atomi yadrosining zaryadi va elektronlar soni 52, yodniki esa 53. Jadvalga qarang va buni ko'rishingiz mumkin. o'zingiz.
Atomning tuzilishi va atom yadrosi kashf etilgandan so'ng, davriy sistema yana bir necha o'zgarishlarga uchradi, u nihoyat bizga maktabdan tanish bo'lgan shaklga, davriy jadvalning qisqa muddatli versiyasiga etib bordi.
 Ushbu jadvalda biz allaqachon hamma narsa bilan tanishmiz: 7 ta davr, 10 qator, ikkilamchi va asosiy kichik guruhlar. Shuningdek, yangi elementlarni kashf qilish va ular bilan jadvalni to'ldirish vaqti bilan aktiniy va lantan kabi elementlarni alohida qatorlarga joylashtirish kerak edi, ularning barchasi mos ravishda aktinidlar va lantanidlar deb nomlandi. Tizimning ushbu versiyasi juda uzoq vaqt davomida - jahon ilmiy hamjamiyatida deyarli 80-yillarning oxiri, 90-yillarning boshlarigacha va bizning mamlakatimizda undan ham uzoqroq - shu asrning 10-yillarigacha mavjud edi.
Ushbu jadvalda biz allaqachon hamma narsa bilan tanishmiz: 7 ta davr, 10 qator, ikkilamchi va asosiy kichik guruhlar. Shuningdek, yangi elementlarni kashf qilish va ular bilan jadvalni to'ldirish vaqti bilan aktiniy va lantan kabi elementlarni alohida qatorlarga joylashtirish kerak edi, ularning barchasi mos ravishda aktinidlar va lantanidlar deb nomlandi. Tizimning ushbu versiyasi juda uzoq vaqt davomida - jahon ilmiy hamjamiyatida deyarli 80-yillarning oxiri, 90-yillarning boshlarigacha va bizning mamlakatimizda undan ham uzoqroq - shu asrning 10-yillarigacha mavjud edi.
Davriy jadvalning zamonaviy versiyasi.
Biroq, ko'pchiligimiz maktabda boshdan kechirgan variant juda chalkash bo'lib chiqdi va chalkashlik kichik guruhlarni asosiy va ikkilamchi guruhlarga bo'lishda ifodalanadi va elementlarning xususiyatlarini ko'rsatish mantiqini eslab qolish juda qiyin bo'ladi. Albatta, shunga qaramay, ko'pchilik undan foydalanishni o'rganib, kimyo fanlari doktori bo'lishdi, ammo hozirgi zamonda u yangi versiya - uzoq muddatli versiya bilan almashtirildi. Shuni ta'kidlash kerakki, ushbu variant IUPAC (Xalqaro sof va amaliy kimyo ittifoqi) tomonidan tasdiqlangan. Keling, buni ko'rib chiqaylik.

Sakkizta guruh o'n sakkizta bilan almashtirildi, ular orasida endi asosiy va ikkilamchi bo'linish yo'q va barcha guruhlar atom qobig'idagi elektronlarning joylashuvi bilan belgilanadi. Shu bilan birga, biz ikki qatorli va bir qatorli davrlardan xalos bo'ldik, endi barcha davrlar faqat bitta qatorni o'z ichiga oladi. Nima uchun bu variant qulay? Endi elementlar xossalarining davriyligi aniqroq ko'rinadi. Guruh raqami, aslida, tashqi darajadagi elektronlar sonini ko'rsatadi va shuning uchun eski versiyaning barcha asosiy kichik guruhlari birinchi, ikkinchi va o'n uchinchi va o'n sakkizinchi guruhlarda joylashgan va barcha "sobiq tomon" guruhlari joylashgan. stol o'rtasida. Shunday qilib, jadvaldan aniq ko'rinib turibdiki, agar bu birinchi guruh bo'lsa, unda bu ishqoriy metallar va siz uchun mis yoki kumush yo'q va barcha tranzit metallar to'ldirish tufayli ularning xususiyatlarining o'xshashligini aniq namoyish etishi aniq. tashqi xossalarga kamroq ta'sir ko'rsatadigan d-pastki sathi, shuningdek, lantanidlar va aktinidlar faqat turli xil f-kichik darajalari tufayli o'xshash xususiyatlarni namoyon qiladi. Shunday qilib, butun jadval quyidagi bloklarga bo'linadi: s-elektronlari to'ldirilgan s-blok, d-blok, p-blok va f-blok, mos ravishda d, p va f-elektronlar to'ldirilgan.
Afsuski, bizning mamlakatimizda bu variant faqat oxirgi 2-3 yil ichida maktab darsliklariga kiritilgan va hatto hammasida ham mavjud emas. Va behuda. Bu nima bilan bog'liq? Birinchidan, 90-yillardagi turg'un davrlar bilan, mamlakatda ta'lim sohasini hisobga olmaganda, umuman rivojlanish yo'q edi va 90-yillarda jahon kimyo hamjamiyati bu variantga o'tdi. Ikkinchidan, ozgina inertsiya va har bir yangi narsani idrok etishda qiyinchilik bilan, chunki bizning o'qituvchilarimiz jadvalning eski, qisqa muddatli versiyasiga o'rganib qolgan, garchi kimyoni o'rganishda u ancha murakkab va kamroq qulay.
Davriy jadvalning kengaytirilgan versiyasi.
Ammo vaqt bir joyda turmaydi, fan va texnika ham bir joyda turmaydi. Davriy jadvalning 118-elementi allaqachon kashf etilgan, ya'ni biz tez orada jadvalning keyingi, sakkizinchi davrini ochishimiz kerak. Bundan tashqari, yangi energiya pastki darajasi paydo bo'ladi: g-pastki daraja. Uning tarkibiy elementlarini lantanidlar yoki aktinidlar kabi jadvaldan pastga siljitish kerak bo'ladi yoki bu jadvalni yana ikki marta kengaytirish kerak bo'ladi, shunda u endi A4 varag'iga sig'maydi. Bu erda men faqat Vikipediyaga havola beraman (Kengaytirilgan davriy jadvalga qarang) va bu variantning tavsifini yana bir bor takrorlamayman. Xohlaganlar havolaga o'tib tanishishi mumkin.
Ushbu versiyada na f-elementlar (lantanidlar va aktinidlar), na g-elementlar (121-128-sonli "kelajak elementlari") alohida joylashtirilmaydi, lekin jadvalni 32 katakchani kengroq qiladi. Shuningdek, geliy elementi ikkinchi guruhga kiritilgan, chunki u s-blokning bir qismidir.
Umuman olganda, kelajakdagi kimyogarlar bu variantdan foydalanishi dargumon, davriy jadval jasur olimlar tomonidan ilgari surilgan alternativalardan biri bilan almashtiriladi: Benfey tizimi, Styuartning "Kimyoviy galaktikasi" yoki boshqa variant; . Ammo bu kimyoviy elementlar barqarorligining ikkinchi oroliga yetgandan keyingina sodir bo'ladi va aniqlik uchun ko'proq narsa kerak bo'ladi. yadro fizikasi, kimyodan ko'ra, lekin hozircha Dmitriy Ivanovichning yaxshi eski davriy tizimi etarli bo'ladi.
Davriy jadval quyidagilardan biridir eng katta kashfiyotlar insoniyat, bu atrofimizdagi dunyo haqidagi bilimlarni tartibga solish va kashf qilish imkonini berdi yangi kimyoviy elementlar. Bu maktab o'quvchilari uchun, shuningdek, kimyoga qiziqqan har bir kishi uchun kerak. Bundan tashqari, ushbu sxema fanning boshqa sohalarida ajralmas hisoblanadi.
Ushbu diagrammada hamma narsa mavjud odamga ma'lum elementlar bo‘lib, ular bo‘yicha guruhlanadi atom massasi va atom raqami. Bu xususiyatlar elementlarning xususiyatlariga ta'sir qiladi. Jadvalning qisqa versiyasida jami 8 ta guruh mavjud, bir guruhga kiritilgan elementlar juda o'xshash xususiyatlarga ega; Birinchi guruh vodorod, litiy, kaliy, misni o'z ichiga oladi, ularning rus tilida lotincha talaffuzi cuprum. Shuningdek, argentum - kumush, seziy, oltin - aurum va fransiy. Ikkinchi guruhga berilliy, magniy, kaltsiy, rux, undan keyin stronsiy, kadmiy, bariy kiradi va guruh simob va radiy bilan tugaydi.
Uchinchi guruhga bor, alyuminiy, skandiy, galliy, undan keyin itriy, indiy, lantan kiradi va guruh talliy va aktiniy bilan tugaydi. To'rtinchi guruh uglerod, kremniy, titandan boshlanib, germaniy, sirkoniy, qalay bilan davom etadi va gafniy, qo'rg'oshin va ruterfordiy bilan tugaydi. Beshinchi guruhga azot, fosfor, vanadiy kabi elementlar kiradi, quyida mishyak, niobiy, surma, keyin tantal, vismut keladi va guruhni dubniy bilan yakunlaydi. Oltinchisi kisloroddan boshlanadi, undan keyin oltingugurt, xrom, selen, keyin molibden, tellur, keyin volfram, poloniy va seaborgium.
Ettinchi guruhda birinchi element ftor, undan keyin xlor, marganets, brom, texnetiy, keyin yod, keyin reniy, astatin va boriy. Oxirgi guruh eng ko'p. U geliy, neon, argon, kripton, ksenon va radon kabi gazlarni o'z ichiga oladi. Bu guruhga temir, kobalt, nikel, rodiy, palladiy, ruteniy, osmiy, iridiy va platina metallari ham kiradi. Keyingi o'rinlarda hannium va meitnerium. ni tashkil etuvchi elementlar aktinidlar seriyasi va lantanidlar seriyasi. Ular lantan va aktiniyga o'xshash xususiyatlarga ega.

Ushbu sxema ikkita katta guruhga bo'lingan barcha turdagi elementlarni o'z ichiga oladi - metallar va metall bo'lmaganlar, ega turli xil xususiyatlar. Elementning u yoki bu guruhga tegishli ekanligini qanday aniqlash mumkin bo'lgan an'anaviy chiziq bordan astatingacha chizilgan bo'lishi kerak. Shuni esda tutish kerakki, bunday chiziq faqat chizilgan bo'lishi mumkin to'liq versiya jadvallar. Ushbu chiziqdan yuqorida joylashgan va asosiy kichik guruhlarda joylashgan barcha elementlar metall bo'lmagan deb hisoblanadi. Va quyida joylashganlar, asosiy kichik guruhlarda, metallardir. Metalllar ham mavjud moddalardir yon kichik guruhlar. Ushbu elementlarning joylashuvi bilan batafsil tanishishingiz mumkin bo'lgan maxsus rasmlar va fotosuratlar mavjud. Shuni ta'kidlash kerakki, ushbu chiziqdagi elementlar metallar va metall bo'lmaganlar uchun bir xil xususiyatlarni namoyish etadi.
Alohida ro'yxat amfoter elementlardan iborat bo'lib, ular ikki xil xususiyatga ega va reaktsiyalar natijasida 2 turdagi birikma hosil qilishi mumkin. Shu bilan birga, ular ham asosiy, ham namoyon bo'ladi kislota xossalari. Muayyan xususiyatlarning ustunligi reaksiya sharoitlariga va amfoter element reaksiyaga kirishadigan moddalarga bog'liq.

Shunisi e'tiborga loyiqki, ushbu sxema yaxshi sifatli an'anaviy dizaynida rangli. Qayerda turli ranglar orientatsiya qulayligi uchun ko'rsatilgan asosiy va ikkilamchi kichik guruhlar. Elementlar xossalarining o'xshashligiga qarab ham guruhlanadi.
Biroq, bugungi kunda rang sxemasi bilan bir qatorda, Mendeleevning qora va oq davriy jadvali juda keng tarqalgan. Ushbu turdagi qora va oq chop etish uchun ishlatiladi. Ko'rinib turgan murakkabligiga qaramay, u bilan ishlash, agar siz ba'zi nuanslarni hisobga olsangiz, xuddi shunday qulaydir. Shunday qilib, bu holda siz asosiy kichik guruhni ikkilamchi guruhdan aniq ko'rinadigan soyalardagi farqlar bilan ajrata olasiz. Bundan tashqari, rangli versiyada turli qatlamlarda elektronlar mavjud bo'lgan elementlar ko'rsatilgan turli ranglar.
Shunisi e'tiborga loyiqki, bitta rangli dizaynda sxema bo'yicha harakat qilish juda qiyin emas. Buning uchun elementning har bir alohida katagida ko'rsatilgan ma'lumotlar etarli bo'ladi.

Yagona davlat imtihoni bugungi kunda maktab oxiridagi testning asosiy turi bo'lib, unga tayyorgarlik ko'rish kerakligini anglatadi. Maxsus e'tibor. Shuning uchun, tanlashda kimyo fanidan yakuniy imtihon, siz uni o'tkazishga yordam beradigan materiallarga e'tibor berishingiz kerak. Qoidaga ko'ra, maktab o'quvchilariga imtihon paytida ba'zi jadvallardan, xususan, davriy jadvaldan foydalanishga ruxsat beriladi. yaxshi sifat. Shuning uchun sinov paytida u faqat foyda keltirishi uchun uning tuzilishiga va elementlarning xususiyatlarini, shuningdek ularning ketma-ketligini o'rganishga oldindan e'tibor qaratish lozim. Siz ham o'rganishingiz kerak stolning qora va oq versiyasidan foydalaning imtihonda ba'zi qiyinchiliklarga duch kelmaslik uchun.

Elementlarning xossalarini va ularning atom massasiga bog'liqligini tavsiflovchi asosiy jadvaldan tashqari, kimyoni o'rganishda yordam beradigan boshqa diagrammalar ham mavjud. Masalan, bor moddalarning eruvchanligi va elektr manfiyligi jadvallari. Birinchisi, ma'lum bir birikmaning normal haroratda suvda qanchalik eruvchanligini aniqlash uchun ishlatilishi mumkin. Bunda anionlar gorizontal - manfiy zaryadlangan ionlar, kationlar - ya'ni musbat zaryadlangan ionlar esa vertikal joylashadi. Bilish uchun eruvchanlik darajasi u yoki bu birikmaning tarkibiy qismlarini jadval yordamida topish kerak. Va ularning kesishgan joyida kerakli belgi bo'ladi.
Agar bu "p" harfi bo'lsa, u holda modda normal sharoitda suvda to'liq eriydi. Agar "m" harfi mavjud bo'lsa, modda ozgina eriydi va "n" harfi mavjud bo'lsa, u deyarli erimaydi. Agar "+" belgisi bo'lsa, birikma cho'kma hosil qilmaydi va erituvchi bilan qoldiqsiz reaksiyaga kirishadi. Agar "-" belgisi mavjud bo'lsa, bu bunday moddaning mavjud emasligini anglatadi. Ba'zan jadvalda "?" belgisini ham ko'rishingiz mumkin, demak, bu birikmaning eruvchanlik darajasi aniq emas. Elementlarning elektron manfiyligi 1 dan 8 gacha o'zgarishi mumkin, bu parametrni aniqlash uchun maxsus jadval ham mavjud.
 Yana bir foydali jadval metall faoliyati seriyasidir. Barcha metallar elektrokimyoviy potentsialning ortib borayotgan darajalariga qarab unda joylashgan. Metall kuchlanish seriyasi lityum bilan boshlanadi va oltin bilan tugaydi. Metall ma'lum bir qatorda qanchalik chap tomonda joy egallasa, u shunchalik faol bo'ladi, deb ishoniladi. kimyoviy reaksiyalar. Shunday qilib, eng faol metall Litiy ishqoriy metal hisoblanadi. Elementlar ro'yxati oxirida vodorodni ham o'z ichiga oladi. Undan keyin joylashgan metallar deyarli faol emas deb ishoniladi. Bularga mis, simob, kumush, platina va oltin kabi elementlar kiradi.
Yana bir foydali jadval metall faoliyati seriyasidir. Barcha metallar elektrokimyoviy potentsialning ortib borayotgan darajalariga qarab unda joylashgan. Metall kuchlanish seriyasi lityum bilan boshlanadi va oltin bilan tugaydi. Metall ma'lum bir qatorda qanchalik chap tomonda joy egallasa, u shunchalik faol bo'ladi, deb ishoniladi. kimyoviy reaksiyalar. Shunday qilib, eng faol metall Litiy ishqoriy metal hisoblanadi. Elementlar ro'yxati oxirida vodorodni ham o'z ichiga oladi. Undan keyin joylashgan metallar deyarli faol emas deb ishoniladi. Bularga mis, simob, kumush, platina va oltin kabi elementlar kiradi.
Yaxshi sifatli davriy jadval rasmlar
Ushbu sxema kimyo sohasidagi eng katta yutuqlardan biridir. Qayerda bu jadvalning ko'p turlari mavjud- qisqa versiya, uzoq, shuningdek, qo'shimcha uzun. Eng keng tarqalgan qisqa jadval, lekin diagrammaning uzun versiyasi ham keng tarqalgan. Shuni ta'kidlash kerakki, sxemaning qisqa versiyasi hozirda IUPAC tomonidan foydalanish uchun tavsiya etilmaydi.
Hammasi bo'lib bor edi Yuzdan ortiq turdagi jadvallar ishlab chiqilgan, taqdimot, shakl va grafik taqdimotda farqlanadi. Ular ichida ishlatiladi turli hududlar fan, yoki umuman qo'llanilmaydi. Hozirgi vaqtda tadqiqotchilar tomonidan yangi elektron konfiguratsiyalar ishlab chiqilmoqda. Asosiy variant - mukammal sifatda qisqa yoki uzoq tutashuv.