Pagkalkula ng mga thermal effect ng mga reaksiyong kemikal. Ang init ng reaksyon at mga kalkulasyon ng thermochemical
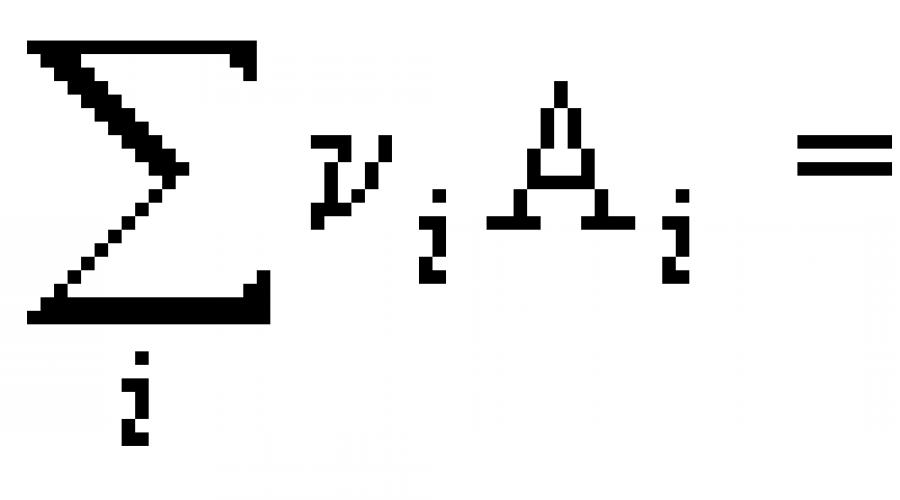
Pag-aaral ng Thermochemistry thermal effect mga reaksiyong kemikal. Sa maraming mga kaso, ang mga reaksyong ito ay nangyayari sa pare-pareho ang dami o pare-pareho ang presyon. Mula sa unang batas ng thermodynamics sumusunod na sa ilalim ng mga kondisyong ito ang init ay isang function ng estado. Sa pare-parehong dami, ang init ay katumbas ng pagbabago panloob na enerhiya:
at sa patuloy na presyon - ang pagbabago sa enthalpy:
Ang mga pagkakapantay-pantay na ito, kapag inilapat sa mga reaksiyong kemikal, ay bumubuo ng kakanyahan Batas ni Hess:
Ang thermal effect ng isang kemikal na reaksyon na nagaganap sa pare-pareho ang presyon o pare-pareho ang dami ay hindi nakasalalay sa landas ng reaksyon, ngunit tinutukoy lamang ng estado ng mga reactant at mga produkto ng reaksyon.
Sa madaling salita, ang thermal effect ng isang kemikal na reaksyon ay katumbas ng pagbabago sa function ng estado.
Sa thermochemistry, hindi tulad ng iba pang mga aplikasyon ng thermodynamics, ang init ay itinuturing na positibo kung ito ay inilabas kapaligiran, ibig sabihin. Kung H < 0 или U
< 0. Под тепловым эффектом химической реакции
понимают значение H(na simpleng tinatawag na "enthalpy of reaction") o U mga reaksyon.
Kung ang reaksyon ay nangyayari sa solusyon o sa solid phase, kung saan ang pagbabago sa volume ay bale-wala, kung gayon
H = U + (pV) U. (3.3)
Kung ang mga perpektong gas ay lumahok sa reaksyon, pagkatapos ay sa pare-pareho ang temperatura
H = U + (pV) = U+n. RT, (3.4)
kung saan ang n ay ang pagbabago sa bilang ng mga moles ng mga gas sa reaksyon.
Upang mapadali ang paghahambing ng mga enthalpies ng iba't ibang mga reaksyon, ang konsepto ng isang "standard na estado" ay ginagamit. Ang karaniwang estado ay ang estado ng isang purong sangkap sa isang presyon ng 1 bar (= 10 5 Pa) at isang ibinigay na temperatura. Para sa mga gas, ito ay isang hypothetical na estado sa isang presyon ng 1 bar, na may mga katangian ng isang walang katapusang rarefied na gas. Enthalpy ng reaksyon sa pagitan ng mga sangkap sa karaniwang estado sa temperatura T, magpakilala ( r nangangahulugang "reaksyon"). Ipinapahiwatig ng mga thermochemical equation hindi lamang ang mga formula ng mga sangkap, kundi pati na rin ang kanilang mga pinagsama-samang estado o mga pagbabago sa kristal.
Ang mga mahahalagang kahihinatnan ay sumusunod mula sa batas ni Hess, na ginagawang posible upang makalkula ang mga enthalpi ng mga reaksiyong kemikal.
Bunga 1.
![]()
katumbas ng pagkakaiba sa pagitan ng mga karaniwang enthalpies ng pagbuo ng mga produkto ng reaksyon at reagents (isinasaalang-alang ang mga stoichiometric coefficients):
Standard enthalpy (init) ng pagbuo ng isang substance (f nangangahulugang "pagbuo") sa isang naibigay na temperatura ay ang enthalpy ng reaksyon ng pagbuo ng isang nunal ng sangkap na ito mula sa mga elemento, na nasa pinaka-stable na karaniwang estado. Ayon sa kahulugan na ito, ang enthalpy ng pagbuo ng pinaka-matatag mga simpleng sangkap sa karaniwang estado ito ay katumbas ng 0 sa anumang temperatura. Ang mga karaniwang enthalpies ng pagbuo ng mga sangkap sa temperatura na 298 K ay ibinibigay sa mga reference na libro.
Ang konsepto ng "enthalpy of formation" ay ginagamit hindi lamang para sa mga ordinaryong sangkap, kundi pati na rin para sa mga ions sa solusyon. Sa kasong ito, ang H + ion ay kinuha bilang reference point, kung saan ang karaniwang enthalpy ng pagbuo sa isang may tubig na solusyon ay ipinapalagay na zero: ![]()
Bunga 2. Standard enthalpy ng isang kemikal na reaksyon
![]()
katumbas ng pagkakaiba sa mga enthalpies ng pagkasunog ng mga reactant at mga produkto ng reaksyon (isinasaalang-alang ang mga stoichiometric coefficients):
(c nangangahulugang "pagkasunog"). Ang karaniwang enthalpy (init) ng pagkasunog ng isang substance ay ang enthalpy ng reaksyon ng kumpletong oksihenasyon ng isang nunal ng isang substance. Ang kinahinatnan na ito ay karaniwang ginagamit upang kalkulahin ang mga thermal effect ng mga organikong reaksyon.
Bunga 3. Ang enthalpy ng isang kemikal na reaksyon ay katumbas ng pagkakaiba sa mga energies ng mga kemikal na bono na nasira at ang mga nabuo.
Enerhiya ng komunikasyon Pangalanan ng A-B ang enerhiya na kinakailangan upang masira ang isang bono at paghiwalayin ang mga nagresultang particle sa isang walang katapusang distansya:
AB (g) A (g) + B (g) .
Ang enerhiya ng komunikasyon ay palaging positibo.
Karamihan sa mga thermochemical data sa mga reference na libro ay ibinibigay sa temperatura na 298 K. Upang kalkulahin ang mga thermal effect sa ibang mga temperatura, gamitin Equation ng Kirchhoff:
(differential form) (3.7)
 (integral na anyo) (3.8)
(integral na anyo) (3.8)
saan C p- ang pagkakaiba sa pagitan ng isobaric heat capacities ng mga produkto ng reaksyon at panimulang materyales. Kung ang pagkakaiba T 2 - T 1 ay maliit, pagkatapos ay maaari mong tanggapin C p= const. Sa malaking pagkakaiba dapat gamitin ang mga temperatura pagtitiwala sa temperatura C p(T) uri:
nasaan ang mga coefficient a, b, c atbp. para sa mga indibidwal na sangkap sila ay kinuha mula sa reference na libro, at ang sign ay nagpapahiwatig ng pagkakaiba sa pagitan ng mga produkto at reagents (isinasaalang-alang ang mga coefficient).
MGA HALIMBAWA
Halimbawa 3-1. Ang mga karaniwang enthalpies ng pagbuo ng likido at gas na tubig sa 298 K ay -285.8 at -241.8 kJ/mol, ayon sa pagkakabanggit. Kalkulahin ang enthalpy ng vaporization ng tubig sa temperaturang ito.
Solusyon. Ang mga enthalpies ng pagbuo ay tumutugma sa mga sumusunod na reaksyon:
H 2 (g) + SO 2 (g) = H 2 O (l), H 1 0 = -285.8;
H 2 (g) + SO 2 (g) = H 2 O (g), H 2 0 = -241.8.
Ang pangalawang reaksyon ay maaaring isagawa sa dalawang yugto: una, magsunog ng hydrogen upang bumuo ng likidong tubig ayon sa unang reaksyon, at pagkatapos ay sumingaw ang tubig:
H 2 O (l) = H 2 O (g), H 0 isp = ?
Pagkatapos, ayon sa batas ni Hess,
H 1 0 + H 0 isp = H 2 0 ,
saan H 0 isp = -241.8 - (-285.8) = 44.0 kJ/mol.
Sagot. 44.0 kJ/mol.
Halimbawa 3-2. Kalkulahin ang enthalpy ng reaksyon
6C (g) + 6H (g) = C 6 H 6 (g)
a) sa pamamagitan ng mga enthalpies ng pagbuo; b) sa pamamagitan ng mga nagbubuklod na enerhiya, sa ilalim ng pagpapalagay na ang mga dobleng bono sa molekula ng C 6 H 6 ay naayos.
Solusyon. a) Ang mga enthalpies ng pagbuo (sa kJ/mol) ay matatagpuan sa sangguniang aklat (halimbawa, P.W. Atkins, Physical Chemistry, 5th edition, pp. C9-C15): fH 0 (C 6 H 6 (g)) = 82.93, fH 0 (C (g)) = 716.68, fH 0 (H (g)) = 217.97. Ang enthalpy ng reaksyon ay:
r H 0 = 82.93 - 6,716.68 - 6,217.97 = -5525 kJ/mol.
b) Sa ganitong reaksyon mga bono ng kemikal huwag masira, ngunit bumuo lamang. Sa pagtatantya ng mga nakapirming dobleng bono, ang C 6 H 6 na molekula ay naglalaman ng 6 C-H bond, 3 C-C bond at 3 C=C bond. Bond energies (sa kJ/mol) (P.W.Atkins, Physical Chemistry, 5th edition, p. C7): E(C-H) = 412, E(C-C) = 348, E(C=C) = 612. Ang enthalpy ng reaksyon ay:
r H 0 = -(6,412 + 3,348 + 3,612) = -5352 kJ/mol.
Ang pagkakaiba sa eksaktong resulta -5525 kJ/mol ay dahil sa ang katunayan na sa molekula ng benzene ay walang solong C-C bond at dobleng C=C bond, ngunit mayroong 6 na aromatic C C bond.
Sagot. a) -5525 kJ/mol; b) -5352 kJ/mol.
Halimbawa 3-3. Gamit ang reference data, kalkulahin ang enthalpy ng reaksyon
3Cu (tv) + 8HNO 3(aq) = 3Cu(NO 3) 2(aq) + 2NO (g) + 4H 2 O (l)
Solusyon. Ang pinaikling ionic equation para sa reaksyon ay:
3Cu (s) + 8H + (aq) + 2NO 3 - (aq) = 3Cu 2+ (aq) + 2NO (g) + 4H 2 O (l).
Ayon sa batas ni Hess, ang enthalpy ng reaksyon ay katumbas ng:
r H 0 = 4fH 0 (H 2 O (l)) + 2 fH 0 (HINDI (g)) + 3 fH 0 (Cu 2+ (aq)) - 2 fH 0 (HINDI 3 - (aq))
(ang mga enthalpies ng pagbuo ng tanso at ang H + ion ay pantay, ayon sa kahulugan, 0). Ang pagpapalit sa mga halaga ng enthalpies of formation (P.W.Atkins, Physical Chemistry, 5th edition, pp. C9-C15), nakita namin:
r H 0 = 4 (-285.8) + 2 90.25 + 3 64.77 - 2 (-205.0) = -358.4 kJ
(batay sa tatlong moles ng tanso).
Sagot. -358.4 kJ.
Halimbawa 3-4. Kalkulahin ang enthalpy ng pagkasunog ng methane sa 1000 K, kung ang enthalpy ng pagbuo sa 298 K ay ibinigay: fH 0 (CH 4) = -17.9 kcal/mol, fH 0 (CO 2) = -94.1 kcal/mol, fH 0 (H 2 O (g)) = -57.8 kcal/mol. Ang mga kapasidad ng init ng mga gas (sa cal/(mol. K)) sa hanay mula 298 hanggang 1000 K ay katumbas ng:
C p (CH 4) = 3.422 + 0.0178. T, C p(O2) = 6.095 + 0.0033. T,
C p (CO 2) = 6.396 + 0.0102. T, C p(H 2 O (g)) = 7.188 + 0.0024. T.
Solusyon. Enthalpy ng methane combustion reaction
CH 4 (g) + 2O 2 (g) = CO 2 (g) + 2H 2 O (g)
sa 298 K ay katumbas ng:
94.1 + 2 (-57.8) - (-17.9) = -191.8 kcal/mol.
Hanapin natin ang pagkakaiba sa mga kapasidad ng init bilang isang function ng temperatura:
C p = C p(CO2) + 2 C p(H 2 O (g)) - C p(CH 4) - 2 C p(O2) =
= 5.16 - 0.0094T(cal/(mol K)).
Ang enthalpy ng reaksyon sa 1000 K ay kinakalkula gamit ang Kirchhoff equation:
= +  = -191800 + 5.16
= -191800 + 5.16
(1000-298) - 0.0094 (1000 2 -298 2)/2 = -192500 cal/mol.
Sagot. -192.5 kcal/mol.
MGA GAWAIN
3-1. Gaano karaming init ang kinakailangan upang ilipat ang 500 g ng Al (mp 658 o C, H 0 pl = 92.4 cal/g), kinuha sa temperatura ng silid, sa isang tunaw na estado, kung C p(Al TV) = 0.183 + 1.096 10 -4 T cal/(g K)?
3-2. Ang karaniwang enthalpy ng reaksyon na CaCO 3 (s) = CaO (s) + CO 2 (g) na nagaganap sa isang bukas na sisidlan sa temperatura na 1000 K ay 169 kJ/mol. Ano ang init ng reaksyong ito, na nagaganap sa parehong temperatura, ngunit sa isang saradong sisidlan?
3-3. Kalkulahin ang karaniwang panloob na enerhiya ng pagbuo ng likidong benzene sa 298 K kung ang karaniwang enthalpy ng pagbuo nito ay 49.0 kJ/mol.
3-4. Kalkulahin ang enthalpy ng pagbuo ng N 2 O 5 (g) sa T= 298 K batay sa sumusunod na data:
2NO(g) + O 2 (g) = 2NO 2 (g), H 1 0 = -114.2 kJ/mol,
4NO 2 (g) + O 2 (g) = 2N 2 O 5 (g), H 2 0 = -110.2 kJ/mol,
N 2 (g) + O 2 (g) = 2NO (g), H 3 0 = 182.6 kJ/mol.
3-5. Ang enthalpies ng combustion ng -glucose, -fructose at sucrose sa 25 o C ay katumbas ng -2802,
-2810 at -5644 kJ/mol, ayon sa pagkakabanggit. Kalkulahin ang init ng hydrolysis ng sucrose.
3-6. Tukuyin ang enthalpy ng pagbuo ng diborane B 2 H 6 (g) sa T= 298 K mula sa sumusunod na data:
B 2 H 6 (g) + 3O 2 (g) = B 2 O 3 (tv) + 3H 2 O (g), H 1 0 = -2035.6 kJ/mol,
2B(tv) + 3/2 O 2 (g) = B 2 O 3 (tv), H 2 0 = -1273.5 kJ/mol,
H 2 (g) + 1/2 O 2 (g) = H 2 O (g), H 3 0 = -241.8 kJ/mol.
3-7. Kalkulahin ang init ng pagbuo ng zinc sulfate mula sa mga simpleng sangkap sa T= 298 K batay sa sumusunod na data.
Ang anumang kemikal na reaksyon ay sinamahan ng paglabas o pagsipsip ng enerhiya sa anyo ng init.
Batay sa pagpapalabas o pagsipsip ng init, nakikilala nila exothermic At endothermic mga reaksyon.
Exothermic Ang mga reaksyon ay mga reaksyon kung saan ang init ay inilabas (+Q).
Ang mga endothermic na reaksyon ay mga reaksyon kung saan ang init ay sinisipsip (-Q).
Thermal na epekto ng reaksyon (Q) ay ang dami ng init na inilalabas o hinihigop sa panahon ng pakikipag-ugnayan ng isang tiyak na halaga ng mga unang reagents.
Ang thermochemical equation ay isang equation na tumutukoy sa thermal effect ng isang chemical reaction. Kaya, halimbawa, ang mga thermochemical equation ay:
Dapat ding tandaan na ang mga thermochemical equation ay kinakailangang may kasamang impormasyon tungkol sa estado ng pagsasama-sama reagents at produkto, dahil ang halaga ng thermal effect ay nakasalalay dito.
Mga pagkalkula ng thermal effect ng reaksyon
Halimbawa tipikal na gawain upang mahanap ang thermal effect ng reaksyon:
Kapag ang 45 g ng glucose ay tumutugon sa labis na oxygen ayon sa equation
C 6 H 12 O 6 (solid) + 6O 2 (g) = 6CO 2 (g) + 6H 2 O (g) + Q
700 kJ ng init ang pinakawalan. Tukuyin ang thermal effect ng reaksyon. (Isulat ang numero sa pinakamalapit na buong numero.)
Solusyon:
Kalkulahin natin ang dami ng glucose:
n(C 6 H 12 O 6) = m(C 6 H 12 O 6) / M(C 6 H 12 O 6) = 45 g / 180 g/mol = 0.25 mol
Yung. Kapag ang 0.25 mol ng glucose ay nakikipag-ugnayan sa oxygen, 700 kJ ng init ang inilalabas. Mula sa thermochemical equation na ipinakita sa kondisyon, sumusunod na ang pakikipag-ugnayan ng 1 mole ng glucose na may oxygen ay gumagawa ng isang halaga ng init na katumbas ng Q (thermal effect ng reaksyon). Kung gayon ang sumusunod na proporsyon ay tama:
0.25 mol glucose - 700 kJ
1 mole ng glucose - Q
Mula sa proporsyon na ito ang kaukulang equation ay sumusunod:
0.25 / 1 = 700 / Q
Ang paglutas ng kung alin, nakita namin na:
Kaya, ang thermal effect ng reaksyon ay 2800 kJ.
Mga kalkulasyon gamit ang mga thermochemical equation
Mas madalas sa Mga takdang-aralin sa Pinag-isang State Exam sa thermochemistry, alam na ang halaga ng thermal effect, dahil ang kondisyon ay nagbibigay ng kumpletong thermochemical equation.
Sa kasong ito, kinakailangang kalkulahin ang alinman sa dami ng init na inilabas/nasipsip sa isang kilalang halaga ng reagent o produkto, o, sa kabaligtaran, sa pamamagitan ng kilalang halaga init, kinakailangan upang matukoy ang masa, dami o dami ng isang sangkap ng sinumang kalahok sa reaksyon.
Halimbawa 1
Ayon sa thermochemical reaction equation
3Fe 3 O 4 (tv.) + 8Al (tv.) = 9Fe (tv.) + 4Al 2 O 3 (tv.) + 3330 kJ
68 g ng aluminum oxide ay nabuo. Gaano karaming init ang inilabas? (Isulat ang numero sa pinakamalapit na buong numero.)
Solusyon
Kalkulahin natin ang dami ng aluminum oxide substance:
n(Al 2 O 3) = m(Al 2 O 3) / M(Al 2 O 3) = 68 g / 102 g/mol = 0.667 mol
Alinsunod sa thermochemical equation ng reaksyon, kapag nabuo ang 4 na moles ng aluminum oxide, 3330 kJ ang pinakawalan. Sa aming kaso, nabuo ang 0.6667 mol ng aluminum oxide. Ang pagkakaroon ng tinukoy na dami ng init na inilabas sa kasong ito ng x kJ, nilikha namin ang proporsyon:
4 mol Al 2 O 3 - 3330 kJ
0.667 mol Al 2 O 3 - x kJ
Ang proporsyon na ito ay tumutugma sa equation:
4 / 0.6667 = 3330 / x
Paglutas ng alin, nakita namin na x = 555 kJ
Yung. kapag ang 68 g ng aluminum oxide ay nabuo alinsunod sa thermochemical equation sa kondisyon, 555 kJ ng init ay inilabas.
Halimbawa 2
Bilang resulta ng isang reaksyon, ang thermochemical equation kung saan
4FeS 2 (tv.) + 11O 2 (g) = 8SO 2 (g) + 2Fe 2 O 3 (tv.) + 3310 kJ
1655 kJ ng init ang pinakawalan. Tukuyin ang volume (l) ng sulfur dioxide na inilabas (no.). (Isulat ang numero sa pinakamalapit na buong numero.)
Solusyon
Alinsunod sa thermochemical equation ng reaksyon, kapag nabuo ang 8 moles ng SO 2, 3310 kJ ng init ang pinakawalan. Sa aming kaso, 1655 kJ ng init ang pinakawalan. Hayaang ang dami ng SO 2 na nabuo sa kasong ito ay x mol. Kung gayon ang sumusunod na proporsyon ay patas:
8 mol SO 2 - 3310 kJ
x mol SO 2 - 1655 kJ
Mula sa kung saan ang equation ay sumusunod:
8 / x = 3310 / 1655
Ang paglutas ng kung alin, nakita namin na:
Kaya, ang halaga ng SO 2 substance na nabuo sa kasong ito ay 4 mol. Samakatuwid, ang dami nito ay katumbas ng:
V(SO 2) = V m ∙ n(SO 2) = 22.4 l/mol ∙ 4 mol = 89.6 l ≈ 90 l(bilugan sa buong numero, dahil ito ay kinakailangan sa kondisyon.)
Ang higit pang nasuri na mga problema sa thermal effect ng isang kemikal na reaksyon ay matatagpuan.
Ang lahat ng mga pamamaraan para sa pagkalkula ng mga thermal effect ay batay sa Kirchhoff equation sa integral form.
Kadalasan, ang karaniwang 298.15K ay ginagamit bilang unang temperatura.
Ang lahat ng mga pamamaraan para sa pagkalkula ng mga thermal effect ay bumaba sa mga paraan ng pagkuha ng integral ng kanang bahagi ng equation.
Mga pamamaraan para sa pagkuha ng integral:
I. Batay sa average na kapasidad ng init. Ang pamamaraang ito ay ang pinakasimple at hindi gaanong tumpak. Sa kasong ito, ang expression sa ilalim ng integral sign ay pinapalitan ng pagbabago average na kapasidad ng init, na hindi nakadepende sa temperatura sa napiling hanay.
Ang mga average na kapasidad ng init ay itinatala at sinusukat para sa karamihan ng mga reaksyon. Madali silang kalkulahin gamit ang reference data.
II. Ayon sa True Heat Capacities. (Gumagamit ng serye ng temperatura)
Sa pamamaraang ito, ang integrand ng kapasidad ng init ay nakasulat bilang isang serye ng temperatura:

III. Ayon sa mataas na temperatura na mga bahagi ng enthalpy. Natanggap ang pamamaraang ito laganap sa pag-unlad ng teknolohiya ng rocket sa pagkalkula ng mga thermal effect ng mga reaksiyong kemikal sa panahon ng mataas na temperatura. Ito ay batay sa kahulugan ng isobaric heat capacity:

Mataas na temperatura na bahagi ng enthalpy. Ipinapakita nito kung gaano magbabago ang enthalpy ng isang indibidwal na substance kapag pinainit ito ng isang tiyak na bilang ng mga degree.
Para sa isang kemikal na reaksyon sumulat kami:

kaya:
Lektura Blg. 3.
Balangkas ng lecture:
1. II batas ng thermodynamics, kahulugan, mathematical notation.
2. Pagsusuri ng II batas ng thermodynamics
3. Pagkalkula ng mga pagbabago sa entropy sa ilang mga proseso
Ang init ng reaksyon (ang thermal effect ng isang reaksyon) ay ang dami ng init na Q na inilabas o nasipsip Kung ang init ay inilabas sa panahon ng isang reaksyon, ang reaksyon ay tinatawag na exothermic kung ang init ay nasisipsip, ang reaksyon ay tinatawag na endothermic.
Ang init ng reaksyon ay tinutukoy batay sa unang batas (batas) ng thermodynamics, ang mathematical expression kung saan sa pinakasimpleng anyo nito para sa mga kemikal na reaksyon ay ang equation:
Q = ΔU + рΔV (2.1)
kung saan ang Q ay ang init ng reaksyon, ΔU ay ang pagbabago sa panloob na enerhiya, p ay ang presyon, ΔV ay ang pagbabago sa volume.
Ang pagkalkula ng thermochemical ay binubuo ng pagtukoy sa thermal effect ng reaksyon. Ayon sa equation (2.1) numerical value Ang init ng reaksyon ay depende sa paraan ng pagpapatupad nito. SA proseso ng isochoric, isinasagawa sa V=const, init ng reaksyon Q V =Δ U, sa proseso ng isobaric sa p=const thermal effect Q P =Δ H. Kaya, ang pagkalkula ng thermochemical ay V pagtukoy sa laki ng pagbabago sa alinman sa panloob na enerhiya o enthalpy sa panahon ng isang reaksyon. Dahil ang karamihan sa mga reaksyon ay nangyayari sa ilalim ng mga kondisyon ng isobaric (halimbawa, ang lahat ng ito ay mga reaksyon sa bukas na mga sisidlan na nangyayari sa presyon ng atmospera), kapag gumagawa ng mga kalkulasyon ng thermochemical, ang pagkalkula ng ΔH ay halos palaging isinasagawa . KungΔ N<0, то реакция экзотермическая, если же Δ H>0, kung gayon ang reaksyon ay endothermic.
Ang mga kalkulasyon ng thermochemical ay ginawa gamit ang alinman sa batas ni Hess, ayon sa kung saan ang thermal effect ng isang proseso ay hindi nakasalalay sa landas nito, ngunit natutukoy lamang ng kalikasan at estado ng mga panimulang sangkap at produkto ng proseso, o, kadalasan, isang corollary mula sa batas ni Hess: ang thermal effect ng isang reaksyon ay katumbas ng kabuuan ng heats (enthalpies ) na pagbuo ng mga produkto minus ang kabuuan ng heats (enthalpies) ng pagbuo ng mga reactant.
Sa mga kalkulasyon ayon sa batas ni Hess, ginagamit ang mga equation ng mga auxiliary na reaksyon na alam ang thermal effect. Ang kakanyahan ng mga operasyon sa mga kalkulasyon ayon sa batas ni Hess ay ang mga algebraic na operasyon ay ginagawa sa mga equation ng mga auxiliary na reaksyon na humahantong sa isang equation ng reaksyon na may hindi kilalang thermal effect.
Halimbawa 2.1. Pagpapasiya ng init ng reaksyon: 2СО + O 2 = 2СО 2 ΔН - ?
Ginagamit namin ang mga sumusunod na reaksyon bilang pantulong: 1) C + O 2 = C0 2;Δ H 1 = -393.51 kJ at 2) 2C + O 2 = 2CO;Δ H 2 = -220.1 kJ, kung saanΔ N/aΔ H 2 - thermal effect ng auxiliary reactions. Gamit ang mga equation ng mga reaksyong ito, posibleng makuha ang equation ng isang ibinigay na reaksyon kung ang auxiliary equation 1) ay i-multiply sa dalawa at ang equation 2) ay ibabawas mula sa resultang nakuha. Samakatuwid, ang hindi kilalang init ng isang ibinigay na reaksyon ay katumbas ng:
Δ H = 2Δ H 1 -Δ H 2 = 2(-393.51) - (-220.1) = -566.92 kJ.
Kung ang isang corollary mula sa batas ni Hess ay ginamit sa isang thermochemical na pagkalkula, kung gayon para sa reaksyon na ipinahayag ng equation na aA+bB=cC+dD, ang sumusunod na kaugnayan ay ginagamit:
ΔH = (cΔNobr,s + dΔHobr D) - (aΔNobr A + bΔH rev,c) (2.2)
kung saan ang ΔН ay ang init ng reaksyon; ΔН o br - init (enthalpy) ng pagbuo, ayon sa pagkakabanggit, ng mga produkto ng reaksyon C at D at reagents A at B; c, d, a, b - stoichiometric coefficients.
Ang init (enthalpy) ng pagbuo ng isang compound ay ang thermal effect ng reaksyon kung saan ang 1 mole ng compound na ito ay nabuo mula sa mga simpleng sangkap na nasa thermodynamically stable na mga phase at mga pagbabago 1 *. Halimbawa , ang init ng pagbuo ng tubig sa estado ng singaw ay katumbas ng kalahati ng init ng reaksyon, na ipinahayag ng equation: 2H 2 (g)+ O 2 (g)= 2H 2 O(g).Ang sukat ng init ng pagbuo ay kJ / mol.
Sa mga kalkulasyon ng thermochemical, ang mga init ng mga reaksyon ay karaniwang tinutukoy para sa mga karaniwang kondisyon, kung saan ang formula (2.2) ay kumukuha ng anyo:
ΔН°298 = (сΔН° 298, arr. C + dΔH° 298, o 6 p , D) - (аΔН° 298, arr. A + bΔН° 298, arr. c)(2.3)
kung saan ang ΔН° 298 ay ang karaniwang init ng reaksyon sa kJ (ang karaniwang halaga ay ipinahiwatig ng superscript "0") sa temperatura na 298K, at ΔН° 298,obR ay ang mga karaniwang heat (enthalpies) ng pagbuo din sa isang temperatura ng 298K. ΔН° values 298 .obR.ay tinukoy para sa lahat ng mga koneksyon at mga tabular na data. 2 * - tingnan ang talahanayan ng apendiks.
Halimbawa 2.2. Pagkalkula karaniwang init r e pagbabahagi na ipinahayag ng equation:
4NH 3 (r) + 5O 2 (g) = 4NO (g) + 6H 2 O (g).
Ayon sa corollary ng batas ni Hess, isinusulat namin ang 3*:
Δ N 0 298 = (4Δ N 0 298. o b p . Hindi +6ΔH 0 298. dr.H20) - 4ΔH 0 298 arr. NH z. Pagpapalit mga halaga ng talahanayan karaniwang init ng pagbuo ng mga compound na ipinakita sa equation, nakukuha namin:Δ N °298= (4(90.37) + 6(-241.84)) - 4(-46.19) = - 904.8 kJ.
Ang isang negatibong palatandaan para sa init ng reaksyon ay nagpapahiwatig na ang proseso ay exothermic.
Sa thermochemistry, ang mga thermal effect ay karaniwang ipinahiwatig sa mga equation ng reaksyon. ganyan Ang mga equation na may itinalagang thermal effect ay tinatawag na thermochemical. Halimbawa, ang thermochemical equation ng reaksyon na isinasaalang-alang sa halimbawa 2.2 ay nakasulat:
4NH 3 (g) + 50 2 (g) = 4NO (g) + 6H 2 0 (g);Δ Н° 29 8 = - 904.8 kJ.
Kung ang mga kondisyon ay naiiba mula sa mga karaniwang, sa mga praktikal na kalkulasyon ng thermochemical pinapayagan nito Xia gamit ang zoom:Δ N ≈Δ Н° 298 (2.4) Ang ekspresyon (2.4) ay sumasalamin sa mahinang pag-asa ng init ng reaksyon sa mga kondisyon ng paglitaw nito.
7. Kalkulahin ang thermal effect ng reaksyon sa ilalim ng mga karaniwang kondisyon: Fe 2 O 3 (t) + 3 CO (g) = 2 Fe (t) + 3 CO 2 (g), kung ang init ng pagbuo: Fe 2 O 3 (t) = – 821.3 kJ/mol; ) = – 110.5 kJ/mol;
CO 2 (g) = – 393.5 kJ/mol.
Fe 2 O 3 (t) + 3 CO (g) = 2 Fe (t) + 3 CO 2 (g),
Alam ang karaniwang thermal effect ng pagkasunog ng mga panimulang materyales at mga produkto ng reaksyon, kinakalkula namin ang thermal effect ng reaksyon sa ilalim ng mga karaniwang kondisyon:
16. Pagdepende sa bilis ng isang kemikal na reaksyon sa temperatura. Ang panuntunan ni Van't Hoff. Temperatura koepisyent ng reaksyon.
Ang mga reaksyon ay nagreresulta lamang mula sa mga banggaan sa pagitan ng mga aktibong molekula na ang average na enerhiya ay lumampas sa average na enerhiya ng mga kalahok sa reaksyon.
Kapag ang mga molekula ay binigyan ng ilang activation energy E (labis na enerhiya sa itaas ng average) ay bumababa potensyal na enerhiya Ang mga pakikipag-ugnayan ng mga atomo sa mga molekula, ang mga bono sa loob ng mga molekula ay humihina, ang mga molekula ay nagiging reaktibo.
Ang activation energy ay hindi kinakailangang ibinibigay mula sa labas; Ayon kay Boltzmann, kabilang sa mga N molecule ay mayroong susunod na numero aktibong molekula N pagkakaroon ng tumaas na enerhiya :
N N·e – E / RT (1)
kung saan ang E ay ang activation energy, na nagpapakita ng kinakailangang labis na enerhiya, kumpara sa average na antas, na dapat taglayin ng mga molekula upang maging posible ang reaksyon; ang natitirang mga pagtatalaga ay kilala.
Sa thermal activation para sa dalawang temperatura T 1 at T 2, ang ratio ng mga rate constant ay magiging:
 , (2)
, (2)
 , (3)
, (3)
na ginagawang posible upang matukoy ang activation energy sa pamamagitan ng pagsukat ng reaction rate sa dalawa iba't ibang temperatura T 1 at T 2.
Ang pagtaas ng temperatura ng 10 0 ay nagpapataas ng rate ng reaksyon ng 2–4 na beses (tinatayang panuntunan ng Van't Hoff). Ang bilang na nagpapakita kung gaano karaming beses tumataas ang rate ng reaksyon (at samakatuwid ang rate constant) kapag tumaas ang temperatura ng 10 0 ay tinatawag na temperature coefficient ng reaksyon:
 (4)
(4)
 .(5)
.(5)
Nangangahulugan ito, halimbawa, na kapag ang temperatura ay tumaas ng 100 0 para sa isang karaniwang tinatanggap na pagtaas average na bilis ng 2 beses ( = 2) ang rate ng reaksyon ay tumataas ng 2 10, i.e. humigit-kumulang 1000 beses, at kapag = 4 – 4 10, i.e. 1000000 beses. Ang panuntunan ni Van't Hoff ay naaangkop para sa mga reaksyong nagaganap sa medyo mababang temperatura sa isang makitid na hanay ng temperatura. Ang matalim na pagtaas sa rate ng reaksyon sa pagtaas ng temperatura ay ipinaliwanag sa pamamagitan ng katotohanan na ang bilang ng mga aktibong molekula ay tumataas nang exponentially.
25. Van't Hoff chemical reaction isotherm equation.
Alinsunod sa batas ng mass action para sa isang arbitrary na reaksyon
at A + bB = cC + dD
Ang rate equation para sa pasulong na reaksyon ay maaaring isulat:
at para sa rate ng reverse reaction:
Habang ang reaksyon ay nagpapatuloy mula kaliwa hanggang kanan, ang mga konsentrasyon ng mga sangkap A at B ay bababa at ang rate ng pasulong na reaksyon ay bababa. Sa kabilang banda, habang nag-iipon ang mga produkto ng reaksyon na C at D, tataas ang rate ng reaksyon mula kanan papuntang kaliwa. Dumating ang isang sandali kapag ang bilis υ 1 at υ 2 ay naging pareho, ang mga konsentrasyon ng lahat ng mga sangkap ay nananatiling hindi nagbabago, samakatuwid,
,Kung saanK c = k 1 / k 2 =
Ang pare-parehong halaga Kc, katumbas ng ratio ng mga constant ng rate ng pasulong at baligtad na mga reaksyon, ay quantitatively na naglalarawan ng estado ng equilibrium sa pamamagitan ng mga konsentrasyon ng equilibrium ng mga panimulang sangkap at ang mga produkto ng kanilang pakikipag-ugnayan (sa lawak ng kanilang stoichiometric coefficients) at ay tinatawag na equilibrium constant. Ang equilibrium constant ay pare-pareho lamang para sa isang naibigay na temperatura, i.e.
K c = f (T). Ang equilibrium constant ng isang kemikal na reaksyon ay karaniwang ipinahayag bilang isang ratio, ang numerator nito ay ang produkto ng equilibrium molar na mga konsentrasyon ng mga produkto ng reaksyon, at ang denominator ay ang produkto ng mga konsentrasyon ng mga panimulang sangkap.
Kung ang mga sangkap ng reaksyon ay isang halo ng mga ideal na gas, kung gayon ang equilibrium constant (Kp) ay ipinahayag sa mga tuntunin ng bahagyang presyon ng mga sangkap:
Upang lumipat mula K p hanggang K c, ginagamit namin ang equation ng estado P · V = n · R · T. Since
, pagkatapos ay P = C·R·T. .Mula sa equation ay sumusunod na K p = K c ibinigay na ang reaksyon ay nagpapatuloy nang hindi binabago ang bilang ng mga moles sa gas phase, i.e. kapag (c + d) = (a + b).
Kung ang reaksyon ay kusang nagpapatuloy sa pare-parehong P at T o V at T, kung gayon ang mga halaga ng G at F ng reaksyong ito ay maaaring makuha mula sa mga equation:
 ,
,
kung saan ang С А, С В, С С, С D ay mga nonequilibrium na konsentrasyon ng mga panimulang sangkap at mga produkto ng reaksyon.
,kung saan ang Р А, Р В, Р С, Р D ay ang mga partial pressure ng mga panimulang sangkap at mga produkto ng reaksyon.
Ang huling dalawang equation ay tinatawag na van't Hoff isotherm equation para sa isang kemikal na reaksyon. Ginagawang posible ng relasyong ito na kalkulahin ang mga halaga ng G at F ng reaksyon at matukoy ang direksyon nito sa iba't ibang konsentrasyon ng mga panimulang sangkap.
Dapat pansinin na para sa mga sistema ng gas, at para sa mga solusyon, na may partisipasyon sa reaksyon mga solido(i.e. para sa mga heterogenous system) ang konsentrasyon ng solid phase ay hindi kasama sa expression para sa equilibrium constant, dahil ang konsentrasyon na ito ay halos pare-pareho. Oo, para sa reaksyon
2 CO (g) = CO 2 (g) + C (t)
ang equilibrium constant ay nakasulat bilang
.Ang dependence ng equilibrium constant sa temperatura (para sa temperatura T 2 na may kaugnayan sa temperatura T 1) ay ipinahayag ng sumusunod na van't Hoff equation:
 ,
,
kung saan ang Н 0 ay ang thermal effect ng reaksyon.
Para sa isang endothermic na reaksyon (ang reaksyon ay nangyayari sa pagsipsip ng init), ang ekwilibriyong pare-pareho ay tumataas sa pagtaas ng temperatura, ang sistema ay tila lumalaban sa pag-init.
34. Osmosis, osmotic pressure. Van't Hoff equation at osmotic coefficient.
Ang Osmosis ay ang kusang paggalaw ng mga solvent na molekula sa pamamagitan ng isang semi-permeable na lamad na naghihiwalay sa mga solusyon ng iba't ibang konsentrasyon, mula sa isang solusyon ng mas mababang konsentrasyon hanggang sa isang solusyon ng mas mataas na konsentrasyon, na humahantong sa pagbabanto ng huli. Ang isang cellophane film ay kadalasang ginagamit bilang isang semi-permeable na lamad, sa pamamagitan ng maliliit na butas kung saan ang maliliit na dami lamang na mga solvent na molekula ang maaaring piliing dumaan at ang mga malalaki o natutunaw na molekula o ion ay pinananatili - para sa mga high-molecular substance, at isang tansong ferrocyanide film. para sa mga low-molecular substance. Ang proseso ng paglilipat ng solvent (osmosis) ay mapipigilan kung ang panlabas na hydrostatic pressure ay inilapat sa isang solusyon na may mas mataas na konsentrasyon (sa ilalim ng mga kondisyon ng equilibrium ito ang tinatawag na osmotic pressure, na tinutukoy ng titik ). Upang kalkulahin ang halaga ng sa mga solusyon ng mga non-electrolytes, ang empirical na Van't Hoff equation ay ginagamit:
kung saan ang C ay ang molal na konsentrasyon ng sangkap, mol/kg;
R – pangkalahatang gas constant, J/mol K.
Ang magnitude ng osmotic pressure ay proporsyonal sa bilang ng mga molekula (sa pangkalahatan, ang bilang ng mga particle) ng isa o higit pang mga sangkap na natunaw sa isang naibigay na dami ng solusyon, at hindi nakasalalay sa kanilang kalikasan at likas na katangian ng solvent. Sa mga solusyon ng malakas o mahinang electrolytes, ang kabuuang bilang ng mga indibidwal na particle ay tumataas dahil sa dissociation ng mga molekula, samakatuwid, ang isang naaangkop na koepisyent ng proporsyonalidad, na tinatawag na isotonic coefficient, ay dapat ipasok sa equation para sa pagkalkula ng osmotic pressure.
i CRT,
kung saan ang i ay ang isotonic coefficient, na kinakalkula bilang ratio ng kabuuan ng mga bilang ng mga ion at mga hindi magkakahiwalay na electrolyte molecule sa unang bilang ng mga molekula ng sangkap na ito.
Kaya, kung ang antas ng dissociation ng electrolyte, i.e. ratio ng bilang ng mga molekula na nahati sa mga ion hanggang kabuuang bilang ang mga molekula ng natunaw na sangkap ay katumbas ng at ang molekula ng electrolyte ay bumagsak sa n ions, pagkatapos ay ang isotonic coefficient ay kinakalkula tulad ng sumusunod:
i = 1 + (n – 1) · ,(i > 1).
Para sa malakas na electrolytes, maaari nating kunin ang = 1, pagkatapos ay i = n, at ang koepisyent i (mas malaki rin sa 1) ay tinatawag na osmotic coefficient.
Ang kababalaghan ng osmosis ay may malaking halaga para sa mga organismo ng halaman at hayop, dahil ang mga lamad ng kanilang mga selula na may kaugnayan sa mga solusyon ng maraming mga sangkap ay may mga katangian ng isang semi-permeable na lamad. SA malinis na tubig ang cell swells malaki, sa ilang mga kaso sa punto ng pagkalagot ng lamad, at sa mga solusyon na may mataas na konsentrasyon ng asin, sa kabaligtaran, ito ay bumababa sa laki at wrinkles dahil sa malaking pagkawala ng tubig. Samakatuwid, kapag canning mga produktong pagkain idinagdag sa kanila malaking bilang asin o asukal. Ang mga microbial cell sa ilalim ng ganitong mga kondisyon ay nawawalan ng malaking halaga ng tubig at namamatay.