Pagpapabuti ng pamamahala ng pagbabago. Ang mga makabagong teknolohiya bilang isang bagay para sa pagpapabuti ng pamamahala ng negosyo gamit ang halimbawa ng SMZ. · kultura ng organisasyon ng kumpanya, pati na rin ang interpersonal na relasyon sa pagitan ng mga empleyado, administrasyon at
Basahin din
>> Chemistry: Produksyon ng mga halogens. Biological na kahalagahan at ang paggamit ng mga halogens at ang kanilang mga compound
Produksyon ng mga halogens . Ang fluorine at chlorine ay nakukuha sa pamamagitan ng electrolysis ng mga natutunaw o mga solusyon ng kanilang mga asin. Halimbawa, ang proseso ng electric | Ang trolysis ng molten sodium chloride ay maipapakita ng equation:
Ngunit kung ang hydrogen ay maaaring makuha sa iba, mas maginhawa at mas murang mga paraan, halimbawa mula sa natural na gas, pagkatapos ay ang sodium hydroxide ay nakukuha halos eksklusibo sa pamamagitan ng electrolysis ng isang solusyon ng table salt, tulad ng chlorine.
Ang bromine at yodo ay ginawa sa industriya sa pamamagitan ng reaksyon ng kanilang displacement mula sa bromides at iodide, ayon sa pagkakabanggit.
Biological na kahalagahan ng mga halogens. Ang kanilang aplikasyon. Hindi mo maiwasang mapansin na ang mga label ng maraming tatak ng toothpastes ay nagpapahiwatig ng nilalaman ng fluoride sa mga ito - siyempre, hindi libreng fluoride, ngunit ang mga compound nito. Salamat sa mahalagang sangkap na ito, na kasangkot sa pagtatayo ng enamel at buto ng ngipin, ang mga sakit tulad ng mga karies ng ngipin ay pinipigilan. Bilang karagdagan, ang fluorine ay kinakailangang elemento sa mga metabolic na proseso sa mga glandula, kalamnan at nerve cells.
Mahalaga ang fluorine sa industriyal na produksyon, kung saan ang pangunahing mga mamimili nito ay ang nuclear industry at electrical engineering. Ang tambalang Na3AlF6 (ano ang tawag dito?) ay ginagamit sa paggawa ng aluminyo. At sa pang-araw-araw na buhay higit pa at higit pa malawak na aplikasyon nakahanap ng Teflon cookware, ang pangalan kung saan ay ibinigay ng fluorine-containing plastic - Teflon.
Chlorine- isa sa mga elemento ng kemikal, kung wala ito ay hindi maiisip ang pagkakaroon ng mga buhay na organismo. Ang pangunahing anyo nito. ang pumapasok sa katawan ay sodium chloride. Pinasisigla nito ang metabolismo, paglago ng buhok, nagbibigay sigla at lakas. Karamihan sa NaCl ay matatagpuan sa plasma ng dugo.
Ang hydrochloric acid HC1, na bahagi ng gastric juice, ay gumaganap ng isang espesyal na papel sa panunaw. Kung walang 0.2% HCl, halos humihinto ang proseso ng pagtunaw ng pagkain. At bagaman halos lahat mga produktong pagkain naglalaman ng isang tiyak na halaga ng table salt, ang isang tao ay napipilitang magdagdag ng mga 20 g ng asin sa pagkain araw-araw.
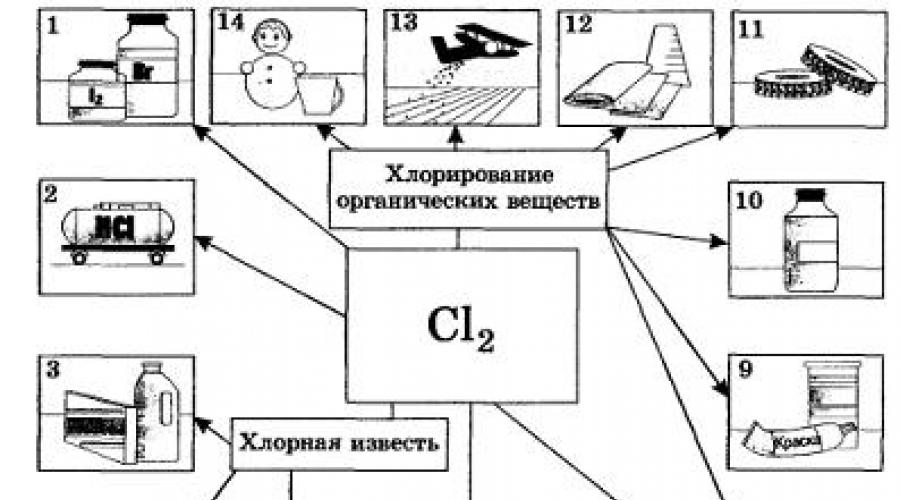
Sa sukat pang-industriya na aplikasyon Ang klorin ay higit na nakahihigit sa lahat ng mga halogen. Ang klorin at ang mga compound nito ay kinakailangan para sa pagpapaputi ng mga tela ng lino at koton, papel, atbp. Lalo na marami sa mga ito ay natupok sa organic synthesis para sa produksyon ng mga plastik, goma, tina at solvents (Fig. 20).

Maraming mga compound na naglalaman ng chlorine ang ginagamit para sa pagkontrol ng peste agrikultura. SA malalaking dami ang chlorine ay ginagamit para sa pagdidisimpekta inuming tubig, gayunpaman, walang negatibong kahihinatnan (aling sangkap ang mas ligtas na gamitin para sa layuning ito?). Sa non-ferrous na metalurhiya, ang ilang mga metal (titanium, niobium, tantalum) ay nakuha mula sa ores sa pamamagitan ng chlorination. Natagpuan din ang klorin na ginagamit para sa mga layuning militar bilang ahente ng pakikipagdigma sa kemikal. Nang maglaon ay pinalitan ito ng iba, mas mabisang chlorine-containing toxic substances, tulad ng phosgene COCl2.
Ang klorin ay nakapaloob sa isang sangkap na lubhang mapanganib sa buhay at kalusugan - dioxin. Ang mga chlorine compound ay isa sa mga dahilan ng pagkasira ng ozone layer ng Earth.
Ang isa pang halogen, bromine, ay napakahalaga din para sa katawan ng tao. Ang mga compound ng elementong ito ay kinokontrol ang mga proseso ng paggulo at pagsugpo ng gitnang sistema ng nerbiyos Samakatuwid, para sa paggamot ng mga sakit sa nerbiyos (insomnia, hysteria, neurasthenia, atbp.), Inireseta ng mga doktor ang "bromine" - mga gamot na naglalaman ng bromine.
Ang bromine ay aktibong naipon ng ilang halaman, kabilang ang seaweed. Nasa dagat ang karamihan sa bromine sa ating planeta ay puro, at ang dagat ang nagsisilbing pangunahing tagapagtustos ng bromine. Tinatayang humigit-kumulang 4 na milyong tonelada ng bromine ang inilalabas sa hangin bawat taon kasama ng tubig-dagat. Malinaw na ang nilalaman nito sa hangin ng mga lugar sa baybayin ay palaging mas mataas kaysa sa mga lugar na malayo sa dagat. Ito ay isa sa mga dahilan kung bakit ang paglanghap ng hangin sa dagat ay lubhang kapaki-pakinabang.
Ang bromine, o mas tiyak, silver bromide AgBr, ay gumaganap ng parehong mahalagang papel sa photography. Ang mga kasangkot sa photography ay malamang na agad na maaalala ang mga pangalan ng mga uri ng photographic paper - "Uni-bromine", "Bromine-portrait", atbp. Ang photographic paper ay naglalaman ng isang layer ng silver bromide na inilapat dito gamit ang gelatin, na madaling nabubulok sa ilalim impluwensya ng liwanag:
2АgBr = 2Ag + Br2
At sa wakas, ang huling halogens na aming isinasaalang-alang - yodo - ay ang elemento kung wala ang isang tao ay hindi mabubuhay: ang kakulangan nito sa tubig at pagkain ay binabawasan ang produksyon ng thyroid hormone at humahantong sa endemic goiter. Ang mga nagre-regulate na epekto ng thyroid hormone ay kinabibilangan ng muscle arousal, heartbeat, appetite, digestion, brain function at human temperament. Ang yodo ay pumapasok sa katawan kasama ang pagkain: tinapay, itlog, gatas, tubig, damong-dagat at may hangin (lalo na hangin sa dagat) kapag humihinga.
Ang isang alkohol na solusyon ng yodo (5-10%), na tinatawag na iodine tincture, ay ginagamit upang gamutin ang mga sugat. Ang yodo ay kasama sa maraming gamot.
Ang mga pangunahing mamimili ng yodo ay ang mga industriya ng parmasyutiko at kemikal, pati na rin ang paggawa ng mga photosensitive na photographic na materyales.
1. Produksyon ng mga halogens sa pamamagitan ng electrolysis ng mga natutunaw at mga solusyon sa asin.
2. Biological na kahalagahan ng mga halogens.
3. Ang paggamit ng chlorine at compounds ng fluorine, chlorine at yodo.
Anong volume ng chlorine (no.) at anong mass ng sodium ang maaaring makuha sa pamamagitan ng electrolysis ng 585 g ng sodium chloride na naglalaman ng 2% impurities?
Kalkulahin kung gaano karaming gramo ng isang 40% alkali solution ang maaaring makuha mula sa sodium, ang masa na iyong natukoy sa nakaraang problema.
Ang French chemist na si Scheele ay nakakuha ng chlorine mula sa reaksyon ng manganese(IV) oxide na may hydrochloric acid. Bilang resulta ng reaksyong ito, nabuo din ang manganese(II) chloride at tubig. Sumulat ng equation para sa reaksyong ito, isaalang-alang ang mga proseso ng redox at kalkulahin ang masa ng manganese(IV) oxide at ang halaga ng hydrogen chloride na kinakailangan upang makagawa ng 100 litro ng chlorine (n.o.), kung ang ani nito ay 95% ng theoretically possible.
Maghanda ng mensahe tungkol sa positibo at negatibong kahalagahan ng mga halogens sa buhay ng tao.
Nilalaman ng aralin mga tala ng aralin frame ng suporta pamamaraan ng pagpabilis ng presentasyon ng aralin interactive na teknolohiya Magsanay mga gawain at pagsasanay mga workshop sa pagsusulit sa sarili, mga pagsasanay, mga kaso, mga pakikipagsapalaran sa mga tanong sa talakayan sa araling-bahay, mga retorika na tanong mula sa mga mag-aaral Mga Ilustrasyon audio, mga video clip at multimedia litrato, larawan, graphics, talahanayan, diagram, katatawanan, anekdota, biro, komiks, talinghaga, kasabihan, crosswords, quote Mga add-on mga abstract articles tricks para sa mga curious crib textbooks basic at karagdagang diksyunaryo ng mga terminong iba Pagpapabuti ng mga aklat-aralin at mga aralinpagwawasto ng mga pagkakamali sa aklat-aralin pag-update ng isang fragment sa isang aklat-aralin, mga elemento ng pagbabago sa aralin, pagpapalit ng hindi napapanahong kaalaman ng mga bago Para lamang sa mga guro perpektong mga aralin plano sa kalendaryo para sa isang taon mga rekomendasyong metodolohikal mga programa sa talakayan Pinagsanib na AralinDEPINISYON
Halogens– Mga elemento ng Group VIIA – fluorine (F), chlorine (Cl), bromine (Br) at iodine (I). Electronic na pagsasaayos ng panlabas na antas ng enerhiya ng mga halogens ns 2 np 5.
Dahil ang mga halogens ay kulang lamang ng isang electron bago kumpletuhin ang antas ng enerhiya, sa ORR madalas nilang ipinapakita ang mga katangian ng mga ahente ng oxidizing. Mga estado ng oksihenasyon ng mga halogens: mula sa "-1" hanggang "+7". Ang tanging elemento ng pangkat ng halogen, fluorine, ay nagpapakita lamang ng isang estado ng oksihenasyon na "-1" at ito ang pinaka-electronegative na elemento.
Paghahanda ng mga halogens at ang kanilang mga compound
Ang mga halogen ay maaaring makuha sa pamamagitan ng electrolysis ng mga solusyon o pagkatunaw ng halides:
MgCl 2 = Mg + Cl 2 (natunaw)
Kadalasan, ang mga halogens ay nakuha sa pamamagitan ng reaksyon ng oksihenasyon ng mga hydrohalic acid:
MnO 2 + 4HCl = MnCl 2 + Cl 2 +2H 2 O
K 2 Cr 2 O 7 + 14HCl = 3Cl 2 + 2KCl +2CrCl 3 +7H 2 O
2KMnO 4 +16HCl = 2MnCl 2 +5Cl 2 +8H 2 O +2KCl
Ang HF at HCl ay inihahanda sa pamamagitan ng pagtugon sa kanilang mga solidong asing-gamot na may puro sulfuric acid kapag pinainit:
CaCl 2 + H 2 SO 4 = CaSO 4 + 2HCl
Ang HBr at HI ay hindi makukuha sa ganitong paraan, dahil ang mga sangkap na ito ay malakas na mga ahente ng pagbabawas at na-oxidized ng sulfuric acid:
2KBr + 2H 2 SO 4 = K 2 SO 4 + Br 2 + 2H 2 O + SO 2
8KI + 5H 2 SO 4 = 4K 2 SO 4 +4I 2 +4H 2 O + H 2 S
Samakatuwid, ang HBr at HI ay nakuha sa pamamagitan ng hydrolysis ng kaukulang phosphorus halides:
PBr 3 + 3H 2 O = 3HBr + H 3 PO 3
Among mga compound na naglalaman ng oxygen halogens pinakamataas na halaga may mga acid na naglalaman ng oxygen at mga asin nito. Kaya, ang HClO ay isa sa mga acid na naglalaman ng oxygen ng chlorine - ang hypochlorous acid ay nakuha sa mga may tubig na solusyon ng chlorine bilang isang produkto ng hydrolysis:
Cl 2 + H 2 O ↔ HClO + HCl
Mga asin ng hypochlorous acid - ang mga hypochlorite ay nabuo kapag ang kloro ay ipinapasa sa pamamagitan ng malamig na mga solusyon sa alkali, halimbawa:
Cl 2 + 2KOH = KClO + KCl + H 2 O
Ang hypochlorous acid (HClO 3) ay nakukuha sa pamamagitan ng paggamot sa mga acid salts (chlorates) na may puro sulfuric acid:
Ba(ClO 3) 2 + H 2 SO 4 = BaSO 4 +2HClO 3
Ang mga asin ng hypochlorous acid - chlorates ay nakuha sa pamamagitan ng pagpasa ng Cl 2 sa isang mainit na solusyon sa alkali:
3Cl 2 + 6KOH = 5 KCl + KClO 3 + 3H 2 O
Ang HClO 4 ay perchloric acid, na maaaring makuha sa pamamagitan ng paggamot sa potassium perchlorate na may concentrated sulfuric acid:
2 KClO 4 + H 2 SO 4 = K 2 SO 4 +2 HClO 4
Ang mga solusyon ng hypobromous (HOBr) at hypoiodic (HOI) acid ay maaaring ihanda, tulad ng HClO, sa pamamagitan ng pagtugon sa kaukulang mga halogen sa tubig.
Br 2 + H 2 O = HBr + HOBr
I 2 + H 2 O = HI + HOI
Ang mga bromic (HBrO 3) at iodic (HIO 3) acid ay maaaring makuha sa pamamagitan ng pag-oxidize ng bromine o iodine na tubig na may chlorine:
Br 2 + 5Cl 2 + 6H 2 O = 2HBrO 3 + 10 HCl
Biological na kahalagahan ng mga halogens at ang kanilang mga compound
Chlorine - isa mahahalagang elemento na bahagi ng mga buhay na organismo. Ang katawan ay naglalaman nito sa anyo ng asin - sodium chloride. Ang klorin ay nagpapasigla sa metabolismo, paglago ng buhok, nagbibigay ng sigla at lakas. Karamihan sa NaCl ay matatagpuan sa plasma ng dugo.
Ang HCl, na bahagi ng gastric juice, ay kumokontrol sa mga proseso ng panunaw. Sa kawalan ng 0.2% HCl, halos humihinto ang proseso ng pagtunaw ng pagkain.
Ang algae, pati na rin ang ilang iba pang mga halaman, ay aktibong nag-iipon ng bromine. tubig dagat naglalaman ng pinakamaraming malaking bilang bromine, na may kakayahang dumaan sa hangin, samakatuwid ang nilalaman nito sa hangin ng mga lugar sa baybayin ay palaging mas mataas kaysa sa mga lugar na malayo sa dagat.
Ang yodo, tulad ng chlorine, ay isa sa pinakamahalagang elemento na bumubuo sa mga buhay na organismo. Ang kakulangan ng iodine sa tubig at pagkain ay nakakabawas sa produksyon ng thyroid hormone at humahantong sa endemic goiter. Ang yodo ay pumapasok sa katawan na may kasamang pagkain: tinapay, itlog, gatas, tubig, damong-dagat at may hangin (lalo na ang hangin sa dagat) kapag humihinga.
Application ng mga halogens at ang kanilang mga compound
Ang mga halogens ay malawakang ginagamit sa industriya. Kaya, ang fluorine ay ginagamit upang makagawa ng mga pampadulas na makatiis mataas na temperatura, Teflon, freon, atbp. Ang klorin ay ginagamit sa paggawa hydrochloric acid, bleach, hypochlorites at chlorates, para sa pagpapaputi ng mga tela at cellulose na ginagamit para sa paggawa ng papel, para sa pag-sterilize ng inuming tubig at pagdidisimpekta basurang tubig atbp.
Ang bromine ay kinakailangan para sa paggawa ng iba't ibang sangkap na panggamot, ilang mga tina, pati na rin ang pilak na bromide, na ginagamit sa paggawa ng mga materyales sa photographic.
Ang Iodine ay ginagamit sa gamot sa anyo ng isang 10% na solusyon sa ethanol bilang isang antiseptic at hemostatic agent. Ang yodo ay kasama sa isang bilang ng mga pharmaceutical na gamot.
Ang hydrofluoric acid (HF) ay ginagamit upang makagawa ng mga fluoride, etching glass, pag-alis ng buhangin mula sa metal castings, at mineral analysis.
Ang hydrochloric acid (HCl) ay malawakang ginagamit sa kemikal na kasanayan, pati na rin ang mga asin nito. Halimbawa, sodium chloride ( table salt) nagsisilbing hilaw na materyal para sa paggawa ng chlorine, hydrochloric acid, caustic soda, at ginagamit sa pagtitina, paggawa ng sabon at iba pang industriya.
Mga halimbawa ng solusyon sa pamamagitan ng pagtatanong
HALIMBAWA 1
| Mag-ehersisyo | Isulat ang mga equation para sa mga sumusunod na reaksyon: 1) FeSO 4 + KClO 3 + H 2 SO 4 → ... 2) FeSO 4 + KClO 3 + KOH → ... 3) I 2 + Ba(OH) 2 → … 4) KBr + KVrO 3 + H 2 SO 4 → ... |
| Sagot | a) Sa reaksyong ito, pinapataas ng iron ang estado ng oksihenasyon nito mula sa "+2" hanggang sa "+3", i.e. Ang FeSO 4 ay isang reducing agent, at binabawasan ng chlorine ang oxidation state mula sa "+5" hanggang "1", i.e. Ang KClO 3 ay isang oxidizing agent: 6FeSO 4 + KClO 3 + 3H 2 SO 4 = 3Fe 2 (SO 4) 3 + KCl + 3H 2 O b) Sa reaksyong ito, pinapataas ng iron ang estado ng oksihenasyon nito mula sa "+2" hanggang sa "+3", i.e. Ang FeSO 4 ay isang reducing agent, at binabawasan ng chlorine ang oxidation state mula sa "+5" hanggang "1", i.e. Ang KClO 3 ay isang oxidizing agent: 6FeSO 4 + KClO 3 + 12KOH + 3H 2 O = 6Fe(OH) 3 ↓ + KCl + 6K 2 SO 4 c) Sa reaksyong ito, parehong pinapataas at binabawasan ng iodine ang estado ng oksihenasyon mula "0" hanggang "+5" at mula sa "0" hanggang "-1", i.e. Ang I 2 ay parehong ahente ng pagbabawas at ahente ng pag-oxidizing - nangyayari ang isang disproporsyon na reaksyon: 6I 2 + 6Ba(OH) 2 = 5BaI 2 + Ba(IO 3) 2 + 6H 2 O d) Sa reaksyong ito, ang bromine ay parehong tumataas at bumababa sa estado ng oksihenasyon mula "-1" hanggang "0" at mula sa "+5" hanggang "0", ibig sabihin. Ang KBr ay isang reducing agent, at ang KBrO 3 ay isang oxidizing agent: 5КВr + КВrО 3 + 3Н 2 SO 4 = 3Вr 2 + 3К 2 SO 4 + 3Н 2 О |
1. Pangkalahatang katangian ng mga halogens . Atomic na istraktura at mga estado ng oksihenasyon ng mga halogens sa mga compound. Ang likas na katangian ng mga pagbabago sa atomic radii, ionization energies, electron affinities at electronegativity sa seryeng F - At. Ang likas na katangian ng mga kemikal na bono ng mga halogens na may mga metal at di-metal. Katatagan ng mas mataas na mga estado ng valence ng mga halogens. Mga tampok ng fluorine.
1. Sa. 367-371; 2. Sa. 338-347; 3. Sa. 415-416; 4. Sa. 270-271; 7. Sa. 340-345.
2. Molecular structure at pisikal na katangian ng mga simpleng halogen substance . karakter bono ng kemikal sa mga molekulang halogen. Mga katangiang pisikal halogens: estado ng pagsasama-sama, natutunaw at kumukulo na mga punto sa fluorine - serye ng astatine, solubility sa tubig at mga organikong solvent.
1. Sa. 370-372; 2. Sa. 340-347; 3. Sa. 415-416; 4. Sa. 271-287; 8. Sa. 367-370.
3. Mga kemikal na katangian ng mga halogens . Mga dahilan para sa mataas na aktibidad ng kemikal ng mga halogens at pagbabago nito ayon sa pangkat. Kaugnayan sa tubig, alkali solution, metal at non-metal. Ang impluwensya ng temperatura sa komposisyon ng mga produktong halogen disproportionation sa mga solusyon sa alkali. Mga tampok ng fluorine chemistry. Mga likas na halogen compound. Mga prinsipyo ng mga pamamaraan ng pang-industriya at laboratoryo para sa paggawa ng mga halogens. Paggamit ng mga halogens. Physiological at pharmacological effect ng mga halogens at ang kanilang mga compound sa mga buhay na organismo. Lason ng mga halogens at pag-iingat kapag nagtatrabaho sa kanila.
1. Sa. 372-374, p. 387-388; 2. Sa. 342-347; 3. Sa. 416-419; 4. Sa. 276-287; 7. pp.340-345, p. 355; 8. Sa. 380-382.
Ang mga simpleng sangkap, halogens, hindi katulad ng hydrogen, ay napaka-aktibo. Ang mga ito ay pinakanailalarawan sa pamamagitan ng mga katangian ng pag-oxidizing, na unti-unting humina sa seryeng F 2 - Sa 2. Ang pinaka-aktibo sa mga halogens ay fluorine: kahit ang tubig at buhangin ay kusang nag-aapoy sa kapaligiran nito! Masiglang tumutugon ang mga halogen sa karamihan ng mga metal, hindi metal, at mga kumplikadong sangkap.
4. Produksyon at paggamit ng mga halogens .
1. Sa. 371-372; 2. Sa. 345-347; 3. Sa. 416-419; 4. Sa. 275-287; 7. pp.340-345; 8. Sa. 380-382.
Ang lahat ng mga pamamaraan para sa paggawa ng mga halogens ay batay sa mga reaksyon ng oksihenasyon ng mga halide anion na may iba't ibang mga ahente ng oxidizing: 2Gal -1 -2e - = Gal
Sa industriya, ang mga halogens ay nakukuha sa pamamagitan ng electrolysis ng mga natutunaw (F 2 at Cl 2) o may tubig na solusyon (Cl 2) ng mga halides; pag-aalis ng mga hindi gaanong aktibong halogens ng mas aktibo mula sa kaukulang mga halides (I 2 - bromine; I 2 o Br 2 - chlorine)
Ang mga halogens sa laboratoryo ay nakuha sa pamamagitan ng oksihenasyon ng hydrogen halides (HCl, HBr) sa mga solusyon na may malakas na oxidizing agent (KMnO 4, K 2 Cr 2 O 7, PbO 2, MnO 2, KClO 3); oksihenasyon ng mga halides (NaBr, KI) kasama ang ipinahiwatig na mga ahente ng oxidizing sa isang acidic na kapaligiran (H 2 SO 4).
Binary halogen compounds
1. Mga compound na may hydrogen (hydrogen halides) . Ang likas na katangian ng mga bono ng kemikal sa mga molekula. Polarity ng mga molekula. Mga pisikal na katangian, estado ng pagsasama-sama, solubility sa tubig. Ang likas na katangian ng mga pagbabago sa temperatura ng pagkatunaw at pagkulo sa serye ng HF – HI. Samahan ng mga molekula ng hydrogen fluoride. Thermal na katatagan ng hydrogen halides. Reaktibiti. Mga katangian ng acid, mga tampok ng hydrofluoric acid. Mga katangian ng pagpapanumbalik. Pangkalahatang mga prinsipyo pagkuha ng hydrogen halides: synthesis mula sa mga simpleng sangkap at mula sa halides. Hydrogen chloride at hydrochloric acid. Pisikal at mga katangian ng kemikal. Mga paraan ng pagkuha. Ang paggamit ng hydrochloric acid. Ang papel ng hydrochloric acid at chlorides sa mga proseso ng buhay. Halides.
1. Sa. 375-382; 2. Sa. 347-353; 3. Sa. 419-420; 4. Sa. 272-275, p. 289-292; 7. pp.354-545; 8. Sa. 370-373, p. 374-375.
2 . Mga compound ng halogens na may oxygen.
1. Sa. 377-380; 2. Sa. 353-359; 3. Sa. 420-423; 4. Sa. 292-296; 7. pp.350-354; 8. Sa. 375-376, p. 379.
3. Mga compound na may iba pang hindi metal.
1. Sa. 375-381; 2. Sa. 342-345; 4. Sa. 292-296; 7. p.350-355.
4 . Mga koneksyon sa mga metal .
2. Sa. 342; 4. Sa. 292-296; 7. p.350-355.
Mga multi-element na halogen compound
1. Ang mga chlorine acid na naglalaman ng oxygen at ang mga asin nito. Hypochlorous, chlorous, perchloric at perchloric acids. Mga pagbabago sa mga katangian ng acid, katatagan at mga katangian ng oxidizing sa seryeng HClO – HClO 4 . Mga prinsipyo para sa pagkuha ng mga acid na ito. Hypochlorite, chlorites, chlorates at perchlorates. Thermal stability at oxidative properties. Pangkalahatang mga prinsipyo para sa pagkuha ng mga asin. Paggamit ng mga asin. Pagpaputi. asin ni Berthollet. Ammonium perchlorate.
1. Sa. 382-387; 2. Sa. 353-359; 3. Sa. 423; 4. Sa. 292-296; 7. pp.350-354; 8. Sa. 375-378.
2 . Oxygen-containing acids ng bromine at iodine at ang kanilang mga asin .
1. Sa. 382-387; 2. Sa. 353-359; 3. Sa. 423; 4. Sa. 292-296; 7. pp.350-354; 8. Sa. 379-380.
3 . Paglalapat ng mga halogens at ang kanilang pinakamahalagang compound
1. Sa. 387-388; 2. Sa. 345-347; 3. Sa. 419-423; 4. Sa. 272-296; 8. Sa. 380-382.
4 . Biological na papel ng mga halogen compound
1. Sa. 387-388; 2. Sa. 340-347; 3. Sa. 419-423; 4. Sa. 272-296; 8. Sa. 380-382.
Relasyonang pinakamahalagang chlorine compound:
