Mga reaksyon ng attachment. Mga uri ng mga reaksiyong kemikal sa organikong kimika Dibisyon ng mga substituent sa singsing ng benzene sa dalawang uri
Basahin din
) mga bono ng isa pang kemikal na tambalan. Ang pag-akyat ay maaaring isagawa bilang isang koneksyon carbon-carbon, at sa pamamagitan ng komunikasyon carbon heteroatom. Ang mga reaksyon sa karagdagan ay tinutukoy ng mga letrang Ingles "Ad".
Pangkalahatang pagtingin sa mga reaksyon ng karagdagan sa pamamagitan ng bono carbon-carbon:
Pangkalahatang pagtingin sa mga reaksyon ng karagdagan sa pamamagitan ng bono carbon-oxygen:
Karaniwan, ang reagent kung saan nangyayari ang pagdaragdag ay tinatawag substrate, at ang iba pa ( "X-Y") - atake reagent.
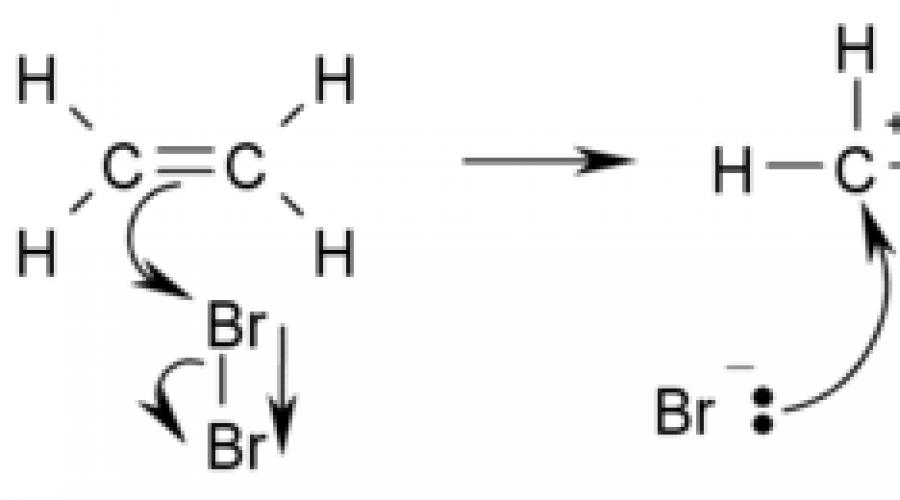
Ang isang halimbawa ng isang reaksyon sa karagdagan ay ang bromination ng ethylene:

Ang mga reaksyon sa pagdaragdag ay kadalasang nababaligtad, na nagpapares sa mga reaksyon ng pag-aalis, kaya dapat tandaan na ang mekanismo para sa naturang "pinares" na reaksyon sa pagdaragdag-pag-aalis ay karaniwan.
Depende sa likas na katangian ng umaatakeng particle at ang mekanismo ng reaksyon, ang pagkakaiba ay ginawa sa pagitan ng nucleophilic, electrophilic, radical, o synchronous na karagdagan.
Mga reaksyon sa pagdaragdag ng nucleophilic
Sa mga reaksyon ng pagdaragdag ng nucleophilic, ang umaatakeng particle ay ang nucleophile, iyon ay, isang particle na may negatibong charge o isang particle na may libreng pares ng elektron.
Pangkalahatang pagtingin sa mga reaksyon sa pagdaragdag ng nucleophilic:
Ang mga reaksyon sa pagdaragdag ng nucleophilic ay tinutukoy "AdN".
Mga reaksyon sa pagdaragdag ng nucleophilic sa isang bono C=C ay medyo bihira, ang pinakakalat at praktikal na halaga ay koneksyon sa pamamagitan ng koneksyon C=O :
Kabilang sa mga reaksyon ng pagdaragdag ng nucleophilic, ang pinakakaraniwan ay ang dalawang yugto na bimolecular na mekanismo sa itaas Ad N 2: Sa simula, ang nucleophile ay dahan-dahang nagdaragdag sa isang maramihang mga bono upang bumuo ng isang carbanion, na sa pangalawang hakbang ay mabilis na inaatake ng isang electrophilic species.
Mga reaksyon ng pagdaragdag ng electrophilic
Sa mga reaksyon ng pagdaragdag ng electrophilic, ang umaatakeng particle ay electrophile, iyon ay, isang positibong sisingilin na particle, kadalasan ay isang proton H+, o isang particle na kulang sa elektron.
Pangkalahatang pagtingin sa mga reaksyon ng pagdaragdag ng electrophilic:
Ang mga reaksyon ng pagdaragdag ng electrophilic ay tinutukoy "Ad e".
Ang mga reaksyon ng pagdaragdag ng electrophilic ay laganap sa mga reaksyon ng unsaturated hydrocarbons: alkenes, alkynes at dienes.
Ang isang halimbawa ng gayong mga reaksyon ay ang hydration ng mga alkenes:
Electrophilic bonding carbon heteroatom ay medyo pangkaraniwan din, at kadalasan ang ganitong koneksyon ay C=O:



Kabilang sa mga reaksyon ng pagdaragdag ng electrophilic, ang pinakakaraniwan ay ang dalawang yugto na bimolecular na mekanismo sa itaas Ad E 2: Sa simula, ang electrophile ay dahan-dahang nagdaragdag sa isang maramihang mga bono upang bumuo ng isang carbocation, na sumasailalim sa nucleophilic attack sa ikalawang hakbang.
Mga reaksyon ng radikal na karagdagan
Sa mga radikal na reaksyon ng karagdagan, ang mga libreng radikal ay ang umaatake na mga species.
Ang mga radikal na reaksyon ng karagdagan ay tinutukoy "Ad R".
Ang mga reaksyon ng radikal na karagdagan ay karaniwang nagpapatuloy sa halip na mga reaksyon ng pagdaragdag ng electrophilic sa pagkakaroon ng isang mapagkukunan ng mga libreng radikal:

Kasabay na mga reaksyon sa karagdagan
Sa ilang mga kaso, ang pagdaragdag sa pamamagitan ng maraming bono ay nangyayari sa sabay-sabay na pag-atake ng parehong mga atomo, na hindi nagpapahintulot sa isa na matukoy ang priyoridad ng pag-atake. Ang ganitong mekanismo ay tinatawag magkasabay na koneksyon. Ang mga kasabay na reaksyon ng karagdagan ay humahantong sa pagbuo ng mga cyclic na produkto, kaya madalas silang tinatawag cycloaddition.
Mga Tala
| Mga reaksiyong kemikal sa organikong kimika | |
|---|---|
| Mga reaksyon ng pagpapalit | Mga reaksyon ng pagpapalit ng nucleophilic Mga reaksyon ng pagpapalit ng electrophilic Mga reaksyon ng pagpapalit ng radikal |
| Mga reaksyon sa karagdagan | Mga reaksyon sa pagdaragdag ng nucleophilic Mga reaksyon sa pagdaragdag ng electrophilic Mga reaksyon sa pagdaragdag ng radikal Mga reaksyon sa pagdaragdag ng sabay-sabay |
| Mga reaksyon sa pag-aalis | Heterolytic elimination reactions Pericyclic elimination reactions Radical elimination reactions |
| muling pagsasaayos ng mga reaksyon | Nucleophilic rearrangements Mga electrophilic rearrangements Mga radikal na rearrangements |
| Mga reaksyon ng oksihenasyon at pagbabawas | Reaksyon ng oksihenasyon Mga reaksyon ng pagbabawas |
| Iba pa | Mga nominal na reaksyon sa organikong kimika |
Wikimedia Foundation. 2010 .
Tingnan kung ano ang "Mga reaksyon sa karagdagan" sa iba pang mga diksyunaryo:
karagdagan reaksyon polimer- - EN pandagdag polymer Isang polimer na nabuo sa pamamagitan ng pagdaragdag ng kadena ng mga unsaturated monomer molecule, tulad ng mga olefin, sa isa't isa nang walang pagbuo ng isang by product, bilang tubig;… … Handbook ng Teknikal na Tagasalin
- (Ingles na karagdagan electrophilic reaksyon) mga reaksyon sa karagdagan, kung saan ang pag-atake sa unang yugto ay isinasagawa ng isang electrophile particle, positibong sisingilin o may kakulangan ng mga electron. Sa huling yugto, ang nagresultang ... ... Wikipedia
- (English na karagdagan nucleophilic reaction) mga reaksyon sa karagdagan kung saan ang pag-atake sa paunang yugto ay isinasagawa ng isang nucleophile particle, negatibong sisingilin o may libreng pares ng elektron. Sa huling yugto, ang nagresultang ... ... Wikipedia
- (eng. addition radical reaction) mga reaksyon sa karagdagan kung saan ang pag-atake ay isinasagawa ng mga libreng radical ng isang particle na naglalaman ng isa o higit pang hindi magkapares na mga electron. Kasabay nito, ang mga radikal ay maaaring umatake sa parehong iba pang mga radikal at ... ... Wikipedia
Mga reaksyon sa pagdaragdag kung saan ang parehong mga atom ng isang maramihang mga bono ay inaatake nang sabay-sabay. Ang isa pang pangalan para sa mga reaksyon ng ganitong uri ay mga reaksyon ng cycloaddition, dahil ang mga huling produkto ng naturang mga reaksyon ay mga cyclic na substrate. Mayroong dalawang ... ... Wikipedia
- (English nucleophilic substitution reaction) mga reaksyon ng pagpapalit kung saan ang pag-atake ay isinasagawa ng isang nucleophile reagent na nagdadala ng hindi nakabahaging pares ng elektron. Ang umaalis na grupo sa mga reaksyon ng pagpapalit ng nucleophilic ay tinatawag na nucleofug. Lahat ... Wikipedia
Ang mga reaksyon ng mga organikong sangkap ay maaaring pormal na nahahati sa apat na pangunahing uri: pagpapalit, karagdagan, pag-aalis (pag-aalis) at muling pagsasaayos (isomerization). Malinaw, ang buong iba't ibang mga reaksyon ng mga organikong compound ay hindi maaaring bawasan sa iminungkahing pag-uuri (halimbawa, mga reaksyon ng pagkasunog). Gayunpaman, ang ganitong pag-uuri ay makakatulong upang magtatag ng mga pagkakatulad sa mga reaksyon na pamilyar sa iyo na nangyayari sa pagitan ng mga di-organikong sangkap.
Bilang isang patakaran, ang pangunahing organic compound na kasangkot sa reaksyon ay tinatawag substrate, at ang iba pang bahagi ng reaksyon ay may kondisyong itinuturing na reagent.
Mga reaksyon ng pagpapalit
Mga reaksyon ng pagpapalit- ito ay mga reaksyon na nagreresulta sa pagpapalit ng isang atom o grupo ng mga atomo sa orihinal na molekula (substrate) ng ibang mga atomo o grupo ng mga atomo.
Ang mga reaksyon ng pagpapalit ay kinabibilangan ng mga saturated at aromatic compound tulad ng mga alkane, cycloalkane o arene. Magbigay tayo ng mga halimbawa ng gayong mga reaksyon.
Sa ilalim ng pagkilos ng liwanag, ang mga atomo ng hydrogen sa isang molekula ng methane ay maaaring mapalitan ng mga atomo ng halogen, halimbawa, ng mga atomo ng klorin:
Ang isa pang halimbawa ng pagpapalit ng hydrogen ng halogen ay ang conversion ng benzene sa bromobenzene:

Ang equation para sa reaksyong ito ay maaaring isulat sa ibang paraan:
![]()
Sa ganitong paraan ng pag-record, ang mga reagents, katalista, mga kondisyon ng reaksyon ay nakasulat sa itaas ng arrow, at ang mga produkto ng inorganic na reaksyon sa ibaba nito.
Bilang resulta ng mga reaksyon Ang mga pagpapalit sa mga organikong sangkap ay nabuo hindi simple at kumplikado mga sangkap, tulad ng sa inorganikong kimika, at dalawa kumplikadong mga sangkap.
Mga reaksyon sa karagdagan
Mga reaksyon sa karagdagan ay mga reaksyon kung saan ang dalawa o higit pang mga molekula ng mga reactant ay pinagsama sa isa.
Ang mga unsaturated compound, tulad ng mga alkenes o alkynes, ay pumapasok sa mga reaksyon ng karagdagan. Depende sa kung aling molekula ang gumaganap bilang isang reagent, ang hydrogenation (o reduction), halogenation, hydrohalogenation, hydration, at iba pang mga reaksyon sa karagdagan ay nakikilala. Ang bawat isa sa kanila ay nangangailangan ng ilang mga kundisyon.
1.Hydrogenation- ang reaksyon ng pagdaragdag ng isang molekula ng hydrogen sa isang maramihang bono:
2. Hydrohalogenation- reaksyon ng pagdaragdag ng hydrogen halide (hydrochlorination):
3. Halogenation- reaksyon sa pagdaragdag ng halogen:
![]()
4.Polimerisasyon- isang espesyal na uri ng mga reaksyon ng karagdagan, kung saan ang mga molekula ng isang sangkap na may maliit na molekular na timbang ay pinagsama sa bawat isa upang bumuo ng mga molekula ng isang sangkap na may napakataas na timbang ng molekular - mga macromolecule.
Ang mga reaksyong polimerisasyon ay ang mga proseso ng pagsasama-sama ng maraming molekula ng isang mababang molekular na timbang na substansiya (monomer) sa malalaking molekula (macromolecules) ng isang polimer.
Ang isang halimbawa ng isang polymerization reaction ay ang paggawa ng polyethylene mula sa ethylene (ethene) sa ilalim ng pagkilos ng ultraviolet radiation at isang radical polymerization initiator R.
Ang covalent bond na pinaka-katangian ng mga organikong compound ay nabuo kapag ang mga atomic orbital ay nagsasapawan at ang pagbuo ng mga karaniwang pares ng elektron. Bilang resulta nito, nabuo ang isang orbital na karaniwan sa dalawang atomo, kung saan matatagpuan ang isang karaniwang pares ng elektron. Kapag nasira ang bono, maaaring mag-iba ang kapalaran ng mga karaniwang electron na ito.
Mga uri ng mga reaktibong particle
Ang isang orbital na may hindi magkapares na electron na kabilang sa isang atom ay maaaring mag-overlap sa isang orbital ng isa pang atom na naglalaman din ng isang hindi pares na elektron. Sa kasong ito, ang pagbuo ng isang covalent bond ay nangyayari ayon sa mekanismo ng palitan:
Ang mekanismo ng palitan para sa pagbuo ng isang covalent bond ay naisasakatuparan kung ang isang karaniwang pares ng elektron ay nabuo mula sa hindi magkapares na mga electron na kabilang sa iba't ibang mga atomo.
Ang prosesong kabaligtaran sa pagbuo ng isang covalent bond sa pamamagitan ng exchange mechanism ay bond breaking, kung saan isang electron () ang napupunta sa bawat atom. Bilang resulta, nabuo ang dalawang uncharged na particle na may mga hindi pares na electron:
![]()
Ang mga nasabing particle ay tinatawag na free radicals.
mga libreng radical- mga atom o grupo ng mga atom na may mga hindi magkapares na electron.
Mga reaksyon ng libreng radikal ay mga reaksyong nagaganap sa ilalim ng pagkilos at kasama ng mga libreng radikal.
Sa kurso ng inorganic na kimika, ito ay mga reaksyon ng pakikipag-ugnayan ng hydrogen sa oxygen, halogens, mga reaksyon ng pagkasunog. Ang mga reaksyon ng ganitong uri ay nailalarawan sa pamamagitan ng mataas na bilis, pagpapalabas ng isang malaking halaga ng init.
Ang isang covalent bond ay maaari ding mabuo ng mekanismo ng donor-acceptor. Ang isa sa mga orbital ng isang atom (o anion), na naglalaman ng hindi nakabahaging pares ng elektron, ay magkakapatong sa isang hindi napunong orbital ng isa pang atom (o cation) na may hindi napunong orbital, at isang covalent bond ay nabuo, halimbawa:
![]()
Ang pagsira sa isang covalent bond ay humahantong sa pagbuo ng positibo at negatibong sisingilin na mga particle (); dahil sa kasong ito ang parehong mga electron mula sa isang karaniwang pares ng elektron ay nananatili sa isa sa mga atomo, ang isa pang atom ay may hindi napunong orbital:
![]()
Isaalang-alang ang electrolytic dissociation ng mga acid:
![]()
Madaling mahulaan na ang isang particle na may hindi nakabahaging pares ng electron R: -, ibig sabihin, isang negatibong sisingilin na ion, ay maaakit sa mga atom na may positibong sisingilin o sa mga atomo kung saan mayroong hindi bababa sa isang bahagyang o epektibong positibong singil.
Ang mga particle na may hindi nakabahaging mga pares ng elektron ay tinatawag mga ahente ng nucleophilic (nucleus- "nucleus", ang positibong sisingilin na bahagi ng atom), iyon ay, ang "mga kaibigan" ng nucleus, isang positibong singil.
Mga nucleophile(Nu) - mga anion o mga molekula na may nag-iisang pares ng mga electron, na nakikipag-ugnayan sa mga rehiyon ng mga molekula, kung saan nakakonsentra ang epektibong positibong singil.
Mga halimbawa ng mga nucleophile: Cl - (chloride ion), OH - (hydroxide anion), CH 3 O - (methoxide anion), CH 3 COO - (acetate anion).
Ang mga particle na may isang hindi napunong orbital, sa kabaligtaran, ay may posibilidad na punan ito at, samakatuwid, ay maaakit sa mga rehiyon ng mga molekula na may mas mataas na density ng elektron, isang negatibong singil, at isang hindi nakabahaging pares ng elektron. Ang mga ito ay mga electrophile, "kaibigan" ng isang electron, isang negatibong singil, o mga particle na may mas mataas na density ng elektron.
mga electrophile- mga kasyon o molekula na mayroong hindi napunong electron orbital, na may posibilidad na punan ito ng mga electron, dahil ito ay humahantong sa isang mas kanais-nais na elektronikong pagsasaayos ng atom.
Hindi lahat ng particle ay isang electrophile na may walang laman na orbital. Kaya, halimbawa, ang mga alkali metal cation ay may pagsasaayos ng mga inert na gas at hindi malamang na makakuha ng mga electron, dahil mayroon silang mababang pagkakaugnay ng elektron.
Mula dito maaari nating tapusin na sa kabila ng pagkakaroon ng isang hindi napunong orbital, ang mga naturang particle ay hindi magiging mga electrophile.
Mga pangunahing mekanismo ng reaksyon
Mayroong tatlong pangunahing uri ng mga particle na tumutugon - mga libreng radikal, electrophile, nucleophile - at tatlong kaukulang uri ng mekanismo ng reaksyon:
- libreng radikal;
- electrophilic;
- nullophilic.
Bilang karagdagan sa pag-uuri ng mga reaksyon ayon sa uri ng tumutugon na mga particle, ang organikong kimika ay nakikilala ang apat na uri ng mga reaksyon ayon sa prinsipyo ng pagbabago ng komposisyon ng mga molekula: karagdagan, pagpapalit, pag-aalis, o pag-aalis (mula sa Ingles. sa alisin- tanggalin, hatiin) at regroup. Dahil ang karagdagan at pagpapalit ay maaaring mangyari sa ilalim ng pagkilos ng lahat ng tatlong uri ng reaktibong species, marami majormga mekanismo ng reaksyon.


Bilang karagdagan, isaalang-alang ang mga reaksyon ng cleavage o elimination na nagaganap sa ilalim ng impluwensya ng mga nucleophilic particle - mga base.
6. Pag-aalis:
Ang isang natatanging tampok ng alkenes (unsaturated hydrocarbons) ay ang kakayahang pumasok sa mga reaksyon ng karagdagan. Karamihan sa mga reaksyong ito ay nagpapatuloy sa pamamagitan ng mekanismo ng pagdaragdag ng electrophilic.
Hydrohalogenation (pagdaragdag ng halogen hydrogen):
Kapag ang isang hydrogen halide ay idinagdag sa isang alkene hydrogen ay idinagdag sa higit pang hydrogenated carbon atom, ibig sabihin, ang atom kung saan mayroong higit pang mga atom hydrogen, at halogen - sa hindi gaanong hydrogenated.
Mga kemikal na katangian ng alkanes
Ang mga alkanes (paraffins) ay mga non-cyclic hydrocarbons, sa mga molekula kung saan ang lahat ng mga carbon atom ay konektado lamang sa pamamagitan ng mga solong bono. Sa madaling salita, walang maramihang, doble o triple na mga bono sa mga molekula ng alkanes. Sa katunayan, ang mga alkane ay mga hydrocarbon na naglalaman ng pinakamataas na posibleng bilang ng mga atomo ng hydrogen, at samakatuwid ang mga ito ay tinatawag na paglilimita (saturated).
Dahil sa saturation, ang mga alkane ay hindi maaaring pumasok sa mga reaksyon ng karagdagan.
Dahil ang carbon at hydrogen atoms ay may medyo malapit na electronegativity, humahantong ito sa katotohanan na ang mga CH bond sa kanilang mga molekula ay napakababang polarity. Sa pagsasaalang-alang na ito, para sa mga alkanes, ang mga reaksyon na nagpapatuloy ayon sa mekanismo ng radikal na pagpapalit, na tinutukoy ng simbolong S R, ay higit na katangian.
1. Mga reaksyon ng pagpapalit
Sa mga reaksyon ng ganitong uri, ang mga bono ng carbon-hydrogen ay nasira.
RH + XY → RX + HY
Halogenation
Ang mga alkane ay tumutugon sa mga halogens (chlorine at bromine) sa ilalim ng pagkilos ng ultraviolet light o may malakas na init. Sa kasong ito, ang isang halo ng mga halogen derivatives na may iba't ibang antas ng pagpapalit ng mga atomo ng hydrogen ay nabuo - mono-, di-tri-, atbp. halogen-substituted alkanes.
Sa halimbawa ng methane, ganito ang hitsura:
Sa pamamagitan ng pagpapalit ng halogen/methane ratio sa reaction mixture, posibleng matiyak na ang anumang partikular na methane halogen derivative ay nangingibabaw sa komposisyon ng mga produkto.
mekanismo ng reaksyon
Suriin natin ang mekanismo ng free radical substitution reaction gamit ang halimbawa ng interaksyon ng methane at chlorine. Binubuo ito ng tatlong yugto:
- pagsisimula (o pagsisimula ng kadena) - ang proseso ng pagbuo ng mga libreng radikal sa ilalim ng pagkilos ng enerhiya mula sa labas - pag-iilaw sa UV light o pag-init. Sa yugtong ito, ang molekula ng chlorine ay sumasailalim sa isang homolytic cleavage ng Cl-Cl bond na may pagbuo ng mga libreng radical:
Ang mga libreng radikal, gaya ng makikita mula sa pigura sa itaas, ay tinatawag na mga atomo o mga grupo ng mga atomo na may isa o higit pang hindi magkapares na mga electron (Cl, H, CH 3, CH 2, atbp.);
2. Pag-unlad ng kadena
Ang yugtong ito ay binubuo sa pakikipag-ugnayan ng mga aktibong libreng radikal sa mga di-aktibong molekula. Sa kasong ito, nabuo ang mga bagong radikal. Sa partikular, kapag ang mga chlorine radical ay kumikilos sa mga molekula ng alkane, isang alkyl radical at hydrogen chloride ay nabuo. Sa turn, ang alkyl radical, na nagbabanggaan sa mga chlorine molecule, ay bumubuo ng chlorine derivative at isang bagong chlorine radical:
3) Masira (kamatayan) ng kadena:
Nangyayari bilang resulta ng recombination ng dalawang radical sa isa't isa sa mga hindi aktibong molekula:
2. Mga reaksyon ng oksihenasyon
Sa ilalim ng normal na mga kondisyon, ang mga alkane ay hindi gumagalaw na may kinalaman sa mga malakas na ahente ng oxidizing tulad ng concentrated sulfuric at nitric acids, permanganate at potassium dichromate (KMnO 4, K 2 Cr 2 O 7).
Pagkasunog sa oxygen
A) kumpletong pagkasunog na may labis na oxygen. Humantong sa pagbuo ng carbon dioxide at tubig:
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
B) hindi kumpletong pagkasunog na may kakulangan ng oxygen:
2CH 4 + 3O 2 \u003d 2CO + 4H 2 O
CH 4 + O 2 \u003d C + 2H 2 O
Catalytic oxidation na may oxygen
Bilang resulta ng pag-init ng mga alkanes na may oxygen (~200 o C) sa pagkakaroon ng mga catalyst, maraming uri ng mga organikong produkto ang maaaring makuha mula sa kanila: aldehydes, ketones, alcohols, carboxylic acids.
Halimbawa, ang methane, depende sa likas na katangian ng catalyst, ay maaaring ma-oxidize sa methyl alcohol, formaldehyde, o formic acid:
3. Thermal transformations ng alkanes
Nagbitak
Ang pag-crack (mula sa English to crack - to tear) ay isang kemikal na proseso na nagaganap sa mataas na temperatura, bilang isang resulta kung saan ang carbon skeleton ng mga molekula ng alkane ay nasira sa pagbuo ng mga molekula ng alkene at alkane na may mas mababang timbang ng molekular kumpara sa mga orihinal na alkane. Halimbawa:
CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 3 → CH 3 -CH 2 -CH 2 -CH 3 + CH 3 -CH \u003d CH 2
Ang pag-crack ay maaaring thermal o catalytic. Para sa pagpapatupad ng catalytic cracking, dahil sa paggamit ng mga catalyst, makabuluhang mas mababang temperatura ang ginagamit kumpara sa thermal cracking.
Dehydrogenation
Ang pag-aalis ng hydrogen ay nangyayari bilang resulta ng pagsira sa mga bono ng C-H; isinasagawa sa pagkakaroon ng mga catalyst sa mataas na temperatura. Ang dehydrogenation ng methane ay gumagawa ng acetylene:
2CH 4 → C 2 H 2 + 3H 2
Ang pag-init ng methane sa 1200 ° C ay humahantong sa pagkabulok nito sa mga simpleng sangkap:
CH 4 → C + 2H 2
Ang dehydrogenation ng iba pang mga alkanes ay nagbibigay ng mga alkenes:
C 2 H 6 → C 2 H 4 + H 2
Kapag dehydrogenating n-butane, butene-1 at butene-2 ay nabuo (ang huli sa anyo cis- at kawalan ng ulirat-isomer):
Dehydrocyclization
Isomerization
Mga kemikal na katangian ng cycloalkanes
Ang mga kemikal na katangian ng mga cycloalkane na may higit sa apat na carbon atoms sa mga cycle ay karaniwang halos magkapareho sa mga alkanes. Para sa cyclopropane at cyclobutane, kakaiba, ang mga reaksyon ng karagdagan ay katangian. Ito ay dahil sa mataas na tensyon sa loob ng cycle, na humahantong sa katotohanan na ang mga cycle na ito ay may posibilidad na masira. Kaya ang cyclopropane at cyclobutane ay madaling magdagdag ng bromine, hydrogen o hydrogen chloride:
Mga kemikal na katangian ng alkenes
1. Mga reaksyon ng karagdagan
Dahil ang dobleng bono sa mga molekula ng alkene ay binubuo ng isang malakas na bono ng sigma at isang mahina na bono ng pi, sila ay medyo aktibong mga compound na madaling pumasok sa mga reaksyon ng karagdagan. Ang mga alkenes ay madalas na pumapasok sa gayong mga reaksyon kahit na sa ilalim ng banayad na mga kondisyon - sa malamig, sa may tubig na mga solusyon at mga organikong solvent.
Hydrogenation ng mga alkenes
Ang mga alkenes ay maaaring magdagdag ng hydrogen sa pagkakaroon ng mga catalyst (platinum, palladium, nickel):
CH 3 -CH \u003d CH 2 + H 2 → CH 3 -CH 2 -CH 3
Ang hydrogenation ng mga alkenes ay madaling nagpapatuloy kahit na sa normal na presyon at bahagyang pag-init. Ang isang kagiliw-giliw na katotohanan ay ang parehong mga catalyst ay maaaring gamitin para sa dehydrogenation ng mga alkanes sa alkenes, tanging ang proseso ng dehydrogenation ay nagpapatuloy sa isang mas mataas na temperatura at mas mababang presyon.
Halogenation
Ang mga alkenes ay madaling pumasok sa isang karagdagan na reaksyon sa bromine kapwa sa may tubig na solusyon at sa mga organikong solvent. Bilang resulta ng pakikipag-ugnayan, sa una ang mga dilaw na solusyon ng bromine ay nawawala ang kanilang kulay, i.e. pagkawalan ng kulay.
CH 2 \u003d CH 2 + Br 2 → CH 2 Br-CH 2 Br
Hydrohalogenation
Madaling makita na ang pagdaragdag ng isang hydrogen halide sa isang unsymmetrical alkene molecule ay dapat theoretically humantong sa isang pinaghalong dalawang isomer. Halimbawa, kapag ang hydrogen bromide ay idinagdag sa propene, ang mga sumusunod na produkto ay dapat makuha:
Gayunpaman, sa kawalan ng mga tiyak na kondisyon (halimbawa, ang pagkakaroon ng mga peroxide sa pinaghalong reaksyon), ang pagdaragdag ng isang molekula ng hydrogen halide ay magaganap nang mahigpit alinsunod sa panuntunan ng Markovnikov:
Ang pagdaragdag ng isang hydrogen halide sa isang alkene ay nangyayari sa paraang ang hydrogen ay nakakabit sa isang carbon atom na may mas malaking bilang ng mga hydrogen atoms (mas hydrogenated), at isang halogen ay nakakabit sa isang carbon atom na may mas maliit na bilang ng mga hydrogen atoms (hindi gaanong hydrogenated).
Hydration
Ang reaksyong ito ay humahantong sa pagbuo ng mga alkohol, at nagpapatuloy din alinsunod sa panuntunan ng Markovnikov:
Tulad ng maaari mong hulaan, dahil sa ang katunayan na ang pagdaragdag ng tubig sa molekula ng alkene ay nangyayari ayon sa panuntunan ng Markovnikov, ang pagbuo ng pangunahing alkohol ay posible lamang sa kaso ng ethylene hydration:
CH 2 \u003d CH 2 + H 2 O → CH 3 -CH 2 -OH
Ito ay sa pamamagitan ng reaksyong ito na ang pangunahing halaga ng ethyl alcohol ay isinasagawa sa industriya ng malaking kapasidad.
Polimerisasyon
Ang isang tiyak na kaso ng reaksyon ng karagdagan ay ang reaksyon ng polimerisasyon, na, hindi katulad ng halogenation, hydrohalogenation at hydration, ay nagpapatuloy sa pamamagitan ng isang libreng radikal na mekanismo:
Mga reaksyon ng oksihenasyon
Tulad ng lahat ng iba pang hydrocarbons, ang mga alkenes ay madaling nasusunog sa oxygen upang bumuo ng carbon dioxide at tubig. Ang equation para sa pagkasunog ng mga alkenes sa labis na oxygen ay may anyo:
C n H 2n + (3/2)nO 2 → nCO 2 + nH 2 O
Hindi tulad ng mga alkanes, ang mga alkenes ay madaling na-oxidized. Sa ilalim ng pagkilos ng isang may tubig na solusyon ng KMnO 4 sa mga alkenes, pagkawalan ng kulay, na isang husay na reaksyon sa doble at triple na mga bono ng CC sa mga molekula ng mga organikong sangkap.
Ang oksihenasyon ng mga alkenes na may potassium permanganate sa isang neutral o bahagyang alkalina na solusyon ay humahantong sa pagbuo ng mga diols (dihydric alcohols):
C 2 H 4 + 2KMnO 4 + 2H 2 O → CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH (paglamig)
Sa isang acidic na kapaligiran, ang isang kumpletong cleavage ng double bond ay nangyayari sa pagbabago ng mga carbon atoms na nabuo ang double bond sa mga carboxyl group:
5CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 12H 2 SO 4 → 5CH 3 COOH + 5C 2 H 5 COOH + 8MnSO 4 + 4K 2 SO 4 + 17H 2 O (pagpainit)
Kung ang dobleng C=C na bono ay nasa dulo ng molekula ng alkene, kung gayon ang carbon dioxide ay nabuo bilang produkto ng oksihenasyon ng matinding carbon atom sa dobleng bono. Ito ay dahil sa ang katunayan na ang intermediate na produkto ng oksihenasyon, ang formic acid, ay madaling na-oxidized sa pamamagitan ng kanyang sarili sa labis na isang oxidizing agent:
5CH 3 CH=CH 2 + 10KMnO 4 + 15H 2 SO 4 → 5CH 3 COOH + 5CO 2 + 10MnSO 4 + 5K 2 SO 4 + 20H 2 O (pagpainit)
Sa oksihenasyon ng mga alkenes, kung saan ang C atom sa double bond ay naglalaman ng dalawang hydrocarbon substituents, isang ketone ang nabuo. Halimbawa, ang oksihenasyon ng 2-methylbutene-2 ay gumagawa ng acetone at acetic acid.
Ang oksihenasyon ng mga alkenes, na sumisira sa carbon skeleton sa double bond, ay ginagamit upang itatag ang kanilang istraktura.
Mga kemikal na katangian ng alkadienes
Mga reaksyon sa karagdagan
Halimbawa, ang pagdaragdag ng mga halogens:
Ang tubig ng bromine ay nagiging walang kulay.
Sa ilalim ng normal na mga kondisyon, ang pagdaragdag ng mga atomo ng halogen ay nangyayari sa mga dulo ng molekula ng butadiene-1,3, habang ang mga bono ng π ay nasira, ang mga atomo ng bromine ay nakakabit sa mga sukdulang atomo ng carbon, at ang mga libreng valence ay bumubuo ng isang bagong bono ng π. Kaya, parang may "movement" ng double bond. Sa labis na bromine, maaaring magdagdag ng isa pang molekula ng bromine sa lugar ng nabuong double bond.
mga reaksyon ng polimerisasyon
Mga kemikal na katangian ng alkynes
Ang mga alkynes ay unsaturated (unsaturated) hydrocarbons at samakatuwid ay may kakayahang pumasok sa mga reaksyon ng karagdagan. Kabilang sa mga reaksyon ng pagdaragdag para sa mga alkynes, ang pagdaragdag ng electrophilic ay ang pinakakaraniwan.
Halogenation
Dahil ang triple bond ng mga molekulang alkyne ay binubuo ng isang mas malakas na sigma bond at dalawang mas mahinang pi bond, nagagawa nilang ilakip ang alinman sa isa o dalawang halogen molecule. Ang pagdaragdag ng dalawang halogen molecule ng isang alkyne molecule ay nagpapatuloy sa pamamagitan ng electrophilic mechanism na sunud-sunod sa dalawang yugto:
Hydrohalogenation
Ang pagdaragdag ng mga molekula ng hydrogen halide ay nagpapatuloy din sa pamamagitan ng mekanismong electrophilic at sa dalawang yugto. Sa parehong mga yugto, ang karagdagan ay nagpapatuloy alinsunod sa panuntunan ng Markovnikov:
Hydration
Ang pagdaragdag ng tubig sa mga alkynes ay nangyayari sa pagkakaroon ng mga ruthium salts sa isang acidic na daluyan at tinatawag na reaksyon ng Kucherov.
Bilang resulta ng hydration ng pagdaragdag ng tubig sa acetylene, ang acetaldehyde (acetic aldehyde) ay nabuo:
Para sa mga homologue ng acetylene, ang pagdaragdag ng tubig ay humahantong sa pagbuo ng mga ketone:
Alkyne hydrogenation
Ang mga alkynes ay tumutugon sa hydrogen sa dalawang hakbang. Ang mga metal tulad ng platinum, palladium, nickel ay ginagamit bilang mga katalista:
Alkyne trimerization
Kapag ang acetylene ay ipinapasa sa activated carbon sa mataas na temperatura, ang isang halo ng iba't ibang mga produkto ay nabuo mula dito, ang pangunahing nito ay benzene, isang produkto ng acetylene trimerization:
Dimerization ng alkynes
Ang acetylene ay pumapasok din sa isang dimerization reaction. Ang proseso ay nagpapatuloy sa pagkakaroon ng mga tansong asin bilang mga katalista:
Oksihenasyon ng alkyne
Ang mga alkynes ay nasusunog sa oxygen:
C n H 2n-2 + (3n-1) / 2 O 2 → nCO 2 + (n-1) H 2 O
Ang pakikipag-ugnayan ng mga alkynes sa mga base
Ang mga alkynes na may triple C≡C sa dulo ng molekula, hindi tulad ng iba pang mga alkynes, ay maaaring pumasok sa mga reaksyon kung saan ang hydrogen atom sa triple bond ay pinapalitan ng isang metal. Halimbawa, ang acetylene ay tumutugon sa sodium amide sa likidong ammonia:
HC≡CH + 2NaNH 2 → NaC≡CNa + 2NH 3,
at gayundin ng ammonia solution ng silver oxide, na bumubuo ng hindi matutunaw na mga sangkap na parang asin na tinatawag na acetylenides:
Salamat sa reaksyong ito, posible na makilala ang mga alkynes na may isang terminal na triple bond, gayundin ang paghiwalayin ang naturang alkyne mula sa isang halo sa iba pang mga alkynes.
Dapat pansinin na ang lahat ng pilak at tansong acetylenides ay mga paputok na sangkap.
Ang mga acetylide ay may kakayahang tumugon sa mga halogen derivatives, na ginagamit sa synthesis ng mas kumplikadong mga organikong compound na may triple bond:
CH 3 -C≡CH + NaNH 2 → CH 3 -C≡CNa + NH 3
CH 3 -C≡CNa + CH 3 Br → CH 3 -C≡C-CH 3 + NaBr
Mga kemikal na katangian ng aromatic hydrocarbons
Ang aromatic na katangian ng bono ay nakakaapekto sa mga kemikal na katangian ng benzenes at iba pang aromatic hydrocarbons.
Ang nag-iisang 6pi electron system ay mas matatag kaysa sa conventional pi bond. Samakatuwid, para sa aromatic hydrocarbons, ang mga reaksyon ng pagpapalit ay higit na katangian kaysa sa mga reaksyon ng karagdagan. Ang mga arenes ay pumapasok sa mga reaksyon ng pagpapalit sa pamamagitan ng isang electrophilic na mekanismo.
Mga reaksyon ng pagpapalit
Halogenation
Nitrasyon
Ang reaksyon ng nitration ay pinakamahusay na nagpapatuloy sa ilalim ng pagkilos ng hindi purong nitric acid, ngunit ang halo nito na may puro sulfuric acid, ang tinatawag na nitrating mixture:
Alkylation
Ang reaksyon kung saan ang isa sa mga hydrogen atoms sa aromatic nucleus ay pinalitan ng isang hydrocarbon radical:
Maaari ding gamitin ang mga alkenes sa halip na mga halogenated alkanes. Ang mga aluminyo halides, ferric iron halides o inorganic acid ay maaaring gamitin bilang mga catalyst.<
Mga reaksyon sa karagdagan
hydrogenation
Pag-akyat ng chlorine
Nagpapatuloy ito sa pamamagitan ng isang radikal na mekanismo sa ilalim ng matinding pag-iilaw ng ultraviolet light:
Katulad nito, ang reaksyon ay maaaring magpatuloy lamang sa klorin.
Mga reaksyon ng oksihenasyon
Pagkasunog
2C 6 H 6 + 15O 2 \u003d 12CO 2 + 6H 2 O + Q
hindi kumpletong oksihenasyon
Ang singsing na benzene ay lumalaban sa mga ahente ng oxidizing tulad ng KMnO 4 at K 2 Cr 2 O 7 . Ang reaksyon ay hindi napupunta.
Dibisyon ng mga substituent sa singsing ng benzene sa dalawang uri:
Isaalang-alang ang mga kemikal na katangian ng benzene homologues gamit ang toluene bilang isang halimbawa.
Mga kemikal na katangian ng toluene
Halogenation
Ang toluene molecule ay maaaring ituring na binubuo ng mga fragment ng benzene at methane molecule. Samakatuwid, makatuwirang ipagpalagay na ang mga kemikal na katangian ng toluene ay dapat sa ilang lawak ay pagsamahin ang mga kemikal na katangian ng dalawang sangkap na ito na kinuha nang hiwalay. Sa partikular, ito ay tiyak kung ano ang naobserbahan sa panahon ng halogenation nito. Alam na natin na ang benzene ay pumapasok sa isang substitution reaction na may chlorine sa pamamagitan ng isang electrophilic na mekanismo, at ang mga catalyst (aluminum o ferric halides) ay dapat gamitin upang maisagawa ang reaksyong ito. Kasabay nito, ang mitein ay may kakayahang tumugon sa murang luntian, ngunit sa pamamagitan ng isang mekanismo ng libreng radikal, na nangangailangan ng pag-iilaw ng unang pinaghalong reaksyon na may ilaw ng UV. Ang Toluene, depende sa mga kondisyon kung saan ito sumasailalim sa chlorination, ay maaaring magbigay ng alinman sa mga produkto ng pagpapalit ng mga atomo ng hydrogen sa singsing ng benzene - para dito kailangan mong gumamit ng parehong mga kondisyon tulad ng sa chlorination ng benzene, o mga produkto ng pagpapalit ng mga hydrogen atoms sa methyl radical, kung nasa ibabaw nito, kung paano kumilos sa methane na may chlorine kapag na-irradiated ng ultraviolet light:
Tulad ng makikita mo, ang chlorination ng toluene sa pagkakaroon ng aluminum chloride ay humantong sa dalawang magkaibang mga produkto - ortho- at para-chlorotoluene. Ito ay dahil sa ang katunayan na ang methyl radical ay isang substituent ng unang uri.
Kung ang chlorination ng toluene sa pagkakaroon ng AlCl 3 ay isinasagawa nang labis sa chlorine, ang pagbuo ng trichlorine-substituted toluene ay posible:
Katulad nito, kapag ang toluene ay chlorinated sa liwanag sa isang mas mataas na chlorine / toluene ratio, dichloromethylbenzene o trichloromethylbenzene ay maaaring makuha:
Nitrasyon
Ang pagpapalit ng hydrogen atoms para sa nitrogroup, sa panahon ng nitration ng toluene na may pinaghalong puro nitric at sulfuric acid, ay humahantong sa mga produkto ng pagpapalit sa aromatic nucleus, at hindi sa methyl radical:
Alkylation
Tulad ng nabanggit na, ang methyl radical ay isang orientant ng unang uri, samakatuwid, ang Friedel-Crafts alkylation nito ay humahantong sa mga produkto ng pagpapalit sa mga posisyon ng ortho at para:
Mga reaksyon sa karagdagan
Ang Toluene ay maaaring hydrogenated sa methylcyclohexane gamit ang metal catalysts (Pt, Pd, Ni):
C 6 H 5 CH 3 + 9O 2 → 7CO 2 + 4H 2 O
hindi kumpletong oksihenasyon
Sa ilalim ng pagkilos ng naturang ahente ng oxidizing bilang isang may tubig na solusyon ng potassium permanganate, ang side chain ay sumasailalim sa oksihenasyon. Ang mabangong nucleus ay hindi maaaring ma-oxidized sa ilalim ng gayong mga kondisyon. Sa kasong ito, depende sa pH ng solusyon, alinman sa isang carboxylic acid o asin nito ay mabubuo.
; sa kasong ito, ang isang p-bond ay nasira at isa o dalawang s-bond ay nabuo. Upang ipahiwatig ang koneksyon mga reaksyon gamitin ang simbolo na Ad (mula sa Ingles na karagdagan - pagsali); para sa mga p-tion ng cycloaddition, hindi ginagamit ang naturang simbolo.
depende sa kalikasan substrate makilala sa pagitan ng mga koneksyon mga reaksyon sa nakahiwalay o pinagsama maramihang mga bono, halimbawa: C=C, C=C, C=C-C=C, C=O, C=N, C=N. Tukuyin ang p-tion homolytic. (Ad R) at heterolytic. mga accession. Ang huli ay depende sa singil ng umaatake reagent nahahati sa r-tion elektrof. (Ad E) at nucleoph. (AdN)mga karagdagan. Pag-uugali reagent depende sa uri substrate at ang mga kondisyon para sa pagsasagawa ng pamamahagi (pamamahagi, presensya katalista, ang epekto ng UV irradiation, atbp.). Mn. reagents sa iba't ibang mga kondisyon ay maaaring magpakita ng iba't ibang. mga uri ng reaksyon. kakayahan, hal. halogens maaaring kumilos bilang radikal, elektrof. at maging ang nucleoph. mga ahente.
Naib. pinag-aralan ang mga accession mga reaksyon sa maramihang mga bono carbon-carbon. Ang mga prosesong ito ay nagpapatuloy ayon sa isang stepwise (staged) o synchronous (coordinated) na mekanismo. Sa pamamagitan ng isang stepwise na mekanismo, ang unang yugto ay ang pag-atake ng nucleophile, electrophile, o libre. radikal, ang pangalawa - recombination nagreresulta nasa pagitan positibo, negatibo o isang neutral na butil, halimbawa:
Electrof. o nucleoph. ang mga particle ay hindi kailangang maging mga ion; maaari silang kumatawan sa isang electron-withdraw o electron-donate na bahagi (grupo) mga molekula. Ang mga R-tion ng Ad N ay posible lamang sa mga C=C bond na isinaaktibo ng mga pamalit na nag-withdraw ng elektron; ang pagpapatupad ng Ad E ay nangangailangan ng alinman sa hindi napalitang C=C na mga bono o yaong na-activate ng mga pamalit na nag-donate ng elektron. Para sa p-tion Ad R, ang katangian ng substituent sa C=C bond ay hindi gaanong mahalaga.
Stereochem. ang resulta ng pagdaragdag ng hakbang ay nakasalalay sa mekanismo ng p-tion at sa likas na katangian ng mga tumutugon na compound. Oo, electro. pagsali mga olefin maaaring magpatuloy bilang pag-atake ng son-attachment-particles na Y at W molekula sa isang gilid ng eroplano dobleng bono o bilang anti-attachment - umaatake ang mga particle mula sa iba't ibang panig ng eroplano; sa ilang mga kaso, ang mga distrito ay hindi stereospecifically pumunta. Nucleof. sumasali sa carbanion nalikom, bilang panuntunan, hindi stereospecifically. Kapag sumali mga reaksyon sa triple bond Ang pagdaragdag ng syn ay humahantong sa cis isomer, ang anti karagdagan ay humahantong sa trans isomer.
Sa kaso ng isang kasabay na mekanismo, isang pag-atake sa pareho atom Ang C ay isinasagawa nang sabay-sabay at ang p-tion ay nagpapatuloy bilang isang dipolar na karagdagan (tingnan ang Cyclloaddition), habang ang karagdagan mga reaksyon sa pamamagitan ng doble o triple bond pumunta bilang son-attachment (tingnan, hal., Reppe reaksyon).
P mga koneksyon mga reaksyon sa pamamagitan ng conjugate dobleng bono, na dumadaloy sa isang hakbang-hakbang na mekanismo, humantong sa pagbuo ng 1,2- at 1,4-dagdag na mga produkto:
Kasabay na 1,4 na koneksyon sa dienes tumatakbo ang trail. paraan:

Ang isang espesyal na uri ng mga reaksyon sa karagdagan ay conjugated karagdagan. Ang daloy ng naturang mga p-tions ay sinamahan ng pagbubuklod ng p-solvent (o espesyal na idinagdag reagent) sa huling yugto ng proseso. Halimbawa, conjugated elektrof. pag-akyat halogens sa mga alkenes sa CH 3 COOH ay humahantong, kasama ang 1,2-dihalides, sa b-acetoxyalkyl halides:
Mga halimbawa ng conjugated nucleoph. pag-akyat - Reaksyon ni Michael at pakikipag-ugnayan. activated mga alkenes na may cyanide anion sa proton p-solvents SH:

Sa kaso ng pagsali mga reaksyon sa maramihang mga bono carbon-hetero-atom, kung saan ilagay. naka-localize ang singil atom C (mga bono C=O, C=N, C=N at C=S), palaging nakakabit ang mga nucleophile sa atom C, at mga electrophile sa isang heteroatom. Sa naib. degree na pinag-aralan ang mga nucleophilic na karagdagan mga reaksyon para sa pangkat ng carbonyl:

P mga koneksyon reaksyon sa atom Ang C ay maaaring isa sa mga yugto ng pagpapalit ng p-tion sa aromatic. sa isang hilera, halimbawa: