Paglalarawan ng likidong sangkap. Katayuan ng likido. Ang mga istruktura ng mga likido at amorphous na katawan ay magkatulad
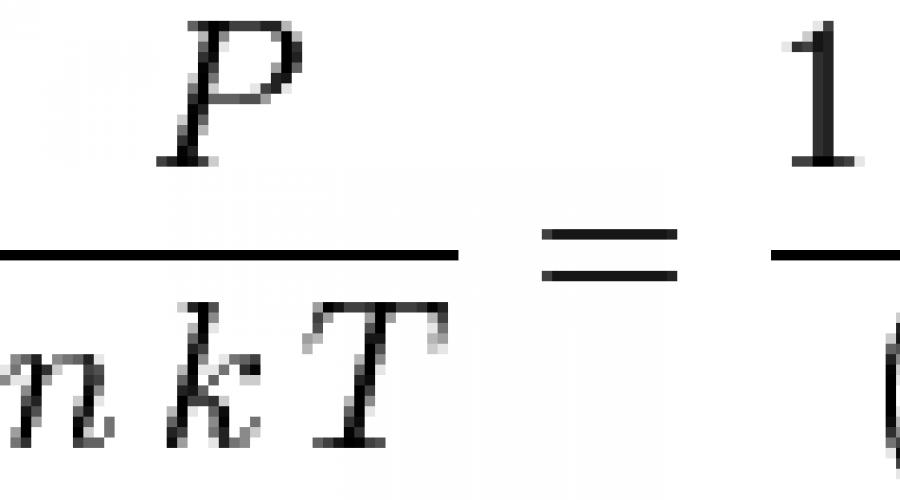
Basahin din
· Euler equation · Navier - Stokes equation · Diffusion equation · Hooke's law
Bilang isang patakaran, ang isang sangkap sa estado ng likido ay may isang pagbabago lamang. (Ang pinakamahalagang eksepsiyon ay ang mga quantum liquid at liquid crystals.) Samakatuwid, sa karamihan ng mga kaso, ang likido ay hindi lamang isang estado ng pagsasama-sama, kundi pati na rin isang thermodynamic phase (liquid phase).
Ang lahat ng mga likido ay karaniwang nahahati sa mga purong likido at pinaghalong. Ang ilang mga pinaghalong likido ay may malaking kahalagahan para sa buhay: dugo, tubig dagat, atbp. Ang mga likido ay maaaring gumana bilang mga solvents.
Mga pisikal na katangian ng mga likido
- Pagkalikido
Ang pangunahing pag-aari ng mga likido ay pagkalikido. Kung ang isang panlabas na puwersa ay inilapat sa isang seksyon ng isang likido na nasa ekwilibriyo, pagkatapos ay isang daloy ng mga particle ng likido ay lumitaw sa direksyon kung saan inilalapat ang puwersa na ito: ang likido ay dumadaloy. Kaya, sa ilalim ng impluwensya ng hindi balanseng panlabas na puwersa, ang likido ay hindi nagpapanatili ng hugis at kamag-anak na pag-aayos ng mga bahagi, at samakatuwid ay tumatagal ng hugis ng sisidlan kung saan ito matatagpuan.
Hindi tulad ng mga plastik na solido, ang isang likido ay walang punto ng pagbubunga: ito ay sapat na upang mag-aplay ng isang arbitraryong maliit na panlabas na puwersa para sa likido na dumaloy.
- Pagtitipid ng volume
Ang isa sa mga katangian ng isang likido ay ang pagkakaroon nito ng isang tiyak na dami (sa ilalim ng patuloy na panlabas na mga kondisyon). Ang isang likido ay napakahirap na i-compress nang mekanikal dahil, hindi tulad ng isang gas, mayroong napakakaunting libreng espasyo sa pagitan ng mga molekula. Ang presyon na ibinibigay sa isang likidong nakapaloob sa isang sisidlan ay ipinapadala nang walang pagbabago sa bawat punto sa dami ng likidong ito (ang batas ng Pascal ay may bisa din para sa mga gas). Ang tampok na ito, kasama ang napakababang compressibility, ay ginagamit sa mga hydraulic machine.
Ang mga likido ay karaniwang tumataas sa volume (lumalawak) kapag pinainit at bumababa sa volume (kontrata) kapag pinalamig. Gayunpaman, may mga pagbubukod, halimbawa, ang tubig ay kumukuha kapag pinainit, sa normal na presyon at temperatura mula 0°C hanggang humigit-kumulang 4°C.
- Lagkit
Bilang karagdagan, ang mga likido (tulad ng mga gas) ay nailalarawan sa pamamagitan ng lagkit. Ito ay tinukoy bilang ang kakayahang labanan ang paggalaw ng isang bahagi na may kaugnayan sa isa pa - iyon ay, bilang panloob na alitan.
Kapag ang mga katabing layer ng likido ay gumagalaw nang may kaugnayan sa isa't isa, ang mga banggaan ng mga molekula ay hindi maiiwasang mangyari bilang karagdagan sa dulot ng thermal motion. Lumilitaw ang mga puwersa na pumipigil sa maayos na paggalaw. Sa kasong ito, ang kinetic energy ng nakaayos na paggalaw ay nagiging thermal energy - ang enerhiya ng magulong paggalaw ng mga molekula.
Ang likido sa sisidlan, na kumikilos at iniiwan sa sarili nitong mga aparato, ay unti-unting titigil, ngunit ang temperatura nito ay tataas.
- Libreng pagbuo ng ibabaw at pag-igting sa ibabaw
Dahil sa pag-iingat ng lakas ng tunog, ang likido ay maaaring bumuo ng isang libreng ibabaw. Ang nasabing ibabaw ay ang interface sa pagitan ng mga phase ng isang naibigay na sangkap: sa isang gilid mayroong isang likidong bahagi, sa kabilang banda ay may gas na bahagi (singaw), at, marahil, iba pang mga gas, halimbawa, hangin.
Kung ang likido at gas na mga phase ng parehong substansiya ay nakipag-ugnay, ang mga puwersa ay lumitaw na may posibilidad na bawasan ang lugar ng interface - mga puwersa ng pag-igting sa ibabaw. Ang interface ay kumikilos tulad ng isang nababanat na lamad na may posibilidad na kumukuha.
Ang pag-igting sa ibabaw ay maaaring ipaliwanag sa pamamagitan ng pagkahumaling sa pagitan ng mga likidong molekula. Ang bawat molekula ay umaakit ng iba pang mga molekula at may posibilidad na "palibutan" ang sarili sa kanila, na nangangahulugang umalis sa ibabaw. Alinsunod dito, ang ibabaw ay may posibilidad na bumaba.
Samakatuwid, ang mga bula ng sabon at mga bula ay may posibilidad na magkaroon ng spherical na hugis kapag kumukulo: para sa isang partikular na volume, ang isang globo ay may pinakamababang lugar sa ibabaw. Kung ang mga puwersa ng pag-igting sa ibabaw ay kumikilos lamang sa isang likido, ito ay kinakailangang magkaroon ng isang spherical na hugis - halimbawa, ang tubig ay bumaba sa zero gravity.
Ang mga maliliit na bagay na may densidad na mas malaki kaysa sa likido ay maaaring "lumulutang" sa ibabaw ng likido, dahil ang puwersa ng grabidad ay mas mababa kaysa sa puwersa na pumipigil sa pagtaas ng lugar sa ibabaw. (Tingnan ang pag-igting sa ibabaw.)
- Pagsingaw at paghalay
- Pagsasabog
Kapag mayroong dalawang halo-halong likido sa isang sisidlan, ang mga molekula, bilang resulta ng thermal movement, ay nagsisimulang unti-unting dumaan sa interface, at sa gayon ang mga likido ay unti-unting naghahalo. Ang hindi pangkaraniwang bagay na ito ay tinatawag na pagsasabog (nagaganap din sa mga sangkap sa ibang mga estado ng pagsasama-sama).
- Overheating at hypothermia
Ang isang likido ay maaaring painitin sa itaas ng kumukulong punto nito upang walang kumukulo na mangyari. Nangangailangan ito ng pare-parehong pag-init, nang walang makabuluhang pagbabago sa temperatura sa loob ng volume at walang mga mekanikal na impluwensya tulad ng vibration. Kung magtapon ka ng isang bagay sa sobrang init na likido, agad itong kumukulo. Ang sobrang init na tubig ay madaling makuha sa microwave oven.
Ang supercooling ay ang paglamig ng isang likido sa ibaba ng nagyeyelong punto nito nang hindi nagiging solidong estado ng pagsasama-sama. Tulad ng overheating, ang supercooling ay nangangailangan ng kawalan ng vibration at makabuluhang pagbabago sa temperatura.
- Densidad na alon
Bagama't napakahirap i-compress ng likido, nagbabago pa rin ang volume at density nito kapag nagbabago ang presyon. Hindi ito nangyayari kaagad; Kaya, kung ang isang lugar ay naka-compress, ang naturang compression ay ipinadala sa ibang mga lugar na may pagkaantala. Nangangahulugan ito na ang mga elastic wave, mas partikular na density waves, ay may kakayahang magpalaganap sa loob ng likido. Kasabay ng density, nagbabago rin ang iba pang pisikal na dami, gaya ng temperatura.
Kung, habang lumalaganap ang alon, medyo nagbabago ang density, ang naturang alon ay tinatawag na sound wave, o tunog.
Kung ang density ay nagbabago nang malakas, kung gayon ang naturang alon ay tinatawag na shock wave. Ang shock wave ay inilalarawan ng iba pang mga equation.
Ang mga densidad na alon sa isang likido ay pahaba, iyon ay, nagbabago ang density kasama ang direksyon ng pagpapalaganap ng alon. Walang mga transverse elastic wave sa likido dahil sa hindi pag-iingat ng hugis.
Ang mga nababanat na alon sa isang likido ay kumukupas sa paglipas ng panahon, ang kanilang enerhiya ay unti-unting nagiging thermal energy. Ang mga dahilan para sa pagpapalambing ay lagkit, "classical absorption", molecular relaxation at iba pa. Sa kasong ito, ang tinatawag na pangalawa, o volumetric na lagkit ay gumagana - panloob na alitan kapag nagbabago ang density. Ang shock wave, bilang isang resulta ng attenuation, pagkatapos ng ilang oras ay nagiging sound wave.
Ang mga nababanat na alon sa isang likido ay napapailalim din sa pagkalat ng mga inhomogeneities na nagreresulta mula sa magulong thermal motion ng mga molekula.
- Mga alon sa ibabaw
Kung ililipat mo ang isang seksyon ng likidong ibabaw mula sa posisyon ng balanse, pagkatapos ay sa ilalim ng pagkilos ng pagpapanumbalik ng mga puwersa ang ibabaw ay nagsisimulang bumalik sa posisyon ng balanse. Ang paggalaw na ito, gayunpaman, ay hindi tumitigil, ngunit nagiging isang oscillatory na paggalaw malapit sa posisyon ng equilibrium at kumakalat sa ibang mga lugar. Ito ay kung paano lumilitaw ang mga alon sa ibabaw ng likido.
Kung ang puwersa ng pagpapanumbalik ay pangunahing gravity, kung gayon ang mga naturang alon ay tinatawag na gravitational waves (hindi dapat malito sa mga gravity wave). Ang mga gravitational wave sa tubig ay makikita sa lahat ng dako.
Kung ang puwersa ng pagpapanumbalik ay higit sa lahat ang puwersa ng pag-igting sa ibabaw, kung gayon ang mga naturang alon ay tinatawag na capillary.
Kung ang mga puwersang ito ay maihahambing, ang mga naturang alon ay tinatawag na mga alon ng capillary-gravity.
Ang mga alon sa ibabaw ng isang likidong pagkabulok sa ilalim ng impluwensya ng lagkit at iba pang mga kadahilanan.
- Pagsasama-sama sa iba pang mga yugto
Sa pormal na pagsasalita, para sa balanseng magkakasamang buhay ng isang likidong bahagi sa iba pang mga yugto ng parehong sangkap - gas o mala-kristal - mahigpit na tinukoy na mga kondisyon ay kinakailangan. Kaya, sa isang naibigay na presyon, kinakailangan ang isang mahigpit na tinukoy na temperatura. Gayunpaman, sa kalikasan at sa teknolohiya sa lahat ng dako, ang likido ay magkakasamang umiiral sa singaw, o din sa isang solidong estado ng pagsasama-sama - halimbawa, tubig na may singaw at madalas na may yelo (kung isasaalang-alang natin ang singaw bilang isang hiwalay na bahagi na naroroon kasama ng hangin). Ito ay dahil sa mga sumusunod na dahilan.
Estado ng hindi balanse. Ito ay tumatagal ng oras para sa isang likido upang sumingaw hanggang sa ang likido ay ganap na sumingaw, ito ay kasama ng singaw. Sa likas na katangian, ang tubig ay patuloy na sumingaw, pati na rin ang kabaligtaran na proseso - paghalay.
Saradong volume. Ang likido sa isang saradong sisidlan ay nagsisimulang mag-evaporate, ngunit dahil ang dami ay limitado, ang presyon ng singaw ay tumataas, ito ay nagiging puspos bago pa man ang likido ay ganap na sumingaw, kung ang dami nito ay sapat na malaki. Kapag naabot ang saturation state, ang halaga ng evaporated liquid ay katumbas ng halaga ng condensed liquid, ang system ay pumapasok sa equilibrium. Kaya, sa isang limitadong dami, ang mga kondisyon na kinakailangan para sa ekwilibriyong magkakasamang buhay ng likido at singaw ay maaaring maitatag.
Ang pagkakaroon ng atmospera sa mga kondisyon ng gravity ng lupa. Ang isang likido ay apektado ng atmospheric pressure (hangin at singaw), habang para sa singaw halos lamang ang bahagyang presyon nito ay dapat isaalang-alang. Samakatuwid, ang likido at singaw sa itaas ng ibabaw nito ay tumutugma sa iba't ibang mga punto sa phase diagram, sa rehiyon ng pagkakaroon ng likidong bahagi at sa rehiyon ng pagkakaroon ng gaseous phase, ayon sa pagkakabanggit. Hindi nito kinansela ang pagsingaw, ngunit ang pagsingaw ay nangangailangan ng panahon kung kailan magkakasamang nabubuhay ang parehong mga yugto. Kung wala ang kondisyong ito, ang mga likido ay kumukulo at sumingaw nang napakabilis.
Teorya
Mechanics
Ang pag-aaral ng paggalaw at mekanikal na balanse ng mga likido at gas at ang kanilang pakikipag-ugnayan sa isa't isa at sa mga solidong katawan ay nakatuon sa seksyon ng mekanika - hydroaeromechanics (madalas na tinatawag ding hydrodynamics). Ang fluid aeromechanics ay bahagi ng isang mas pangkalahatang sangay ng mechanics, continuum mechanics.
Ang fluid mechanics ay isang sangay ng hydroaeromechanics na tumatalakay sa mga incompressible na likido. Dahil ang compressibility ng mga likido ay napakaliit, sa maraming mga kaso maaari itong mapabayaan. Ang dinamika ng gas ay nakatuon sa pag-aaral ng mga compressible na likido at gas.
Ang fluid mechanics ay nahahati sa hydrostatics, na pinag-aaralan ang equilibrium ng incompressible fluids, at hydrodynamics (sa makitid na kahulugan), na nag-aaral ng kanilang paggalaw.
Ang paggalaw ng mga electrically conductive at magnetic fluid ay pinag-aralan sa magnetohydrodynamics. Ginagamit ang hydraulics upang malutas ang mga inilapat na problema.
Ang pangunahing batas ng hydrostatics ay ang batas ni Pascal.
2. Mga likido mula sa mga molekulang diatomic na binubuo ng magkaparehong mga atomo (likidong hydrogen, likidong nitrogen). Ang ganitong mga molekula ay may quadrupole moment.
4. Mga likidong binubuo ng mga polar molecule na konektado ng dipole-dipole interaction (liquid hydrogen bromide).
5. Mga kaugnay na likido, o mga likidong may hydrogen bond (tubig, gliserin).
6. Mga likidong binubuo ng malalaking molekula kung saan mahalaga ang panloob na antas ng kalayaan.
Ang mga likido ng unang dalawang grupo (minsan tatlo) ay karaniwang tinatawag na simple. Ang mga simpleng likido ay napag-aralan nang mas mahusay kaysa sa iba; Hindi kasama sa klasipikasyong ito ang mga quantum liquid at liquid crystal, na mga espesyal na kaso at dapat isaalang-alang nang hiwalay.
Teorya ng istatistika
Ang istruktura at thermodynamic na katangian ng mga likido ay pinakamatagumpay na pinag-aralan gamit ang Percus-Yevik equation.
Kung gagamitin namin ang modelo ng hard ball, iyon ay, isinasaalang-alang namin ang mga likidong molekula bilang mga bola na may diameter d, kung gayon ang equation ng Percus-Yevick ay maaaring malutas nang analytical at makuha ang equation ng estado ng likido:
![]() saan n- bilang ng mga particle bawat dami ng yunit,
saan n- bilang ng mga particle bawat dami ng yunit, ![]() - walang sukat na density. Sa mababang densidad, ang equation na ito ay nagbabago sa equation ng estado ng isang ideal na gas:
- walang sukat na density. Sa mababang densidad, ang equation na ito ay nagbabago sa equation ng estado ng isang ideal na gas: ![]() . Para sa napakataas na densidad, , ang equation ng estado ng isang incompressible fluid ay nakuha: .
. Para sa napakataas na densidad, , ang equation ng estado ng isang incompressible fluid ay nakuha: .
Ang modelo ng solid ball ay hindi isinasaalang-alang ang atraksyon sa pagitan ng mga molekula, kaya walang matalim na paglipat sa pagitan ng likido at gas kapag nagbabago ang mga panlabas na kondisyon.
Kung kinakailangan ang mas tumpak na mga resulta, kung gayon ang pinakamahusay na paglalarawan ng istraktura at mga katangian ng likido ay nakakamit gamit ang teorya ng perturbation. Sa kasong ito, ang modelo ng hard ball ay itinuturing na isang zero approximation, at ang mga kaakit-akit na puwersa sa pagitan ng mga molekula ay itinuturing na isang kaguluhan at nagbibigay ng mga pagwawasto.
Teorya ng klaster
Isa sa mga makabagong teorya ay "Cluster theory". Ito ay batay sa ideya na ang isang likido ay kinakatawan bilang isang kumbinasyon ng isang solid at isang gas. Sa kasong ito, ang mga solidong bahagi ng particle (mga kristal na gumagalaw sa maikling distansya) ay matatagpuan sa isang ulap ng gas, na bumubuo istraktura ng kumpol. Ang enerhiya ng butil ay tumutugma sa pamamahagi ng Boltzmann, habang ang average na enerhiya ng system ay nananatiling pare-pareho (sa kondisyon na ito ay nakahiwalay). Ang mga mabagal na particle ay bumabangga sa mga kumpol at naging bahagi ng mga ito. Kaya ang pagsasaayos ng mga kumpol ay patuloy na nagbabago, ang sistema ay nasa isang estado ng dynamic na balanse. Kapag nalikha ang isang panlabas na impluwensya, ang sistema ay kikilos ayon sa prinsipyo ng Le Chatelier. Kaya, madaling ipaliwanag ang pagbabagong bahagi:
- Kapag pinainit, ang sistema ay unti-unting magiging gas (kumukulo)
- Kapag pinalamig, ang sistema ay unti-unting magiging solid (nagyeyelo).
Mga eksperimental na pamamaraan ng pananaliksik
Ang istraktura ng mga likido ay pinag-aaralan gamit ang mga pamamaraan ng x-ray structural analysis, electron diffraction at neutron diffraction.
Tingnan din
- Mga tampok ng ibabaw na layer ng likido
Mga link
| Thermodynamic na estado ng bagay | |
|---|---|
| Physics: Solid likido Gas Plasma | |
- Solid na estado
- Katayuan ng likido
- Gaseous na estado
- Pagbabago sa estado ng bagay
Mahalaga ang pag-aaral ng kimika. Ano ang "substance"? Ang bagay ay anumang bagay na may mass at volume. Ang isang sangkap ay maaaring nasa isa sa tatlong estado ng pagsasama-sama: solid, likido, gas.
1. Solid na estado
Ang mga particle (molekula) sa isang solid ay pinagsama sa isang matibay na paulit-ulit na istraktura - kristal na sala-sala. Ang mga particle sa crystal lattice ay sumasailalim sa maliliit na vibrations sa paligid ng mga sentro ng equilibrium. Ang isang solid ay may anyo At dami.
2. Katayuan ng likido
Hindi tulad ng mga solido, ang mga likido ay walang tiyak na hugis, ngunit mayroon silang volume. Ito ay ipinaliwanag sa pamamagitan ng katotohanan na sa mga likido ang mga particle ay nasa mas malaking distansya mula sa isa't isa kaysa sa mga solido at kumikilos nang mas aktibo.
Dahil ang mga particle sa mga likido ay matatagpuan nang hindi gaanong siksik kaysa sa mga solido, hindi sila maaaring bumuo ng isang kristal na sala-sala, samakatuwid ang mga likido ay walang tiyak na hugis.
3. Gaseous na estado
Sa mga gas, ang mga particle ay matatagpuan sa mas malaking distansya kaysa sa mga likido. Bukod dito, ang mga particle ay patuloy na nasa magulong (hindi maayos) na paggalaw. Samakatuwid, ang mga gas ay may posibilidad na pantay na punan ang volume na ibinigay sa kanila (kaya ang katotohanan na ang mga gas ay walang tiyak na hugis).
4. Pagbabago sa estado ng bagay
Kumuha tayo ng isang maliit na halimbawa at sundin ang proseso ng pagbabago ng estado ng tubig.
Sa solid state nito, ang tubig ay yelo. Ang temperatura ng yelo ay mas mababa sa 0 o C. Kapag pinainit, ang yelo ay nagsisimulang matunaw at nagiging tubig. Ito ay ipinaliwanag sa pamamagitan ng katotohanan na ang mga particle ng yelo na matatagpuan sa kristal na sala-sala ay nagsisimulang gumalaw kapag pinainit, bilang isang resulta kung saan ang sala-sala ay nawasak. Ang temperatura kung saan natutunaw ang isang sangkap ay tinatawag "titik ng pagkatunaw" mga sangkap. Ang punto ng pagkatunaw ng tubig ay 0 o C.
Dapat tandaan na hanggang sa ganap na matunaw ang yelo, ang temperatura ng yelo ay magiging 0 o C.
| Sa panahon ng mga pagbabago sa bahagi ng isang sangkap, ang temperatura ay nananatiling pare-pareho |
Matapos ganap na maging tubig ang yelo, ipagpapatuloy namin ang pag-init. Ang temperatura ng tubig ay tataas, at ang paggalaw ng mga particle sa ilalim ng impluwensya ng init ay lalong magpapabilis. Nangyayari ito hanggang sa maabot ng tubig ang susunod na punto ng pagbabago - kumukulo.
Ang sandaling ito ay nangyayari kapag ang mga bono ng mga particle ng tubig ay ganap na naputol at ang kanilang paggalaw ay nagiging malaya: ang tubig ay nagiging singaw.
| Ang proseso ng pagbabago ng isang sangkap mula sa isang likido patungo sa isang gas na estado ay tinatawag kumukulo |
Ang temperatura kung saan kumukulo ang isang likido ay tinatawag "punto ng kumukulo".
Mangyaring tandaan na ang punto ng kumukulo ay depende sa presyon. Sa normal na presyon (760 mm Hg), ang kumukulo na punto ng tubig ay 100 o C.
Sa pamamagitan ng pagkakatulad sa pagkatunaw: hanggang ang tubig ay ganap na nagiging singaw, ang temperatura ay mananatiling pare-pareho.
I-summarize natin. Bilang resulta ng pag-init, nakakuha kami ng iba't ibang phase states ng tubig:
Yelo → tubig → singaw o N 2 0 (t) → N 2 0 (g) → N 2 0 (g)
Ano ang mangyayari kung sinimulan nating palamigin ang singaw ng tubig? Hindi mo kailangang maging isang "pinakamahusay na mag-aaral" upang hulaan na ang kabaligtaran na proseso ng mga pagbabago sa yugto ng tubig ay magaganap:
Singaw → tubig → yelo
Mayroong ilang mga sangkap na direktang napupunta mula sa isang solidong estado sa isang estado ng gas, na lumalampas sa likidong bahagi. Ang prosesong ito ay tinatawag na pangingimbabaw o pangingimbabaw. Ganito, halimbawa, ang "dry ice" (nitrogen dioxide CO 2) kumilos. Kapag pinainit, hindi ka makakakita ng isang patak ng tubig - ang "dry ice" ay tila sumingaw sa harap ng iyong mga mata.
Ang kabaligtaran na proseso ng sublimation (ang paglipat ng isang sangkap mula sa isang gas patungo sa isang solidong estado) ay tinatawag desublimation.
Ang mga likido ay sumasakop sa isang intermediate na posisyon sa pagitan ng mga gas at solidong sangkap. Sa mga temperatura na malapit sa kumukulo, ang mga katangian ng mga likido ay lumalapit sa mga gas; sa mga temperatura na malapit sa punto ng pagkatunaw, ang mga katangian ng mga likido ay lumalapit sa mga katangian ng mga solido. Kung ang mga solidong sangkap ay nailalarawan sa pamamagitan ng isang mahigpit na pagkakasunud-sunod ng mga particle, na umaabot sa mga distansya ng hanggang sa daan-daang libong interatomic o intermolecular radii, kung gayon sa isang likidong sangkap ay karaniwang hindi hihigit sa ilang dosenang mga naka-order na mga particle - ito ay ipinaliwanag sa pamamagitan ng katotohanan na Ang pagkakasunud-sunod sa pagitan ng mga particle sa iba't ibang lugar ng isang likidong substansiya ay mabilis ding bumangon, at muli ay "nasira" ng thermal vibration ng mga particle. Kasabay nito, ang kabuuang densidad ng packing ng mga particle ng isang likidong substansiya ay kaunti lamang ang naiiba sa solidong sangkap - samakatuwid, ang kanilang density ay malapit sa density ng mga solido, at ang kanilang compressibility ay napakababa. Halimbawa, upang mabawasan ang volume na inookupahan ng likidong tubig sa pamamagitan ng 1%, isang presyon ng ~200 atm ay kinakailangan, samantalang para sa parehong pagbawas sa dami ng mga gas, isang presyon ng tungkol sa 0.01 atm ay kinakailangan. Dahil dito, ang compressibility ng mga likido ay humigit-kumulang 200: 0.01 = 20,000 beses na mas mababa kaysa sa compressibility ng mga gas.
Nabanggit sa itaas na ang mga likido ay may sariling dami at kunin ang hugis ng sisidlan kung saan sila matatagpuan; ang mga katangiang ito ay mas malapit sa mga katangian ng isang solid kaysa sa isang gas na sangkap. Ang kalapitan ng estado ng likido sa solidong estado ay kinumpirma rin ng data sa mga karaniwang enthalpi ng pagsingaw ∆H° eva at karaniwang mga enthalpi ng natutunaw na ∆H° pl. Standard enthalpy ng singaw ay ang halaga ng init na kinakailangan upang ma-convert ang 1 mole ng likido sa singaw sa 1 atm (101.3 kPa). Ang parehong halaga ng init ay inilabas kapag ang 1 mole ng singaw ay nag-condense sa isang likido sa 1 atm. Ang dami ng init na natupok upang i-convert ang 1 mole ng solid sa isang likido sa 1 atm karaniwang enthalpy ng pagsasanib(Ang parehong dami ng init ay inilabas kapag ang 1 mole ng likido ay "nag-freeze" ("tumigas") sa 1 atm). Alam na ang ∆Н° pl ay mas mababa kaysa sa kaukulang mga halaga ng ∆Н° isp, na madaling maunawaan, dahil ang paglipat mula sa isang solido patungo sa isang likidong estado ay sinamahan ng mas kaunting pagkagambala ng intermolecular attraction kaysa sa paglipat mula sa isang likido hanggang sa isang gas na estado.
Ang isang bilang ng iba pang mahahalagang katangian ng mga likido ay mas katulad ng mga katangian ng mga gas. Kaya, tulad ng mga gas, ang mga likido ay maaaring dumaloy - ang ari-arian na ito ay tinatawag na pagkalikido. Ang paglaban sa daloy ay tinutukoy ng lagkit. Ang pagkalikido at lagkit ay apektado ng mga kaakit-akit na puwersa sa pagitan ng mga likidong molekula, ang kanilang kamag-anak na timbang ng molekular, at ilang iba pang mga kadahilanan. Ang lagkit ng mga likido ay ~100 beses na mas malaki kaysa sa mga gas. Tulad ng mga gas, ang mga likido ay maaaring magkalat, bagama't mas mabagal dahil ang mga particle ng likido ay naka-pack na mas siksik kaysa sa mga particle ng gas.
Ang isa sa pinakamahalagang katangian ng isang likido ay ang nito pag-igting sa ibabaw(ang ari-arian na ito ay hindi likas sa alinman sa mga gas o solid). Ang isang molekula sa isang likido ay pantay na kumikilos sa pamamagitan ng mga intermolecular na pwersa mula sa lahat ng panig. Gayunpaman, sa ibabaw ng likido ang balanse ng mga puwersang ito ay nabalisa, at bilang isang resulta, ang "ibabaw" na mga molekula ay nahahanap ang kanilang mga sarili sa ilalim ng impluwensya ng isang tiyak na resultang puwersa na nakadirekta sa likido. Para sa kadahilanang ito, ang ibabaw ng likido ay nasa isang estado ng pag-igting. Pag-igting sa ibabaw- ito ang pinakamababang puwersa na pumipigil sa paggalaw ng mga particle ng likido sa lalim ng likido at sa gayon ay pinipigilan ang ibabaw ng likido mula sa pagkontrata. Ito ay ang pag-igting sa ibabaw na nagpapaliwanag sa "hugis-patak" na hugis ng malayang bumabagsak na mga particle ng likido.
Sa likidong estado, ang distansya sa pagitan ng mga particle ay mas maliit kaysa sa gas na estado. Ang mga particle ay sumasakop sa karamihan ng lakas ng tunog, patuloy na naghipo sa isa't isa at umaakit sa isa't isa. Ang ilang pag-order ng mga particle (short-range order) ay sinusunod. Ang mga particle ay mobile na may kaugnayan sa bawat isa.
Sa mga likido, ang mga interaksyon ng van der Waals ay lumitaw sa pagitan ng mga particle: pagpapakalat, oryentasyon at induction. Ang mga maliliit na grupo ng mga particle na pinagsama ng ilang pwersa ay tinatawag mga kumpol. Sa kaso ng magkaparehong mga particle, ang mga kumpol sa isang likido ay tinatawag mga kasama
Sa mga likido, ang pagbuo ng mga bono ng hydrogen ay nagdaragdag sa pag-order ng mga particle. Gayunpaman, ang mga bono ng hydrogen at mga puwersa ng van der Waals ay marupok - ang mga molekula sa isang likidong estado ay nasa patuloy na magulong paggalaw, na tinatawag na Brownian motion.
Para sa likidong estado, ang pamamahagi ng Maxwell-Boltzmann ng mga molekula sa pamamagitan ng bilis at enerhiya ay wasto.
Ang teorya ng mga likido ay hindi gaanong binuo kaysa sa mga gas, dahil ang mga katangian ng mga likido ay nakasalalay sa geometry at polarity ng magkalapit na lokasyon ng mga molekula. Bilang karagdagan, ang kakulangan ng isang tiyak na istraktura ng mga likido ay nagpapahirap sa kanilang pormal na paglalarawan - sa karamihan ng mga aklat-aralin ay mas kaunting espasyo ang nakatuon sa mga likido kaysa sa mga gas at mala-kristal na solido.
Walang matalim na hangganan sa pagitan ng mga likido at gas - ito ay ganap na nawawala kritikal na puntos. Para sa bawat gas mayroong isang kilalang temperatura sa itaas kung saan hindi ito maaaring maging likido sa anumang presyon; kasama nito kritikal temperatura, ang hangganan (meniscus) sa pagitan ng likido at ang puspos na singaw nito ay nawawala. Ang pagkakaroon ng isang kritikal na temperatura ("ganap na kumukulo") ay itinatag ni D.I. Mendeleev noong 1860
Talahanayan 7.2 - Mga kritikal na parameter (t k, p k, V k) ng ilang mga sangkap
| sangkap | t k, o C | p k, atm | Vc, cm 3 /mol | t matunaw o C | t kip o C |
| Siya | -267,9 | 2,26 | 57,8 | -271,4 | -268,94 |
| H 2 | -239,9 | 12,8 | 65,0 | -259,2 | -252,77 |
| N 2 2 | -147,0 | 33,54 | 90,1 | -210,01 | -195,82 |
| O 2 2 | -118,4 | 50,1 | -218,76 | -182,97 | |
| CH 4 | -82,1 | 45,8 | 99,0 | -182,49 | -161,58 |
| CO2 | +31,0 | 72,9 | 94,0 | -56,16 | -78.48(sub) |
| NH 3 | 132,3 | 111,3 | 72,5 | -77,76 | -33,43 |
| Cl2 | 144,0 | 76,1 | -101,0 | -34,06 | |
| KAYA 2 | 157,5 | 77,8 | -75,48 | -10,02 | |
| H2O | 374,2 | 218,1 | 0,0 | 100,0 |
Presyon ng singaw– bahagyang presyon kung saan ang mga rate ng evaporation at condensation ng singaw ay pantay:
kung saan ang A at B ay mga pare-pareho.
Boiling point– ang temperatura kung saan ang saturated vapor pressure ng isang likido ay katumbas ng atmospheric pressure.
May mga likido pagkalikido– kakayahang lumipat sa ilalim ng impluwensya ng maliliit na puwersa ng paggugupit; sinasakop ng likido ang dami kung saan ito inilalagay.
Ang fluid resistance sa fluidity ay tinatawag lagkit,[Pa. Kasama].
Pag-igting sa ibabaw[J/m2] – ang gawaing kinakailangan upang lumikha ng isang yunit ng ibabaw.
Katayuan ng likidong kristal– ang mga sangkap sa likidong estado, na may mataas na antas ng pagkakasunud-sunod, ay sumasakop sa isang intermediate na posisyon sa pagitan ng mga kristal at likido. Mayroon silang pagkalikido, ngunit sa parehong oras ay may mahabang hanay na pagkakasunud-sunod. Halimbawa, ang mga derivative ng brown acid, azolitines, at steroid.
Pag-clear ng temperatura– ang temperatura kung saan ang mga likidong kristal (LC) ay nagbabago sa isang normal na estado ng likido.
7.5 Solids
Sa solidong estado, ang mga particle ay napakalapit sa isa't isa na ang mga malakas na bono ay lumitaw sa pagitan nila, walang paggalaw ng pagsasalin at nananatili ang mga panginginig ng boses sa kanilang posisyon. Ang mga solid ay maaaring nasa amorphous o crystalline na estado.
7.5.1 Mga sangkap na nasa amorphous na estado
Sa amorphous state, ang mga substance ay walang ordered structure.
malasalamin estado - isang solidong amorphous na estado ng isang sangkap na nakuha bilang isang resulta ng malalim na supercooling ng isang likido. Ang estado na ito ay wala sa equilibrium, ngunit ang mga baso ay maaaring umiral nang mahabang panahon. Ang paglambot ng salamin ay nangyayari sa isang tiyak na hanay ng temperatura - ang saklaw ng paglipat ng salamin, ang mga hangganan nito ay nakasalalay sa rate ng paglamig. Sa isang pagtaas sa rate ng paglamig ng isang likido o singaw, ang posibilidad na makuha ang sangkap na ito sa isang malasalamin na estado ay tumataas.
Sa pagtatapos ng 60s ng ika-20 siglo, ang mga amorphous na metal (metallic na baso) ay nakuha - para dito kinakailangan na palamig ang tinunaw na metal sa bilis na 10 6 - 10 8 deg/s. Karamihan sa mga amorphous na metal at haluang metal ay nag-kristal kapag pinainit nang higit sa 300 o C. Ang isa sa pinakamahalagang aplikasyon ay microelectronics (diffusion barrier sa interface ng metal-semiconductor) at magnetic storage device (LCD heads). Ang huli ay dahil sa kakaibang magnetic softness nito (magnetic anisotropy ay dalawang order ng magnitude na mas mababa kaysa sa conventional alloys).
Mga amorphous na sangkap isotropiko, ibig sabihin. may parehong mga katangian sa lahat ng direksyon.
7.5.2 Mga sangkap sa isang mala-kristal na estado
Solid na mala-kristal ang mga sangkap ay may nakaayos na istraktura na may paulit-ulit na mga elemento, na nagpapahintulot sa kanila na pag-aralan sa pamamagitan ng x-ray diffraction (x-ray diffraction method, ginamit mula noong 1912).
Ang mga solong kristal (mga solong compound) ay nailalarawan sa pamamagitan ng anisotropy - ang pagtitiwala ng mga katangian sa direksyon sa espasyo.
Ang regular na pag-aayos ng mga particle sa isang solid ay inilalarawan bilang isang kristal na sala-sala. Ang mga kristal na sangkap ay natutunaw sa isang tiyak na temperatura, na tinatawag na punto ng pagkatunaw.
Ang mga kristal ay nailalarawan sa pamamagitan ng enerhiya, lattice constant at coordination number.
Permanenteng grid nailalarawan ang distansya sa pagitan ng mga sentro ng mga particle na sumasakop sa mga node sa kristal sa direksyon ng mga katangian ng axes.
Numero ng koordinasyon karaniwang tinatawag na bilang ng mga particle na direktang katabi ng isang partikular na particle sa isang kristal (tingnan ang Figure 7.2 - numero ng koordinasyon na walo para sa parehong cesium at chlorine)
Enerhiya ng kristal na sala-sala ay ang enerhiya na kinakailangan upang sirain ang isang nunal ng isang kristal at alisin ang mga particle na lampas sa mga limitasyon ng kanilang pakikipag-ugnayan.

Figure 7.2 - Istraktura ng cesium chloride crystal CsCl (a) at ang body-centered cubic unit cell ng kristal na ito (b)
7.5.3 Mga istrukturang kristal
Ang pinakamaliit na yunit ng istruktura ng isang kristal, na nagpapahayag ng lahat ng mga katangian ng simetrya nito, ay elementarya cell. Kapag ang mga cell ay paulit-ulit na maraming beses sa tatlong dimensyon, ang isang kristal na sala-sala ay nakuha.
Mayroong pitong pangunahing mga cell: kubiko, tetrahedral, hexagonal, rhombohedral, ortho-rhombohedral, monoclinic at triclinic. Mayroong pitong derivatives ng mga pangunahing unit cell, halimbawa, body-centered, face-centered cubic.

a - unit cell ng NaCl crystal; b - siksik na nakasentro sa mukha na cubic packing ng NaCl; c - body-centered cubic packing ng isang CsCl crystal Figure Figure 7.3 - Unit cell
Mga isomorphic na sangkap– mga sangkap na may katulad na kemikal na kalikasan na bumubuo ng magkatulad na istrukturang kristal: CaSiO 4 at MgSiO 4
Polymorphism– mga compound na umiiral sa dalawa o higit pang kristal na istruktura, halimbawa SiO 2 (sa anyo ng hexagonal quartz, orthorhombic tridymite at cubic cristoballite.)
Mga pagbabago sa allotropic– polymorphic na mga pagbabago ng mga simpleng sangkap, halimbawa, carbon: brilyante, grapayt, carbyne, fullerene.
Batay sa likas na katangian ng mga particle sa mga node ng kristal na sala-sala at ang mga kemikal na bono sa pagitan nila, ang mga kristal ay nahahati sa:
1) molekular– ang mga node ay naglalaman ng mga molecule sa pagitan ng mababang-enerhiya na puwersa ng van der Waals na kumikilos: mga kristal ng yelo;
2) atomically- mga covalent na kristal– sa mga node ng mga kristal ay may mga atomo na bumubuo ng malakas na covalent bond sa isa't isa at may mataas na enerhiya ng sala-sala, halimbawa, brilyante (carbon);
3) mga ionic na kristal– ang mga istrukturang yunit ng mga kristal ng ganitong uri ay positibo at negatibong sisingilin ng mga ion, kung saan nagaganap ang pakikipag-ugnayang elektrikal, na nailalarawan ng medyo mataas na enerhiya, halimbawa NaCL, KCL;
4) mga kristal na metal– mga sangkap na may mataas na electrical conductivity, thermal conductivity, malleability, ductility, metallic glare at mataas na reflectivity na may kinalaman sa liwanag; ang bono sa mga kristal ay metal, ang enerhiya ng metal na bono ay intermediate sa pagitan ng mga energies ng covalent at molekular na kristal;
5) halo-halong mga kristal ng bono– may mga kumplikadong pakikipag-ugnayan sa pagitan ng mga particle na maaaring ilarawan sa pamamagitan ng superposisyon ng dalawa o higit pang mga uri ng mga bono sa isa't isa, halimbawa clathrates (kasama ang mga compound) - nabuo sa pamamagitan ng pagsasama ng mga molekula (panauhin) sa mga cavity ng isang mala-kristal na balangkas na binubuo ng mga particle ng ibang uri (hosts): gas clathrates CH 4. 6H 2 O, urea clathrates.
Sa kalikasan, ang tubig ay matatagpuan sa tatlong estado:
- solid state (snow, granizo, yelo);
- likidong estado (tubig, fog, hamog at ulan);
- estado ng gas (singaw).
Mula sa maagang pagkabata, kahit sa paaralan, pinag-aaralan nila ang iba't ibang pisikal na estado ng tubig: fog, rainfall, granizo, snow, yelo, atbp. Mayroong isa na pinag-aaralan nang detalyado sa paaralan. Nakikilala nila tayo araw-araw sa buhay at nakakaimpluwensya sa ating buhay. – ito ang estado ng tubig sa isang tiyak na temperatura at presyon, na nailalarawan sa loob ng isang tiyak na agwat.
Ang mga pangunahing konsepto ng estado ng tubig ay dapat na linawin na ang estado ng fog at maulap na estado ay hindi nauugnay sa pagbuo ng gas. Lumilitaw ang mga ito sa panahon ng paghalay. Ito ay isang natatanging katangian ng tubig na maaaring nasa tatlong magkakaibang estado ng pagsasama-sama. Ang tatlong estado ng tubig ay mahalaga para sa planeta; Sa paaralan ay nagpapakita sila ng iba't ibang mga eksperimento sa pagsingaw at. Sa anumang sulok ng kalikasan, ang tubig ay itinuturing na pinagmumulan ng buhay. Mayroong pang-apat na estado, hindi gaanong mahalaga - Deryagin water (Russian version), o bilang karaniwang tinatawag sa ngayon - Nanotube water (American version).
Solid na estado ng tubig
Ang hugis at dami ay napanatili. Sa mababang temperatura, ang sangkap ay nagyeyelo at nagiging solid. Kung ang presyon ay mataas, kung gayon ang temperatura ng solidification ay kinakailangan na mas mataas. Ang isang solid ay maaaring mala-kristal o walang hugis. Sa isang kristal, ang posisyon ng isang atom ay mahigpit na iniutos. Ang mga hugis ng mga kristal ay natural at kahawig ng isang polyhedron. Sa isang amorphous na katawan, ang mga punto ay matatagpuan magulo at oscillate lamang ang pinananatili sa kanila.
Liquid na estado ng tubig
Sa likidong estado, ang tubig ay nagpapanatili ng dami nito, ngunit ang hugis nito ay hindi napanatili. Ang ibig sabihin nito ay ang likido ay sumasakop lamang ng bahagi ng dami at maaaring dumaloy sa buong ibabaw. Kapag nag-aaral ng mga isyu ng estado ng likido sa paaralan, dapat mong maunawaan na ito ay isang intermediate na estado sa pagitan ng solid medium at gaseous medium. Ang mga likido ay nahahati sa dalisay at pinaghalong estado. Ang ilang mga pinaghalong ay napakahalaga para sa buhay, tulad ng dugo o tubig dagat. Ang mga likido ay maaaring kumilos bilang mga solvent.
Kondisyon ng gas
Ang hugis at dami ay hindi napanatili. Sa ibang paraan, ang estado ng gas, na pinag-aaralan sa paaralan, ay tinatawag na singaw ng tubig. Malinaw na ipinapakita ng mga eksperimento na ang singaw ay hindi nakikita, ito ay natutunaw sa hangin, at nagpapakita ng relatibong halumigmig. Ang solubility ay depende sa temperatura at presyon. Ang saturated steam at dew point ay mga indicator ng pinakamataas na konsentrasyon. Ang singaw at fog ay magkakaibang estado ng pagsasama-sama.
Ang pang-apat na estado ng pagsasama-sama ay plasma
Ang pag-aaral ng plasma at modernong mga eksperimento ay nagsimulang isaalang-alang ng kaunti mamaya. Ang plasma ay isang ganap o bahagyang na-ionized na gas; ito ay nangyayari sa isang estado ng equilibrium sa mataas na temperatura. Sa ilalim ng mga kondisyon ng lupa, nabuo ang isang paglabas ng gas. Tinutukoy ng mga katangian ng plasma ang estado ng gas nito, maliban na ang electrodynamics ay gumaganap ng malaking papel sa lahat ng ito. Sa mga pinagsama-samang estado, ang plasma ang pinakakaraniwan sa Uniberso. Ang pag-aaral ng mga bituin at interplanetary space ay nagpakita na ang mga sangkap ay nasa estado ng plasma.
Paano nagbabago ang mga estado ng pagsasama-sama?
Pagbabago ng proseso ng paglipat mula sa isang estado patungo sa isa pa:
- likido - singaw (pagsingaw at pagkulo);
- singaw - likido (condensation);
- likido - yelo (crystallization);
- yelo - likido (natutunaw);
- yelo - singaw (sublimation);
- singaw - yelo, pagbuo ng hamog na nagyelo (desublimation).
 Ang tubig ay tinatawag na isang kawili-wiling natural na mineral sa lupa. Ang mga tanong na ito ay kumplikado at nangangailangan ng patuloy na pag-aaral. Ang pisikal na estado sa paaralan ay nakumpirma ng mga eksperimento na isinagawa, at kung ang mga tanong ay lumitaw, ang mga eksperimento ay malinaw na ginagawang posible na maunawaan ang materyal na itinuro sa aralin. Kapag sumingaw, ang likido ay nagiging, ang proseso ay maaaring magsimula mula sa zero degrees. Habang tumataas ang temperatura, tumataas ito. Ang intensity nito ay nakumpirma ng kumukulong mga eksperimento sa 100 degrees. Ang mga tanong ng pagsingaw ay sinasagot sa pagsingaw mula sa ibabaw ng mga lawa, ilog at maging mula sa lupa. Kapag pinalamig, ang isang reverse transformation na proseso ay nangyayari kapag ang isang likido ay nabuo mula sa isang gas. Ang prosesong ito ay tinatawag na condensation, kapag ang maliliit na patak ng ulap ay nabuo mula sa singaw ng tubig sa hangin.
Ang tubig ay tinatawag na isang kawili-wiling natural na mineral sa lupa. Ang mga tanong na ito ay kumplikado at nangangailangan ng patuloy na pag-aaral. Ang pisikal na estado sa paaralan ay nakumpirma ng mga eksperimento na isinagawa, at kung ang mga tanong ay lumitaw, ang mga eksperimento ay malinaw na ginagawang posible na maunawaan ang materyal na itinuro sa aralin. Kapag sumingaw, ang likido ay nagiging, ang proseso ay maaaring magsimula mula sa zero degrees. Habang tumataas ang temperatura, tumataas ito. Ang intensity nito ay nakumpirma ng kumukulong mga eksperimento sa 100 degrees. Ang mga tanong ng pagsingaw ay sinasagot sa pagsingaw mula sa ibabaw ng mga lawa, ilog at maging mula sa lupa. Kapag pinalamig, ang isang reverse transformation na proseso ay nangyayari kapag ang isang likido ay nabuo mula sa isang gas. Ang prosesong ito ay tinatawag na condensation, kapag ang maliliit na patak ng ulap ay nabuo mula sa singaw ng tubig sa hangin.
Ang isang kapansin-pansin na halimbawa ay ang mercury thermometer, kung saan ang mercury ay ipinakita sa isang likidong estado sa temperatura na -39 degrees, ang mercury ay nagiging solid. Posibleng baguhin ang estado ng isang solidong katawan, ngunit mangangailangan ito ng karagdagang pagsisikap, halimbawa kapag baluktot ang isang kuko. Kadalasan, nagtatanong ang mga mag-aaral tungkol sa kung paano binibigyan ng hugis ang isang solidong katawan. Ginagawa ito sa mga pabrika at dalubhasang pagawaan gamit ang mga espesyal na kagamitan. Ganap na anumang sangkap ay maaaring umiral sa tatlong estado, kabilang ang tubig, depende ito sa mga pisikal na kondisyon. Kapag ang tubig ay dumadaan mula sa isang estado patungo sa isa pa, nagbabago ang pag-aayos ng molekular at paggalaw, ngunit ang komposisyon ng molekula ay hindi nagbabago. Tutulungan ka ng mga pang-eksperimentong gawain na obserbahan ang mga kagiliw-giliw na estado.