Propriedades básicas do elétron. De que é feito um elétron? Massa e carga de um elétron. Propriedades fundamentais e quânticas do elétron
Um elétron é uma partícula elementar, que é uma das principais unidades na estrutura da matéria. A carga de um elétron é negativa. As medições mais precisas foram feitas no início do século XX por Millikan e Ioffe.
A carga do elétron é igual a menos 1,602176487 (40) * 10 -1 9 C.
Através deste valor, a carga elétrica de outras partículas menores é medida.
Conceito geral do elétron
Na física de partículas, diz-se que o elétron é indivisível e não tem estrutura. Está envolvido em processos eletromagnéticos e gravitacionais, pertence ao grupo lépton, assim como sua antipartícula, o pósitron. Entre outros léptons, tem o peso mais leve. Se elétrons e pósitrons colidem, isso leva à sua aniquilação. Tal par pode surgir do gama-quântico de partículas.
Antes de o neutrino ser medido, era o elétron que era considerado a partícula mais leve. Na mecânica quântica, é referido como férmions. O elétron também tem um momento magnético. Se um pósitron também é referido a ele, então o pósitron é separado como uma partícula carregada positivamente, e o elétron é chamado de negatron, como uma partícula com carga negativa.

Propriedades individuais dos elétrons
Os elétrons pertencem à primeira geração de léptons, com propriedades de partículas e ondas. Cada um deles é dotado de um estado quântico, que é determinado pela medição da energia, orientação do spin e outros parâmetros. Ele revela sua pertença aos férmions pela impossibilidade de ter dois elétrons no mesmo estado quântico ao mesmo tempo (segundo o princípio de Pauli).
É estudado da mesma forma que uma quasipartícula em um potencial cristalino periódico, no qual a massa efetiva pode diferir significativamente da massa em repouso.
Através do movimento dos elétrons, ocorre uma corrente elétrica, magnetismo e termo EMF. A carga de um elétron em movimento forma um campo magnético. No entanto, um campo magnético externo desvia a partícula de uma direção reta. Quando acelerado, o elétron adquire a capacidade de absorver ou emitir energia como um fóton. Seu conjunto consiste em camadas atômicas de elétrons, cujo número e posição determinam as propriedades químicas.
A massa atômica consiste principalmente de prótons e nêutrons nucleares, enquanto a massa dos elétrons é de cerca de 0,06% do peso atômico total. A força elétrica de Coulomb é uma das principais forças que podem manter um elétron próximo ao núcleo. Mas quando moléculas são criadas a partir de átomos e ligações químicas surgem, os elétrons são redistribuídos no novo espaço formado.
Nucleons e hádrons estão envolvidos no aparecimento de elétrons. Isótopos com propriedades radioativas são capazes de emitir elétrons. Em condições de laboratório, essas partículas podem ser estudadas em instrumentos especiais e, por exemplo, os telescópios podem detectar radiação delas em nuvens de plasma.

Abertura
O elétron foi descoberto por físicos alemães no século XIX, quando estudavam as propriedades catódicas dos raios. Então outros cientistas começaram a estudá-lo com mais detalhes, trazendo-o para a categoria de uma partícula separada. A radiação e outros fenômenos físicos relacionados foram estudados.
Por exemplo, um grupo liderado por Thomson estimou a carga de um elétron e a massa dos raios catódicos, cujas proporções, como descobriram, não dependem de uma fonte material.
E Becquerel descobriu que os minerais emitem radiação por si mesmos, e seus raios beta podem ser desviados pela ação de um campo elétrico, enquanto a massa e a carga mantêm a mesma proporção que a dos raios catódicos.

Teoria atômica
De acordo com essa teoria, um átomo consiste em um núcleo e elétrons ao seu redor, dispostos na forma de uma nuvem. Eles estão em alguns estados quantizados de energia, cuja mudança é acompanhada pelo processo de absorção ou emissão de fótons.
Mecânica quântica
No início do século XX, foi formulada uma hipótese segundo a qual as partículas materiais têm as propriedades de partículas e ondas próprias. Além disso, a luz pode se manifestar na forma de uma onda (é chamada de onda de Broglie) e partículas (fótons).
Como resultado, foi formulada a famosa equação de Schrödinger, que descrevia a propagação das ondas de elétrons. Essa abordagem é chamada de mecânica quântica. Ele foi usado para calcular os estados eletrônicos de energia no átomo de hidrogênio.
Propriedades fundamentais e quânticas do elétron
A partícula exibe propriedades fundamentais e quânticas.
Os fundamentais incluem massa (9,109 * 10 -31 quilogramas), carga elétrica elementar (ou seja, a porção mínima da carga). De acordo com as medições feitas até agora, não foram encontrados elementos no elétron que possam revelar sua subestrutura. Mas alguns cientistas são da opinião de que é uma partícula com carga puntiforme. Conforme indicado no início do artigo, a carga elétrica eletrônica é -1,602 * 10 -19 C.

Sendo uma partícula, um elétron pode ser simultaneamente uma onda. O experimento com duas fendas confirma a possibilidade de sua passagem simultânea por ambas. Isso entra em conflito com as propriedades da partícula, onde só é possível passar por uma fenda de cada vez.
Os elétrons são considerados como tendo as mesmas propriedades físicas. Portanto, sua permutação, do ponto de vista da mecânica quântica, não leva a uma mudança no estado do sistema. A função de onda dos elétrons é antisimétrica. Portanto, suas soluções desaparecem quando elétrons idênticos entram no mesmo estado quântico (princípio de Pauli).
A carga específica de um elétron (ou seja, a razão) foi medida pela primeira vez por Thomson em 1897 usando o tubo de descarga mostrado na fig. 74.1. O feixe de elétrons emergindo do buraco no ânodo A (raios catódicos; ver § 85) passou entre as placas de um capacitor plano e caiu sobre uma tela fluorescente, criando um ponto luminoso sobre ela.
Ao aplicar tensão nas placas do capacitor, foi possível influenciar o feixe com um campo elétrico quase uniforme. O tubo foi colocado entre os pólos de um eletroímã, com a ajuda do qual foi possível criar um campo magnético uniforme perpendicular ao elétrico na mesma seção do caminho do elétron (a área desse campo é circulado na Fig. 74.1 com um círculo pontilhado). Com os campos desligados, o feixe atingiu a tela no ponto O. Cada um dos campos separadamente fez com que o feixe se deslocasse na direção vertical. Os valores de deslocamento são determinados pelas fórmulas (73.3) e (73.4) obtidas no parágrafo anterior.
Ligando o campo magnético e medindo o deslocamento do traço do feixe causado por ele
![]()
Thomson também ligou o campo elétrico e selecionou seu valor para que o feixe atingisse novamente o ponto O. Neste caso, os campos elétrico e magnético atuaram sobre os elétrons do feixe simultaneamente com a mesma magnitude, mas forças de direção oposta. Neste caso, a condição
Resolvendo as equações (74.1) e (74.2) juntas, Thomson calculou .
Bush usou o método de focalização magnética para determinar a carga específica dos elétrons. A essência deste método é a seguinte. Suponhamos que, em um campo magnético uniforme, um feixe de elétrons ligeiramente divergente, simétrico em relação à direção do campo, voe de um certo ponto, com a mesma velocidade v. As direções ao longo das quais os elétrons voam formam pequenos ângulos a com a direção B. No § 72, verificou-se que os elétrons se movem neste caso ao longo de trajetórias espirais, fazendo ao mesmo tempo
![]()
volta completa e deslocando-se ao longo da direção do campo a uma distância igual a
![]()

Devido à pequenez do ângulo a, as distâncias (74,3) para elétrons diferentes acabam sendo praticamente iguais e iguais (para ângulos pequenos). Consequentemente, um feixe ligeiramente divergente será focado em um ponto separado do ponto de emissão de elétrons por uma distância
![]()
No experimento de Bush, os elétrons emitidos pelo cátodo quente K (Fig. 74.2) são acelerados, passando pela diferença de potencial U aplicada entre o cátodo K e o ânodo A. Como resultado, eles adquirem uma velocidade u, o valor de que pode ser encontrado a partir da relação
Depois de voar para fora do buraco no ânodo, os elétrons formam um feixe estreito direcionado ao longo do eixo do tubo evacuado inserido dentro do solenóide. Um capacitor é colocado na entrada do solenóide, ao qual uma tensão alternada é aplicada. O campo criado pelo capacitor desvia os elétrons do feixe do eixo do instrumento por pequenos ângulos que mudam com o tempo. Isso leva a um "redemoinho" do feixe - os elétrons começam a se mover ao longo de várias trajetórias em espiral. Uma tela fluorescente é colocada na saída do solenóide. Se escolhermos a indução magnética B de modo que a distância Γ do capacitor à tela satisfaça a condição
(l é o passo da hélice, é um número inteiro), então o ponto de interseção das trajetórias dos elétrons atingirá a tela - o feixe de elétrons será focado neste ponto e excitará um ponto luminoso nítido na tela. Se a condição (74.6) não for atendida, o ponto luminoso na tela ficará borrado. Resolvendo as equações (74.4), (74.5) e (74.6) juntos, podemos encontrar
O valor mais preciso da carga específica de um elétron, estabelecido levando em consideração os resultados obtidos por diferentes métodos, é igual a
O valor (74,7) dá a razão entre a carga do elétron e sua massa de repouso. Nos experimentos de Thomson, Bush e outros experimentos semelhantes, a razão entre carga e massa relativística foi determinada, igual a
![]()

Nos experimentos de Thomson, a velocidade dos elétrons foi de aproximadamente 0,1 s. A esta velocidade, a massa relativística excede a massa de repouso em 0,5%. Em experimentos subsequentes, a velocidade do elétron atingiu valores muito altos. Em todos os casos, foi encontrada uma diminuição nos valores medidos com o aumento de v, o que ocorreu exatamente de acordo com a fórmula (74,8).
A carga de um elétron foi determinada com grande precisão por Millikan em 1909. Millikan introduziu minúsculas gotículas de óleo no espaço fechado entre placas de capacitores localizadas horizontalmente (Fig. 74.3). Quando pulverizadas, as gotículas eram eletrificadas, podendo ser instaladas imóveis, escolhendo-se o valor e o sinal da tensão no capacitor.
O equilíbrio veio sob a condição
aqui está a carga da gota, P é a força resultante da gravidade e a força de Arquimedes, igual a
![]() (74.10)
(74.10)
( - densidade de gotículas, - seu raio, - densidade do ar).
A partir das fórmulas (74,9) e (74,10), conhecendo , foi possível encontrar . Para determinar o raio, a taxa de queda uniforme de uma gota foi medida na ausência de um campo. O movimento uniforme da gota é estabelecido sob a condição de que a força P seja equilibrada pela força de resistência (ver fórmula (78.1) do 1º volume; - viscosidade do ar):
![]() (74.11)
(74.11)
O movimento das gotas foi observado com um microscópio. A medida foi determinada pelo tempo durante o qual a gota percorreu a distância entre dois filamentos visíveis no campo de visão do microscópio.
É muito difícil fixar com precisão o equilíbrio de uma gota. Portanto, em vez do campo correspondente à condição (74.9), tal campo foi acionado, sob a ação da qual a gota começou a se mover para cima em baixa velocidade. A velocidade constante de subida é determinada a partir da condição de que a força P e a força no total equilibrem a força
Eliminando da equação (74.10), (74.11) e (74.12) P e , obtemos uma expressão para
![]()
(Miliken fez uma correção nesta fórmula, levando em consideração que os tamanhos das gotículas eram comparáveis ao caminho livre médio das moléculas de ar).

Assim, medindo a velocidade de queda livre de uma gota e a velocidade de sua ascensão em um campo elétrico conhecido, foi possível encontrar a carga da gota e. Ao medir a velocidade em um determinado valor da carga, Millikan causou a ionização do ar irradiando o espaço entre as placas com raios-x. Íons separados aderidos à gota mudaram sua carga, como resultado da qual a velocidade também mudou. Após medir um novo valor de velocidade, o espaço entre as placas foi novamente irradiado, etc.
As mudanças na carga da gota medida por Millikan e a própria carga a cada vez acabaram sendo múltiplos inteiros do mesmo valor. Assim, provou-se experimentalmente a discrição da carga elétrica, ou seja, o fato de que toda carga é composta de cargas elementares de mesma magnitude.
O valor da carga elementar, estabelecido tendo em conta as medições de Millikan e os dados obtidos por outros métodos, é igual a
FUNDAMENTOS FÍSICOS DA OPERAÇÃO DE IONIC |
|||
E DISPOSITIVOS SEMICONDUTORES |
|||
1.1. Propriedades do elétron |
|||
O campo elétrico em dispositivos eletrônicos acelera ou tor- |
|||
provoca o movimento dos elétrons. Seja o elétron e localizado em |
|||
intensidade do campo elétrico E , força F atua (Fig. 1.1) |
|||
F = −eE, |
|||
dirigido contra a força do campo. |
|||
De acordo com a segunda lei de Newton, a força F é igual ao produto |
|||
massa do elétron m pela aceleração a, transmitida ao elétron pela força F |
|||
em um campo com intensidade E: |
|||
F = m. |
|||
De (1.1) e (1.2) a aceleração do |
|||
a = E e , |
|||
da equação (1.3) pode-se ver que c |
|||
alterando a voltagem da rede elétrica |
Arroz. 1.1. Um elétron em um |
||
do campo muda acelerando |
campo elétrico |
||
nielétron. Além disso, anexa- |
|||
na confluência da força de campo na direção da velocidade inicial v 0 |
elétron |
||
move-se rapidamente e adquire a maior velocidade e cinética |
|||
energia cal no final de seu caminho. |
|||
Encontramos a velocidade v do elétron com base nas posições conhecidas |
|||
física. Em primeiro lugar, o trabalho das forças de campo sobre o movimento de um |
|||

ron do ponto A ao ponto B é o produto da carga |
|||
elétron e na diferença de potencial desses pontos: |
|||
W e \u003d (− e) (UA − U B ). |
|||
Como U B > U A, então |
|||
U A − U B = − U . |
|||
Portanto, trabalhe |
|||
Nós = (e)(− U ) = eU. |
|||
Em segundo lugar, de acordo com a lei da conservação da energia, o trabalho que gastamos |
|||
campo no movimento de um elétron é igual ao incremento de cinética |
|||
a energia líquida de um elétron movendo-se em um campo elétrico: |
|||
W = m (v 2 − v 2 ) / 2 . |
|||
Tomando a velocidade inicial v 0 = 0, de (5) encontramos o valor |
|||
velocidade final do elétron |
|||
2 Nós = |
2 U e . |
||
A velocidade de um elétron em dispositivos eletrônicos é muito menor |
|||
menor que a velocidade da luz, então a razão dos valores e /m ≈ e /m 0 |
|||
v ≈ 600 |
|||
De (1.9) pode-se ver que a velocidade do elétron no |
|||
campo (km/s) depende apenas da diferença de potencial entre |
|||
os pontos inicial e final do caminho percorrido pelo elétron, e |
|||
não depende da forma do caminho. Às vezes, a velocidade de um elétron é medida em |
|||
volts. Por exemplo: a velocidade de um elétron é 100 V. Isso significa que a corrente elétrica |
|||
o trono adquiriu essa velocidade passando por uma diferença de potencial de 100 V. |
|||
Se um elétron inicia seu movimento a partir de um estado de repouso, ele |
|||
se moverá uniformemente acelerado, retilíneo contra a força |
|||
linhas de campo elétrico, absorvendo energia do campo. Elétrico |
|||
O campo magnético para um elétron está se acelerando. |
|||
Se a velocidade inicial coincide com a direção da força |
|||
linhas do campo elétrico, tal campo para um elétron é um |
|||
gemendo. A velocidade do elétron diminuirá, a energia do |
|||
a rone também diminuirá (será devolvida ao campo). Se um |
|||

permitir o tamanho do campo, o elétron irá parar, e então começar a se mover contra as linhas de força deste campo.
Se a velocidade inicial é direcionada contra as linhas de força do campo elétrico, tal campo para o elétron está se acelerando. O campo elétrico move cargas positivas na direção das linhas de força do campo.
1.2. Tipos de emissão eletrônica
O fenômeno de emissão de elétrons da superfície de um corpo sólido é chamado de emissão de elétrons, e a fonte de elétrons é chamada de emissor. Dependendo dos métodos de impacto da energia externa nos elétrons que os fazem sair do emissor, existem vários tipos de emissão de elétrons.
Emissão termionica ocorre como resultado do aquecimento do emissor. Com o aumento da temperatura, ocorrem vibrações térmicas da rede sólida. Devido a essa energia de excitação térmica, alguns dos elétrons saem do emissor, formando uma corrente de emissão. Quanto maior a temperatura do emissor, mais elétrons adquirem essa energia, como resultado do aumento da corrente de emissão termiônica. A temperatura mínima na qual a corrente de emissão aparece é chamada de crítica. Depende do material do emissor.
Emissão de elétrons secundário - emissão de eletrificado secundário
elétrons da superfície do emissor quando este é irradiado com um fluxo de elétrons primários. O fluxo de elétrons primário incidente no emissor secundário é parcialmente refletido de sua superfície e parcialmente penetra profundamente nele. Aqui, os elétrons primários colidem com os elétrons da rede cristalina do emissor, dando-lhes parte de sua energia, excitando-os. Parte dos elétrons excitados vai para o ambiente externo, esses elétrons são secundários.
Emissão eletrostática de elétrons (autoeletrônico)
surge da superfície de um corpo sólido ou líquido sob a ação de um campo elétrico acelerador externo de alta intensidade (107 V/m). Quanto maior a intensidade do campo, maior a corrente de emissão do campo.
Emissão fotoeletrônica ocorre quando o emissor é irradiado com um fluxo de luz. A eficiência deste tipo de emissão depende do comprimento de onda (dependência inversa) e da magnitude do fluxo luminoso (dependência direta).
Um elétron é uma partícula fundamental, uma daquelas que são as unidades estruturais da matéria. De acordo com a classificação, é um férmion (partícula com spin semi-inteiro, em homenagem ao físico E. Fermi) e um lépton (partículas com spin semi-inteiro que não participam de interação forte, uma das quatro principais em física). O bárion é zero, como outros léptons.
Até recentemente, acreditava-se que o elétron é uma partícula elementar, ou seja, indivisível, sem estrutura, mas agora os cientistas têm uma opinião diferente. Em que consiste um elétron de acordo com os físicos modernos?
Histórico de nomes
Mesmo na Grécia antiga, os naturalistas notaram que o âmbar, previamente esfregado com lã, atrai pequenos objetos para si, ou seja, exibe propriedades eletromagnéticas. O elétron recebeu o nome do grego ἤλεκτρον, que significa "âmbar". O termo foi proposto por J. Stoney em 1894, embora a própria partícula tenha sido descoberta por J. Thompson em 1897. Foi difícil detectá-lo, a razão para isso é a pequena massa, e a carga do elétron se tornou decisiva no experimento. As primeiras fotos da partícula foram tiradas por Charles Wilson usando uma câmera especial, que é usada até em experimentos modernos e leva seu nome.
Um fato interessante é que um dos pré-requisitos para a descoberta do elétron é a afirmação de Benjamin Franklin. Em 1749 ele desenvolveu a hipótese de que a eletricidade é uma substância material. Foi em suas obras que os termos cargas positivas e negativas, capacitor, descarga, bateria e uma partícula de eletricidade foram usados pela primeira vez. A carga específica de um elétron é considerada negativa e a de um próton é positiva.
Descoberta do elétron
Em 1846, o conceito de "átomo de eletricidade" começou a ser utilizado em seu trabalho pelo físico alemão Wilhelm Weber. Michael Faraday descobriu o termo "íon", que agora é, talvez, ainda conhecido na escola. Muitos cientistas eminentes lidaram com a natureza da eletricidade, como o físico e matemático alemão Julius Plücker, Jean Perrin, o físico inglês William Crookes, Ernst Rutherford e outros.
Assim, antes de Joseph Thompson concluir com sucesso seu famoso experimento e provar a existência de uma partícula menor que um átomo, muitos cientistas trabalharam nesse campo, e a descoberta não teria sido possível se não tivessem feito esse trabalho colossal.

Em 1906, Joseph Thompson recebeu o Prêmio Nobel. O experimento foi o seguinte: feixes de raios catódicos foram passados através de placas metálicas paralelas que criaram um campo elétrico. Depois tiveram que fazer o mesmo, mas através de um sistema de bobinas que criava um campo magnético. Thompson descobriu que sob a ação de um campo elétrico, os raios eram desviados, e o mesmo era observado com efeito magnético, mas os feixes de raios catódicos não mudavam suas trajetórias se ambos os campos atuassem sobre eles em certas proporções que dependiam de a velocidade das partículas.
Após cálculos, Thompson descobriu que a velocidade dessas partículas é significativamente menor que a velocidade da luz, o que significa que elas têm massa. A partir desse momento, os físicos passaram a acreditar que partículas abertas de matéria faziam parte do átomo, o que mais tarde foi confirmado, que ele chamou de "modelo planetário do átomo".
Paradoxos do mundo quântico
A questão do que consiste o elétron é bastante complicada, pelo menos neste estágio do desenvolvimento da ciência. Antes de considerá-lo, é preciso abordar um dos paradoxos da física quântica que nem os próprios cientistas podem explicar. Este é o famoso experimento da dupla fenda, que explica a natureza dual do elétron.
Sua essência é que, na frente do "canhão" que dispara partículas, é instalado um quadro com um orifício retangular vertical. Atrás dela há uma parede, na qual serão observados vestígios de acertos. Então, primeiro você precisa descobrir como a matéria se comporta. A maneira mais fácil é imaginar como as bolas de tênis são lançadas por uma máquina. Algumas das bolas caem no buraco e as marcas dos golpes na parede formam uma faixa vertical. Se a alguma distância for adicionado mais um furo semelhante, os traços formarão, respectivamente, duas listras.
As ondas se comportam de maneira diferente nesta situação. Se os traços de uma colisão com uma onda forem exibidos na parede, no caso de um único furo, a faixa também será uma. No entanto, tudo muda no caso de duas fendas. A onda, passando pelos buracos, é dividida ao meio. Se o topo de uma das ondas encontra o fundo da outra, elas se cancelam e um padrão de interferência (várias listras verticais) aparecerá na parede. Lugares na intersecção de ondas deixarão um rastro, mas lugares onde ocorreu amortecimento mútuo não o farão.

Descoberta incrível
Com a ajuda do experimento descrito acima, os cientistas podem demonstrar claramente ao mundo a diferença entre a física quântica e a clássica. Quando eles bombardearam a parede com elétrons, a trilha vertical usual apareceu nela: algumas partículas, assim como bolas de tênis, caíram na brecha, e outras não. Mas tudo mudou quando o segundo buraco apareceu. Apareceu na parede Primeiro, os físicos decidiram que os elétrons estavam interferindo uns nos outros, e decidiram deixá-los entrar um por um. No entanto, já depois de algumas horas (a velocidade dos elétrons em movimento ainda é muito menor que a velocidade da luz), o padrão de interferência começou a aparecer novamente.
Curva inesperada
O elétron, juntamente com algumas outras partículas, como fótons, exibe dualidade onda-partícula (o termo "dualismo de onda quântica" também é usado). Como vivo e morto ao mesmo tempo, o estado de um elétron pode ser tanto corpuscular quanto ondulatório.
No entanto, o próximo passo desse experimento deu origem a ainda mais mistérios: uma partícula fundamental, sobre a qual tudo parecia ser conhecido, apresentou uma surpresa incrível. Os físicos decidiram instalar um dispositivo de observação nos buracos para determinar exatamente por qual fenda as partículas passam e como elas se manifestam como uma onda. Mas assim que o mecanismo de observação foi colocado, apenas duas listras apareceram na parede, correspondendo a dois furos, e nenhum padrão de interferência! Assim que a “vigilância” foi removida, a partícula voltou a apresentar propriedades ondulatórias, como se soubesse que ninguém mais a estava observando.
Outra teoria
O físico Born sugeriu que a partícula não se transforma em onda no verdadeiro sentido da palavra. O elétron "contém" uma onda de probabilidade, é essa onda que dá o padrão de interferência. Essas partículas têm a propriedade de superposição, ou seja, podem estar localizadas em qualquer lugar com certo grau de probabilidade, para que possam ser acompanhadas por essa “onda”.
No entanto, o resultado é óbvio: o próprio fato da presença de um observador afeta o resultado do experimento. Parece incrível, mas este não é o único exemplo desse tipo. Os físicos realizaram experimentos em partes maiores da matéria, uma vez que o objeto era o pedaço mais fino de papel alumínio. Os cientistas notaram que o simples fato de certas medições afetaram a temperatura do objeto. Eles ainda não são capazes de explicar a natureza de tais fenômenos.

Estrutura
Mas do que é feito um elétron? No momento, a ciência moderna não pode responder a essa pergunta. Até recentemente, era considerado uma partícula fundamental indivisível, mas agora os cientistas estão inclinados a acreditar que consiste em estruturas ainda menores.
A carga específica do elétron também era considerada elementar, mas agora foram descobertos quarks que têm uma carga fracionária. Existem várias teorias sobre o que um elétron é feito.
Hoje você pode ver artigos que afirmam que os cientistas conseguiram dividir um elétron. No entanto, isso é apenas parcialmente verdade.
Novos experimentos
Na década de 1980, cientistas soviéticos sugeriram que o elétron poderia ser dividido em três quase-partículas. Em 1996, foi possível dividi-la em spinon e hólon, e recentemente a partícula foi dividida em spinon e orbiton pelo físico Van den Brink e sua equipe. No entanto, a divisão só pode ser alcançada sob condições especiais. O experimento pode ser realizado em temperaturas extremamente baixas.
Quando os elétrons “esfriam” até o zero absoluto, que é cerca de -275 graus Celsius, eles praticamente param e formam algo como matéria entre si, como se se fundissem em uma partícula. Sob tais condições, os físicos conseguem observar as quasipartículas que compõem o elétron.

Portadores de informações
O raio de um elétron é muito pequeno, é igual a 2,81794. 10 -13 cm, no entanto, verifica-se que seus componentes são muito menores. Cada uma das três partes em que era possível "dividir" um elétron carrega informações sobre ele. Um orbiton, como o nome sugere, contém dados sobre a onda orbital da partícula. O spinon é responsável pelo spin do elétron, e o hólon nos informa sobre a carga. Assim, os físicos podem observar separadamente diferentes estados de elétrons em uma substância fortemente resfriada. Eles foram capazes de rastrear os pares hólon-spinon e spinon-órbito, mas não todos os três juntos.
Novas tecnologias
Os físicos que descobriram o elétron tiveram que esperar várias décadas até que sua descoberta fosse posta em prática. Em nosso tempo, as tecnologias encontram uso em poucos anos, basta lembrar o grafeno - um material incrível composto por átomos de carbono em uma única camada. Qual é a vantagem de dividir um elétron? Os cientistas prevêem a criação de uma velocidade que, em sua opinião, é várias dezenas de vezes maior que a dos computadores modernos mais poderosos.
Qual é o segredo da tecnologia de computação quântica? Isso pode ser chamado de otimização simples. Em um computador familiar, o menor e indivisível pedaço de informação é um bit. E se considerarmos os dados como algo visual, existem apenas duas opções para uma máquina. Um bit pode conter zero ou um, ou seja, partes do código binário.
Novo método
Agora vamos imaginar que um bit contém um zero e um - este é um "bit quântico" ou "qubit". O papel das variáveis simples será desempenhado pelo spin do elétron (ele pode girar no sentido horário ou anti-horário). Ao contrário de um bit simples, um qubit pode executar várias funções ao mesmo tempo, devido a isso, ocorrerá um aumento na velocidade do trabalho, a pequena massa e carga do elétron não importa aqui.
Isso pode ser explicado pelo exemplo de um labirinto. Para sair disso, você precisa tentar muitas opções diferentes, das quais apenas uma estará correta. Um computador tradicional, embora resolva problemas rapidamente, ainda pode trabalhar em apenas um único problema por vez. Ele passará por todas as opções de caminho, uma de cada vez, e eventualmente encontrará uma saída. Um computador quântico, devido à dualidade do qubit, pode resolver muitos problemas ao mesmo tempo. Ele revisará todas as opções possíveis não em turno, mas em um único momento, e também resolverá o problema. A dificuldade até agora é apenas fazer com que muitos quants trabalhem em uma tarefa - esta será a base de uma nova geração de computadores.

Inscrição
A maioria das pessoas usa computadores no nível doméstico. PCs comuns estão indo muito bem até agora, mas para prever eventos que dependem de milhares, talvez centenas de milhares de variáveis, a máquina deve ser simplesmente enorme. pode lidar facilmente com coisas como prever o clima por um mês, processar dados sobre desastres naturais e predizê-los, e também realizar cálculos matemáticos complexos com muitas variáveis em uma fração de segundo, tudo com um processador do tamanho de vários átomos. Então, talvez muito em breve nossos computadores mais poderosos sejam finos como papel.

Preservação da Saúde
As tecnologias de computação quântica darão uma enorme contribuição à medicina. A humanidade terá a oportunidade de criar nanomecanismos com o potencial mais poderoso, com a ajuda deles será possível não apenas diagnosticar doenças simplesmente olhando todo o corpo por dentro, mas também prestar assistência médica sem intervenção cirúrgica: os menores robôs com o “cérebro” de um excelente computador poderá realizar todas as operações.
Uma revolução também é inevitável no campo dos jogos de computador. Máquinas poderosas que podem resolver problemas instantaneamente poderão jogar com gráficos incrivelmente realistas, e mundos de computador imersivos estão ao virar da esquina.
A estrutura da matéria.
A estrutura do átomo.
Um átomo é a menor partícula de um elemento químico, o portador de todas as suas propriedades químicas. O átomo é quimicamente indivisível. Os átomos podem existir tanto em estado livre quanto em combinação com átomos do mesmo elemento ou de outro elemento.
Atualmente, 1/12 da massa de um átomo de carbono com massa atômica igual a 12 (isótopo ) é considerada uma unidade de massa atômica e molecular. Essa unidade é chamada de unidade de carbono.
Massa e tamanho dos átomos. O número de Avogadro.
Um átomo-grama, assim como uma molécula-grama de qualquer substância, contém 6,023 10^23 átomos ou moléculas, respectivamente. Este número é chamado de número de Avogadro (N0). Assim, em 55,85 g de ferro, 63,54 g de cobre, 29,98 g de alumínio, etc., há um número de átomos igual ao número de Avogadro.
Conhecendo o número de Avogadro, é fácil calcular a massa de um átomo de qualquer elemento. Para fazer isso, a massa grama-atômica de um átomo deve ser dividida por 6,023 10^23. Assim, a massa de um átomo de hidrogênio (1) e a massa de um átomo de carbono (2) são respectivamente iguais: 
Com base no número de Avogadro, pode-se também estimar o volume de um átomo. Por exemplo, a densidade do cobre é 8,92 g / cm ^ 3, e a massa gram-atômica é 63,54 g. Portanto, um grama-átomo de cobre ocupa o volume  , e um átomo de cobre tem um volume
, e um átomo de cobre tem um volume  .
.
Estrutura dos átomos.
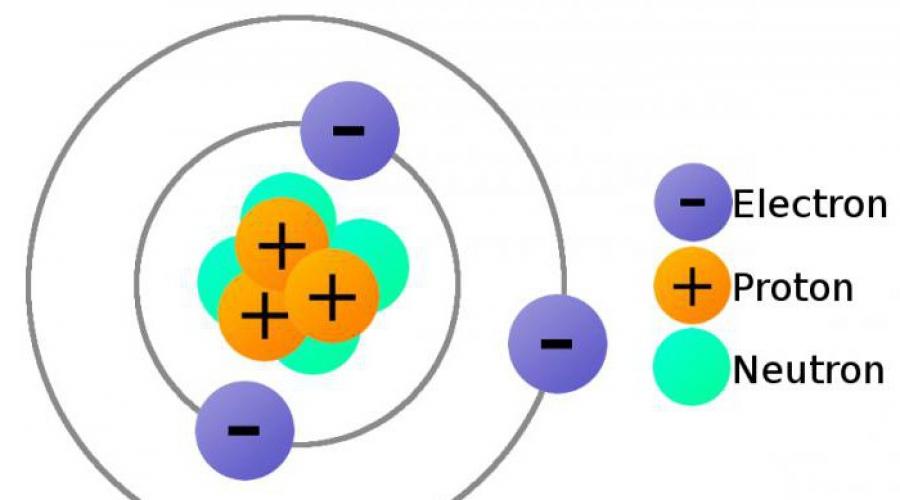
Um átomo é uma formação complexa e consiste em um número de partículas menores. Os átomos de todos os elementos consistem em um núcleo carregado positivamente e elétrons - partículas carregadas negativamente de massa muito pequena. O núcleo ocupa uma parte desprezível do volume total do átomo. O diâmetro de um átomo é cm, e o diâmetro do núcleo é cm.
Embora o diâmetro do núcleo de um átomo seja 100.000 vezes menor que o diâmetro do próprio átomo, praticamente toda a massa do átomo está concentrada em seu núcleo. Segue-se que a densidade dos núcleos atômicos é muito alta. Se fosse possível coletar 1 cm3 de núcleos atômicos, sua massa seria de cerca de 116 milhões de toneladas.
O núcleo é formado por prótons e nêutrons. Essas partículas têm um nome comum - nucleons.
próton- - partícula elementar estável com massa próxima a uma unidade de carbono. A carga do próton é igual à carga do eletrodo, mas com o sinal oposto. Se a carga de um elétron for igual a -1, então a carga de um próton é +1. Um próton é um átomo de hidrogênio sem um elétron.
Nêutron- uma concha atômica, cuja carga negativa compensa a carga positiva do núcleo, devido à presença de prótons nele.
Assim, o número de elétrons em um átomo é igual ao número de prótons em seu núcleo.
A relação entre o número de prótons, o número de nêutrons e o número de massa de um átomo é expressa pela equação: N=A-Z
Assim, o número de nêutrons no núcleo de um átomo de qualquer elemento é igual à diferença entre seu número de massa e o número de prótons.
Portanto, o número de nêutrons no núcleo de um átomo de rádio com massa de 226 N=A-Z=226-88=138
Massa e carga de um elétron.
Todos os processos químicos de formação e destruição de compostos químicos ocorrem sem alterar os núcleos dos átomos dos elementos que compõem esses compostos. Apenas as camadas eletrônicas sofrem alterações. A energia química está, portanto, relacionada à energia dos elétrons. Para entender os processos de formação e destruição de compostos químicos, deve-se ter uma compreensão das propriedades de um elétron em geral, e especialmente das propriedades e comportamento de um elétron em um átomo.
Elétron- esta é uma partícula elementar que possui uma carga elétrica negativa elementar, ou seja, a menor quantidade de eletricidade que pode existir. A carga de um elétron é igual a el. Arte. unidades ou pingente. A massa de repouso de um elétron é igual a r, ou seja, 1837,14 vezes menor que a massa de um átomo de hidrogênio. A massa de um elétron é uma unidade de carbono.
Modelo de Bohr do átomo.
No início do século 20, M. Planck A. Einstein criou a teoria quântica da luz, segundo a qual a luz é um fluxo de quanta de energia individual transportado por partículas de luz - fótons.
O valor do quantum de energia(E) é diferente para diferentes radiações e é proporcional à frequência de oscilação:
,
onde h é a constante de Planck.
M. Planck mostrou que os átomos absorvem ou emitem energia radiante apenas em porções separadas e bem definidas - quanta.
Tentando vincular a lei da mecânica clássica com a teoria quântica, o cientista dinamarquês N. Bohr acreditava que um elétron em um átomo de hidrogênio só pode estar em certas órbitas constantes, cujos raios estão relacionados entre si como quadrados de inteiros ![]() Essas órbitas foram chamadas de estacionárias por N. Bohr.
Essas órbitas foram chamadas de estacionárias por N. Bohr.
A radiação de energia ocorre apenas quando um elétron se move de uma órbita mais distante para uma órbita mais próxima do núcleo. Quando um elétron passa de uma órbita próxima para uma mais distante, a energia é absorvida pelo átomo. ![]() , onde são as energias dos elétrons em estados estacionários.
, onde são as energias dos elétrons em estados estacionários.
Quando Ei > Ek, a energia é liberada.
Para Ei< Ек энергия поглощается.
A solução do problema da distribuição de elétrons em um átomo baseia-se no estudo dos espectros de linha dos elementos e suas propriedades químicas. O espectro do átomo de hidrogênio confirmou quase completamente a teoria de N. Bohr. No entanto, a divisão observada de linhas espectrais em átomos multieletrônicos e o aumento dessa divisão em campos magnéticos e elétricos não podem ser explicados pela teoria de N. Bohr.
Propriedades ondulatórias de um elétron.
As leis da física clássica se opõem aos conceitos de "partícula" e "onda". A teoria física moderna, chamada quântica, ou mecânica das ondas, mostrou que o movimento e a interação de partículas de pequena massa - micropartículas ocorrem de acordo com leis diferentes das leis da mecânica clássica. Uma micropartícula tem simultaneamente algumas propriedades de corpúsculos (partículas) e algumas propriedades de ondas. Por um lado, um elétron, próton ou outra micropartícula se move e age como um corpúsculo, por exemplo, ao colidir com outra micropartícula. Por outro lado, quando uma micropartícula se move, são detectados fenômenos de interferência e difração típicos de ondas eletromagnéticas.
Assim, nas propriedades de um elétron (assim como de outras micropartículas), nas leis de seu movimento, manifestam-se a continuidade e a interconexão de duas formas qualitativamente diferentes da existência da matéria, substância e campo. Uma micropartícula não pode ser considerada nem como uma partícula comum nem como uma onda comum. Uma micropartícula tem dualismo de onda corpuscular.
Falando sobre a relação entre matéria e campo, pode-se concluir que se cada partícula material tem uma certa massa, então, aparentemente, a mesma partícula também deve corresponder a um certo comprimento, uma onda. Há uma questão sobre a relação entre massa e onda. Em 1924, o físico francês Louis de Broglie sugeriu que a cada elétron em movimento (e em geral a cada partícula de material em movimento) está associado um processo de onda, cujo comprimento de onda é , onde é o comprimento de onda em cm (m), h é o de Planck constante, igual a ![]() erg. sec(), m - massa da partícula em g (kg), - velocidade da partícula, em cm/seg.
erg. sec(), m - massa da partícula em g (kg), - velocidade da partícula, em cm/seg.
Pode-se ver a partir desta equação que uma partícula em repouso deve ter um comprimento de onda infinitamente longo e que o comprimento de onda diminui com o aumento da velocidade da partícula. O comprimento de onda de uma partícula em movimento de grande massa é muito pequeno e ainda não pode ser determinado experimentalmente. Portanto, estamos falando apenas das propriedades ondulatórias de micropartículas. O elétron tem propriedades ondulatórias. Isso significa que seu movimento em um átomo pode ser descrito por uma equação de onda.
O modelo planetário da estrutura do átomo de hidrogênio, criado por N. Bohr, que partiu do conceito do elétron apenas como uma partícula clássica, não pode explicar uma série de propriedades do elétron. A mecânica quântica mostrou que a ideia do movimento de um elétron ao redor do núcleo em certas órbitas, como o movimento dos planetas ao redor do Sol, deve ser considerada insustentável.
Um elétron, tendo as propriedades de uma onda, move-se por todo o volume, formando uma nuvem eletrônica, que para os elétrons de um átomo pode ter uma forma diferente. a densidade dessa nuvem eletrônica em uma ou outra parte do volume atômico não é a mesma.
Caracterização de um elétron por quatro números quânticos.
A principal característica que determina o movimento de um elétron no campo do núcleo é sua energia. A energia de um elétron, como a energia de uma partícula de um fluxo de luz - um fóton, não assume nenhum, mas apenas certos valores discretos, descontínuos ou, como dizem, quantizados.
Um elétron em movimento tem três graus de liberdade de movimento no espaço (correspondendo a três eixos coordenados) e um grau de liberdade adicional devido à presença dos próprios momentos mecânicos e magnéticos do elétron, que levam em conta a rotação do elétron em torno de seu eixo . Portanto, para uma característica energética completa do estado de um elétron em um átomo, é necessário e suficiente ter quatro parâmetros. Esses parâmetros são chamados Números quânticos. Os números quânticos, assim como a energia de um elétron, podem assumir não todos, mas apenas certos valores. Os valores vizinhos dos números quânticos diferem em um.
Número quântico principal n caracteriza a energia total do elétron ou seu nível de energia. O número quântico principal pode receber valores de inteiros de 1 a . Para um elétron localizado no campo do núcleo, o número quântico principal pode assumir valores de 1 a 7 (correspondendo ao número do período no sistema periódico em que o elemento está localizado). Os níveis de energia são indicados por números de acordo com os valores do número quântico principal ou por letras:
P | |||||||
Designação de nível |
Se, por exemplo, n=4, então o elétron está no quarto nível de energia, contando a partir do núcleo do átomo, ou no nível N.
Número quântico orbital l, que às vezes é chamado de número quântico lateral, caracteriza o estado de energia diferente de um elétron de um determinado nível. A estrutura fina das linhas espectrais indica que os elétrons de cada nível de energia são agrupados em subníveis. O número quântico orbital está relacionado ao momento angular de um elétron quando ele se move em relação ao núcleo de um átomo. O número quântico orbital também determina a forma da nuvem eletrônica. O número quântico l pode assumir todos os valores inteiros de 0 a (n-1). Por exemplo, quando n=4, l=0, 1, 2, 3. Cada valor de l corresponde a um determinado subnível. As letras são usadas para subníveis. Então, em l=0, 1, 2, 3 elétrons estão respectivamente nos subníveis s-, p-, d-, f-. Elétrons de diferentes subníveis são respectivamente chamados de elétrons s-, p-, d-, f-. O número possível de subníveis para cada nível de energia é igual ao número desse nível, mas não excede quatro. O primeiro nível de energia (n=1) consiste em um subnível s, o segundo (n=2), terceiro (n=3) e quarto (n=4) níveis de energia consistem respectivamente em dois (s, p), três (s , p, d) e quatro (s, p, d, f) subníveis. Não pode haver mais de quatro subníveis, pois os valores l=0, 1, 2, 3 descrevem os elétrons dos átomos de todos os 104 elementos conhecidos agora.
Se l = 0 (elétrons s), então o momento angular do elétron em relação ao núcleo do átomo é igual a zero. Isso só pode acontecer quando o elétron não se move translacionalmente ao redor do núcleo, mas do núcleo para a periferia e vice-versa. A nuvem de elétrons do elétron s tem forma esférica.
Número quântico magnético- seu momento magnético também está conectado com o momento angular do elétron. O número quântico magnético caracteriza o momento magnético do elétron. o número quântico magnético caracteriza o momento magnético do elétron e indica a orientação da nuvem de elétrons em relação à direção escolhida ou em relação à direção do campo magnético. O número quântico magnético pode assumir qualquer valor inteiro positivo e negativo, incluindo zero, variando de – l a + l. Por exemplo, se l=2, então tem 2 l+1=5 valores (-2, -1, 0, +1, +2). Com l=3, o número de valores é 2 l+1=7 (-3, -2, -1, 0, +1, +2, +3). O número de valores do número quântico magnético, que é igual a 2 l + 1, é o número de estados de energia em que os elétrons de um determinado subnível podem estar. Assim, os elétrons s têm apenas um estado (2 l+1=1), os elétrons p têm 3 estados (2 l+1=3), os elétrons d-, f têm 5 e 7 estados respectivamente. Os estados de energia são geralmente denotados esquematicamente por células de energia, representando-os como retângulos e os elétrons como setas nessas células.
Gire o número quântico- caracteriza o movimento interno do elétron - spin. Está associado ao próprio momento magnético do elétron, devido ao seu movimento em torno de seu eixo. Este número quântico pode assumir apenas dois valores: + 1/2 e -1/2, dependendo se o campo magnético do spin do elétron é orientado paralelamente ou antiparalelamente ao campo magnético devido ao movimento do elétron ao redor do núcleo.
Dois elétrons (par) com os mesmos valores de números quânticos: n, I, mas com spins de direção oposta ( ↓) são chamados de pares de elétrons pareados ou solitários. Elétrons com spins insaturados () são chamados desemparelhados.
Princípio de Pauli, princípio da menor energia, regra de Hund.
A distribuição de elétrons nos átomos dos elementos é determinada por três disposições principais: o princípio de Pauli, o princípio da menor energia e a regra de Hund.
Princípio de Pauli. Estudando os numerosos espectros de átomos, o físico suíço W. Pauli em 1925 chegou à conclusão, que foi chamada de princípio ou proibição de Pauli: talvez até dois elétrons com os mesmos valores de todos os quatro números quânticos." Os estados de energia dos elétrons, caracterizados pelos mesmos valores de três números quânticos: n, I e m1, geralmente são denotados por uma célula de energia.
De acordo com o princípio de Pauli, pode haver apenas dois elétrons em uma célula de energia e com spins opostos
A presença de um terceiro elétron em uma célula de energia significaria que dois deles têm todos os quatro números quânticos iguais. O número de possíveis estados de elétrons (Fig. .4) em um determinado subnível é igual ao número de valores do número quântico magnético para este subnível, ou seja, 21 + 1. O número máximo de elétrons neste subnível, de acordo com ao princípio de Pauli, será 2 (21 + 1). Assim, 2 elétrons são possíveis no subnível s; elétrons p-subnível 6; nos elétrons do subnível d 10; existem 14 elétrons no subnível f. O número de estados possíveis de elétrons em qualquer nível é igual ao quadrado do número quântico principal, e o número máximo de elétrons neste nível
O princípio da menor energia.
A sequência de colocação dos elétrons em um átomo deve corresponder à sua maior conexão com o núcleo, ou seja, o elétron deve ter a menor energia. Portanto, não é necessário que um elétron ocupe um nível de energia mais alto se houver lugares no nível subjacente onde o elétron terá uma energia mais baixa.
Como a energia de um elétron é determinada principalmente pelos valores do n principal e dos números orbitais / quânticos, esses subníveis são preenchidos primeiro, para os quais a soma dos valores dos números quânticos n e / é menor. Por exemplo, a reserva de energia no subnível 4s(n +/ = 4 +0 = 4) é menor que 3d(n + /= 3 + 2 = 5); 5s (n + / = 5 + 0 = 5) menor que 4d(n + / = 4 + 2 = 6); 5p(n + / = 5 +1 =6) menor que 4f(n + 1 = 4+3 = 7). Se para dois níveis as somas dos valores n e / forem iguais, então o subnível com o menor valor de n é preenchido primeiro. n, ou seja, na seguinte sequência: 3d-4p-5s.
Quando as energias de subníveis próximos diferem muito pouco umas das outras, há algumas exceções a essa regra. Assim, o subnível 5d é preenchido com um elétron 5dl antes de 4f; 6d1-2 antes de 5f.
O preenchimento dos níveis e subníveis de energia segue a seguinte sequência: ls→2s→2p→3s→3p→4s→3d→4р→5s→4d→5р→6s→(5dl)→4f→5d→6p→7s→ ( 6d1-2 )→5f→ 6d→7p
Regra de Gund.
Os elétrons dentro de um determinado subnível são primeiro localizados em uma célula separada na forma de elétrons "ociosos" desemparelhados. Em outras palavras, para um determinado valor de I, os elétrons no átomo são organizados de modo que seu número total de spins seja máximo . Por exemplo, se três elétrons, cada um deles estará localizado em uma célula separada desta maneira:
Fórmulas eletrônicas de átomos e esquemas.
Levando em conta as provisões acima, é fácil imaginar a distribuição de elétrons em níveis e subníveis de energia nos átomos de qualquer elemento. Essa distribuição de elétrons em um átomo é escrita na forma das chamadas fórmulas eletrônicas. Em fórmulas eletrônicas, as letras s, p, d, f denotam os subníveis de energia dos elétrons; os números na frente das letras indicam o nível de energia em que o elétron dado está localizado, e o índice no canto superior direito é o número de elétrons neste subnível. Por exemplo, escrever 5p3 significa que 3 elétrons estão localizados no subnível p do quinto nível de energia.
Para compor a fórmula eletrônica de um átomo de qualquer elemento, basta conhecer o número desse elemento no sistema periódico e cumprir as disposições básicas que regem a distribuição dos elétrons em um átomo.
Vamos, por exemplo, você precisar fazer fórmulas eletrônicas para os átomos de enxofre, cálcio, escândio, ferro e lantânio. A partir da tabela periódica, determinamos os números desses elementos, que são respectivamente iguais a 16, 20, 21, 26,. Isso significa que nos níveis e subníveis de energia, os átomos desses elementos contêm 16, 20, 21, 26, 57 elétrons, respectivamente. Observando o princípio de Pauli e o princípio da menor energia, ou seja, a sequência de preenchimento dos níveis e subníveis de energia, pode-se compor as fórmulas eletrônicas dos átomos desses elementos:

A estrutura da camada eletrônica de um átomo também pode ser representada na forma de um arranjo de elétrons em células de energia.
Para átomos de ferro, esse esquema tem a seguinte forma:

Este diagrama mostra claramente a implementação da regra de Hund. No subnível 3d, o número máximo de células (quatro) é preenchido com elétrons desemparelhados. A imagem da estrutura da camada de elétrons no átomo na forma de fórmulas eletrônicas e na forma de diagramas não reflete claramente as propriedades de onda do elétron. No entanto, deve-se lembrar que cada elétron s-, p-, d-, f tem sua própria nuvem eletrônica. A forma diferente da nuvem de elétrons indica que o elétron tem uma probabilidade diferente de estar em uma determinada região do espaço do átomo. Dependendo do valor do número quântico magnético m1, a orientação da nuvem de elétrons no espaço também será diferente.