Velocidade normal de propagação da chama. Influência de vários fatores na velocidade da chama Velocidade máxima da chama da queima de propano
Acima da superfície de um líquido ou sólido a qualquer temperatura, existe uma mistura vapor-ar, cuja pressão no estado de equilíbrio é determinada pela pressão dos vapores saturados ou sua concentração. Com o aumento da temperatura, a pressão de vapor saturado aumentará, mas exponencialmente (equação de Clapeyron - Clausis):
onde P n „ - pressão de vapor saturado, Pa; Q„ C11 - calor de vaporização, kJ/mol; T- temperatura do líquido, K.
Para qualquer líquido, existe uma faixa de temperatura na qual a concentração de vapores saturados acima do espelho (superfície do líquido) estará na região de ignição, ou seja, NKPV
Para criar LCVV de vapores, basta aquecer não todo o líquido, mas apenas sua camada superficial, a uma temperatura igual à LTPV.
Na presença de uma fonte de ignição, tal mistura será capaz de ignição. Na prática, os conceitos de "ponto de fulgor" e "temperatura de ignição" são mais usados.
Ponto de inflamação - a temperatura mínima de um líquido na qual uma concentração de vapor se forma acima de sua superfície, capaz de ser inflamado por uma fonte de ignição, mas a taxa de formação de vapor é insuficiente para sustentar a combustão.
Assim, tanto no ponto de fulgor quanto no limite inferior de temperatura de ignição acima da superfície do líquido, forma-se um limite inferior de concentração de ignição, porém, neste último caso, o LEL é criado por vapores saturados. Portanto, o ponto de fulgor é sempre um pouco maior que o LTLW. Embora no ponto de fulgor haja uma ignição de curto prazo do vapor, que não é capaz de se transformar em uma combustão estável do líquido, no entanto, sob certas condições, o fulgor pode causar um incêndio.
O ponto de fulgor é tomado como base para a classificação de líquidos em inflamáveis (líquidos inflamáveis) e líquidos combustíveis (FL). Líquidos inflamáveis incluem líquidos com ponto de fulgor em um recipiente fechado de 61 ° C e abaixo, líquidos combustíveis com ponto de fulgor superior a 61 ° C.
Experimentalmente, o ponto de fulgor é determinado em dispositivos abertos e fechados. Em vasos fechados, os pontos de fulgor são sempre menores do que em vasos abertos, pois neste caso os vapores líquidos têm a oportunidade de se difundir na atmosfera e uma temperatura mais alta é necessária para criar uma concentração combustível acima da superfície.
Na tabela. 2.4 mostra o ponto de fulgor de alguns líquidos, determinado por dispositivos do tipo aberto e fechado.
Tabela 2.4
Ponto de fulgor de diferentes tipos de líquidos com diferentes métodos de determinação
Temperatura de ignição - a temperatura mínima de um líquido na qual, após a ignição de vapores de uma fonte de ignição, a combustão estacionária é estabelecida.
Em líquidos inflamáveis, a temperatura de ignição é maior que o ponto de fulgor em 1-5 °, enquanto quanto menor o ponto de fulgor, menor a diferença entre a ignição e os pontos de fulgor.
Para líquidos combustíveis com alto ponto de fulgor, a diferença entre essas temperaturas chega a 25-35 °. Existe uma correlação entre o ponto de fulgor em um cadinho fechado e o limite inferior da temperatura de ignição, descrito pela fórmula
Esta relação é válida para Г В(.
A dependência significativa das temperaturas de flash e ignição das condições experimentais causa certas dificuldades na criação de um método de cálculo para estimar seus valores. Um dos mais comuns é o método semi-empírico proposto por V. I. Blinov:
onde G sol - ponto de fulgor (ignição), K; R np - pressão parcial do vapor saturado do líquido no ponto de fulgor (ignição), Pa; D()- coeficiente de difusão de vapores líquidos, s/m 2 ; b- o número de moléculas de oxigênio necessárias para a oxidação completa de uma molécula de combustível; NO - constante do método de definição.
Ao calcular o ponto de fulgor em um recipiente fechado, recomenda-se NO= 28, em um recipiente aberto NO= 45; para calcular a temperatura de ignição, tome NO = 53.
Os limites de temperatura inflamável podem ser calculados:
De acordo com os valores conhecidos do ponto de ebulição
onde ^n(v)' 7/ip - limite inferior (superior) de temperatura de ignição e ponto de ebulição, respectivamente, °C; k, eu- parâmetros, cujos valores dependem do tipo de líquido combustível;
De acordo com valores conhecidos de limites de concentração. Para fazer isso, primeiro determine a concentração de vapores saturados acima da superfície do líquido
onde (р„ n é a concentração de vapores saturados, %; R n p - pressão de vapor saturado, Pa; R 0 - pressão externa (atmosférica), Pa.
Da fórmula (2.41) segue
Tendo determinado a pressão do vapor saturado pelo valor do limite de ignição inferior (superior), encontramos a temperatura na qual essa pressão é atingida. É o limite inferior (superior) de temperatura de ignição.
Usando a fórmula (2.41), também pode-se resolver o problema inverso: calcular os limites de concentração de ignição a partir de valores conhecidos dos limites de temperatura.
A propriedade de uma chama de propagação espontânea é observada não apenas durante a combustão de misturas de gases combustíveis com um agente oxidante, mas também ao queimar líquidos e sólidos. Sob exposição local a uma fonte de calor, por exemplo, uma chama aberta, o líquido aquecerá, a taxa de evaporação aumentará e, quando a superfície do líquido atingir a temperatura de ignição, a mistura vapor-ar entrará em ignição no local de ignição. exposição à fonte de calor, uma chama estável será estabelecida, que se espalhará a uma certa velocidade sobre a superfície e a parte fria.
Qual é a força motriz por trás da propagação do processo de combustão, qual é o seu mecanismo?
A propagação da chama sobre a superfície do líquido ocorre como resultado da transferência de calor devido à radiação, convecção e condução de calor molecular da zona da chama para a superfície do espelho líquido.
De acordo com conceitos modernos, a principal força motriz para a propagação do processo de combustão é a radiação de calor da chama. A chama, tendo uma temperatura elevada (mais de 1000°C), é conhecida por ser capaz de irradiar energia térmica. De acordo com a lei de Stefan-Boltzmann, a intensidade do fluxo de calor radiante emitido por um corpo aquecido é determinada pela relação
Onde c eu- intensidade do fluxo de calor radiante, kW/m 2 ; 8 0 - grau de escuridão do corpo (chama) (e 0 \u003d 0,75-H.0); um = = 5,7 10 11 kJ/(m2s K4) - constante de Stefan-Boltzmann; Г g - temperatura do corpo (chama), K; Г 0 - temperatura média, K.
O calor, irradiando em todas as direções, penetra parcialmente nas áreas da superfície do líquido que ainda não pegaram fogo, aquecendo-as. Com o aumento da temperatura da camada superficial acima da área aquecida, intensifica-se o processo de evaporação do líquido e forma-se uma mistura vapor-ar. Assim que a concentração de vapor líquido exceder o NKVP, ele será inflamado pela chama. Então, esta seção da superfície do líquido começa a aquecer intensamente a seção adjacente da superfície do líquido e assim por diante. A taxa de propagação da chama através do líquido depende da taxa de aquecimento da superfície do líquido pelo fluxo de calor radiante da chama, ou seja, na taxa de formação de uma mistura vapor-ar combustível acima da superfície do líquido, que, por sua vez, depende da natureza do líquido e da temperatura inicial.
Cada tipo de líquido tem seu próprio calor de vaporização e ponto de fulgor. Quanto maiores os seus valores, maior o tempo necessário para o seu aquecimento formar uma mistura vapor-ar combustível, menor a velocidade de propagação da chama. Com o aumento do peso molecular de uma substância dentro da mesma série homóloga, a pressão de vapor de elasticidade diminui, o calor de evaporação e o ponto de fulgor aumentam e a velocidade de propagação da chama diminui proporcionalmente.
O aumento da temperatura do líquido aumenta a velocidade de propagação da chama, pois o tempo necessário para o líquido aquecer até o ponto de fulgor em frente à zona de combustão é reduzido.
Durante um flash, a velocidade de propagação da chama ao longo do espelho líquido será (em termos físicos) igual à velocidade de propagação da chama através da mistura vapor-ar de uma composição próxima ao LCV, ou seja, 4-5 cm/s. Com um aumento na temperatura inicial do líquido acima do ponto de fulgor, a taxa de propagação da chama dependerá (de forma semelhante à taxa de propagação da chama) da composição da mistura combustível. De fato, à medida que a temperatura do líquido aumenta acima de seu ponto de fulgor, a concentração da mistura vapor-ar acima da superfície do espelho aumentará de NKVP para 100% (ponto de ebulição).
Portanto, inicialmente, à medida que a temperatura do líquido sobe do ponto de fulgor até a temperatura na qual os vapores saturados são formados acima da superfície, com uma concentração igual à estequiométrica (mais precisamente, um pouco maior que a estequiométrica), a taxa de propagação da chama vai aumentar. Em vasos fechados, à medida que a temperatura do líquido aumenta ainda mais, a taxa de propagação da chama começa a diminuir, até a velocidade correspondente ao limite superior de temperatura de ignição, na qual a propagação da chama e da mistura vapor-ar deixa de ocorrer. possível devido à falta de oxigênio na mistura vapor-ar acima da superfície do líquido. Acima da superfície de um reservatório aberto, a concentração de vapores em diferentes níveis será diferente: na superfície será máxima e corresponderá à concentração de vapor saturado a uma determinada temperatura, à medida que a distância da superfície aumenta, a concentração será diminuir gradualmente devido à difusão convectiva e molecular.
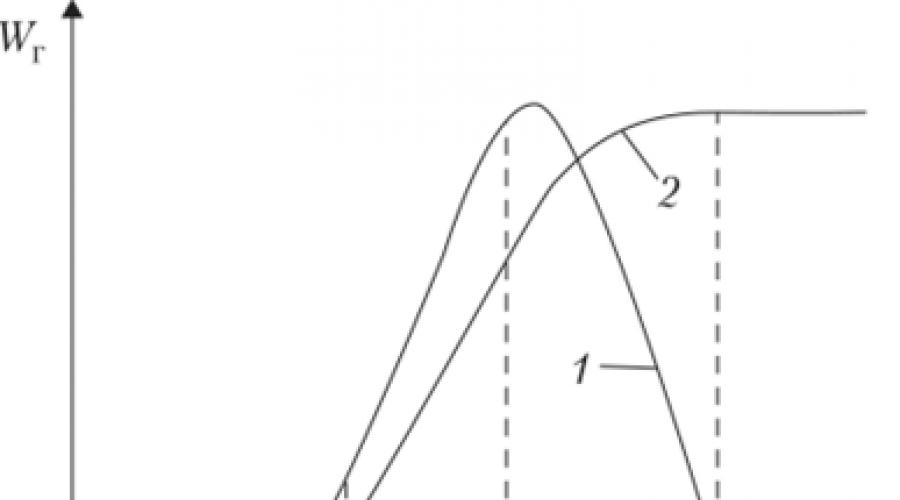
A uma temperatura do líquido próxima ao ponto de fulgor, a velocidade de propagação da chama sobre a superfície do líquido será igual à velocidade de sua propagação através da mistura de vapores no ar no LIP, ou seja, 3-4 cm/s. Neste caso, a frente da chama estará localizada próxima à superfície do líquido. Com um aumento adicional na temperatura inicial do líquido, a velocidade de propagação da chama aumentará de forma semelhante ao crescimento da velocidade normal de propagação da chama na mistura vapor-ar com o aumento de sua concentração. Na velocidade máxima, a chama se propagará através de uma mistura com concentração próxima à estequiométrica. Conseqüentemente, com um aumento na temperatura inicial do líquido acima de G stx, a taxa de propagação da chama permanecerá constante, igual ao valor máximo da taxa de propagação da combustão na mistura estequiométrica ou um pouco maior que ele (Fig. 2.5). Por isso,

Arroz. 25.
1 - queima de líquido em um recipiente fechado; 2 - combustão de um líquido em um recipiente aberto com uma mudança na temperatura inicial do líquido em um recipiente aberto em uma ampla faixa de temperatura (até o ponto de ebulição), a velocidade de propagação da chama varia de alguns milímetros a 3-4 m /s.
Na velocidade máxima, a chama se propagará através de uma mistura com concentração próxima à estequiométrica. Com um aumento na temperatura do líquido acima de Гstx, a distância acima do líquido aumentará, na qual a concentração estequiométrica se formará, e a velocidade de propagação da chama permanecerá a mesma (ver Fig. 2.5). Esta circunstância deve ser sempre lembrada, tanto ao organizar o trabalho preventivo quanto ao extinguir incêndios, quando, por exemplo, pode haver o risco de o ar ser sugado para um recipiente fechado - sua despressurização.
Após a ignição do líquido e a propagação da chama, mas sua superfície é estabelecida modo de difusão de seu burnout, que se caracteriza pela massa específica WrM e linear W V Jl velocidades.
Velocidade de massa específica - a massa de uma substância que queima a partir de uma unidade de área de um espelho líquido por unidade de tempo (kg / (m 2 * s)).
Velocidade linear - a distância sobre a qual o nível do espelho líquido se move por unidade de tempo devido ao seu desgaste (m / s).
As taxas de queima de massa e linear são interconectadas através da densidade do líquido p:
Após a ignição do líquido, sua temperatura superficial aumenta da temperatura de ignição para a ebulição, e uma camada aquecida é formada. Durante este período, a taxa de queima do líquido aumenta gradualmente, a altura da chama cresce dependendo do diâmetro do tanque e do tipo de líquido combustível. Após 1 a 10 minutos de combustão, o processo se estabiliza: a taxa de queima e as dimensões da chama permanecem inalteradas no futuro.
A altura e a forma da chama durante a combustão por difusão de líquido e gás obedecem às mesmas leis, pois em ambos os casos o processo de combustão é determinado pela difusão mútua do combustível e do oxidante. No entanto, se durante a combustão por difusão de gases, a velocidade do jato de gás não depende dos processos que ocorrem na chama, durante a combustão de um líquido, é estabelecida uma certa taxa de queima, que depende tanto dos parâmetros termodinâmicos do líquido e nas condições de difusão do oxigênio do ar e do vapor líquido.
Uma certa transferência de calor e massa é estabelecida entre a zona de combustão e a superfície do líquido (Fig. 2.6). Parte do fluxo de calor que chega à superfície do líquido q 0 anoé gasto no aquecimento até o ponto de ebulição q ucn . Além disso, quente q TC para o aquecimento o líquido vem da tocha da chama através das paredes do tanque devido à condução de calor. Com um diâmetro suficientemente grande q TC pode ser desprezado, então q() = K„n+
É óbvio que
onde c é a capacidade calorífica do líquido, kJDkg-K); p é a densidade do líquido, kg/m 3; Wnc- taxa de crescimento da camada aquecida, m/s; W Jl- taxa de esgotamento linear, m/s; 0i SP - calor de vaporização, kJ/kg; G kip - o ponto de ebulição do líquido, K.

Arroz. 2.6.
Г () - temperatura inicial; G kip - ponto de ebulição;
Tg- temperatura de combustão; q KUW q Jl - fluxos de calor convectivo e radiante, respectivamente; q 0 - fluxo de calor que entra na superfície do líquido
Segue-se da fórmula (2.45) que a intensidade do fluxo de calor da zona da chama determina uma certa taxa de fornecimento de combustível a essa zona, cuja interação química com o oxidante, por sua vez, afeta o valor # 0 . Isto é o que consiste a relação de massa e troca de calor entre a zona de chama e a fase condensada durante a combustão de líquidos e sólidos.
Estimativa da parcela de calor da liberação total de calor durante a combustão do líquido, que é gasto em sua preparação para combustão q 0 , pode ser realizado na seguinte sequência.
Tomando por simplicidade wrijl= W nx , obtemos
A taxa de liberação de calor por unidade de superfície do espelho líquido (calor específico de fogo qll7K) pode ser determinado pela fórmula
onde Q H é o valor calorífico mais baixo da substância, kJ/kg; P p - coeficiente de completude de combustão.
Então, levando em conta o estado (2.44) e dividindo a expressão (2.45) pela fórmula (2.46), obtemos
Os cálculos mostram que cerca de 2% da liberação total de calor durante a combustão líquida é gasto na formação e distribuição de vapor líquido para a zona de combustão. Quando o processo de burnout é estabelecido, a temperatura da superfície do líquido aumenta até o ponto de ebulição, que posteriormente permanece inalterado. Esta afirmação refere-se a um líquido individual. Se, no entanto, considerarmos misturas de líquidos com diferentes pontos de ebulição, ocorre primeiro a liberação de frações de ebulição leve, depois - de ebulição cada vez mais alta.
A taxa de queima é significativamente afetada pelo aquecimento do líquido em profundidade como resultado da transferência de calor do líquido aquecido pelo fluxo radiante q0 a superfície do líquido até a sua profundidade. Essa transferência de calor é feita por condutividade térmica e convenções.
O aquecimento de um líquido devido à condutividade térmica pode ser representado por uma dependência exponencial da forma
Onde Tx- temperatura da camada líquida em profundidade X, PARA; G kip - temperatura da superfície (ponto de ebulição), K; k- coeficiente de proporcionalidade, m -1 .
Este tipo de campo de temperatura é chamado distribuição de temperatura do primeiro tipo(Fig. 2.7).
A convenção laminar surge como resultado de diferentes temperaturas do líquido nas paredes do tanque e no seu centro, bem como devido à destilação fracionada na camada superior durante a combustão da mistura.
A transferência de calor adicional das paredes aquecidas do reservatório para o líquido leva ao aquecimento de suas camadas próximas às paredes a uma temperatura mais alta do que no centro. O líquido aquecido perto das paredes (ou mesmo bolhas de vapor se for aquecido perto das paredes acima do ponto de ebulição) sobe, o que contribui para uma mistura intensiva e aquecimento rápido do líquido em grande profundidade. O assim chamado camada homotérmica, Essa. uma camada com uma temperatura praticamente constante, cuja espessura aumenta durante a combustão. Esse campo de temperatura é chamado distribuição de temperatura do segundo tipo.

Arroz. 2.7.
1 - distribuição de temperatura do primeiro tipo; 2 - distribuição de temperatura do segundo tipo
A formação de uma camada homotérmica também é possível como resultado da destilação fracionada de camadas próximas à superfície de uma mistura de líquidos com diferentes pontos de ebulição. À medida que esses líquidos queimam, a camada próxima à superfície é enriquecida em frações mais densas e de alto ponto de ebulição, que afundam, contribuindo para o aquecimento mais convectivo do líquido.
Foi estabelecido que quanto menor o ponto de ebulição de um líquido (combustível diesel, óleo de transformador), mais difícil é formar uma camada homotérmica. Quando queimam, a temperatura das paredes do tanque raramente excede o ponto de ebulição. No entanto, ao queimar produtos petrolíferos úmidos de alto ponto de ebulição, a probabilidade de formação de uma camada homotérmica é bastante alta. Quando as paredes do tanque são aquecidas a 100°C ou mais, formam-se bolhas de vapor d'água que, ao subir, provocam um movimento intensivo de todo o líquido e um aquecimento rápido em profundidade. A dependência da espessura da camada homotérmica no tempo de queima é descrita pela relação
Onde X- espessura da camada homotérmica em um determinado momento do tempo de combustão, m; x pr - espessura limite da camada homotérmica, m; t é o tempo contado desde o início da formação da camada, s; p - coeficiente, s -1.
A possibilidade de formação de uma camada homotérmica suficientemente espessa durante a combustão de produtos petrolíferos úmidos é preocupante com a ocorrência de ebulição e ejeção de líquido.
A taxa de queima depende significativamente do tipo de líquido, temperatura inicial, umidade e concentração de oxigênio na atmosfera.
A partir da equação (2.45), levando em consideração a expressão (2.44), é possível determinar a taxa de burnout em massa:

É óbvio pela fórmula (2.50) que a taxa de queima é afetada pela intensidade do fluxo de calor proveniente da chama para o espelho líquido e pelos parâmetros termofísicos do combustível: ponto de ebulição, capacidade calorífica e calor de evaporação.
Da Tabela. 2.5 é óbvio que existe uma certa correspondência entre a taxa de queima e os custos de calor para aquecer e evaporar o líquido. Assim, na série dos benzenoxilenogliceróis, com o aumento do consumo de calor para aquecimento e evaporação, a taxa de burnout diminui. No entanto, ao passar de benzeno para éter dietílico, os custos de calor diminuem. Essa aparente discrepância se deve à diferença na intensidade dos fluxos de calor provenientes da chama para a superfície do líquido. O fluxo radiante é grande o suficiente para uma chama de benzeno esfumaçada e pequeno para uma chama de éter dietílico relativamente transparente. Como regra, a proporção das taxas de queima dos líquidos de queima mais rápida e dos líquidos de queima mais lenta é bastante pequena e equivale a 3,0-4,5.
Tabela 25
Dependência da taxa de queima no consumo de calor para aquecimento e evaporação
Segue da expressão (2.50) que com um aumento em Г 0 a taxa de burnout aumenta, uma vez que os custos de calor para aquecer o líquido até o ponto de ebulição diminuem.
O teor de umidade na mistura reduz a taxa de queima do líquido, em primeiro lugar, devido ao consumo adicional de calor para sua evaporação e, em segundo lugar, como resultado do efeito fleumatizante do vapor de água na zona gasosa. Este último leva a uma diminuição da temperatura da chama e, portanto, de acordo com a fórmula (2.43), seu poder radiante também diminui. A rigor, a taxa de queima de um líquido úmido (líquido contendo água) não é constante, aumenta ou diminui durante o processo de combustão, dependendo do ponto de ebulição do líquido.
O combustível úmido pode ser representado como uma mistura de dois líquidos: combustível + água, durante a combustão dos quais seus dispersão fracionada. Se o ponto de ebulição de um líquido combustível for menor que o ponto de ebulição da água (100°C), então o combustível queima preferencialmente, a mistura é enriquecida com água, a taxa de queima diminui e, finalmente, a combustão pára. Se o ponto de ebulição do líquido for superior a 100 ° C, pelo contrário, a umidade evapora primeiro e sua concentração diminui. Como resultado, a taxa de queima do líquido aumenta, até a taxa de queima do produto puro.
Como regra, com um aumento na velocidade do vento, a taxa de queima do líquido aumenta. O vento intensifica o processo de mistura do combustível com o oxidante, elevando assim a temperatura da chama (Tabela 2.6) e aproximando a chama da superfície de combustão.
Tabela 2.6
Efeito da velocidade do vento na temperatura da chama
Tudo isso aumenta a intensidade do fluxo de calor fornecido ao aquecimento e evaporação do líquido, portanto, leva a um aumento na taxa de queima. Em velocidades de vento mais altas, a chama pode se romper, o que levará à cessação da combustão. Assim, por exemplo, quando o querosene do trator queimou em um tanque com diâmetro de 3 m, o incêndio ocorreu a uma velocidade do vento de 22 m/s.
A maioria dos líquidos não pode queimar em uma atmosfera com menos de 15% de oxigênio. Com um aumento na concentração de oxigênio acima desse limite, a taxa de queima aumenta. Em uma atmosfera significativamente enriquecida com oxigênio, a combustão do líquido prossegue com a liberação de grande quantidade de fuligem na chama, e observa-se intensa ebulição da fase líquida. Para líquidos multicomponentes (gasolina, querosene, etc.), a temperatura da superfície aumenta com o aumento do teor de oxigênio no ambiente.
Um aumento na taxa de queima e na temperatura da superfície do líquido com o aumento da concentração de oxigênio na atmosfera é devido a um aumento na emissividade da chama como resultado do aumento da temperatura de combustão e do alto teor de fuligem. .
A taxa de queima também muda significativamente com a diminuição do nível de líquido inflamável no tanque: a taxa de queima diminui, até a cessação da combustão. Como o fornecimento de oxigênio do ar do ambiente dentro do tanque é difícil, quando o nível do líquido diminui, a distância h np entre a zona de chama e a superfície de combustão (Fig. 2.8). O fluxo radiante para o espelho líquido diminui e, consequentemente, a taxa de queima também diminui, até a atenuação. Ao queimar líquidos em tanques de grande diâmetro, a profundidade limite /gpr na qual a combustão é atenuada é muito grande. Assim, para um tanque com um diâmetro de 5 m, é de 11 m e com um diâmetro de Im - cerca de 35 m.

A velocidade normal de propagação da chama é a velocidade de movimento da frente da chama em relação ao gás não queimado em uma direção perpendicular à sua superfície.
O valor da velocidade normal de propagação da chama deve ser usado no cálculo da taxa de aumento da pressão de uma explosão de misturas de gás e vapor em equipamentos e instalações fechadas e com vazamento, o diâmetro crítico (extintor) no desenvolvimento e criação da chama pára-raios, a área de estruturas facilmente derrubadas, membranas de segurança e outros dispositivos de despressurização; ao desenvolver medidas para garantir a segurança contra incêndio e explosão de processos tecnológicos de acordo com os requisitos do GOST 12.1.004 e GOST 12.1.010.
A essência do método para determinar a velocidade normal de propagação da chama é preparar uma mistura combustível de composição conhecida dentro do recipiente de reação, inflamar a mistura no centro com uma fonte pontual, registrar a mudança de pressão no recipiente com o tempo e processar a dependência experimental pressão-tempo usando um modelo matemático do processo de combustão de gás em vaso fechado e procedimentos de otimização. O modelo matemático permite obter uma dependência calculada “pressão-tempo”, cuja otimização de acordo com uma dependência experimental semelhante resulta em uma mudança na velocidade normal durante o desenvolvimento de uma explosão para um determinado teste.
A taxa de queima normal é a taxa na qual a frente de chama se propaga em relação aos reagentes não queimados. A taxa de queima depende de uma série de propriedades físico-químicas dos reagentes, em particular, da condutividade térmica e da velocidade de uma reação química, e tem um valor bem definido para cada combustível (sob condições de combustão constantes). Na tabela. 1 mostra as taxas de queima (e limites de ignição) de algumas misturas gasosas. As concentrações de combustível nas misturas foram determinadas a 25°C e pressão atmosférica normal. Os limites de inflamabilidade, com as exceções observadas, foram obtidos com a propagação da chama em um tubo de 0,05 m de diâmetro fechado em ambos os lados. Os coeficientes de excesso de combustível são definidos como a razão do conteúdo volumétrico de combustível na mistura real para a mistura estequiométrica (j1) e para a mistura na taxa de queima máxima (j2).
tabela 1
Taxas de queima de misturas condensadas (oxidante inorgânico + magnésio)
| Folha |
| N º do documento. |
| Assinatura |
| a data |
| Folha |
| TGIV 20.05.01.070000.000 PZ |
Como pode ser visto, durante a combustão de misturas de ar e gás à pressão atmosférica você max está dentro de 0,40-0,55 m/s, e - dentro de 0,3-0,6 kg/(m2-s). Apenas para alguns compostos insaturados de baixo peso molecular e hidrogênio você max está dentro de 0,8-3,0 m/s e atinge 1-2 kg/(m2s). Por ampliação e max os combustíveis estudados em misturas com o ar podem ser
organizar na seguinte linha: gasolina e combustíveis líquidos para foguetes - parafinas e aromáticos - monóxido de carbono - ciclohexano e ciclopropano - etileno - óxido de propileno - óxido de etileno - acetileno - hidrogênio.
| Mudar |
| Folha |
| N º do documento. |
| Assinatura |
| a data |
| Folha |
| TGIV 20.05.01.070000.000 PZ |
A taxa de combustão linear das misturas de oxigênio é muito maior do que as misturas de ar (para hidrogênio e monóxido de carbono - 2-3 vezes e para metano - mais de uma ordem de grandeza). A taxa de combustão de massa das misturas de oxigênio estudadas (exceto para a mistura CO + O2) está na faixa de 3,7–11,6 kg/(m2 s).
Na tabela. A Tabela 1 mostra (de acordo com os dados de N. A. Silin e D. I. Postovsky) as taxas de queima de misturas compactadas de nitratos e percloratos com magnésio. Para a preparação das misturas, foram utilizados componentes em pó com tamanhos de partículas de nitratos 150–250 μm, percloratos 200–250 μm e magnésio 75–105 μm. A mistura foi envasada em cascas de papelão com um diâmetro de 24-46 mm a um fator de compactação de 0,86. As amostras foram queimadas ao ar à pressão e temperatura inicial normais.
A partir de uma comparação dos dados da Tabela. 1 e 1.25 segue que as misturas condensadas são superiores às misturas gasosas em termos de massa e inferiores a elas em termos de taxa de queima linear. A taxa de queima de misturas com percloratos é menor do que a taxa de queima de misturas com nitratos, e as misturas com nitratos de metais alcalinos queimam a uma taxa mais alta do que as misturas com nitratos de metais alcalino-terrosos.
mesa 2
Limites de inflamabilidade e taxas de queima de misturas com ar (I) e oxigênio (II) à pressão normal e temperatura ambiente
| Folha |
| N º do documento. |
| Assinatura |
| a data |
| Folha |
| TGIV 20.05.01.070000.000 PZ |
| Mudar |
Métodos para calcular a taxa de queima de líquidos
| Mudar |
| Folha |
| N º do documento. |
| Assinatura |
| a data |
| Folha |
| TGIV 20.05.01.070000.000 PZ |
![]() ; (16)
; (16)
Onde Mé a taxa de burnout adimensional;
 ; (17)
; (17)
M F- peso molecular do líquido, kg mol -1 ;
d- tamanho característico do espelho do líquido em chamas, m. É determinado como a raiz quadrada da área da superfície de combustão; se a área de combustão tem a forma de um círculo, então o tamanho característico é igual ao seu diâmetro. Ao calcular a taxa de combustão turbulenta, pode-se tomar d= 10m;
T paraé o ponto de ebulição do líquido, K.
O procedimento de cálculo é o seguinte.
O modo de combustão é determinado pelo valor do critério de Galileu Ga, calculado pela fórmula
Onde g- aceleração de queda livre, m·s -2 .
Dependendo do modo de combustão, a taxa de queima adimensional é calculada M. Para o modo de combustão laminar:
Para o modo de combustão transiente:
se então ![]() , (20)
, (20)
se , então , (21)
Para regime de combustão turbulenta:
; ![]() , (22)
, (22)
M0- peso molecular do oxigênio, kg mol -1 ;
n 0- coeficiente estequiométrico de oxigênio na reação de combustão;
n F- coeficiente estequiométrico do líquido na reação de combustão.
B- parâmetro adimensional que caracteriza a intensidade da transferência de massa, calculada pela fórmula
![]() , (23)
, (23)
Onde Q- menor poder calorífico do líquido, kJ·kg -1 ;
| Mudar |
| Folha |
| N º do documento. |
| Assinatura |
| a data |
| Folha |
| TGIV 20.05.01.070000.000 PZ |
c- capacidade calorífica isobárica dos produtos de combustão (assumida igual à capacidade calorífica do ar c = 1), kJ·kg -1 ·K -1 ;
T0- temperatura ambiente, tomada igual a 293 K;
H- calor de vaporização do líquido no ponto de ebulição, kJ·kg -1 ;
c eé a capacidade térmica isobárica média do líquido na faixa de T0 antes T para.
Se a viscosidade cinemática do vapor ou o peso molecular e o ponto de ebulição do líquido em estudo são conhecidos, então a taxa de combustão turbulenta é calculada usando dados experimentais pela fórmula
Onde eu- valor experimental da taxa de queima no modo de combustão transiente, kg·m -2 ·s -1 ;
eu- o diâmetro do queimador em que o valor é obtido eu, M. Recomenda-se o uso de uma tocha com diâmetro de 30 mm. Se for observado um regime de combustão laminar em um queimador com diâmetro de 30 mm, deve-se utilizar um queimador de diâmetro maior.
3. PROPAGAÇÃO DE CHAMA EM MISTURAS DE GÁS
A velocidade de propagação da chama durante a combustão de substâncias sólidas, líquidas e gasosas é de interesse prático em termos de prevenção de incêndios e explosões. Considere a velocidade de propagação da chama em misturas de gases e vapores combustíveis com ar. Conhecendo essa velocidade, é possível determinar a velocidade segura do fluxo gás-ar em uma tubulação, mina, instalação de ventilação e outros sistemas explosivos.
3.1. VELOCIDADE DA CHAMA
Como exemplo, na fig. 3.1 mostra um diagrama de ventilação de exaustão em uma mina de carvão. Das derivações da mina 1 até a tubulação 2, uma mistura empoeirada de ar e pó de carvão é removida e, em alguns casos, o metano é liberado nas camadas de carvão. Quando ocorrer um incêndio, a frente de chama 3 se espalhará em direção aos drifts 1. Se a velocidade da mistura combustívelW será menor que a velocidade de propagação da frente de chamae em relação às paredes do tubo, a chama se espalhará pela mina e causará uma explosão. Portanto, para o funcionamento normal do sistema de ventilação, é necessário cumprir a condição
w> você.
A taxa de remoção da mistura explosiva deve ser maior que a taxa de propagação da frente de chama. Isso evitará que as chamas entrem nas derivações do eixo.
Arroz. 3.1. Esquema de propagação da chama na mina:
1 - meu; 2 - tubulação; 3 - frente de chama
A teoria da propagação da chama desenvolvida nos trabalhos de Ya.B. Zeldovich e D.A. Frank-Kamenetsky, baseia-se nas equações de condução de calor, difusão e cinética química. A ignição de uma mistura combustível sempre começa em um ponto e se espalha por todo o volume ocupado pela mistura combustível. Considere um caso unidimensional - um tubo preenchido com uma mistura combustível (Fig. 3.2).
Se a mistura for inflamada a partir de uma extremidade do tubo, uma frente de chama estreita se propagará ao longo do tubo, separando os produtos de combustão (atrás da frente de chama) da mistura combustível fresca. A frente de chama tem a forma de uma tampa ou cone com sua parte convexa voltada para o movimento da chama. A frente de chama é uma fina camada gasosa (10 -4 ÷10 -6) m de largura, nesta camada, que é chamada de zona de combustão, ocorrem reações de combustão química. A temperatura da frente de chama, dependendo da composição da mistura, é T= (1500 ÷ 3000) K. O calor de combustão liberado é gasto no aquecimento dos produtos de combustão da mistura combustível fresca e das paredes do tubo devido aos processos de condução de calor e radiação.

Arroz. 3.2. Esquema de propagação da frente de chama em um tubo
Quando a frente da chama se move no tubo, surgem ondas de compressão na mistura combustível, que criam movimentos de vórtice. Redemoinhos de gás dobram a frente da chama sem alterar sua espessura e a natureza dos processos que ocorrem nela. Em uma superfície unitária da frente de chama, a mesma quantidade de substância por unidade de tempo sempre queima. ![]() . O valor é constante para cada mistura combustível e é chamado de taxa de queima de massa. .
Conhecendo a área da frente de chamaS, você pode calcular a massa de uma substância M, combustível em toda a frente de combustão por unidade de tempo:
. O valor é constante para cada mistura combustível e é chamado de taxa de queima de massa. .
Conhecendo a área da frente de chamaS, você pode calcular a massa de uma substância M, combustível em toda a frente de combustão por unidade de tempo:
Cada elemento da frente de chama dSse move em relação à mistura fresca sempre na direção da normal à frente da chama em um determinado ponto (Fig. 3.2), e a velocidade desse movimento:
onde é a densidade da mistura combustível fresca.
Valor é chamada de velocidade normal de propagação da chama e tem a dimensão m/s. É um valor constante do processo de combustão de uma determinada mistura e não depende das condições hidrodinâmicas que acompanham o processo de combustão. A velocidade normal de propagação da chama é sempre menor que a velocidade observada e, ou seja, a velocidade da frente de combustão em relação às paredes do tubo:
você< u .
Se a frente da chama for plana e direcionada perpendicularmente ao eixo do tubo, então neste caso a velocidade observada e normal de propagação da chama será a mesma
u n = u.
A área da frente de chama convexaQuestão Ssempre maior que a área da frente planaS pl, É por isso
> 1.
Velocidade normal da chamavocêpara cada mistura combustível depende da mistura de gases inertes, temperatura da mistura, umidade e outros fatores. Em particular, o pré-aquecimento do gás combustível aumenta a taxa de propagação da chama. Pode-se mostrar que a velocidade de propagação da chamavocêé proporcional ao quadrado da temperatura absoluta da mistura:
u n .= const T 2.
Na fig. 3.3 mostra a dependência da velocidade de propagação da chama na mistura combustível "ar - monóxido de carbono" em função da concentração de CO. Como segue dos gráficos acima, a velocidade de propagação da chama aumenta com o aumento da temperatura da mistura. Para cada valor de temperatura, a velocidade de propagação da chama tem um máximo na região de concentração de monóxido de carbono CO igual a ~ 40%.
A capacidade calorífica do gás inerte afeta a taxa de propagação da chama. Quanto maior a capacidade calorífica de um gás inerte, mais ele reduz a temperatura de combustão e mais reduz a velocidade de propagação da chama. Portanto, se uma mistura de metano com ar for diluída com dióxido de carbono, a velocidade de propagação da chama pode diminuir em 2 a 3 vezes. A taxa de propagação da chama em misturas de monóxido de carbono com ar é muito influenciada pela umidade contida na mistura, pela presença de partículas de fuligem e impurezas de gases inertes.

Arroz. 3.3. Dependência da velocidade de propagação da chama
na concentração de monóxido de carbono na mistura
Distribuição da zona de transformações químicas em um sistema combustível aberto
A combustão começa com a ignição da mistura combustível no volume local do sistema combustível, depois se espalha na direção da mistura em movimento. A zona de queima na qual as reações químicas redox visíveis ao observador são realizadas é chamada de chama. A superfície que separa a chama e a mistura ainda não queimada serve como frente de chama. A natureza da propagação da chama depende de muitos processos, mas o processo de aquecimento da mistura combustível é decisivo. Dependendo do método de aquecimento da mistura combustível até a temperatura de ignição, a propagação da chama normal, turbulenta e de detonação são distinguidas.
A propagação normal da chama é observada durante a combustão em um sistema combustível com uma mistura laminar em movimento. Durante a propagação normal da chama, a energia térmica é transferida da camada ardente para a fria principalmente por condutividade térmica, bem como por difusão molecular. A condutividade térmica em gases é caracterizada por baixa intensidade, portanto, a velocidade de propagação normal da chama é baixa.
Durante o movimento turbulento de uma mistura combustível, a transferência de energia térmica da camada ardente para a fria ocorre principalmente por difusão molar, bem como por condutividade térmica. A transferência molar é proporcional à escala de turbulência, que é determinada pela velocidade da mistura. A velocidade de propagação turbulenta da chama depende das propriedades da mistura e da dinâmica gasosa do escoamento.
A propagação da chama em uma mistura combustível da zona de combustão para as camadas frias através de processos moleculares e molares é chamada de deflagração.
Os processos de combustão física e química são acompanhados por um aumento de temperatura e pressão na chama. Em sistemas combustíveis, sob certas condições, podem surgir zonas de alta pressão que podem comprimir as camadas adjacentes, aquecendo-as até um estado de ignição. A propagação da chama pela compressão rápida de uma mistura fria até a temperatura de ignição é chamada de detonação e é sempre explosiva.
Em sistemas combustíveis, pode ocorrer combustão vibratória, na qual a frente de chama se move a uma velocidade que varia tanto em magnitude quanto em direção.
A velocidade de propagação da frente de combustão em uma mistura em movimento laminar ou estacionária é chamada de velocidade normal ou fundamental de propagação da chama. O valor numérico da velocidade normal é determinado pela velocidade da mistura ainda não inflamada, normalmente direcionada para a frente de combustão.
O valor de u n para uma frente de combustão plana pode ser determinado a partir da condição de equilíbrio dinâmico entre a taxa de aquecimento da mistura por condutividade térmica até a temperatura de ignição e a taxa de reação química. O resultado é a seguinte fórmula
onde l é o coeficiente de condutividade térmica da mistura gasosa, ср é o coeficiente de capacidade calorífica da mistura a pressão constante, Тin é a temperatura inicial da mistura, Та é a temperatura de combustão adiabática, Arr é o critério de Arrhenius, k 0 é o coeficiente da lei de Arrhenius.
A velocidade normal pode ser determinada experimentalmente a partir da velocidade da frente em um tubo com mistura estacionária ou da altura do cone de combustão em um bico de Bunsen. O bico de Bunsen é um queimador de laboratório com pré-mistura parcial de gás e ar. Na saída do queimador forma-se uma chama com uma frente de combustão em forma de cone de formato regular (Fig.).
Fig.7. Frente de combustão em um bico de Bunsen
Com uma posição estável da frente de combustão, a velocidade de propagação da chama u n é equilibrada pela componente W n normal à superfície do cone de combustão e a velocidade da mistura gás-ar W, ou seja.
onde j é o ângulo entre o vetor velocidade da mistura gás-ar e o vetor de sua componente normal à superfície do cone de combustão.
O valor da velocidade de movimento da mistura gás-ar na saída do bocal com um cone de combustão de formato regular é determinado pela fórmula
onde d 0 é o diâmetro do bocal do queimador, V é a vazão da mistura gás-ar através do queimador.
O valor de cos j pode ser expresso em termos da altura do cone de combustão
Tendo em conta que a superfície de combustão é a superfície lateral de um cone regular
o valor da velocidade normal é determinado
O valor da velocidade normal de propagação da chama é afetado por:
1. Temperatura inicial da mistura. Em baixas temperaturas, u n é diretamente proporcional ao quadrado da temperatura absoluta da mistura que entra na combustão. A uma temperatura acima da temperatura de ignição, o conceito de velocidade normal perde seu significado, pois a mistura torna-se capaz de auto-ignição.
2. A temperatura das paredes do canal, desde que a chama se propague dentro deste canal. Paredes frias interrompem reações em cadeia e retardam a propagação da chama.
3. Diâmetro do canal. Para cada mistura combustível, existe um valor crítico do diâmetro d cr, a partir do qual é impossível a propagação da chama no interior do canal. O valor do diâmetro crítico pode ser determinado pela fórmula
onde a cm é a difusividade térmica da mistura.
4. Pressão. Com o aumento da pressão, u n diminui.
5. A composição da mistura. Para uma mistura com composição próxima a estequiométrica, a velocidade normal tem um valor máximo. Além disso, existem limites inferiores e superiores em termos de concentração de combustível, além dos quais a chama não pode se espalhar.
Lubrificantes
O principal objetivo no desenvolvimento de lubrificantes ecologicamente corretos é criar um produto com alta biodegradabilidade e baixa ecotoxicidade. Nos países desenvolvidos do Ocidente,
Atualmente, empresas públicas e privadas estão começando a criar um mercado para lubrificantes ecologicamente corretos. A maioria dos estudos está focada na composição química do produto e na avaliação de sua biodegradabilidade. Ao criar lubrificantes ecologicamente corretos, duas áreas principais são consideradas: a produção de óleos básicos, cuja natureza química determina a natureza do impacto no meio ambiente, e a síntese de novos aditivos ecologicamente corretos, biodegradáveis e eficazes.
Atualmente, e provavelmente no futuro, três grupos de óleos básicos derivados de várias fontes de matéria-prima são de particular importância: óleos de petróleo hidrocraqueados (HAs), polialfaolefinas (PAOs) e ésteres, que são rapidamente biodegradáveis no meio ambiente. De grande importância por um período indefinidamente longo, os óleos básicos de petróleo dos esquemas de fluxo tradicionais, sem dúvida, permanecerão, especialmente levando em consideração o fator que os lubrificantes obtidos com base no PAO. ésteres de poliálcoois, polialquilenoglicóis e diésteres, têm um custo de 2 a 10 vezes mais do que os produtos petrolíferos. O aumento da biodegradabilidade não é um incentivo para superar os diferenciais de preços.
As características de alto desempenho e a compatibilidade ambiental dos óleos minerais são fornecidas por um conjunto de certas qualidades. Em primeiro lugar, esta é a sua composição química fracionária estreita e favorável do grupo com uma quantidade mínima de compostos de enxofre e nitrogênio em óleos básicos. A escolha das matérias-primas, a classificação dos óleos usados na produção de óleos de alto índice e seu processamento separado são de suma importância. Na obtenção de óleos minerais básicos que atendem aos requisitos ambientais, a purificação seletiva desempenha um papel importante,
significativa carcinogenicidade do produto. Atualmente, nos EUA e Canadá, mais de 70% dos óleos básicos são obtidos por refino seletivo. O uso de processos modernos como hidrocraqueamento, hidrodesparafinação, hidroisomerização abre amplas possibilidades. Essas tecnologias são descritas em detalhes no trabalho. O uso de processos hidrocatalíticos em combinação com métodos tradicionais de refino de matérias-primas de petróleo com solventes seletivos melhora o desempenho e as propriedades ambientais dos óleos básicos.
Na tabela. A Tabela 1.4 mostra dados comparativos sobre a composição química dos óleos básicos obtidos por refino seletivo e hidrotratamento. Este último reduz significativamente o teor de arenos, enxofre e nitrogênio nos óleos.
Tabela 14
Efeito do Hidrotratamento na Composição Química
óleos básicos
A introdução de processos de hidrocraqueamento e hidroisomerização na produção de óleos minerais básicos permite obter produtos de maior biodegradabilidade e isentos de arenos. Os óleos de hidrocraqueamento, de acordo com os resultados obtidos usando métodos de teste modernos, não são tóxicos, a ausência prática de arenos neles indica uma carcinogenicidade muito baixa e uma probabilidade insignificante de seu crescimento através da formação e acúmulo de arenos policíclicos durante a operação; a ausência de arenos e a predominância
Dar isoparafinas fornece uma biodegradabilidade bastante alta.
Os óleos base hidrocraqueados são produzidos nos EUA desde o final de 1996. . Uma instalação na Finlândia foi preparada para start-up.
Na Rússia, VNIINP, juntamente com o centro científico e de engenharia da OAO LUKOIL e AO LUKOIL - Volgogradneftepererabotka, estão realizando pesquisas para organizar a produção de uma série de óleos e bases escassos usando tecnologias de hidrogenação, em particular, óleo de aviação MS-8 e AMG fluido hidráulico de aviação - dez.
Comparados aos óleos minerais, os óleos sintéticos em alguns casos apresentam melhores características ambientais. As classes de óleos sintéticos mais importantes em termos de segurança ambiental incluem óleos feitos à base de ésteres sintéticos, polialfao-lefinas e polibutenos. São atóxicos, não cancerígenos, caracterizados pela baixa emissão de substâncias nocivas.
Óleos sintéticos à base de ésteres com aditivos têm sido amplamente utilizados em motores de turbina a gás de aeronaves civis e militares desde a década de 1960. No CIAM, juntamente com o VNIINP e o 25º Instituto Estadual de Pesquisa do Ministério da Defesa da Federação Russa, está em andamento o trabalho para criar um óleo de éster altamente estável termicamente (até 240 ° C) usando composições de aditivos eficazes que não são inferiores em qualidade aos melhores óleos estrangeiros. Uma análise de informações científicas, técnicas e de patentes sobre óleos para motores de turbinas a gás de aviação mostra que os ésteres de poliol continuam sendo a principal classe de compostos para uso como estoques de base [PO]. No entanto, a situação está mudando com a próxima geração de motores de aeronaves, pois as melhorias no projeto e a necessidade de reduzir o consumo de combustível levam a um aumento na pressão, temperatura e estresse no óleo.
Este último contribui para o perigo de formações locais de carbono. Portanto, para a aviação militar no futuro, é necessário abandonar o uso de óleos à base de ésteres. Para este fim, os óleos de um novo tipo são mais promissores - baseados em perfluoroalquilpoliéteres simples. De acordo com dados modernos, esses compostos não são tóxicos e são usados até no exterior em perfumaria e para a conservação de monumentos de arte e arquitetura em mármore.
Os aditivos têm uma grande influência nas propriedades ambientais dos lubrificantes. Em óleos de aviação, antioxidantes tradicionais e inibidores de corrosão como dioctildifenilamina, fenil-p-naftilamina, benzotriazol, aditivo tipo succinimida K-51 e outros que se mostraram comprovados são amplamente utilizados como aditivos.
Em todo o mundo, o trabalho está em andamento há muito tempo para criar novos produtos não tóxicos e biodegradáveis. Em particular, desde os anos 90, foram desenvolvidos substitutos para aditivos contendo cloro. Uma questão importante é a substituição de compostos de chumbo. Substitutos de chumbo são compostos de bismuto. O desenvolvimento de um aditivo de bismutoditiocarbamato já começou.
Aditivos como Mif-1 (aditivo tipo benzeno de composição complexa), Irganox L-57 (aditivo antioxidante da Siba, difenilamina octilada e butilada), aditivo X (um composto contendo flúor com grupos funcionais oxissulfito e hidroxicarbamato) e outros têm foi desenvolvido.
As propriedades dos aditivos conhecidos são melhoradas. Assim, no fosfato de tricresil, o conteúdo do ortoisômero neutrotóxico é reduzido para 3% (Rússia), e nos EUA, é produzido fosfato de tricresil que não contém o ortoisômero.
Risco de incêndio e explosão de avnafuels e lubrificantes
Os combustíveis e lubrificantes de aviação atualmente usados são produtos inflamáveis. Em termos de fogo, os combustíveis gasosos são especialmente perigosos. Combustíveis de hidrocarbonetos (combustíveis de aviação, gasolinas, etc.) são líquidos inflamáveis (líquidos inflamáveis). Eles são caracterizados pela alta produção de calor (-2000 ° C) e volatilidade, criam facilmente misturas combustíveis com o ar, que, quando queimados, formam uma grande quantidade de produtos de combustão (grande coeficiente estequiométrico), que são bons dielétricos e, portanto, podem acumular cargas de eletricidade estática.
De acordo com o risco de incêndio, os líquidos inflamáveis são divididos em três categorias. O ponto de fulgor é usado como um indicador determinante (é determinado de acordo com GOST 12.1.044-89):
Dependendo da temperatura de autoignição (determinada de acordo com GOST 12.1.044-89), os combustíveis de hidrocarbonetos pertencem a um ou outro grupo de uma mistura explosiva de vapores com ar:
Ousamos que os vapores de combustíveis de hidrocarbonetos com ar pertencem à categoria de explosivos TTA: é determinado de acordo com GOST 12.1.011-78. Este indicador é usado ao escolher o tipo de equipamento elétrico à prova de explosão e ao projetar extintores de incêndio.
As propriedades inflamáveis do combustível também são determinadas pelos limites de concentração de ignição (CIL) - o teor mínimo e máximo de vapores de combustível em uma mistura com ar (oxidante), no qual a propagação da chama através da mistura é possível a qualquer distância da ignição fonte (GOST 12.1.044-89). Uma característica importante do combustível são os limites de temperatura de ignição - as temperaturas nas quais os vapores saturados do combustível no ar estão em concentrações iguais ao CPV inferior ou superior, respectivamente. De grande importância é a energia mínima da descarga elétrica necessária para inflamar a mistura vapor-ar.
Ao avaliar o risco de incêndio ao manusear combustíveis, a taxa de queima também é determinada - a quantidade de combustível que queima por unidade de tempo de uma superfície de unidade; energia mínima de ignição - para garantir a segurança da faísca eletrostática. A interação da queima de combustível com agentes extintores de espuma de água é avaliada (de acordo com GOST 12.1.044-89).
Um incêndio é frequentemente precedido por uma explosão de uma mistura de gás-ar. Com a explosão de misturas de ar em tubos de grande diâmetro e comprimento, pode ocorrer a combustão por detonação, propagando-se a uma velocidade de 1100-1400 m/s. Neste caso, a pressão pode subir para 0,8 MPa ou mais. Uma onda de choque de alta velocidade causa um aumento acentuado na pressão, temperatura e densidade da mistura combustível, que, por sua vez, acelera as reações químicas da combustão e aumenta o efeito destrutivo.
Concentrações explosivas de vapores de combustível com ar podem se formar em uma ampla faixa de temperaturas, e especialmente em espaços fechados e recipientes. A natureza e o conteúdo das medidas cautelares são regulados por instruções especiais departamentais. A essência das precauções é evitar a ocorrência de uma fonte de aquecimento em locais onde se formam misturas explosivas, especialmente uma fonte de fogo aberto. Uma das fontes mais perigosas de fogo aberto é a descarga de potenciais eletrostáticos através de um meio vapor-ar e a formação de uma faísca quando atingida por corpos sólidos. A ocorrência de altos potenciais elétricos no combustível é explicada por suas propriedades eletrofísicas. Eles podem ser caracterizados pela capacidade de acumular cargas no volume (eletrolisabilidade) e propriedades de relaxamento de carga (fio elétrico para eles).
Na tabela. 1.5. indicadores que caracterizam as propriedades perigosas ao fogo dos combustíveis de aviação são fornecidos.
Tabela 1.5
Propriedades inflamáveis dos combustíveis de aviação
1 Calculado por aditividade.
^ Calculado de acordo com as equações (47) e (48) GOST 12.1.044-89 com base no ponto de ebulição inicial de -10/-4°C.
° No numerador - em cadinho fechado, no denominador - em cadinho aberto. a 'Limites de propagação de chama de acordo com GOST 10277-89.
Velocidade normal da chama
A velocidade de propagação da chama em uma mistura combustível depende das condições para sua determinação e contagem. Para uma avaliação comparativa dos combustíveis de acordo com esta característica, adota-se a velocidade normal de propagação da chama - esta é a velocidade linear de movimento da zona de combustão em relação a uma mistura combustível homogênea fresca na direção normal à frente da chama. A taxa de propagação da chama nessas condições para uma dada composição da mistura combustível pode ser considerada como uma característica físico-química que depende apenas da pressão e da temperatura.
Experimentalmente, a velocidade normal de propagação da chama é determinada de acordo com GOST 12.1.044-89.
A uma temperatura de 20 ° C e uma pressão de 0,101 MPa em misturas hidrocarboneto-hidrogênio-ar, a velocidade máxima u é alcançada em uma concentração de combustível na mistura de C ^ ~ 1,15 C st x (Fig. 1.24), ou seja,
com a - 0,87 e com o número de átomos de carbono no hidrocarboneto n\u003e 7, é -39-40 cm / s (Fig. 1.25). A velocidade mínima normal de propagação da chama e a velocidade de combustão em massa alcançada nos limites de concentração de propagação da chama sob condições normais são 4–6 cm/se (5–7) 10° g/(cm 2 s), respectivamente.
Na ausência de dados experimentais, a velocidade normal de propagação da chama deve ser escolhida por interpolação dos valores de u para misturas com propriedades físico-químicas semelhantes, ou devem ser usadas equações empíricas. Equações simples e convenientes foram propostas por A.S. Pré-condução:
- (1.3)
t \u003d t p + B (St-C ^ (C em -C t),
onde u é a velocidade de propagação em cm/s; m é a taxa de combustão em massa da mistura, g/(cm 2 s); e 11P, tn - valores limitantes (mínimos) da velocidade de propagação da chama; С„ e С n são a concentração de combustível na mistura nos limites de concentração inferior e superior de propagação da chama; A e B são coeficientes determinados a partir de um ponto experimental.

Arroz. 1,24.
propagação da chama dependendo do coeficiente estequiométrico molar do excesso de ar bm:
- - parafina; * - olefínico; ° - acetileno; D - óleo; © - dipolar; ° hidrocarbonetos com ciclos C p 11 2 „
- 1 2 3 4 5 b 7 p

Arroz. 1,25. A velocidade máxima normal de propagação da chama na mistura combustível-ar dependendo do número de átomos de carbono na molécula de hidrocarboneto (P=0,101 MPa, 1=20°C, tubo de vidro aberto: comprimento 57 cm, diâmetro 2,5 cm): - parafina; * - olefínico;
° - acetileno; D - naftênico; em - dnolsfipovye; o cíclico (C P P2 ");
1 - gasolina [ 116]; 2 - benzeno
A relação funcional entre a velocidade de propagação da chama e a concentração de combustível C t em C t C * t (mas dada por EMIN) pode ser representada pela equação:
- - = 11p
/sr-s; eu
"s t -s "t"
onde m e e n- velocidade normal de propagação da chama
nas concentrações de combustível na mistura C t e C*t, cm/s; e pp- também,
no limite inferior de concentração de propagação da chama, cm/s.
Curso aproximado da curva e n - /(Ct) em uma mistura de complexos
A composição pode ser construída em três pontos de referência correspondentes aos limites de concentração inferior e superior e à velocidade máxima de propagação da chama. Para esses pontos, as concentrações de combustível e as velocidades de propagação da chama devem ser conhecidas.
Valores C t e e e para os pontos especificados são calculados
pelo seguinte método. Cada mistura complexa de gases combustíveis é representada como consistindo de um número correspondente de misturas simples. O cálculo da composição nos limites de concentração e no ponto de velocidades máximas é realizado de acordo com a regra de mistura, com base nos limites de concentração e na composição das "misturas máximas". A equação de cálculo correspondente tem a forma:
C] + C* 2 + Su uh...
- -eu---g...
- (1.5)
Onde b- a concentração de combustível no CPRP ou em uma mistura com velocidade máxima de propagação da chama,% (vol.); C, C 2, C 3, ... - a concentração de gases simples em uma mistura complexa,
(s, + C 2 + C 3 + ... = 100%); b|, b 2 , b 3> ... - a concentração de gases em misturas simples no KPRP ou em misturas com e e, % (vol.).
O valor da velocidade máxima normal de propagação da chama na mistura é calculado pela equação;
C, r/, + C2u2 + C3u3 +
C, + C 2 + c 3 4-...
- (1.6)
onde C*, C 2 , C 3 - o teor de misturas simples em uma mistura complexa com velocidade máxima de propagação da chama,% (vol.); e*, e 2, e 3 são as velocidades máximas de propagação da chama em misturas simples, cm/s.
Para calcular outros pontos da curva e e= /(C; .) deve-se definir vários valores arbitrários da velocidade da chama, encontrar a concentração b em uma mistura complexa de acordo com a equação (1.5), na qual C, C 2 , C 3 são dados pela composição de a mistura.
Este método de cálculo é aplicável a misturas gasosas de natureza relacionada (por exemplo, metano-propano). Esta técnica não é aplicável a uma mistura de S P N W com H3 e CO.
A taxa de combustão em massa é diretamente proporcional à temperatura absoluta de pré-aquecimento da mistura e pode ser calculada a partir da equação:

onde w, então e t „ R e- taxa de combustão em massa da mistura na temperatura T, To e T P r e d, respectivamente, g/(cm -s).
Se T»T pr e D, então

A dependência da velocidade máxima normal de propagação da chama da temperatura e pressão é descrita aproximadamente pela equação:
e' =u1(T/273) 2 ?(/’/10 5)", (19)
onde u'o é a velocidade máxima normal de propagação da chama a uma temperatura de 293 K e uma pressão de 0,101 MPa, cm/s; T é a temperatura l da chama, em K; P - pressão, em Pa; p - expoente, ns dependendo da pressão na faixa MO 4 + 5-10 5 Pa; para mistura ar-combustível n = -0,3 -*? -0,4; para misturas hidrocarboneto-oxigênio P = -0,1 -5-0.
Velocidade máxima normal de propagação da chama em função da concentração de oxigênio no oxidante P R P Wu P
giil = \%ig" 0 + B-
onde G „Eu! Mas - em y, p y^ 0 , cm2/s; B - coeficiente determinado a partir de dados experimentais (para propano B ~ 0,22); u/t- concentração extremamente baixa de oxigênio no oxidante.
O valor de u*n em diferentes concentrações de oxigênio no oxidante 1 //"P quando a temperatura de pré-aquecimento da mistura muda de 310 para 422 K, pode ser determinada pela equação:
":=at; (u,-s), (MO
onde u*n - em cm/s; T - em K; А, С ip - são encontrados de acordo com dados experimentais, seus valores para propano, isooctano e etileno são dados abaixo:
Limites de concentração e temperatura de propagação da chama
Os limites de concentração de propagação da chama (KPRP) em uma mistura combustível são as concentrações mínimas e máximas limitantes de combustível na mistura nas quais a propagação da chama ainda é possível (limites inferior e superior, respectivamente). Eles dependem da atividade química do combustível, da concentração do oxidante e das impurezas inertes, da condutividade térmica e capacidade calorífica da mistura, temperatura e pressão. KPPR para combustíveis em suspensão, com base em suas propriedades físicas e químicas, são determinados pelo meio de dispersão. A determinação de KPRP para misturas combustíveis homogêneas é realizada de acordo com GOST 12.1.044-89: de acordo com a cláusula 4.11 experimentalmente e de acordo com a cláusula 4.12 - por cálculo.
De acordo com o GOST 12.1.044-84, os limites de concentração de propagação da chama são definidos como

onde Cn(i) - CPRP inferior (superior),% (vol.); R- coeficiente estequiométrico (número de moles de oxigênio por mol de combustível); uma e b- constantes universais, seus valores são dados abaixo:
Para combustíveis C P N W
P \u003d n + t / 4.
Erro de cálculo: para o limite inferior 0,12; para os 0,40 superiores em (3 p > 7,5. Dados sobre KIRP dependendo R(% vol.) são dados na tabela. 1.6 (GOST 12.1.044-84).
Tabela 1.6
Limites de concentração de propagação da chama (inferior e superior) de vapores e gases no ar
Existem outras equações para o cálculo do CPRP, a saber:
- 4,76-(N-1)+! '
- (1.14)
- 4,76/Y +4'
- (1.15)
onde С„ e De para - em cerca de.); N é o número de átomos de oxigênio necessários para a oxidação completa do combustível.
Para combustível С„Н t
- (1.17)
- 3,74 10 5
onde Cn - em% (vol.); () né o valor calorífico molar mais baixo, kJ/kmol.
Para combustíveis de hidrocarbonetos SpN t em 3 p 10, o erro de cálculo é de ±15%.
Se o KRI para componentes individuais de combustível for conhecido, seu KRI mais baixo é recomendado para ser calculado usando a equação:
onde C e Cn são as concentrações do 1º componente na mistura e no limite inferior, % (vol.).
Para combustíveis C p N t na primeira aproximação a k ~ a p - 1,42. Recálculo, e de dentro para a e a produzido:

onde Cn (d) é a concentração de combustível na parte inferior (superior)
KPRP, % (vol.); Mt e Mo são o peso molecular do combustível e do oxidante; Bo - em kg de oxidante/kg de combustível; bm é o coeficiente estequiométrico molar, mol de combustível/mol de combustível.
O recálculo do KPPR mais baixo para diferentes temperaturas pode ser realizado de acordo com a equação:
LIIl
T - 293
onde Tn é a temperatura (em K) dos produtos de combustão da mistura, em que a concentração de combustível a 293 K corresponde ao KPP mais baixo (na primeira aproximação, Tn para uma mistura hidrocarboneto-ar é 1600-1650 K); C „ e C „ - concentrações de combustível correspondentes ao limite inferior de concentração nas temperaturas T e 293 K, % (cerca de.).
A Equação (1.20) é válida em uma ampla faixa de temperaturas, mas não pode ser usada em temperaturas próximas à temperatura de auto-ignição.
A temperatura dos produtos de combustão no KPRP mais baixo também pode ser calculada usando a equação
- (A. + 1) -s_s
- (1.21)
steh
onde Tn em K; T com a temperatura da mistura antes da combustão, K; Сstsh - concentração de combustível em uma mistura de composição estequiométrica, % (vol.);
Срш é a capacidade térmica isobárica média dos produtos de combustão a uma temperatura T, „ kJ / (kg ° С).
A PCR é praticamente independente das dimensões de um vaso de reação cilíndrico se seu diâmetro for maior que 50 mm, e para um esférico, se o volume for superior a 2.000 cm 3 .
Para determinar o KPPR e a composição ótima da mistura hidrocarboneto-ar, os gráficos mostrados na fig. 1,26.
С„,s,%(ov.)

Arroz. 1,26. Os limites de concentração de propagação de chama em misturas de hidrocarbonetos-ar (Cb e C") e a concentração de hidrocarbonetos em misturas de composição estequiométrica (Cc, ") dependendo do coeficiente estequiométrico molar 1^ m em H20 ° C P = 0,101 MPa:
- - parafina; a - olefínico;
- ? - naftênico; ? - aromático
Misturas combustíveis de vapores de combustível com ar no espaço acima do combustível podem ser formadas apenas em uma determinada faixa de temperatura. A temperatura mínima na qual uma mistura combustível capaz de combustão estacionária quando inflamada de uma fonte externa ainda pode se formar em um volume fechado do espaço de sobrecombustível é chamada de limite inferior de temperatura; corresponde ao KPP inferior. A temperatura mais alta na qual a mistura de vapores com ar no espaço acima do combustível ainda mantém a capacidade de combustão estacionária é chamada de limite superior de temperatura; corresponde ao KPRP superior A determinação experimental dos limites de temperatura para a formação de misturas explosivas é realizada de acordo com GOST 12.1.044-89 (p. 4.12), calculado - de acordo com a aplicação do mesmo padrão.
A temperatura na qual é atingido o limite inferior de temperatura para a formação de uma mistura explosiva à pressão atmosférica é geralmente identificada com o ponto de fulgor. No ponto de fulgor, apenas a mistura vapor-ar resultante queima, mas o processo de combustão não se estabiliza.
O cálculo dos limites de temperatura para a formação de misturas combustíveis é reduzido às seguintes operações. Inicialmente, a uma determinada pressão total P e valores conhecidos do coeficiente de excesso de oxidante (ar) correspondente ao KPRP inferior e superior (uma n e ac), de acordo com a equação (1.22) determinar
pressões parciais de vapores de combustível Р t :
X | 0,232 sobre? 0 Mt " ?« -
onde P é a pressão total, Pa; C - coeficiente estequiométrico, kg de oxidante/kg de combustível; uma - fator de excesso de oxidante; Mt é a massa de um mol de combustível, kg/kmol; Mo é a massa de um mol de um agente oxidante, para o ar Mo = 28,966 kg/kmol; no/ 0 - concentração de oxigênio no oxidante em massa.

Arroz. 1,27.
Então, de acordo com as tabelas ou gráficos, Pc.p. = ^ (0 (onde P, a pressão dos vapores de combustível saturados) encontre as temperaturas correspondentes aos valores calculados de Pt-
Se os limites de concentração para a formação de misturas combustíveis são desconhecidos, então os limites de temperatura podem ser calculados aproximadamente usando a equação:
1,15 1*(7,5 R d) - 0,239 3,31
onde I - a 0 C; 15% - ponto de ebulição da fração de 5%, 0 C; Рт - pressão dos vapores de combustível no KPP (Р„ ou Р„), kPa; 8 „ com „ - a entropia de evaporação a uma temperatura de 15% e pressão atmosférica (tomada de acordo com o gráfico da Fig. 1.28).

Arroz. 1,28.
60 80 100 120 140 160 180 1,°C
Limites de energia inflamável e concentração inflamável
A inflamabilidade de uma mistura combustível homogênea por uma fonte externa de calor é caracterizada pelos limites de concentração e pela energia necessária para incendiá-la.
Os limites de ignição por concentração (CIL) são tais concentrações limitantes de combustível em uma mistura em que uma fonte de ignição local (descarga elétrica, corpo aquecido, chama) é capaz de garantir a propagação do processo de combustão para todo o volume da mistura. Por analogia com KG1RP, o CPV inferior e superior são distinguidos. Eles dependem das propriedades físico-químicas do combustível e do oxidante, energia e tipo de fonte de ignição, sua localização, etc.
De acordo com Ya.B. Zeldovich, a energia necessária para inflamar uma mistura combustível homogênea é determinada por:
R1-T com r (T 2 -Tc)
onde pc e Tc são a densidade e a temperatura da mistura; Tg é a temperatura dos produtos de combustão na câmara de combustão inicial; eu 7 - coeficiente de condutividade térmica dos produtos de combustão em Tg; u - velocidade normal de propagação da chama; C rt - médio
capacidade de calor isobárica de massa de gás em uma camada esférica 8 T que circunda a câmara de combustão inicial esférica; 5, - largura térmica da frente de chama.
A equação (1.24) também é aplicável ao caso de ignição de uma mistura em movimento, se o coeficiente de condutividade térmica eu 7 ser substituído pelo coeficiente de troca turbulenta 4/"(/ - escala
turbulência, V/*- velocidade pulsante), e o valor de n - a velocidade de propagação da chama em um fluxo turbulento.
A composição da mistura correspondente ao mínimo da curva O = KS,),é chamado de ótimo. Para hidrocarbonetos parafínicos normais, a concentração de combustível em uma mistura de composição ótima a 25°C pode ser determinada a partir da razão:
- 1 - metano; 2 - etano; 3 - propano;
- 4 - n-butano; 5 - n-hexano; 6 - n-heptano;
- 7 - ciclopropano: 8 - éter dietílico;
- 9 - benzeno
Com um aumento na concentração de oxigênio no oxidante, a composição ótima da mistura combustível muda para a região de menor concentração de combustível.
A dependência da energia de ignição ótima (mínima) da pressão e temperatura da mistura combustível é descrita pela equação [114]:
O-opt


onde Oopt é a energia de ignição em P e T, J; Cb - energia de ignição em T = 273 K e P = 10 5 Pa.
A equação (1.26) tem boa correlação com os dados experimentais.
A relação entre a energia de ignição ideal e a concentração de oxigênio no oxidante é descrita pela equação

onde (С? 0 „„,) y / = / - o valor ideal da energia de ignição da mistura combustível-oxigênio; ~ concentração de volume
oxigênio no oxidante; n é o expoente, está próximo da unidade (n ~ 0,8).
Dados experimentais para metano, etano e propano ao mudar c/x, de 0,1 a 0,21 e pressões de 0,98 a 19,6 kPa confirmam a equação (1,27). Aparentemente, continua válido para misturas de hidrocarbonetos.
As concentrações de combustível nos limites de ignição podem ser calculadas se o KPRP e os valores de () ref e C opt forem conhecidos de acordo com as equações

o,5 (s; + s;) \u003d C_ + 0,15 (C. (1,29)
As equações (1.28) e (1.29) são válidas para --
Denotando as partes certas dessas equações, respectivamente, B e 0,5A, obtemos
COM" - COM" = B e C"+C" = MAS . (1.30)
C" = 0,5 (L-B) e C; =0,5 (A + B). (1.31)
Nas equações acima: C in e C n - concentrações de combustível na mistura no KPRP superior e inferior; C in e C " - a concentração de combustível na mistura no CPV superior e inferior com a energia de ignição da carga elétrica capacitiva; C opt - a concentração de combustível na mistura correspondente a O ref.
As equações (1.28) e (1.29) são baseadas nos resultados de estudos experimentais mostrados na fig. 1,30.
- (s;-s>;)-2s opt

Arroz. 1,30. Área de ignição das misturas C p N P1 + 02 + ^ dependendo da energia de ignição
Os limites de concentração de ignição dependem da vazão, aproximando-se um do outro com seu aumento (Fig. 1.31 e 1.32).
A influência da velocidade do fluxo na energia de ignição é corretamente descrita pela equação:
(2 = (?o + Au" para (1,32)
onde (Zo - energia de ignição de uma mistura estacionária, 10"3 J; XV - velocidade de fluxo, m/s; A - coeficiente estabelecido experimentalmente.

Arroz. 1.31.

Arroz. 1,32. Excesso de coeficiente de ar a no CPV da mistura gasolina-ar dependendo da vazão? e pressão Р [ 114]:
Ponto de fulgor e temperatura de auto-ignição
O ponto de fulgor é a temperatura mínima na qual a mistura vapor-ar resultante pode ser inflamada por uma fonte externa de calor, mas o processo de combustão não é estabilizado. Experimentalmente, o ponto de fulgor é determinado em cadinho aberto ou fechado de acordo com GOST 12.1.044-84 (itens 4.3 e 4.4). A determinação calculada do ponto de fulgor é feita de acordo com GOST 12.1.044.84 (cláusula 4.5).
O ponto de fulgor é 10-15°C abaixo do limite de temperatura para a formação de uma mistura combustível capaz de propagar a chama.
Para uma determinação aproximada do ponto de fulgor, a dependência mostrada na Fig. 1 pode ser usada. 1,33.

Arroz. 1,33. Ponto de inflamação 1 V cp de combustíveis para aviação e gasolina B-70 dependendo da pressão de vapor saturado Pn p a 1=40°C em cadinho fechado (62]: o - combustíveis de composição diferente; - curva generalizadora
A auto-ignição é o processo de ignição de uma mistura combustível sem contato com uma chama ou corpo quente. A temperatura inicial mínima suficiente para auto-ignição de uma mistura combustível é chamada de temperatura de auto-ignição. Depende da natureza química do combustível, da composição da mistura ar-combustível, da pressão, da natureza adiabática do processo de auto-ignição, da presença de catalisadores e inibidores de oxidação e outros fatores.
O intervalo de tempo entre o momento em que a mistura combustível atinge a temperatura de auto-ignição e o aparecimento de uma chama é chamado de período de atraso de auto-ignição. Ao fornecer combustível líquido, abrange o processo de atomização, aquecimento e evaporação de gotículas de combustível, difusão de vapores de combustível e oxigênio e, finalmente, reações químicas.
A temperatura e o período de atraso de auto-ignição estão interligados pela relação:

Onde E- energia de ativação efetiva, kJ/kmol; E\u003d 8,31419 kJ / (kmol K) - constante de gás universal; t- período de atraso de auto-ignição à temperatura T.
A tendência dos hidrocarbonetos e suas misturas à auto-ignição é caracterizada pela temperatura mínima de auto-ignição obtida em condições adiabáticas, quando o tempo de exposição da mistura combustível em determinadas condições iniciais não limita o processo de auto-ignição.
A temperatura mínima de auto-ignição é determinada exclusivamente pela estrutura da molécula. Assim, por exemplo, para hidrocarbonetos parafínicos, 1º está diretamente relacionado ao comprimento efetivo da cadeia de carbono Lc, que é calculado pela equação:
- 21>GLG,
- (1.34)
onde r é o número de grupos CH3 na molécula; k é o número de cadeias de carbono começando e terminando com o grupo CH 3, m* é o número de cadeias possíveis contendo b^-átomos de carbono. A dependência 1 sv =A(bc) é mostrada na fig. 1,34.

Arroz. 1,34.
- 1 - CH 4; 2 - C2H6; 3 - C3H"; 10 - n - C 4 H 10; 11 - n - C 5 H 12;
- 14 - n - S L N M; 15 - n - C7H16; 16 - n - SkNsch; 17 - n - SdN 2 o;
- 18 - n - C| 0 H 22; 19 - n - C, 2H2I; 21 - n - C14H30; 22 - n - C|^H 3 4
A temperatura de auto-ignição de misturas de hidrocarbonetos não obedece à regra de aditividade, geralmente é inferior à calculada com base na regra especificada.
Os dados sobre a temperatura de auto-ignição de misturas ar-combustível da composição ideal, dependendo do número de átomos de carbono na molécula de hidrocarboneto (para combustíveis de jato na fórmula acima) são mostrados na Fig. 2. 1,35. O efeito da pressão e concentração de oxigênio no oxidante é ilustrado pelos dados mostrados na fig. 1,36.

Arroz. 1,35. Dependência da temperatura de auto-ignição de misturas ar-combustível de composição ótima do número de átomos de hidrocarboneto n na molécula em Р=0,101 MPa [124]; t é o período de atraso da auto-ignição; t L - "sobre; R.T. - combustíveis para aviação (p-na fórmula acima) - parafina; a-olefínico; ? - hidrocarbonetos naftênicos

Arroz. 1,36. A dependência da temperatura de auto-ignição do combustível T-6 na pressão P e concentração de oxigênio no oxidante f 0 2 (de acordo com V.V. Malyshev):
2 = 0 2/(°2+L, d)
A temperatura de autoignição é determinada pela capacidade do combustível de formar misturas combustíveis na fase de vapor. Segue-se daí que a temperatura de auto-ignição da suspensão
combustíveis é determinado pelo meio de dispersão e pelo espessante. A fase dispersa participa do processo de auto-ignição apenas em termos de absorção de calor quando a suspensão é aquecida à temperatura de auto-ignição da fase líquida.
Pressão de explosão em um volume fechado
Pressão de explosão - a pressão mais alta que ocorre durante uma explosão de deflagração de uma mistura vapor-ar em um volume fechado a uma pressão inicial de 0,101 MPa. A taxa de aumento de pressão durante uma explosão é a derivada da pressão de explosão em relação ao tempo (s1R/(1t) na seção ascendente da dependência P=Y t).
Experimentalmente, a pressão máxima de explosão e a taxa de aumento de pressão durante a explosão de misturas vapor-ar são determinadas de acordo com GOST 12.1.044-89 (Apêndice 8). A determinação calculada da taxa de aumento de pressão durante uma explosão é realizada de acordo com GOST 12.1.044-89 (Apêndice 12).
A pressão de explosão é determinada por:

onde Pvzr - pressão de explosão, Pa; Pn - pressão inicial, Pa; T „, e T p.s. - temperatura inicial e temperatura dos produtos de combustão. PARA; pico - o número de moles de produtos de combustão e a mistura inicial.
A taxa máxima de aumento de pressão (em Pa/s) é calculada a partir da equação

onde Ro é a pressão inicial. Pa; u - velocidade normal de propagação da chama em Po e To m/s; To é a temperatura inicial da mistura, K; r é o raio da bomba, m; P- R m /P 0 - pressão máxima de explosão reduzida; k é o índice adiabático para a mistura em teste; e- indicador termocinético, dependendo de e n, pressão e temperatura; se valor e desconhecido, é tomado igual a 0,4.
A taxa média de aumento de pressão (em Pa/s) é calculada a partir da equação:
"s1R_ZR 0 e '(i-)-i k * e ^m) com g / (l, k, e)
Onde ^m,k 7 e)-função, seu valor é encontrado de acordo com o nomograma fig. 1,37.

Arroz. 1,37. Dependência de função /(n, c.s) de pressão reduzida n=P/P K,„ expoente adiabático para e índice termocinético com mistura de teste (apêndice ao GOST 12.1.044-84)
Valores tg e k é encontrado por cálculo termodinâmico ou. em caso de impossibilidade de cálculo, aceitar para= 9,0 ek=1,4.
Emergências e emergências
Um acidente é um incidente perigoso causado pelo homem que cria uma ameaça à vida e à saúde das pessoas em um objeto, um determinado território ou área de água e leva à destruição de edifícios, estruturas, equipamentos e veículos, interrupção do processo de produção ou transporte , bem como danos ao meio ambiente natural (GOST R 22.0 .05-94).
Um acidente é uma liberação destrutiva descontrolada de energia ou componentes ativos quimicamente (biologicamente, radiação). Dependendo da fonte de ocorrência, distinguem-se as situações de emergência (ES) de natureza natural, artificial e natural. Na fig. 1.38 mostra o crescimento relativo do número de acidentes e desastres naturais, causados pelo homem e naturais na Rússia. Na fig. 1.39 mostra a dinâmica do número de todos os acidentes causados pelo homem na Rússia no período 1990-94. Pode-se observar pela figura que o aumento do número de emergências não ocorre de forma suave, mas abrupta, com surtos ocorrendo em períodos imediatamente posteriores às convulsões sociais (agosto de 1991, outubro de 1993).
O número de emergências provocadas pelo homem aumentou de forma especialmente acentuada nos últimos anos, inclusive na aviação.
Objetos potenciais de acidentes são aeronaves, bem como instalações de armazenamento e depósitos de produtos petrolíferos explosivos e inflamáveis localizados no território do aeroporto, pontos de reabastecimento e manutenção e pontos de reparo. A causa das emergências pode ser vazamentos de óleo.
produtos através das unidades de vedação de válvulas de fechamento, bombas de transferência, tubulações e dispositivos de enchimento; através da ventilação do espaço de gás dos tanques; transbordamento de reservatórios, cisternas e tanques; limpeza de tanques; corrosão destruição de tanques e comunicações.
Vários contêineres são usados para armazenamento e transporte de produtos petrolíferos. A operação segura dos contêineres é determinada pela sua resistência. No entanto, acidentes nessas instalações podem ocorrer por deficiências no sistema existente de monitoramento e monitoramento do estado das estruturas, bem como pela falta de documentação regulatória e técnica.
A segurança da operação das instalações de armazenamento de produtos petrolíferos deve ser garantida durante o projeto, construção e operação. Esta abordagem é ditada pela análise da documentação de aceitação e operacional, bem como das causas das situações de emergência. Uma tarefa importante, cuja solução melhorará a confiabilidade das instalações de armazenamento operadas, é realizar seus exames técnicos abrangentes com base científica e equipá-los com um sistema de diagnóstico e monitoramento operacional do estado do metal, fundação, estruturas isolantes de calor e equipamento de processo.
Para a gestão segura dos fluxos de produtos petrolíferos, a facilidade de manutenção dos acessórios tecnológicos dos oleodutos é de grande importância: bloqueio, borboleta, dispositivos de segurança; válvulas de controle; válvulas de ação reversa (para evitar a possibilidade de movimentação do produto, o reverso do trabalhador); conexões de emergência e de corte (para fechamento automático do fluxo para a seção de emergência ou seu desligamento), drenos de condensado, etc.
Número de acidentes

Arroz. 1,38.
- 1 - pg "parentes;
- 2 - natural-tecnogênico;
- 3 - tecnogênico

Arroz. 1,39.
Quando o equipamento é despressurizado, o produto escoa e evapora rapidamente com a formação de uma concentração
de misturas explosivas e inflamáveis de gás-vapor-ar. Emissões acidentais ou vazamentos de misturas vapor-gás levam à formação de nuvens que podem detonar. A detonação de sistemas vapor-gás e aerodispersos é considerada no trabalho. A ocorrência de detonação em grandes nuvens é explicada pelos seguintes mecanismos. A primeira delas leva em conta o possível efeito da intensa radiação térmica de uma longa chama em nuvens preliminarmente misturadas por fluxos turbulentos de gás.
O segundo mecanismo para a ocorrência da detonação envolve a aceleração das chamas em grandes nuvens devido à diferença nas acelerações dos volumes elementares do gás queimado e da mistura fresca em uma chama turbulenta. Essa diferença surge sob a ação de gradientes médios de pressão na chama devido à flutuação diferente de volumes de gás elementar de diferentes densidades, o que leva a turbulência e feedback adicionais do fluxo. Esse mecanismo de feedback positivo, determinado pela diferença de densidades em diferentes áreas da nuvem, pode intensificar significativamente a aceleração da chama.
A ignição é acompanhada por um flash brilhante de alta temperatura. A figura geométrica mais aceitável da mistura vapor-gás é a figura de uma bola ou elipse irregular (bola de fogo). Entende-se por bola de fogo (OS) o produto da evaporação ou fuga repentina de combustível (ou gás) gaseificado, acompanhada do seu flash e posterior combustão normal ou deflagração. Para numerosas descargas lineares e cíclicas combustíveis de hidrocarbonetos na faixa de densidade de 700 a 1000 kg / m 3, as relações para o diâmetro da bola de fogo são fornecidas:
onde M é a massa de combustível no OH, kg;
Тf - temperatura real no OR (na nuvem), 0 С;
Trep - temperatura de referência (referência), °C.
A faixa do coeficiente 4,2n-5,3 depende do tipo de combustível e das condições de formação de nuvens.
Para o tempo de vida de uma nuvem durante sua combustão natural, a expressão tem a forma:
m = 0M-*1m-1±.
Estas dependências mostram-se no figo. 1,40 e 1,41.

Arroz. 1,40.

Arroz. 1,41.
Existe um grande perigo de explosão de misturas vapor-gás-ar em um volume fechado. Na tabela. 1.7 mostra os limites de detonação de hidrocarbonetos no ar em volume fechado e espaço aberto, que indicam maior perigo de explosão de gás ou misturas gás-vapor em volume fechado. Isso se explica tanto pelos processos de aceleração da reação devido ao aumento da autocatálise, quanto pela amplificação das ondas refletidas durante o início do processo ariano e por uma série de razões cinéticas sempre existentes. A maior facilidade de excitação da detonação nos vasos se deve à capacidade das paredes de gerar turbulência no escoamento em frente à chama, o que acelera a transição da combustão para a detonação.
Limites de detonação para hidrocarbonetos no ar
A explosão da mistura gasosa acumulada pode ocorrer sob a ação de uma faísca acidental. Com um carregamento aberto de um produto de petróleo, uma explosão também é possível devido a uma descarga estática, em particular, na ausência de um dispositivo de aterramento. A causa mais comum de uma explosão é uma faísca, inclusive como resultado do acúmulo de eletricidade estática. Uma faísca elétrica pode ocorrer sem quaisquer condutores e redes. É perigoso porque ocorre nos lugares mais inesperados: nas paredes dos tanques, nos pneus dos carros, nas roupas, no impacto, no atrito, etc. Outra causa da explosão é a negligência e indisciplina dos trabalhadores.
Onde for possível a formação de misturas vapor-gás-ar, é necessário fornecer proteção confiável contra raios, proteção contra eletricidade estática e medidas contra faíscas de aparelhos elétricos e outros equipamentos.
Em caso de acidentes associados a explosões, ocorre a destruição de objetos ao redor e as pessoas ficam feridas. A destruição é uma consequência da ação fantasma dos produtos da explosão e da onda de choque do ar. Neste caso, os principais fatores danosos são a onda de choque, radiação luz-térmica e cargas tóxicas (monóxido de carbono). Pessoas que estão a uma distância de 5 m recebem queimaduras de 1º grau e outras lesões.
Acidentes explosivos são frequentemente acompanhados de incêndios, que podem causar consequências catastróficas e subsequentes explosões mais poderosas e mais destruição. As causas dos incêndios são geralmente as mesmas das explosões. Neste caso, uma explosão pode ser a causa ou efeito de um incêndio e vice-versa, um incêndio pode ser a causa ou efeito de uma explosão.
Um incêndio é uma cidade de rênio em desenvolvimento espontâneo, não fornecida por processos tecnológicos. A combustão de derivados de petróleo pode ocorrer em tanques, equipamentos de produção e derramamentos em áreas abertas. Em caso de incêndio de derivados de petróleo em tanques, podem ocorrer explosões, fervura e sua liberação e, como resultado, derramamentos de líquido quente. As emissões e a ebulição dos produtos petrolíferos são de grande perigo, o que está associado à presença de água nos mesmos, e caracteriza-se pela rápida combustão da massa espumosa dos produtos. Ao ferver, a temperatura aumenta acentuadamente (até 1500 ° C) e a altura da chama.
Para avaliar o grau de dano a um objeto, geralmente é usada a chamada curva de limiar, que relaciona o fluxo de energia luminosa térmica u (fluxo de calor) e a energia total O, caindo por unidade de superfície (Fig. 1.42).

Arroz. 1,42.
Para longos tempos de exposição térmica, excedendo o tempo da possível existência intacta do objeto, o limite de dano será determinado exclusivamente pelo fluxo térmico (luz térmica) n. Sob pulsos de curta exposição, o limite será determinado principalmente pela energia O. Valores de R e O que excederem o limite causarão danos incondicionais ao objeto.
Se I ou O for menor que seus valores limiares, então não há lesão típica e apenas desconforto leve é possível. Por exemplo, com um aumento na duração da radiação de 0,5 para 2 s, i diminui de 120 para 30 unidades, ou seja. com leve aumento de O mesmo com aumento do tempo de exposição em 4 vezes, afetando lesões
estão ausentes, e uma pessoa pode sentir apenas um leve desconforto.
No entanto, o valor da energia total O que incide sobre o objeto de destruição no mesmo período de tempo cresce de cerca de 10 para 25 unidades. (^.
Assim, a linha K, respondendo a mudanças inter-relacionadas em I e O, forma uma zona (área) da lesão, indicada na figura à direita da linha K.
Uma das consequências mais desagradáveis do dano por energia radiante é a queima dos “bastonetes” e “cones” do olho.
Na fig. 1.43 mostra a dependência de i em m, bem como T em m, que determina as áreas de dor tolerável e intolerável durante a formação de queimaduras de luz térmica de vários graus. O critério implementado na figura baseia-se no fato de que, com radiação térmica, ocorre dor insuportável quando a temperatura de uma camada da pele com cerca de 0,14-0,15 mm de espessura (sob a superfície da camada epitelial superior) atinge ou excede uma temperatura de 45 ° C.
Após a eliminação da radiação (mas não mais de 20-30 s), a dor aguda diminui e, em geral, desaparece completamente. Um aumento na temperatura da camada especificada em 4-10 graus ou mais causa choque de dor e queimaduras óbvias na pele.
A área de dor tolerável mostrada no gráfico é determinada pelo fato de que, no momento da exposição à radiação, ocorre um reflexo protetor biológico, causando um aumento no fluxo sanguíneo das partes periféricas do corpo, o que impede um aumento local de temperatura até um nível limite. Quando exposto a uma alta dose de pressão térmica, esse mecanismo fisiológico não pode mais fornecer a remoção de calor necessária, e o corpo sofre cargas térmicas patológicas e às vezes proibitivas. Pela natureza das linhas na Fig. 1,42 mostra que há um certo quantitativo
dose de radiação q e temperatura T, que causa dano térmico e a ocorrência de dor insuportável quando esta dose é fornecida com o tempo de exposição necessário.
Duração da exposição, s Fig 1.43. Limites de lesões térmicas e leves
Acidentes com aeronaves (LA) ocorrem principalmente devido ao mau funcionamento das unidades, em primeiro lugar - falha de motor, ataques terroristas, incêndio e são acompanhados por explosões. Uma explosão pode ocorrer no ar ou no impacto com o solo. Quando uma aeronave cai em áreas residenciais, pessoas, estruturas, etc.
Um dos principais perigos na aviação é a possibilidade de incêndio durante um pouso de emergência. O combustível escapando de tanques danificados pode ser inflamado por faíscas de fricção de
superfícies ou chamas abertas. Neste caso, o centro de combustão resultante se espalha rapidamente por todas as zonas nas quais as relações vapor/ar combustível estão dentro da faixa de inflamabilidade. Um método para reduzir o risco de incêndio é usar combustíveis gelificados, que se espalham mais lentamente e são menos voláteis do que os combustíveis líquidos convencionais. Quando um tanque com combustível engrossado é danificado, tanto a taxa de propagação do combustível quanto a taxa de formação de aerossóis inflamáveis são drasticamente reduzidas. Isso permite aumentar o período de tempo durante o qual os passageiros podem ser evacuados.
Emergências e emergências causam grandes danos materiais e agravam os problemas ambientais. Em caso de acidentes acompanhados de explosões e incêndios, há forte impacto mecânico, térmico e químico no meio ambiente. Ao mesmo tempo, as emissões de poluentes aumentam acentuadamente; a superfície da terra está repleta de fragmentos de LL, resíduos de combustível, produtos de combustão; danos significativos são causados à paisagem natural, flora, fauna; pastagens e solos férteis estão morrendo.
O efeito mecânico é caracterizado pela violação da camada superior (fértil) do solo devido à sua destruição superficial e profunda, o impacto da energia da explosão (onda de choque); violação da cobertura de grama, danos ou morte de arbustos, árvores e outra vegetação. A estrutura da camada fértil superior, as trocas de gás e água e a estrutura capilar estão mudando.
As medidas destinadas a melhorar a segurança em situações de emergência são geralmente divididas em duas categorias. A primeira inclui atividades realizadas após o surgimento de
situação de emergência. As atividades do El1 são geralmente chamadas de operacionais e se resumem essencialmente a proteger a população e eliminar as consequências das emergências. O segundo grupo de medidas inclui atividades realizadas antecipadamente. Isso inclui aumentar a confiabilidade dos equipamentos de processo, reduzir os estoques de substâncias perigosas nas instalações, remover uma instalação perigosa e tomar medidas precoces para proteger as pessoas.
De grande importância é o sistema de segurança de voo ativo (ASOSPS), que é um elemento do sistema de apoio ao piloto "inteligente" de bordo, conhecido na prática da aviação como "assistente do piloto", projetado para funcionar em situações de voo normais e anormais . A ASOBP emite sinais de alerta sobre uma ameaça à segurança de voo, bem como avisa prontamente informações na forma de “dicas” para controlar a aeronave e seu complexo a bordo, a fim de evitar que a aeronave entre em modos de voo críticos. Para evitar colisões com a superfície terrestre e entre aeronaves, o ASOBP gera trajetórias espaciais de "reprodução".
Uma das áreas efetivas de trabalho na prevenção de acidentes aéreos é a investigação completa, profunda e objetiva de eventos já ocorridos e o desenvolvimento de recomendações com base nisso para evitar sua recorrência.
A eficácia de tal trabalho depende não apenas de um nível suficiente de recursos, mas também dos poderes exaustivos do órgão que realiza uma investigação independente, permitindo influenciar qualquer área do sistema de transporte aéreo (fabricação, projeto, teste, certificação , operação, reparo, marco regulatório, etc.).
Padrão 5.4. O Anexo 13 da Convenção sobre Aviação Civil Internacional afirma: "A autoridade responsável pela investigação de acidentes deve ter independência na condução da investigação e poderes irrestritos para conduzi-la". Este requisito também é implementado nas Regras de Investigação Russas aprovadas pelo Governo da Federação Russa. O Comitê de Aviação Interestadual (IAC) formado pelo Acordo recebeu dos chefes de estado e de governo da CEI o direito de investigar independentemente acidentes de aviação. Desde 1992, os especialistas do IAC investigaram mais de 270 acidentes de aviação, incluindo mais de 50 internacionais, incluindo investigações de eventos com aeronaves de fabricação ocidental.
Existem atualmente sete centros especializados de investigação de acidentes no mundo (EUA, França, Grã-Bretanha, Canadá, Alemanha, Austrália e IAC).
De não pouca importância é o fornecimento de informações aos estados com dados sobre falhas e mau funcionamento de equipamentos de aviação e ações errôneas das tripulações. A partir desses dados, as autoridades aeronáuticas de cada Estado podem tomar medidas preventivas.