Oznaczenie żelaza w tabeli. Żelazo: pochodzenie i cechy. Związki żelaza
Żelazo, jego pozycja w układzie okresowym pierwiastków chemicznych D. I. Mendelejewa.
W układzie okresowym pierwiastków chemicznych D. I. Mendelejewa żelazo Fe znajduje się w 4. okresie grupy VIII podgrupy drugorzędowej.
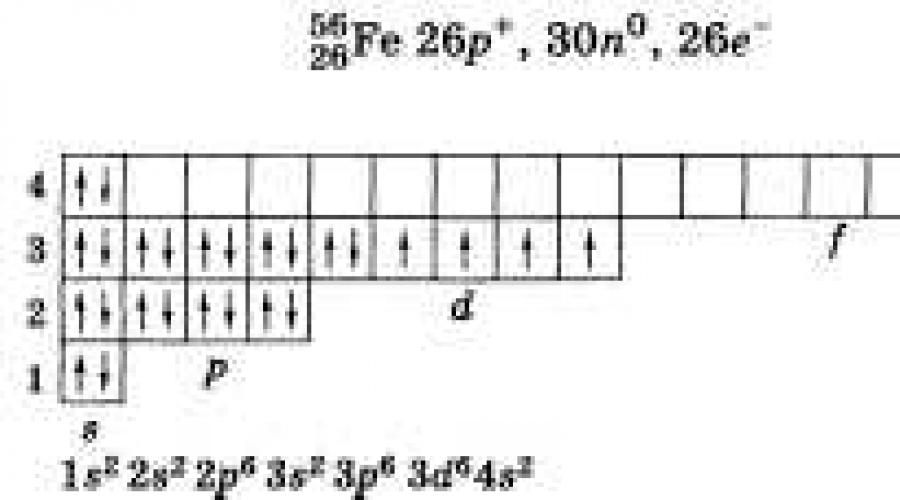
Rozkład elektronów na warstwach elektronowych w atomie żelaza wygląda tak:

W stanie podstawowym.
W stanie wzbudzonym.
Atom żelaza ma cztery warstwy elektronowe. Podpoziom d trzeciej warstwy jest wypełniony elektronami, jest na nim 6 elektronów, a na czwartej warstwie podpoziom s ma 2 elektrony. W związkach żelazo wykazuje stany utlenienia +2 i +3.
Znane są również związki z atomami żelaza na stopniach utlenienia +4, +6 i kilku innych.
właściwości fizyczne.
Żelazo to typowy metal, błyszczący srebrzystobiały metal, jego gęstość wynosi 7,87 g/cm3, t.t. 1539 C. Ma dobrą plastyczność. Żelazo łatwo się namagnesowuje i demagnetyzuje, dlatego jest używane jako rdzeń prądnic i silników elektrycznych. Żelazo składa się z czterech stabilnych izotopów o liczbach masowych 54,56,57 i 58. Żelazo jest metalem umiarkowanie ogniotrwałym. W serii standardowych potencjałów elektrod żelazo stoi przed wodorem i łatwo reaguje z rozcieńczonymi kwasami.
Ponadto warto zauważyć, że żelazo - po aluminium - jest najbardziej powszechnym metalem w przyrodzie (całkowita zawartość w skorupie ziemskiej wynosi 4,65 % masy). Znana jest duża liczba minerałów, w tym żelazo: magnetyt (magnetyczna ruda żelaza) - Fe3O4, hematyt (czerwona ruda żelaza) - Fe2O3, dźwigar żelazny (syderyt) - FeCO3, piryty żelazne - FeS2 itp.
Właściwości chemiczne.
Żelazo charakteryzuje się stopniami utlenienia - +2 i +3.
Stopień utlenienia +2 odpowiada czarnemu tlenku FeO i zielonemu wodorotlenkowi Fe(OH)2. Są podstawowe. W solach Fe(+2) występuje jako kation. Fe(+2) jest słabym środkiem redukującym.
+3 stopnie utlenienia odpowiadają czerwono-brązowemu tlenku Fe 2 O 3 i brązowemu wodorotlenku Fe(OH) 3 . Mają charakter amfoteryczny, chociaż ich właściwości kwasowe i zasadowe są słabo wyrażone. W ten sposób jony Fe 3+ są całkowicie hydrolizowane nawet w środowisku kwaśnym. Fe (OH) 3 rozpuszcza się (a nawet nie całkowicie) tylko w stężonych alkaliach. Fe 2 O 3 reaguje z alkaliami tylko po stopieniu, dając ferryty (formalne sole kwasu HFeO 2, który nie występuje w postaci wolnej):
Żelazo (+3) najczęściej wykazuje słabe właściwości utleniające.
Stany utlenienia +2 i +3 łatwo przechodzą między sobą, gdy zmieniają się warunki redoks.
Ponadto istnieje tlenek Fe 3 O 4, formalny stopień utlenienia żelaza wynosi +8/3. Jednak ten tlenek można również uznać za ferryt żelaza (II) Fe +2 (Fe +3 O 2) 2 .
Istnieje również stopień utlenienia +6. Odpowiedni tlenek i wodorotlenek nie istnieją w postaci wolnej, ale otrzymano sole - żelaziany (na przykład K 2 FeO 4 ). Żelazo (+6) znajduje się w nich w postaci anionu. Żelaziany są silnymi utleniaczami.
Właściwości prostej substancji.
Podczas przechowywania w powietrzu w temperaturze do 200 °C żelazo jest stopniowo pokrywane gęstą warstwą tlenku, co zapobiega dalszemu utlenianiu metalu. W wilgotnym powietrzu żelazo pokryte jest luźną warstwą rdzy, co nie zapobiega dostępowi tlenu i wilgoci do metalu i jego zniszczeniu. Rdza nie ma stałego składu chemicznego, w przybliżeniu jej wzór chemiczny można zapisać jako Fe 2 O 3 x H 2 O.
Reaguje z kwasami.
Z kwasem solnym:
Z rozcieńczonym kwasem siarkowym:
· Stężony kwas azotowy i siarkowy pasywuje żelazo. Oddziałuje ze stężonym kwasem siarkowym tylko po podgrzaniu:
Interakcja z tlenem:
Spalanie żelaza w powietrzu:
Spalanie w czystym tlenie:
Przepuszczanie tlenu lub powietrza przez stopione żelazo:
Interakcja z proszkiem siarki po podgrzaniu:
Interakcja z halogenami po podgrzaniu:
· Spalanie w chlorze:
Przy podwyższonym ciśnieniu par bromu:
Interakcja z jodem:
Interakcja z niemetalami:
Z azotem po podgrzaniu:
Z fosforem po podgrzaniu:
Z węglem:
Z krzemem:
Oddziaływanie gorącego żelaza z parą wodną:
Żelazo przywraca z roztworów soli metale znajdujące się po jego prawej stronie w serii aktywności:
Żelazo redukuje związki żelaza(III):
Przy podwyższonym ciśnieniu metaliczne żelazo reaguje z tlenkiem węgla (II) CO i w normalnych warunkach powstaje ciecz, łatwo lotny pentakarbonyl żelaza Fe (CO) 5 . Znane są również karbonylki żelaza o kompozycjach Fe2(CO)9 i Fe3(CO)12. Karbonylki żelaza służą jako materiały wyjściowe w syntezie związków żelazoorganicznych, w tym ferrocenu o składzie (η5-C5H5)2Fe.
Czyste żelazo metaliczne jest stabilne w wodzie i rozcieńczonych roztworach alkalicznych. Żelazo nie rozpuszcza się w zimnych stężonych kwasach siarkowym i azotowym ze względu na pasywację powierzchni metalu silnym filmem tlenkowym. Gorący stężony kwas siarkowy, będąc silniejszym utleniaczem, oddziałuje z żelazem.
Związki żelaza(II).
Tlenek żelaza (II) FeO ma podstawowe właściwości, odpowiada bazie Fe (OH) 2. Sole żelaza (II) mają jasnozielony kolor. Podczas przechowywania, zwłaszcza w wilgotnym powietrzu, brązowieją w wyniku utleniania do żelaza (III). Ten sam proces zachodzi podczas przechowywania wodnych roztworów soli żelaza(II):
Spośród soli żelaza (II) w roztworach wodnych, sól Mohra jest stabilna - podwójny siarczan amonu i żelaza (II) (NH 4) 2 Fe (SO 4) 2 6H 2 O.
Heksacyjanożelazian(III) potasu K 3 (sól czerwona krwi) może służyć jako odczynnik dla jonów Fe 2+ w roztworze. Gdy jony Fe 2+ i 3− oddziałują ze sobą, wytrąca się heksacyjanożelazian (III) potasu i żelaza (II) (błękit pruski):
który przegrupowuje się wewnątrzcząsteczkowo do heksacyjanożelazianu(II) potasu i żelaza(III):
Związki żelaza(III).
Tlenek żelaza(III) Fe2O3 jest najbardziej stabilnym naturalnym związkiem żelaza zawierającym tlen.
Tlenek żelaza (III) Fe2O3 jest słabo amfoteryczny, odpowiada jeszcze słabszej zasadzie Fe (OH) 2, Fe (OH) 3, która reaguje z kwasami:
Sole Fe3+ mają tendencję do tworzenia krystalicznych hydratów. W nich jon Fe3+ jest zwykle otoczony sześcioma cząsteczkami wody. Te sole mają kolor różowy lub fioletowy.
Jon Fe3+ jest całkowicie hydrolizowany nawet w środowisku kwaśnym. Przy pH>4 jon ten wytrąca się prawie całkowicie jako Fe(OH)3:
Przy częściowej hydrolizie jonu Fe3+ powstają wielopierścieniowe okso- i hydroksokacje, dzięki którym roztwory stają się brązowe.
Główne właściwości wodorotlenku żelaza(III) Fe(OH)3 są bardzo słabo wyrażone. Jest w stanie reagować tylko ze stężonymi roztworami alkalicznymi:
Powstałe hydroksokompleksy żelaza(III) są trwałe tylko w silnie alkalicznych roztworach. Po rozcieńczeniu wodą roztwory ulegają zniszczeniu i wytrąca się Fe (OH) 3 .
Po połączeniu z alkaliami i tlenkami innych metali Fe2O3 tworzy różne ferryty:
Związki żelaza(III) w roztworach są redukowane przez metaliczne żelazo:
Żelazo(III) może tworzyć podwójne siarczany z pojedynczo naładowanymi kationami typu ałunu, na przykład KFe(SO4)2 - ałun żelazowo-potasowy, (NH4)Fe(SO4)2 - ałun żelazowo-amonowy itp.
Do jakościowego wykrywania związków żelaza(III) w roztworze stosuje się jakościową reakcję jonów Fe3+ z nieorganicznymi tiocyjanianami SCN−. W tym przypadku powstaje mieszanina jasnoczerwonych kompleksów tiocyjanianowych żelaza 2+, +, Fe(SCN)3, -. Skład mieszanki (a co za tym idzie intensywność jej barwy) zależy od różnych czynników, dlatego metoda ta nie ma zastosowania do dokładnego jakościowego oznaczania żelaza.
Kolejnym wysokiej jakości odczynnikiem dla jonów Fe3+ jest heksacyjanożelazian(II) potasu (żółta sól krwi). Gdy jony Fe3+ i 4− oddziałują ze sobą, wytrąca się jasnoniebieski osad heksacyjanożelazianu (II) potasu i żelaza (III):
Jony Fe3+ są ilościowo określane przez tworzenie czerwonych (w lekko kwaśnym środowisku) lub żółtych (w lekko zasadowym) kompleksów z kwasem sulfosalicylowym. Ta reakcja wymaga właściwego doboru buforów, ponieważ niektóre aniony (w szczególności octan) tworzą mieszane kompleksy z żelazem i kwasem sulfosalicylowym o własnych właściwościach optycznych.
Związki żelaza(VI).
Żelaziany to sole kwasu żelazowego H2FeO4, które nie występują w postaci wolnej. Są to związki w kolorze fioletowym, przypominające nadmanganiany właściwościami utleniającymi i siarczany w rozpuszczalności. Żelaziany otrzymuje się przez działanie gazowego chloru lub ozonu na zawiesinę Fe (OH) 3 w alkaliach:
Żelaziany można również otrzymać przez elektrolizę 30% roztworu alkalicznego na anodzie żelaznej:
Żelaziany są silnymi utleniaczami. W środowisku kwaśnym rozkładają się z uwolnieniem tlenu:
Utleniające właściwości żelazianów są wykorzystywane do dezynfekcji wody.
Odnajdywanie w naturze:żelazo jest szeroko rozpowszechnione w skorupie ziemskiej – stanowi około 4,1% masy skorupy ziemskiej (4 miejsce wśród wszystkich pierwiastków, 2 wśród metali). Znana jest duża liczba rud i minerałów zawierających żelazo. Czerwona ruda żelaza (ruda hematytowa, Fe2O3; zawiera do 70% Fe), magnetyczna ruda żelaza (ruda magnetytowa, Fe3O4; zawiera 72,4% Fe), brązowa ruda żelaza (ruda hydrogoetytowa НFeO2 nH2O) i drzewcowa (ruda syderytowa, węglan żelaza, FeCO3; zawiera około 48% Fe). W przyrodzie występują również duże złoża pirytu FeS2 (inne nazwy to piryt siarkowy, piryt żelazowy, dwusiarczek żelaza i inne), ale rudy o wysokiej zawartości siarki nie mają jeszcze praktycznego znaczenia. Pod względem zasobów rudy żelaza Rosja zajmuje pierwsze miejsce na świecie. W wodzie morskiej 1 10–5 - 1 10–8% żelaza.
rola biologiczna.
Żelazo jest niezbędnym składnikiem hemoglobiny, mioglobiny, cytochromów, peroksydaz i katalaz. Kompleks żelaza i transferyny wiąże się ze specyficznymi receptorami na błonach proliferujących komórek erytroidalnych, a żelazo dostaje się do komórki. W przypadku niedoboru żelaza w organizmie powstają czerwone krwinki z niewystarczającą zawartością hemoglobiny, dlatego głównym objawem niedoboru żelaza jest niedokrwistość hipochromiczna. Leczenie preparatami żelaza prowadzi do stopniowego ustępowania objawów klinicznych (np. osłabienie, zmęczenie, zawroty głowy, tachykardia, bolesność i suchość skóry) i laboratoryjnych.
Żelazo występuje w organizmach wszystkich roślin i zwierząt jako pierwiastek śladowy, czyli w bardzo małych ilościach (średnio około 0,02%). Jednak bakterie żelazowe, które wykorzystują energię utleniania żelaza (II) do żelaza (III) do chemosyntezy, mogą gromadzić w swoich komórkach do 17-20% żelaza. Główną biologiczną funkcją żelaza jest udział w transporcie tlenu (O) i procesach utleniania. Ta funkcja żelaza pełni w ramach złożonych białek - hemoprotein, których grupą protetyczną jest kompleks żelazowo-porfirynowy - hem. Do najważniejszych hemoprotein należą barwniki układu oddechowego hemoglobina i mioglobina, uniwersalne nośniki elektronów w reakcjach oddychania komórkowego, utleniania i fotosyntezy cytochromów, enzymy katalozy i nadtlenku i inne. U niektórych bezkręgowców pigmenty oddechowe zawierające żelazo, heloerytryna i chlorokruoryna, mają inną strukturę niż hemoglobina. Podczas biosyntezy hemoprotein żelazo przechodzi do nich z białka ferrytyny, które magazynuje i transportuje żelazo. Białko to, którego jedna cząsteczka zawiera około 4500 atomów żelaza, jest skoncentrowane w wątrobie, śledzionie, szpiku kostnym i błonie śluzowej jelit ssaków i ludzi. Dzienne zapotrzebowanie człowieka na żelazo (6-20 mg) jest pokrywane w nadmiarze z pożywieniem (mięso, wątroba, jajka, chleb, szpinak, buraki i inne są bogate w żelazo). Ciało przeciętnego człowieka (masa ciała 70 kg) zawiera 4,2 g żelaza, 1 litr krwi zawiera około 450 mg. Przy braku żelaza w organizmie rozwija się niedokrwistość gruczołowa, którą leczy się lekami zawierającymi żelazo. Preparaty żelaza są również stosowane jako ogólny tonik. Nadmierna dawka żelaza (200 mg lub więcej) może być toksyczna. Żelazo jest również niezbędne do prawidłowego rozwoju roślin, dlatego istnieją mikronawozy na bazie preparatów żelaza.
Preparaty żelaza- grupa leków zawierających sole lub kompleksy żelaza dwu- i żelazowego, a także ich kombinacje z innymi lekami. Stosowany głównie w leczeniu i profilaktyce niedokrwistości z niedoboru żelaza.
Preparaty żelaza są wskazane do:
stany niedoboru żelaza (główne wskazanie);
z nietolerancją mleka krowiego;
dzieci, które przeszły ostre lub długotrwałe choroby zakaźne.
Niedobór żelaza może być spowodowany:
niewystarczające spożycie żelaza w ciele płodu (z transfuzją płodowo-płodową i płodowo-matczyną), dziecka lub osoby dorosłej;
Naruszenie wchłaniania ze światła jelita (zespół złego wchłaniania, procesy zapalne w jelicie, na tle przyjmowania antybiotyków tetracyklinowych i innych leków);
ostra masywna lub przewlekła utrata krwi (krwawienie, inwazja robaków, krwotok z nosa, młodzieńcze krwawienie z macicy, przedłużający się krwiomocz i inne);
Wynik zwiększonego spożycia żelaza (okres intensywnego wzrostu, choroby zakaźne i inne).
Skutki uboczne.
W przypadku doustnego przyjmowania preparatów żelaza mogą wystąpić objawy dyspeptyczne (nudności, wymioty, biegunka). Stopień ich nasilenia jest tym większy, im więcej niewchłoniętego leku pozostaje w świetle jelita. Najgorzej (najniższa biodostępność) wchłaniane jest z przewodu pokarmowego zredukowane żelazo (tylko 0,5%), to właśnie te leki najczęściej prowadzą do upośledzenia czynności jelit (nie powinny być stosowane u dzieci).
Aktywując reakcje wolnorodnikowe preparaty żelaza mogą uszkadzać błony komórkowe (m.in. zwiększając stopień hemolizy erytrocytów).
Po pozajelitowym podaniu preparatów żelaza mogą wystąpić działania niepożądane: ze względu na wzrost stężenia wolnego żelaza we krwi, zmniejszenie napięcia małych naczyń - tętniczek i żyłek - zwiększa ich przepuszczalność. Obserwuj zaczerwienienie skóry twarzy, szyi, przypływ krwi do głowy, klatki piersiowej. Dalsze podawanie leku w tym przypadku jest przeciwwskazane. Jeśli podawanie leku nie zostanie zatrzymane, w przyszłości rozwinie się hemosyderoza narządów wewnętrznych i tkanek.
Przy przedawkowaniu doustnego preparatu żelaza rozwija się krwawa biegunka i wymioty. W przypadku przedawkowania jakiegokolwiek preparatu żelaza zmniejsza się opór naczyń obwodowych, zwiększa się wynaczynienie płynów i zmniejsza się objętość krwi krążącej. W rezultacie spada ciśnienie krwi, pojawia się tachykardia.
Ogólnie rzecz biorąc, tę kategorię leków można podzielić na kilka głównych grup: preparaty na bazie soli żelaza i żelaza, różne złożone związki żelaza i środki połączone. Preparaty z soli żelaza są przepisywane tylko doustnie.
Sole żelaza.
Wchłanianie żelaza przez komórki błony śluzowej przewodu pokarmowego ze związków soli występuje głównie w postaci dwuwartościowej, ponieważ apoferrytyna w enterocytach może wiązać się tylko z jonami Fe2. Dlatego preparaty oparte na różnych solach żelaza (II) (siarczan, fumaran, glukonian, bursztynian, glutaminian, mleczan itp.) mają większą biodostępność i są na ogół korzystniejsze niż preparaty zawierające sole żelaza (III). Ponadto są najtańszymi lekami w porównaniu z innymi preparatami żelaza.
Pomimo tych zalet, preparaty soli żelaza mają również istotne wady, w szczególności wysoki poziom żołądkowo-jelitowych skutków ubocznych (około 23%) przy stosowaniu wysokich dawek. Biodostępność soli żelaza(II) może zmniejszać się podczas interakcji z różnymi składnikami żywności i innymi lekami (fityny, szczawiany, garbniki, leki zobojętniające itp.), dlatego są przepisywane na pusty żołądek, chociaż mają negatywny wpływ na błonę śluzową jelit wzrasta. Każde przedawkowanie tych leków łatwo prowadzi do ostrego zatrucia (w Stanach Zjednoczonych w latach 1986-1996 odnotowano 100 tys. doniesień o zatruciu dzieci poniżej 6 roku życia solami żelaza), co również nieco ogranicza ich powszechne stosowanie u dzieci.
Głównymi przedstawicielami preparatów z soli żelaza są produkty na bazie heptahydrat siarczanu żelaza FeSO 4 7H 2 O(zawartość żelaza pierwiastkowego - 20% wagowo soli). Siarczan żelazawy jest dobrze rozpuszczalny w wodzie i podobnie jak inne sole rozpuszczalne w wodzie ma stosunkowo wysoką biodostępność. Należy zauważyć, że siarczan żelaza(II) w wilgotnym środowisku ulega stopniowemu utlenianiu do siarczanu żelaza(III), co nakłada pewne ograniczenia na jego przechowywanie i stosowanie (nie może być stosowany w postaci roztworów, syropów i innych form płynnych) . W Rosji zarejestrowanych jest kilka nazw handlowych leków zawierających siarczan żelaza: „Tardiferon”, „Hemofer prolongatum”, „Fenyuls”. Ponadto siarczan żelazawy jest czasami stosowany w połączeniu ze środkami stabilizującymi, takimi jak kwas askorbinowy, który działa jako przeciwutleniacz (nazwy handlowe „Sorbifer Durules”, „Ferroplex”).
Preparaty oparte na tetrahydrat chlorku żelaza FeCl 2 4H 2 O(zawartość żelaza 28%), w przeciwieństwie do siarczanu żelazawego nie utleniają się w roztworach wodnych, dlatego produkowane są w postaci kropli do podawania doustnego (znak towarowy zarejestrowany w Rosji – „Gemofer”). Przyjmując takie leki, należy pamiętać, że roztwory soli żelaza mogą powodować ciemnienie zębów związane z osadzaniem się na ich powierzchni nierozpuszczalnego siarczku żelaza, który powstaje podczas interakcji jonów Fe 2+ z siarkowodorem, który może znajdować się w jamie ustnej (na przykład przy próchnicy).
Fumaran żelaza FeC 4 H 2 O 4(zawartość żelaza pierwiastkowego wynosi 33% wagowych soli), w przeciwieństwie do poprzednich soli, jest mniej rozpuszczalny w wodzie, ale dobrze rozpuszcza się w rozcieńczonych roztworach kwasów, takich jak sok żołądkowy. Dzięki temu preparaty na bazie fumaranu żelaza są bardziej stabilne, nie mają charakterystycznego smaku żelaza, nie wiążą się z białkami w górnym odcinku przewodu pokarmowego, ale jednocześnie dobrze rozpuszczają się bezpośrednio w żołądku, dzięki czemu nie ustępują rozpuszczalnym w wodzie sole pod względem biodostępności. Fumaran żelazawy jest zarejestrowany w Rosji jako produkt leczniczy, ale w tej chwili nie otrzymał dystrybucji.
Sole żelaza trójwartościowego.
Preparaty z soli żelaza żelazowego są tradycyjnie mniej preferowane w porównaniu z solami żelaza (II), ponieważ do wchłaniania przez organizm jony Fe 3+ muszą być najpierw zredukowane do Fe 2+, co jest przyczyną ich mniejszej biodostępności. Ponadto sole żelaza(III) w górnych partiach jelita cienkiego łatwo ulegają hydrolizie do słabo rozpuszczalnych wodorotlenków, co również zmniejsza ich strawność.
Mangan.
Mangan jest elementem podgrupy bocznej siódmej grupy czwartego okresu Układu Okresowego Pierwiastków Chemicznych D. I. Mendelejewa o liczbie atomowej 25.
Elektroniczna formuła manganu to:
1s2 2s2 2p6 3s2 3p6 4s2 3d5
Elektrony walencyjne znajdują się na podpoziomach 4s i 3d. Na orbitalach walencyjnych atomu manganu znajduje się 7 elektronów.
Dystrybucja manganu w przyrodzie.Średnia zawartość manganu w skorupie ziemskiej wynosi 0,1%, w większości skał magmowych 0,06-0,2% wag., gdzie występuje w stanie rozproszonym w postaci Mn 2+ (analogicznie do Fe 2+). Na powierzchni ziemi Mn 2+ łatwo się utlenia, znane są tu również minerały Mn 3+ i Mn 4+. W biosferze mangan migruje energicznie w warunkach redukujących i jest nieaktywny w środowisku utleniającym. Mangan jest najbardziej mobilny w kwaśnych wodach tundry i krajobrazów leśnych, gdzie występuje w postaci Mn 2+ . Zawartość manganu jest tu często podwyższona, a rośliny uprawne miejscami cierpią na nadmiar manganu; w glebach, jeziorach, bagnach tworzą się grudki żelazowo-manganowe, rudy jeziorne i bagienne. Na suchych stepach i pustyniach w alkalicznym środowisku utleniającym mangan jest nieaktywny, organizmy są ubogie w mangan, rośliny uprawne często potrzebują mikronawozów manganowych. Wody rzeczne są ubogie w mangan (10 -6 -10 -5 g/l), ale całkowite usuwanie tego pierwiastka przez rzeki jest ogromne, a większość osadza się w strefie przybrzeżnej. W wodach jezior, mórz i oceanów jest jeszcze mniej manganu; w wielu miejscach na dnie oceanu powszechne są guzki żelazomanganu, powstałe w minionych okresach geologicznych.
minerały manganu.
piroluzyt MnO 2 x H 2 O, najczęstszy minerał (zawiera 63,2% manganu);
Manganit (ruda brązowa manganu) MnO(OH) (62,5% manganu);
Brownite 3Mn 2 O 3 MnSiO 3 (69,5% manganu);
Gausmanit (Mn II Mn 2 III) O 4;
Rodochrozyt (drewno manganowe, drzewce malinowe) MnCO 3 (47,8% manganu);
psilomelan m MnO MnO 2 n H20 (45-60% manganu);
purpuryt Mn 3+ (36,65% manganu).
Właściwości chemiczne.
Chemicznie mangan jest dość aktywny, po podgrzaniu silnie oddziałuje z niemetalami - tlenem (powstaje mieszanina tlenków manganu o różnej wartościowości), azotem, siarką, węglem, fosforem i innymi. W temperaturze pokojowej mangan nie zmienia się w powietrzu: bardzo wolno reaguje z wodą. Łatwo rozpuszcza się w kwasach (chlorowodorowy, rozcieńczony siarkowy), tworząc sole dwuwartościowego manganu. Po podgrzaniu w próżni mangan łatwo odparowuje nawet ze stopów.
Mangan tworzy stopy z wieloma pierwiastkami chemicznymi; większość metali rozpuszcza się w swoich indywidualnych modyfikacjach i stabilizuje je. Tak więc Cu, Fe, Co, Ni i inne stabilizują modyfikację γ. Al, Ag i inne rozszerzają obszary β- i σ-Mn w stopach podwójnych. Ma to ogromne znaczenie przy produkcji stopów na bazie manganu podatnych na odkształcenia plastyczne (kucie, walcowanie, tłoczenie).
W związkach mangan zwykle wykazuje wartościowość od 2 do 7 (najbardziej stabilne stany utlenienia to +2, +4 i +7). Wraz ze wzrostem stopnia utlenienia wzrastają właściwości utleniające i kwasowe związków manganu.
Związki Mn(+2) są środkami redukującymi.
Tlenek MnO- szaro-zielony proszek; ma podstawowe właściwości. nierozpuszczalny w wodzie i zasadach, rozpuszczalny w kwasach. Wodorotlenek Mn(OH)3 jest białą substancją nierozpuszczalną w wodzie. Związki Mn(+4) mogą działać zarówno jako czynniki utleniające (a) jak i redukujące (b):
MnO2 + 4HCl \u003d MnCl2 + Cl2 + 2H2O (a)
(wg tego wydania chlor pozyskiwany jest w laboratoriach)
MnO 2 + KClO 3 + 6KOH = 3K 2 MnO 4 + KCl + 3H 2 O (b)
(reakcja zachodzi podczas fuzji).
Tlenek manganu(II) MnO2- czarno-brązowy, odpowiedni wodorotlenek Mn (OH) 4 - ciemnobrązowy. Oba związki są nierozpuszczalne w wodzie, oba są amfoteryczne z niewielką przewagą funkcji kwasowej. Sole typu K2MnO4 nazywane są manganitami.
Spośród związków Mn(+6) najbardziej charakterystyczne są kwas nadmanganowy i jego sole manganianowe. Bardzo ważne są związki Mn(+7) - kwas manganowy, bezwodnik manganu i nadmanganiany.
Typowe stopnie utlenienia manganu: 0, +2, +3, +4, +6, +7 (+1, +5 nie są bardzo typowe).
Utleniony w powietrzu ulega pasywacji. Sproszkowany mangan spala się w tlenie (Mn + O2 → MnO2). Po podgrzaniu mangan rozkłada wodę, wypierając wodór (Mn + 2H2O → (t) Mn (OH) 2 + H2), a powstały wodorotlenek manganu spowalnia reakcję.
Mangan pochłania wodór, wraz ze wzrostem temperatury wzrasta jego rozpuszczalność w manganie. W temperaturach powyżej 1200 °C wchodzi w interakcje z azotem tworząc azotki o różnym składzie.
Węgiel reaguje ze stopionym manganem, tworząc węgliki Mn3C i inne. Tworzy również krzemki, borki, fosforki.
Reaguje z kwasami solnym i siarkowym zgodnie z równaniem:
W przypadku stężonego kwasu siarkowego reakcja przebiega zgodnie z równaniem:
Z rozcieńczonym kwasem azotowym reakcja przebiega zgodnie z równaniem:
Mangan jest stabilny w roztworze alkalicznym.
Mangan tworzy tlenki: MnO, Mn2O3, MnO2, MnO3 (niewydzielone w stanie wolnym) oraz bezwodnik manganu Mn2O7.
Mn2O7 w normalnych warunkach jest ciemnozieloną płynną oleistą substancją, bardzo niestabilną; w mieszaninie ze stężonym kwasem siarkowym zapala substancje organiczne. W temperaturze 90 °C Mn2O7 rozkłada się z wybuchem. Najbardziej stabilnymi tlenkami są Mn2O3 i MnO2, a także połączony tlenek Mn3O4 (sól 2MnO MnO2 lub Mn2MnO4).
Gdy tlenek manganu (IV) (piroluzyt) łączy się z alkaliami w obecności tlenu, powstają manganiany:
Roztwór manganianu ma ciemnozielony kolor. Po zakwaszeniu reakcja przebiega:
Roztwór staje się szkarłatny z powodu pojawienia się anionu MnO4−, z którego wytrąca się brązowy osad wodorotlenku tlenku manganu (IV).
Kwas nadmanganowy jest bardzo silny, ale niestabilny, nie może być skoncentrowany do więcej niż 20%. Sam kwas i jego sole (nadmanganiany) są silnymi utleniaczami. Na przykład nadmanganian potasu, w zależności od pH roztworu, utlenia różne substancje, redukując się do związków manganu o różnym stopniu utlenienia. W środowisku kwaśnym - na związki manganu (II), w obojętnym - na związki manganu (IV), w środowisku silnie zasadowym - na związki manganu (VI).
Kalcynowane nadmanganiany rozkładają się z uwolnieniem tlenu (jedna z laboratoryjnych metod otrzymywania czystego tlenu). Reakcja przebiega zgodnie z równaniem (na przykład nadmanganian potasu):
Pod wpływem silnych utleniaczy jon Mn2+ przechodzi w jon MnO4−:
Ta reakcja służy do jakościowego oznaczania Mn2+.
Gdy roztwory soli Mn(II) są alkalizowane, wytrąca się z nich osad wodorotlenku manganu(II), który w wyniku utleniania szybko brązowieje na powietrzu.
Sole MnCl3, Mn2(SO4)3 są nietrwałe. Wodorotlenki Mn(OH)2 i Mn(OH)3 są zasadowe, natomiast MnO(OH)2 są amfoteryczne. Chlorek manganu (IV) MnCl4 jest bardzo niestabilny, rozkłada się po podgrzaniu, z którego otrzymuje się chlor:
Zerowy stan utlenienia manganu przejawia się w związkach z ligandami σ-donorowymi i π-akceptorowymi. Tak więc w przypadku manganu znany jest karbonyl o składzie Mn2(CO)10.
Znane są również inne związki manganu z ligandami σ-donorowymi i π-akceptorowymi (PF3, NO, N2, P(C5H5)3).
rola biologiczna.
mangan w organizmie. Mangan jest szeroko rozpowszechniony w przyrodzie, będąc stałym składnikiem organizmów roślinnych i zwierzęcych. Zawartość manganu w roślinach wynosi dziesięciotysięczne-setne, a u zwierząt sto-tysięczne-tysięczne procenta. Bezkręgowce są bogatsze w mangan niż kręgowce. Wśród roślin znaczne ilości manganu gromadzą niektóre grzyby rdzy, kasztan wodny, rzęsa wodna, bakterie z rodzaju Leptothrix, Crenothrix i niektóre okrzemki (Cocconeis) (do kilku procent w popiele), a wśród zwierząt - mrówki czerwone, niektóre mięczaki i skorupiaków (do setnych części procenta). Mangan jest aktywatorem wielu enzymów, uczestniczy w procesach oddychania, fotosyntezy, biosyntezy kwasów nukleinowych i innych, wzmaga działanie insuliny i innych hormonów, wpływa na hematopoezę i metabolizm mineralny. Brak manganu w roślinach powoduje martwicę, chlorozę jabłek i cytrusów, plamienie zbóż, oparzenia ziemniaków, jęczmienia itp. Mangan znajduje się we wszystkich narządach i tkankach człowieka (najbogatsze są w niego wątroba, szkielet i tarczyca) . Dzienne zapotrzebowanie zwierząt i ludzi na mangan wynosi kilka mg (dziennie człowiek otrzymuje 3-8 mg manganu z pożywieniem). Zapotrzebowanie na mangan wzrasta wraz z aktywnością fizyczną, przy braku światła słonecznego; Dzieci potrzebują więcej manganu niż dorośli. Wykazano, że brak manganu w pokarmie zwierząt negatywnie wpływa na ich wzrost i rozwój, powoduje anemię tzw. tężyczkę laktacyjną, zaburzenie metabolizmu mineralnego tkanki kostnej. Aby zapobiec tym chorobom, do paszy wprowadza się sole manganu.
Biologiczne działanie manganu:
● przeciwutleniacz
● regulacja poziomu glukozy we krwi
● normalizacja składu cholesterolu i lipidów we krwi
● przeciwanemiczny
● antyalergiczny
● przyczyniając się do dojrzewania komórek rozrodczych, rozwoju płodu i ciąży donoszonej
● odtworzenie struktury tkanki kostnej i chrzęstnej
● przeciwdrgawkowe, zapobiegające PMS (zespół napięcia przedmiesiączkowego) itp.
Oznaki niedoboru manganu:
● Zmęczenie, osłabienie, zawroty głowy, szum w uszach
● Pogorszenie aktywności mózgu, utrata pamięci
wymiociny
● Skurcze i konwulsje
● Bóle mięśni i stawów, zaburzenia ruchu, skłonność do skręceń i zwichnięć, zapalenie stawów, nieprawidłowy wzrost i rozwój układu kostnego
● Upośledzenie wzroku
● Bielactwo, zaburzenia pigmentacji skóry
● Opóźniony wzrost paznokci i włosów
● Cukrzyca, nietolerancja glukozy, nadwaga, wysoki poziom cholesterolu, problemy metaboliczne
● Ryzyko niepłodności, problemów reprodukcyjnych, wczesnej menopauzy, dysfunkcji jajników, osteoporozy menopauzalnej
● Zmniejszona odporność, przedwczesne starzenie
● Alergie
● Ryzyko raka
● Opóźnienie rozwojowe u dzieci, pojawienie się dzieci z patologiami
Oznaki toksyczności manganu:
Nadmiar manganu jest toksyczny: zaburza wchłanianie żelaza i konkuruje z miedzią w procesie hematopoezy, powodując anemię, a także powoduje inne zmiany patologiczne.
● Słaby apetyt, apatia, depresja
● Ogólne osłabienie, impotencja
● Zakłócony sen
● Tymczasowe szaleństwo, demencja
● Problemy neurologiczne
● Parkinsonizm lub choroba Parkinsona (sztywność mięśni, drżenie, monotonny głos, „zamrożona” twarz przypominająca maskę).
Kobalt
Co, pierwiastek chemiczny o liczbie atomowej 27. Jego masa atomowa wynosi 58,9332. Naturalny kobalt składa się z dwóch stabilnych nuklidów: 59Co (99,83% wagowo) i 57Co (0,17%). W układzie okresowym pierwiastków D. I. Mendelejewa kobalt należy do grupy VIII i wraz z żelazem i niklem tworzy w IV okresie w tej grupie triadę metali przejściowych o podobnych właściwościach. Konfiguracja dwóch zewnętrznych warstw elektronowych atomu kobaltu to 3s 2 p 6 d 7 4s 2 . Tworzy związki najczęściej na stopniu utlenienia +2, rzadziej na stopniu utlenienia +3, a bardzo rzadko na stopniu utlenienia +1, +4 i +5.
Kobalt to minerał wchodzący w skład witaminy B12. Zwykle jest mierzony w mikrogramach (mcg). Kobalt - niezbędny dla czerwonych krwinek. Musi być pozyskiwany ze źródeł żywności. Nie ustalono dziennej wartości kobaltu, a w diecie potrzebne są bardzo małe ilości tego minerału (zwykle nie więcej niż 8 mikrogramów).
Odnajdywanie w naturze.
W skorupie ziemskiej zawartość kobaltu wynosi 4,10 -3% wagowo. Kobalt wchodzi w skład ponad 30 minerałów. Należą do nich karolit CuCo 2 S 4 , linneit Co 3 S 4 , kobaltyt CoAsS, sferokobaltyt CoCO 3 , smaltyt CoAs 2 i inne. Z reguły kobaltowi w naturze towarzyszą jego sąsiedzi w IV okresie - nikiel, żelazo, miedź, mangan. W wodzie morskiej około (1-7) 10 -10% kobaltu.
Kobalt jest stosunkowo rzadkim metalem, a bogate w niego złoża są obecnie praktycznie wyczerpane. Dlatego surowce zawierające kobalt (często są to rudy niklu zawierające kobalt jako zanieczyszczenie) są najpierw wzbogacane i otrzymywany z nich koncentrat. Ponadto, w celu ekstrakcji kobaltu, koncentrat poddaje się obróbce roztworami kwasu siarkowego lub amoniaku albo przetwarza się metodami pirometalurgicznymi w siarczek lub stop metalu. Stop ten jest następnie ługowany kwasem siarkowym. Niekiedy w celu wydobycia kobaltu przeprowadza się ługowanie „hałdy” kwasem siarkowym z pierwotnej rudy (rozkruszoną rudę umieszcza się w wysokich pryzmach na specjalnych betonowych platformach i hałdy te są podlewane roztworem ługującym z góry).
właściwości fizyczne.
Kobalt to twardy metal, który istnieje w dwóch modyfikacjach. W temperaturach od temperatury pokojowej do 427 °C modyfikacja α jest stabilna. W temperaturach od 427°C do temperatury topnienia (1494°C) β-modyfikacja kobaltu jest stabilna (sieć sześcienna środkowa środkowa). Kobalt jest ferromagnesem, punkt Curie 1121 °C. Cienka warstwa tlenków nadaje mu żółtawy odcień.
Właściwości chemiczne.
Tlenki.
W powietrzu kobalt utlenia się w temperaturach powyżej 300 °C.
· Stabilny w temperaturze pokojowej tlenek kobaltu jest złożonym tlenkiem Co 3 O 4 o strukturze spinelu, w którego strukturze krystalicznej jedna część miejsc jest zajęta przez jony Co 2+, a druga przez jony Co 3+; rozkłada się z wytworzeniem CoO powyżej 900 °C.
· W wysokich temperaturach można otrzymać postać α lub postać β tlenku CoO.
Wszystkie tlenki kobaltu są redukowane wodorem:
Tlenek kobaltu (III) można otrzymać przez kalcynację związków kobaltu (II), na przykład:
Inne połączenia.
· Po podgrzaniu kobalt reaguje z halogenami, a związki kobaltu (III) tworzą się tylko z fluorem.
· Z siarką kobalt tworzy 2 różne modyfikacje CoS. Srebrnoszara forma α (gdy proszki są stapiane) i czarna forma β (osady z roztworów).
Podczas ogrzewania CoS w
w układzie okresowym jest pod nr 26
Alternatywne opisyGłówny metal w branży
Wykuwają go, gdy jest gorąco i bez wychodzenia z kasy
Znaczenie imienia Timur
Pierwiastek chemiczny, srebrno-biały metal, główny składnik żelaza i stali
Metal dla Feliksa
pierwiastek chemiczny, metal
Aby uniknąć akumulacji pieniędzy, w starożytnej Sparcie bito pieniądze z tego materiału.
Tak informatycy nazywają sam komputer, bez oprogramowania
Ten pierwiastek jest najbardziej stabilnym pierwiastkiem w układzie okresowym.
Metal, z którego można „zrobić” logikę
. „Wchodzę do wody - czerwony, wychodzę - czarny” (zagadka)
Przetłumacz z łaciny słowo „ferrum”
Materiał, z którego powinien być wykonany prezent podarowany w szóstą rocznicę ślubu
Ofiara rdzy
Ugryź, póki jest gorąco!
Pierwiastek chemiczny, Fe
Metalowy Felix jest wykonany
Metalowe części uzdy
Wykuwane tylko w pośpiechu
metalowe paznokcie
zardzewiały, meteorytowy
Kuź, póki jest gorąco
Kui... póki jest gorąco
W tabeli szuka manganu
. „Kuź… bez wychodzenia z kasy!”
Obok manganu w tabeli
Numer metalowy dwadzieścia sześć
Chem. element 26
Podążając za manganem w tabeli
Między manganem a kobaltem
Prekursor kobaltu stołowego
Metal dla logiki
Uderz, póki jest gorąco (ostatni)
Pierwiastek chemiczny 26
Następnie mangan w tabeli
Główny składnik stali
26. w układzie okresowym
Aż do kobaltu w tabeli
Zaakceptowane na złom
Materiał na jedną maskę
Metal, którego zawartość w ciele kobiety jest pięć razy większa niż w ciele mężczyzny
Przed kobaltem w tabeli
Zwolennik stołu manganowego
Między manganem a kobaltem w tabeli
Prekursor kobaltu w tabeli
Główny składnik żeliwa
Post manganowy stół
Metal dla Lady Margaret Thatcher
Ostatni stół manganowy
Obok manganu
Pierwiastek chemiczny, srebrno-biały metal, główny składnik żelaza i stali
Główny składnik stali
Produkty z takiego metalu
Lek zawierający preparaty takiego pierwiastka chemicznego
Nazwa pierwiastka chemicznego
Rodzaj minerału związany z pierwiastkami rodzimymi
. „Kui… bez wychodzenia z kasy!”
. „Wchodzę do wody – jest czerwona, wychodzę – jest czarna” (zagadka)
Uderz, póki jest gorąco
Metal, z którego można „zrobić” logikę
Przetłumacz z łacińskiego słowa „ferrum”
Poślubić sala (s) zo jużn. aplikacja. metal, kruszarka, wytopiona z rudy w postaci żeliwa i wykuta z tego ostatniego pod kwitnącym młotem. w połączeniu z węglem tworzy stal. żelazo sprzedawane jest w postaci: taśmy lub wysokiej jakości; pierwszy prosto spod wrzeszczącego młota; zdarza się: szeroka, wąska, okrągła, prętowa itp. druga jest przekuta: opona, rzeźbiona, blacha itp. Żelazo zjada rdzę. Ubrania na mole, rdzewiejące żelazo i złe bractwo psują moralność. Pieniądze są żelazne, a sukienka gnije. W przypadku rati żelazo jest cenniejsze niż złoto. zdobędę żelazo i złoto. Zardzewiałe żelazo nie świeci. Zabij drzewem na żelazie. Co się uśmiechnął, czy widział żelazo? ogień i żelazo topliwe. kuźnia i żelazo zostaną ustawione. W tym celu droga była pokryta złotem, żeby zjadała żelazo. Uderz, gdy żelazo się zagotuje (gdy jest gorące). Czy wspinam się, wspinam się po żelaznej górze mięsnej? wsiadaj na konia. Żelazko lub więcej żelazo, krawat, kajdany, kajdany, stopy, łańcuszki do rąk; żelazne kajdany końskie. Żelazo, żelazo por. wiór żelazny; na przykład mały żelazny, stalowy przedmiot włożony do dowolnego narzędzia lub bloku. włócznia strzałkowa, strugarka, żelazna część dłuta itp. Żelazo, wykonane z żelaza, z jakiegoś powodu spokrewnione z żelazem; podobny do żelaza pod względem siły, twardości, koloru itp. Ruda żelaza, z której wydobywa się żelazo; fabryka żelaza, zakład wytapiania, kucia; żelazny rząd, gdzie jest sprzedawany przez kupców żelaza. Żelazny sok, fabryka plamy i fragmenty z kwitnienia, sok z kwitnienia. Żelazny koń, żelazo szare, kolor żelaza, garnitur. Ustiuzhna to żelazo, a ludzie w nim są zrobieni z kamienia, do oblegania go pod oszustami. Kolej, kolej, żeliwo. Żelazne koło, tul. pas arktyczny. Żelazne ręce, mocne, ale szorstkie i niezdarne. Człowiek z żelaza, niezłomny, solidny; cierpliwy, kontrowersyjny; niemiłosierny, bez serca. Żelazne zdrowie, silne. Albo żelazny łańcuch, albo złoty, dostanę go. Pożyczki wypisane są na żelaznej tablicy, a długi na piasku. Ironwood, backout, drewno gwajakowe; nazwać i inne bardzo twarde gatunki drewna tropikalnego. Korzeń żelaza, roślina. Centaurea scabiosa. Lekcja żelaza lub żelazo cf. stary grzywna, obowiązek od winnych, na rzecz władz, za nałożenie kajdan. Żelazny koń, patrz garnitur. przymiotnik gruczołowy. zawierające żelazo. Żelazo, zgorzelina, zgorzelina, opary, żużel; żelazo, spalony blask, kruszenie podczas kucia. Kawałek, pasek żelaza. Żelazo, żelazo łuk. żelazne kafelki w dłoni, do zabawy w babcie, kozy; bić, bić. Zheleznik m. drzewo Caragana frutescens, dereza, chapyzhnik, błędnie chilizhnik, syberyjski? krzak akacji. Miotła, dereza, Cytisus biflorus. Skrzyp, skrzyp ciesielski. Potentilla argentea, jagoda, tykwa, zabirukha. Ironwort, ryba Clupea alosa, z rodzaju śledzia, wścieklizny lub okonia. Zheleznyak m. kupiec żelaza. Ogólna nazwa rud zawierających utlenione żelazo i przypominające wyglądem kamień, a nie żelazo: bol. znane: brązowa i magnetyczna ruda żelaza, kamień magnetyczny. Najtwardsza, najlepsza cegła, nieco stopiona. Zardzewiały. Urząd Werbeny. Zardzewiały. Phlomis pungens, kachim, Tumbleweed. Zardzewiały. Sarrothamnus scoparius, zhernovets, dereza, bóbr. Bajeczna porwana trawa skacząca, z której kruszą się żelazne loki i zaparcia; za jego pomocą wydobywa się również skarby. Zheleznyanka, patrz Zheleznyanka, żelazo, zhelv. Huty, huty, huty, produkujące żelazo z rudy. Kucie żelaza, kucie żelaza, związane z kuciem żelaza w paskach i największych rzeczach. Wytapianie żelaza, wytapianie żelaza, wytapianie żelaza, związane z wytopem żelaza; fabryka, piec. Cięcie żelaza, służące do cięcia żelaza; -fabryka, -młyn
Fe pierwiastek chemiczny
Pierwiastek chemiczny o znaku wywoławczym Fe
Jeśli układ okresowy pierwiastków wydaje ci się trudny do zrozumienia, nie jesteś sam! Chociaż zrozumienie jego zasad może być trudne, nauka pracy z nim pomoże w nauce nauk przyrodniczych. Na początek przestudiuj strukturę tabeli i jakich informacji można się z niej dowiedzieć na temat każdego pierwiastka chemicznego. Następnie możesz zacząć badać właściwości każdego elementu. I wreszcie, korzystając z układu okresowego pierwiastków, możesz określić liczbę neutronów w atomie danego pierwiastka chemicznego.
Kroki
Część 1
Struktura tabeli-
Jak widać, każdy kolejny element zawiera o jeden proton więcej niż element go poprzedzający. Jest to oczywiste, gdy spojrzysz na liczby atomowe. Liczby atomowe zwiększają się o jeden w miarę przesuwania się od lewej do prawej. Ponieważ elementy są ułożone w grupy, niektóre komórki tabeli pozostają puste.
- Na przykład pierwszy wiersz tabeli zawiera wodór o liczbie atomowej 1 i hel o liczbie atomowej 2. Znajdują się jednak na przeciwległych końcach, ponieważ należą do różnych grup.
-
Dowiedz się o grupach zawierających pierwiastki o podobnych właściwościach fizycznych i chemicznych. Elementy każdej grupy znajdują się w odpowiedniej kolumnie pionowej. Z reguły oznaczane są tym samym kolorem, co pomaga w identyfikacji pierwiastków o podobnych właściwościach fizycznych i chemicznych oraz przewidywaniu ich zachowania. Wszystkie elementy danej grupy mają taką samą liczbę elektronów w powłoce zewnętrznej.
- Wodór można przypisać zarówno grupie metali alkalicznych, jak i grupie halogenów. W niektórych tabelach jest to wskazane w obu grupach.
- W większości przypadków grupy są ponumerowane od 1 do 18, a numery są umieszczane na górze lub na dole tabeli. Liczby mogą być podawane cyframi rzymskimi (np. IA) lub arabskimi (np. 1A lub 1).
- Przesuwając się po kolumnie od góry do dołu, mówią, że „przeglądasz grupę”.
-
Dowiedz się, dlaczego w tabeli są puste komórki. Pierwiastki są uporządkowane nie tylko według ich liczby atomowej, ale także według grup (pierwiastki z tej samej grupy mają podobne właściwości fizyczne i chemiczne). Ułatwia to zrozumienie zachowania elementu. Jednak wraz ze wzrostem liczby atomowej elementy, które należą do odpowiedniej grupy, nie zawsze są znalezione, więc w tabeli są puste komórki.
- Na przykład pierwsze 3 rzędy mają puste komórki, ponieważ metale przejściowe znajdują się tylko od liczby atomowej 21.
- Pierwiastki o liczbie atomowej od 57 do 102 należą do pierwiastków ziem rzadkich i zazwyczaj umieszczane są w osobnej podgrupie w prawym dolnym rogu tabeli.
-
Każdy wiersz tabeli reprezentuje okres. Wszystkie pierwiastki tego samego okresu mają taką samą liczbę orbitali atomowych, w których elektrony znajdują się w atomach. Liczba orbitali odpowiada liczbie okresu. Tabela zawiera 7 wierszy, czyli 7 okresów.
- Na przykład atomy pierwiastków pierwszego okresu mają jeden orbital, a atomy pierwiastków siódmego okresu mają 7 orbitali.
- Z reguły kropki są oznaczone cyframi od 1 do 7 po lewej stronie tabeli.
- Gdy poruszasz się wzdłuż linii od lewej do prawej, mówi się, że „przeszukujesz okres”.
-
Naucz się rozróżniać metale, metaloidy i niemetale. Lepiej zrozumiesz właściwości elementu, jeśli będziesz w stanie określić, do jakiego typu należy. Dla wygody w większości stołów metale, metaloidy i niemetale są oznaczone różnymi kolorami. Metale znajdują się po lewej stronie, a niemetale po prawej stronie stołu. Pomiędzy nimi znajdują się metaloidy.
Część 2
Oznaczenia elementów-
Każdy element jest oznaczony jedną lub dwiema literami łacińskimi. Z reguły symbol elementu jest wyświetlany dużymi literami w środku odpowiedniej komórki. Symbol to skrócona nazwa elementu, która jest taka sama w większości języków. Podczas przeprowadzania eksperymentów i pracy z równaniami chemicznymi powszechnie używa się symboli pierwiastków, dlatego warto je zapamiętać.
- Zazwyczaj symbole elementów są skrótem ich nazwy łacińskiej, chociaż w przypadku niektórych, szczególnie niedawno odkrytych elementów, wywodzą się one od nazwy zwyczajowej. Na przykład hel jest oznaczony symbolem He, który w większości języków jest zbliżony do nazwy zwyczajowej. Jednocześnie żelazo oznaczane jest jako Fe, co jest skrótem jego łacińskiej nazwy.
-
Zwróć uwagę na pełną nazwę elementu, jeśli jest podana w tabeli. Ta „nazwa” elementu jest używana w normalnych tekstach. Na przykład „hel” i „węgiel” to nazwy pierwiastków. Zwykle, choć nie zawsze, pełne nazwy pierwiastków podawane są pod ich symbolem chemicznym.
- Czasami nazwy pierwiastków nie są podane w tabeli i podane są tylko ich symbole chemiczne.
-
Znajdź liczbę atomową. Zwykle liczba atomowa pierwiastka znajduje się na górze odpowiedniej komórki, w środku lub w rogu. Może również pojawić się pod nazwą symbolu lub elementu. Pierwiastki mają liczby atomowe od 1 do 118.
- Liczba atomowa jest zawsze liczbą całkowitą.
-
Pamiętaj, że liczba atomowa odpowiada liczbie protonów w atomie. Wszystkie atomy pierwiastka zawierają taką samą liczbę protonów. W przeciwieństwie do elektronów liczba protonów w atomach pierwiastka pozostaje stała. W przeciwnym razie pojawiłby się inny pierwiastek chemiczny!
- Liczba atomowa pierwiastka może być również wykorzystana do określenia liczby elektronów i neutronów w atomie.
-
Zwykle liczba elektronów jest równa liczbie protonów. Wyjątkiem jest przypadek, gdy atom jest zjonizowany. Protony mają ładunek dodatni, a elektrony ładunek ujemny. Ponieważ atomy są zwykle obojętne, zawierają taką samą liczbę elektronów i protonów. Jednak atom może zyskać lub stracić elektrony, w którym to przypadku ulega jonizacji.
- Jony mają ładunek elektryczny. Jeśli w jonie jest więcej protonów, to ma on ładunek dodatni, w którym to przypadku po symbolu pierwiastka umieszczany jest znak plus. Jeśli jon zawiera więcej elektronów, ma ładunek ujemny, na co wskazuje znak minus.
- Znaki plus i minus są pomijane, jeśli atom nie jest jonem.
-
Układ okresowy pierwiastków lub układ okresowy pierwiastków chemicznych zaczyna się w lewym górnym rogu i kończy na końcu ostatniego wiersza tabeli (prawy dolny róg). Pierwiastki w tabeli są ułożone od lewej do prawej w kolejności rosnącej ich liczby atomowej. Liczba atomowa mówi, ile protonów znajduje się w jednym atomie. Ponadto wraz ze wzrostem liczby atomowej rośnie masa atomowa. Dzięki położeniu pierwiastka w układzie okresowym można określić jego masę atomową.
Fe (łac. Ferrum), pierwiastek chemiczny grupy VIII układu okresowego, liczba atomowa 26, masa atomowa 55,847. Błyszczący srebrzystobiały metal. Tworzy modyfikacje polimorficzne; w zwykłej temperaturze a - Fe jest stabilny (sześcienna sieć krystaliczna wyśrodkowana na ciele) o gęstości 7,874 g / cm?. a - Fe do 769°C (punkt Curie) ferromagnetycznie; t.t. 1535°C.
W powietrzu utlenia się i pokrywa luźną rdzą. Pod względem występowania pierwiastków w przyrodzie żelazo zajmuje 4 miejsce; formy ok. 300 minerałów. Stopy żelaza z węglem i innymi pierwiastkami stanowią około 95% wszystkich wyrobów metalowych (żeliwo, stal, żelazostopy). W czystej postaci praktycznie nie jest używany (w życiu codziennym produkty ze stali lub żeliwa są często nazywane żelazem). Niezbędne do życia organizmów zwierzęcych; jest częścią hemoglobiny.
Zhelemzo jest elementem drugorzędnej podgrupy ósmej grupy czwartego okresu układu okresowego pierwiastków chemicznych D.I. Mendelejew o liczbie atomowej 26. Jest oznaczony symbolem Fe (łac. Ferrum). Jeden z najczęściej występujących metali w skorupie ziemskiej (drugie miejsce po aluminium).
Prosta substancja żelazo (numer CAS: 7439-89-6) to plastyczny srebrnobiały metal o wysokiej reaktywności chemicznej: żelazo szybko koroduje w wysokich temperaturach lub przy dużej wilgotności powietrza. W czystym tlenie żelazo pali się, aw stanie drobno rozproszonym zapala się samorzutnie w powietrzu.
W rzeczywistości żelazo jest zwykle nazywane jego stopami o niskiej zawartości zanieczyszczeń (do 0,8%), które zachowują miękkość i ciągliwość czystego metalu. Ale w praktyce częściej stosuje się stopy żelaza z węglem: stal (do 2,14% wag. węgla) i żeliwo (powyżej 2,14% wag. węgla), a także stal nierdzewną (stopową) z dodatkiem stopów metale (chrom, mangan, nikiel itp.). Połączenie specyficznych właściwości żelaza i jego stopów sprawia, że jest to „metal nr 1” mający znaczenie dla ludzi.
W naturze żelazo rzadko występuje w czystej postaci, najczęściej występuje jako część meteorytów żelazowo-niklowych. Przewaga żelaza w skorupie ziemskiej wynosi 4,65% (4 miejsce po O, Si, Al). Uważa się również, że większość jądra Ziemi stanowi żelazo.
Żelazo w pismach naukowców
O tym, że starożytni ludzie początkowo używali żelaza pochodzenia meteorytowego, świadczą również powszechne wśród niektórych ludów mity o bogach lub demonach, które zrzucały żelazne przedmioty i narzędzia z nieba - pługi, siekiery itp.
Interesujące jest również to, że do czasu odkrycia Ameryki Indianie i Eskimosi z Ameryki Północnej nie znali metod pozyskiwania żelaza z rud, ale wiedzieli, jak przetwarzać żelazo meteorytowe.
W starożytności i średniowieczu siedem znanych wówczas metali porównywano z siedmioma planetami, które symbolizowały związek metali z ciałami niebieskimi oraz niebiańskie pochodzenie metali. Takie porównanie stało się powszechne ponad 2000 lat temu i jest stale obecne w literaturze aż do XIX wieku.
W II wieku. OGŁOSZENIE żelazo porównywano z Merkurym i nazywano rtęcią, ale później porównano je z Marsem i nazwano Marsem (Mars), co w szczególności podkreślało zewnętrzne podobieństwo czerwonawego koloru Marsa z czerwonymi rudami żelaza.
Jednak niektóre narody nie kojarzyły nazwy żelaza z niebiańskim pochodzeniem metalu. Tak więc wśród ludów słowiańskich żelazo nazywa się zgodnie z atrybutem „funkcjonalnym”.
Żelazo rosyjskie (południowosłowiańskie zalizo, polskie zelaso, litewskie gelesis itp.) ma korzeń „lez” lub „cut” (od słowa lezo - ostrze). Takie słowotwórstwo bezpośrednio wskazuje na funkcję przedmiotów wykonanych z żelaza - narzędzi tnących i broni.
Przedrostek „same” wydaje się być zmiękczeniem starszego „ze” lub „for”; w swojej pierwotnej formie zachował się wśród wielu ludów słowiańskich (wśród Czechów – zelezo).
Dawni filolodzy niemieccy - przedstawiciele teorii indoeuropejskiej lub, jak to nazywali, indo-germańskiego języka ojczystego - starali się wywodzić słowiańskie nazwy z korzeni niemieckich i sanskryckich.
Na przykład Fik porównuje słowo żelazo z sanskryckim ghalgha (roztopiony metal, od ghal do płomienia). Ale to nieprawda: w końcu wytop żelaza był niedostępny dla starożytnych ludzi. Z sanskrycką ghalghą można raczej porównać grecką nazwę miedzi, ale nie słowiańskie słowo oznaczające żelazo.
Funkcjonalna cecha w nazwach żelaza znajduje odzwierciedlenie również w innych językach. Tak więc po łacinie, wraz ze zwykłą nazwą stali (chalibów), wywodzącą się od nazwy plemienia Chalibów żyjącego na południowym wybrzeżu Morza Czarnego, użyto nazwy acies, dosłownie oznaczającej ostrze lub ostrze.
To słowo dokładnie odpowiada starożytnej grece użytej w tym samym znaczeniu.
Wspomnijmy w kilku słowach o pochodzeniu niemieckich i angielskich nazw żelaza. Filolodzy ogólnie przyjmują, że niemieckie słowo Eisen ma pochodzenie celtyckie, podobnie jak angielskie żelazo. Oba terminy odzwierciedlają celtyckie nazwy rzek (Isarno, Isarkos, Eisack), które następnie przekształciły się (isarn, eisarn) i przekształciły w Eisen. Są jednak inne punkty widzenia.
Niektórzy filolodzy wywodzą niemiecki Eisen od celtyckiego isara, co oznacza „silny, silny”. Istnieją również teorie, że Eisen pochodzi z ayas lub aes (miedź), a także z Eis (lód) itp. Staroangielska nazwa żelaza (przed 1150) to iren; był używany wraz z isern i isen i przeszedł do średniowiecza. Nowoczesne żelazo weszło do użytku po 1630 roku.
Zauważ, że w alchemicznym leksykonie Rulanda (1612) słowo Iris jest podane jako jedna ze starych nazw żelaza, co oznacza „tęcza” i spółgłoskę z żelazem.
Łacińska nazwa Ferrum, która stała się międzynarodowa, została przyjęta przez ludy romańskie. Jest to prawdopodobnie spokrewnione z grecko-łacińską fars (trudno), która pochodzi z sanskryckich bhars (utwardzić). Możliwe jest również porównanie z ferreusem, co starożytni pisarze mieli na myśli „niewrażliwym, nieugiętym, mocnym, twardym, ciężkim”, a także z ferre (do noszenia). Alchemicy wraz z Ferrumem używali wielu innych imion, na przykład Iris, Sarsar, Phaulec, Minera itp.
Produkty żelazne wykonane z żelaza meteorytowego znaleziono w pochówkach datowanych na bardzo starożytne czasy (IV-5 tysiąclecia pne) w Egipcie i Mezopotamii. Jednak epoka żelaza w Egipcie rozpoczęła się dopiero w XII wieku. BC, aw innych krajach nawet później. W starożytnej literaturze rosyjskiej słowo żelazo pojawia się w najstarszych zabytkach (od XI wieku) pod nazwami żelazo, żelazo, żelazo.