Podstawową strukturą białka jest wiązanie peptydowe. Pierwotne, drugorzędowe, trzeciorzędowe i czwartorzędowe struktury białkowe. Dodatkowe struktury białkowe
Łączenie aminokwasów poprzez wiązania peptydowe tworzy liniowy łańcuch polipeptydowy zwany pierwotna struktura białka
Biorąc pod uwagę, że w syntezie białek bierze udział 20 aminokwasów, a przeciętne białko zawiera 500 reszt aminokwasowych, możemy mówić o niewyobrażalnej liczbie potencjalnych białek. W organizmie człowieka odkryto około 100 tysięcy różnych białek.
Na przykład 2 aminokwasy (alanina i seryna) tworzą 2 peptydy Ala-Ser i Ser-Ala; 3 aminokwasy dadzą już 6 wariantów tripeptydu; 20 aminokwasów – 1018 różnych peptydów o długości zaledwie 20 aminokwasów (zakładając, że każdy aminokwas został użyty tylko raz).
Największym obecnie znanym białkiem jest tytyna- jest składnikiem sarkomerów miocytów, masa cząsteczkowa różnych jego izoform waha się od 3000 do 3700 kDa. Ludzka soleus titin składa się z 38 138 aminokwasów.
Podstawowa struktura białek, tj. sekwencja aminokwasów jest programowana przez sekwencję nukleotydów w DNA. Utrata, insercja lub zastąpienie nukleotydu w DNA prowadzi do zmiany składu aminokwasów, a co za tym idzie, struktury syntetyzowanego białka.
Sekcja łańcucha białkowego o długości 6 aminokwasów (Ser-Cis-Tyr-Lei-Glu-Ala)
(wiązania peptydowe zaznaczono żółtym tłem, aminokwasy wyróżniono ramką)
Jeśli zmiana w sekwencji aminokwasów nie jest śmiertelna, ale adaptacyjna lub przynajmniej neutralna, wówczas nowe białko może zostać odziedziczone i pozostać w populacji. W rezultacie powstają nowe białka o podobnych funkcjach. Zjawisko to nazywa się wielopostaciowość białka.
W przypadku wielu białek wykryto wyraźny konserwatyzm strukturalny. Na przykład hormon insulina osoba różni się od zwyżkowy tylko trzy aminokwasy, z wieprzowina– na jeden aminokwas (alanina zamiast treoniny).
Sekwencja i stosunek aminokwasów w strukturze pierwszorzędowej determinuje powstawanie wtórny, trzeciorzędowy I czwartorzędowy Struktury.
Heterogeniczność genotypowa
W wyniku tego, że każdy gen u człowieka występuje w dwóch kopiach (allelach) i może podlegać mutacjom (zamian, delecji, insercji) i rekombinacjom, które nie wpływają znacząco na funkcję kodowanego białka, dochodzi do polimorfizm genów i odpowiednio polimorfizm białka. Pojawiają się całe rodziny pokrewnych białek, które mają podobne, ale różne właściwości i funkcje.
Na przykład jest około 300 różnych rodzajów hemoglobiny, niektóre z nich są niezbędne na różnych etapach ontogenezy: na przykład HbP jest embrionalna, powstaje w pierwszym miesiącu rozwoju, HbF jest płodowa, niezbędna na późniejszych etapach rozwoju płodu, HbA i HbA2 to hemoglobina osoby dorosłej. Różnorodność zapewnia polimorfizm łańcuchów globiny: hemoglobina P zawiera łańcuchy 2ξ i 2ε, HbF zawiera łańcuchy 2α i 2γ, HbA zawiera łańcuchy 2α i 2β, a HbA2 zawiera łańcuchy 2α i 2δ.
Na anemia sierpowata na szóstej pozycji łańcucha β hemoglobiny kwas glutaminowy zastępuje walina. Prowadzi to do syntezy hemoglobina S (HbS)- hemoglobina, która polimeryzuje w formie deoksy i tworzy nici. W rezultacie czerwone krwinki ulegają deformacji, przyjmują kształt sierpa (banana), tracą elastyczność i ulegają zniszczeniu podczas przechodzenia przez naczynia włosowate. To ostatecznie prowadzi do zmniejszonego utlenowania tkanek i martwicy.
Grupy krwi AB0 zależą od struktury specjalnego węglowodanu na błonie czerwonych krwinek. Różnice w strukturze węglowodanów wynikają z odmiennej specyficzności i aktywności enzym transferaza glikozylowa, zdolne do modyfikowania oryginalnego oligosacharydu. Enzym ma trzy warianty i przyłącza N-acetylogalaktozę lub galaktozę do oligosacharydu błon erytrocytów lub enzym nie przyłącza dodatkowych grup sacharydowych (grupa 0).
W rezultacie osoby z grupą krwi A0 mają na swoich czerwonych krwinkach oligosacharyd z przyłączoną do niej N-acetylogalaktozaminą, osoby z grupą krwi B0 mają oligosacharyd z galaktozą, 00 mają tylko „czysty” oligosacharyd, osoby z grupą krwi AB mają oligosacharyd i N-acetylogalaktozamina oraz galaktoza.
Jak wiadomo, białka są podstawą powstania życia na naszej planecie. Ale to kropelka koacerwatu, składająca się z cząsteczek peptydów, stała się podstawą powstania żywych istot. Nie ulega to wątpliwości, ponieważ analiza składu wewnętrznego dowolnego przedstawiciela biomasy pokazuje, że substancje te są obecne we wszystkim: roślinach, zwierzętach, mikroorganizmach, grzybach, wirusach. Co więcej, są one bardzo różnorodne i mają charakter makromolekularny.
Struktury te mają cztery nazwy, wszystkie są synonimami:
- białka;
- białka;
- polipeptydy;
- peptydy.
Cząsteczki białka
Ich liczba jest naprawdę niezliczona. W tym przypadku wszystkie cząsteczki białka można podzielić na dwie duże grupy:
- proste - składają się wyłącznie z sekwencji aminokwasów połączonych wiązaniami peptydowymi;
- złożony - strukturę i strukturę białka charakteryzują dodatkowe grupy protolityczne (protetyczne), zwane także kofaktorami.
Jednocześnie złożone cząsteczki mają również swoją własną klasyfikację.
Gradacja złożonych peptydów
- Glikoproteiny są blisko spokrewnionymi związkami białka i węglowodanów. Grupy prostetyczne mukopolisacharydów są wplecione w strukturę cząsteczki.
- Lipoproteiny są złożonym związkiem białek i lipidów.
- Metaloproteiny - jony metali (żelaza, manganu, miedzi i innych) pełnią rolę grupy prostetycznej.
- Nukleoproteiny stanowią połączenie pomiędzy białkiem i kwasami nukleinowymi (DNA, RNA).
- Fosfoproteiny - konformacja białka i reszty kwasu ortofosforowego.
- Chromoproteiny są bardzo podobne do metaloprotein, jednak elementem wchodzącym w skład grupy prostetycznej jest cały kompleks kolorowy (czerwony - hemoglobina, zielony - chlorofil i tak dalej).
W każdej rozpatrywanej grupie struktura i właściwości białek są odmienne. Funkcje, które pełnią, różnią się również w zależności od rodzaju cząsteczki.

Struktura chemiczna białek
Z tego punktu widzenia białka to długi, masywny łańcuch reszt aminokwasowych połączonych ze sobą specyficznymi wiązaniami zwanymi wiązaniami peptydowymi. Od bocznych struktur kwasów odchodzą gałęzie zwane rodnikami. Tę strukturę molekularną odkrył E. Fischer na początku XXI wieku.
Później bardziej szczegółowo zbadano białka, strukturę i funkcje białek. Stało się jasne, że strukturę peptydu tworzy tylko 20 aminokwasów, ale można je łączyć na różne sposoby. Stąd różnorodność struktur polipeptydowych. Ponadto w procesie życia i pełnieniu swoich funkcji białka mogą ulegać szeregowi przemian chemicznych. W rezultacie zmieniają strukturę i pojawia się zupełnie nowy rodzaj połączenia.
Aby rozerwać wiązanie peptydowe, czyli rozbić białko i strukturę łańcuchów, należy wybrać bardzo rygorystyczne warunki (wysokie temperatury, kwasy lub zasady, katalizator). Wynika to z dużej siły w cząsteczce, a mianowicie w grupie peptydowej.

Wykrywanie struktury białka w laboratorium odbywa się za pomocą reakcji biuretowej - ekspozycji na świeżo wytrącony polipeptyd (II). Kompleks grupy peptydowej i jonu miedzi daje jasny fioletowy kolor.
Istnieją cztery główne organizacje strukturalne, z których każda ma swoje własne cechy strukturalne białek.
Poziomy organizacji: struktura pierwotna
Jak wspomniano powyżej, peptyd to sekwencja reszt aminokwasowych z inkluzjami lub bez, koenzymami. Zatem pierwotna jest struktura cząsteczki, która jest naturalnym, naturalnym, prawdziwie aminokwasem połączonym wiązaniami peptydowymi i niczym więcej. Oznacza to, że jest to polipeptyd o strukturze liniowej. Ponadto cechy strukturalne białek tego typu polegają na tym, że taka kombinacja kwasów decyduje o spełnianiu funkcji cząsteczki białka. Dzięki obecności tych cech możliwa jest nie tylko identyfikacja peptydu, ale także przewidywanie właściwości i roli zupełnie nowego, jeszcze nieodkrytego. Przykładami peptydów o naturalnej strukturze pierwszorzędowej są insulina, pepsyna, chymotrypsyna i inne.

Konformacja wtórna
Struktura i właściwości białek tej kategorii są nieco zróżnicowane. Taka struktura może powstać początkowo w naturze lub gdy pierwotna zostanie poddana silnej hydrolizie, temperaturze lub innym warunkom.
Ta konformacja ma trzy odmiany:
- Gładkie, regularne, stereoregularne skręty, zbudowane z reszt aminokwasowych, które owijają się wokół głównej osi połączenia. Łączą je tylko te, które powstają pomiędzy tlenem jednej grupy peptydowej i wodorem drugiej. Ponadto konstrukcję uważa się za poprawną ze względu na fakt, że zwoje powtarzają się równomiernie co 4 ogniwa. Taka konstrukcja może być leworęczna lub praworęczna. Jednak w większości znanych białek dominuje izomer prawoskrętny. Takie konformacje są zwykle nazywane strukturami alfa.
- Skład i struktura białek kolejnego typu różni się od poprzedniego tym, że wiązania wodorowe powstają nie pomiędzy resztami sąsiadującymi z jedną stroną cząsteczki, ale pomiędzy resztami znacznie odległymi i w dość dużej odległości. Z tego powodu cała struktura przybiera postać kilku falistych, wężowych łańcuchów polipeptydowych. Jest jedna cecha, którą musi wykazywać białko. Struktura aminokwasów na gałęziach powinna być jak najkrótsza, jak na przykład glicyna lub alanina. Ten typ konformacji wtórnej nazywany jest arkuszami beta ze względu na ich zdolność do sklejania się, tworząc wspólną strukturę.
- W biologii trzeci typ struktury białka to złożone, heterogenicznie rozproszone, nieuporządkowane fragmenty, które nie posiadają stereoregularności i są zdolne do zmiany struktury pod wpływem warunków zewnętrznych.
Nie zidentyfikowano żadnych przykładów białek, które w sposób naturalny mają strukturę drugorzędową.

Wykształcenie wyższe
Jest to dość złożona konformacja zwana „globulą”. Co to jest za białko? Jej budowa opiera się na strukturze drugorzędowej, jednak dodawane są nowe rodzaje oddziaływań pomiędzy atomami grup, a cała cząsteczka sprawia wrażenie fałdowania, skupiając się tym samym na tym, że grupy hydrofilowe są skierowane do globuli, a hydrofobowe te na zewnątrz.
To wyjaśnia ładunek cząsteczki białka w koloidalnych roztworach wody. Jakie rodzaje interakcji tu występują?
- Wiązania wodorowe - pozostają niezmienione pomiędzy tymi samymi częściami, co w strukturze wtórnej.
- interakcje - zachodzą, gdy polipeptyd jest rozpuszczony w wodzie.
- Przyciągania jonowe powstają pomiędzy różnie naładowanymi grupami reszt aminokwasowych (rodnikami).
- Oddziaływania kowalencyjne - mogą tworzyć się pomiędzy określonymi miejscami kwasowymi - cząsteczkami cysteiny, a raczej ich ogonami.
Zatem skład i strukturę białek o strukturze trzeciorzędowej można opisać jako łańcuchy polipeptydowe złożone w kuleczki, które zachowują i stabilizują swoją konformację na skutek różnego rodzaju oddziaływań chemicznych. Przykłady takich peptydów: kenaza fosfoglicerynianowa, tRNA, alfa-keratyna, fibroina jedwabiu i inne.
Struktura czwartorzędowa
Jest to jedna z najbardziej złożonych globul, jakie tworzą białka. Budowa i funkcje białek tego typu są bardzo różnorodne i specyficzne.
Jaka jest ta konformacja? Jest to kilka (w niektórych przypadkach dziesiątki) dużych i małych łańcuchów polipeptydowych, które powstają niezależnie od siebie. Ale potem, z powodu tych samych interakcji, które rozważaliśmy w przypadku struktury trzeciorzędowej, wszystkie te peptydy skręcają się i przeplatają ze sobą. W ten sposób otrzymuje się złożone globule konformacyjne, które mogą zawierać atomy metali, grupy lipidowe i węglowodany. Przykłady takich białek: polimeraza DNA, otoczka białkowa wirusa tytoniu, hemoglobina i inne.

Wszystkie badane przez nas struktury peptydowe posiadają własne metody identyfikacji w laboratorium, oparte na nowoczesnych możliwościach stosowania chromatografii, wirowania, mikroskopii elektronowej i optycznej oraz zaawansowanych technologiach komputerowych.
Wykonywane funkcje
Struktura i funkcje białek są ze sobą ściśle powiązane. Oznacza to, że każdy peptyd odgrywa określoną rolę, wyjątkową i specyficzną. Są też takie, które są w stanie wykonać kilka znaczących operacji jednocześnie w jednej żywej komórce. Można jednak wyrazić w uogólnionej formie główne funkcje cząsteczek białka w organizmach żywych:
- Zapewnienie ruchu. Organizmy jednokomórkowe, organelle lub niektóre typy komórek są zdolne do ruchu, kurczenia się i ruchu. Zapewniają to białka tworzące strukturę ich aparatu motorycznego: rzęski, wici i błona cytoplazmatyczna. Jeśli mówimy o komórkach niezdolnych do ruchu, to białka mogą przyczyniać się do ich skurczu (miozyna mięśniowa).
- Funkcja odżywcza lub rezerwowa. Polega na gromadzeniu się cząsteczek białka w jajach, zarodkach i nasionach roślin w celu dalszego uzupełnienia brakujących składników odżywczych. Po rozkładzie peptydy wytwarzają aminokwasy i substancje biologicznie czynne, które są niezbędne do prawidłowego rozwoju organizmów żywych.
- Funkcja energii. Oprócz węglowodanów, białka mogą również zapewnić siłę organizmowi. Rozpad 1 g peptydu uwalnia 17,6 kJ użytecznej energii w postaci kwasu adenozynotrójfosforowego (ATP), który jest zużywany na procesy życiowe.
- Sygnalizacja polega na uważnym monitorowaniu zachodzących procesów i przekazywaniu sygnałów z komórek do tkanek, z nich do narządów, z tych ostatnich do układów i tak dalej. Typowym przykładem jest insulina, która ściśle reguluje ilość glukozy we krwi.
- Funkcja receptora. Odbywa się to poprzez zmianę konformacji peptydu po jednej stronie membrany i zaangażowanie drugiego końca w restrukturyzację. Jednocześnie przesyłany jest sygnał i niezbędne informacje. Najczęściej białka takie osadzone są w błonach cytoplazmatycznych komórek i sprawują ścisłą kontrolę nad wszystkimi przechodzącymi przez nie substancjami. Dostarczają również informacji o zmianach chemicznych i fizycznych w środowisku.
- Funkcja transportowa peptydów. Odbywa się to za pośrednictwem białek kanałowych i białek transportowych. Ich rola jest oczywista – przenoszenie niezbędnych cząsteczek do miejsc o niskim stężeniu z części o większym stężeniu. Typowym przykładem jest transport tlenu i dwutlenku węgla przez narządy i tkanki przez białko hemoglobinę. Dokonują także dostarczania związków o niskiej masie cząsteczkowej przez błonę komórkową do wnętrza.
- Funkcja strukturalna. Jedna z najważniejszych funkcji pełnionych przez białko. Strukturę wszystkich komórek i ich organelli zapewniają peptydy. To one, niczym rama, wyznaczają kształt i strukturę. Ponadto wspierają go i modyfikują w razie potrzeby. Dlatego do wzrostu i rozwoju wszystkie żywe organizmy potrzebują białek w swojej diecie. Do takich peptydów zalicza się elastynę, tubulinę, kolagen, aktynę, keratynę i inne.
- Funkcja katalityczna. Dokonują tego enzymy. Liczne i różnorodne, przyspieszają wszelkie reakcje chemiczne i biochemiczne w organizmie. Bez ich udziału zwykłe jabłko w żołądku mogłoby zostać strawione zaledwie w dwa dni, najprawdopodobniej gnijąc przy tym. Pod wpływem katalazy, peroksydazy i innych enzymów proces ten zachodzi w ciągu dwóch godzin. Ogólnie rzecz biorąc, dzięki tej roli białek zachodzi anabolizm i katabolizm, czyli plastyka i

Rola ochronna
Istnieje kilka rodzajów zagrożeń, przed którymi białka mają chronić organizm.
Po pierwsze, traumatyczne odczynniki, gazy, cząsteczki, substancje o różnym spektrum działania. Peptydy potrafią z nimi oddziaływać chemicznie, przekształcając je w nieszkodliwą formę lub po prostu neutralizując.
Po drugie, fizyczne zagrożenie ranami - jeśli białko fibrynogen nie zostanie w odpowiednim czasie przekształcone w fibrynę w miejscu urazu, wówczas krew nie będzie krzepnąć, co oznacza, że nie nastąpi zator. Wręcz przeciwnie, będziesz potrzebować plazminy peptydowej, która może rozpuścić skrzep i przywrócić drożność naczynia.
Po trzecie, zagrożenie dla immunitetu. Niezwykle ważna jest struktura i znaczenie białek tworzących obronę immunologiczną. Przeciwciała, immunoglobuliny, interferony – to wszystko są ważne i istotne elementy układu limfatycznego i odpornościowego człowieka. Każda obca cząstka, szkodliwa cząsteczka, martwa część komórki lub cała struktura podlega natychmiastowemu badaniu przez związek peptydowy. Dlatego człowiek może samodzielnie, bez pomocy leków, codziennie chronić się przed infekcjami i prostymi wirusami.
Właściwości fizyczne
Struktura białka komórkowego jest bardzo specyficzna i zależy od pełnionej funkcji. Ale właściwości fizyczne wszystkich peptydów są podobne i sprowadzają się do następujących cech.
- Masa cząsteczki dochodzi do 1 000 000 daltonów.
- Układy koloidalne powstają w roztworze wodnym. Tam struktura nabiera ładunku, który może się różnić w zależności od kwasowości środowiska.
- Poddane działaniu trudnych warunków (napromieniowanie, kwas lub zasada, temperatura itp.) są w stanie przejść do innych poziomów konformacji, czyli denaturacji. W 90% przypadków proces ten jest nieodwracalny. Istnieje jednak również przesunięcie odwrotne – renaturyzacja.
Są to główne właściwości właściwości fizycznych peptydów.
P ERWICZNAJA STRUKTURABEŁKOW
Struktura pierwotna białka niesie ze sobą informację jego strukturę przestrzenną.
1. Reszty aminokwasowe w łańcuchu peptydowym białek nie zmieniają się losowo, ale są ułożone w określonej kolejności. Nazywa się liniową sekwencję reszt aminokwasowych w łańcuchu polipeptydowym pierwotna struktura białka.
2. Podstawowa struktura każdego pojedynczego białka jest kodowana w cząsteczce DNA (region zwany genem) i jest realizowana podczas transkrypcji (kopiowanie informacji na mRNA) i translacji (synteza łańcucha peptydowego).
3. Każde z 50 000 pojedynczych białek w organizmie człowieka ma unikalny dla danego pojedynczego białka, struktura pierwotna. Wszystkie cząsteczki pojedynczego białka (na przykład albuminy) mają tę samą przemianę reszt aminokwasowych, co odróżnia albuminę od innych pojedynczych białek.
4. Sekwencję reszt aminokwasowych w łańcuchu peptydowym można uznać za
formularz zgłoszeniowy
z pewnymi informacjami.
Informacja ta nakazuje przestrzenne złożenie długiego liniowego łańcucha peptydowego w bardziej zwartą trójwymiarową strukturę.
STRUKTURABEŁKOW
1. Liniowe łańcuchy polipeptydowe poszczególnych białek, w wyniku oddziaływania grup funkcyjnych aminokwasów, uzyskują pewną przestrzenną, trójwymiarową strukturę, czyli konformację. W białkach globularnych są
dwa główne typy strukturałańcuchy peptydowe: struktury drugorzędowe i trzeciorzędowe.
WTÓRNYSTRUKTURABEŁKOW
2. Struktura wtórna białek jest strukturą przestrzenną powstałą w wyniku interakcji pomiędzy grupami funkcyjnymi szkieletu peptydowego. W tym przypadku łańcuch peptydowy może uzyskać regularne struktury dwa typy:os-spirale I struktury p.
Ryż. 1.2. Drugorzędną strukturą białka jest a-helisa.
W os-spirali wiązania wodorowe powstają pomiędzy atomem tlenu grupy karboksylowej a wodą rodzaj azotu amidowego szkieletu peptydowego do 4 aminokwasów; łańcuchy boczne reszt aminokwasowych znajdują się wzdłuż obwodu helisy, nie uczestnicząc w tworzeniu wiązań wodorowych tworzących strukturę drugorzędową (ryc. 1.2).
Zapobiegają temu pozostałości o dużej objętości lub pozostałości o identycznych ładunkach odpychających sprzyjają tworzeniu się α-helisy.
Reszta proliny przerywa α-helisę ze względu na jej strukturę pierścieniową i niemożność utworzenia wiązania wodorowego z powodu braku wodoru przy atomie azotu w łańcuchu peptydowym.
B-Struktura utworzone pomiędzy liniowymi regionami jednego łańcucha polipeptydowego, tworząc fałdy lub pomiędzy różnymi łańcuchami polipeptydowymi. Mogą tworzyć się łańcuchy polipeptydowe lub ich części równoległy(Końce N i C oddziałujących łańcuchów peptydowych są takie same) lub antyrównoległe(Końce N i C oddziałujących łańcuchów peptydowych leżą w przeciwnych kierunkach) struktury p(ryc. 1.3).
W Białka zawierają także regiony o nieregularnej strukturze drugorzędowej, tzw w przypadkowych splotach, chociaż te struktury nie zmieniają się tak bardzo w zależności od cząsteczki białka.
TRZECIORZĘDOWYSTRUKTURABEŁKOW
3. Trzeciorzędowa struktura białka jest trójwymiarową strukturą przestrzenną powstałą w wyniku oddziaływań pomiędzy rodnikami aminokwasów, które w łańcuchu peptydowym mogą znajdować się w znacznych odległościach od siebie.
Ryż. 1.3. Antyrównoległe (struktura beta).
.jpg)
Hydrofobowe rodniki aminokwasowe mają tendencję do łączenia się w obrębie struktury kulistej białek poprzez tzw przewodnik-interakcje rofobiczne i międzycząsteczkowe siły van der Waalsa, tworząc gęsty hydrofobowy rdzeń. Hydrofilowe, zjonizowane i niezjonizowane rodniki aminokwasów zlokalizowane są głównie na powierzchni białka i decydują o jego rozpuszczalności w wodzie.
Hydrofilowe aminokwasy znajdujące się wewnątrz hydrofobowego rdzenia mogą oddziaływać ze sobą za pomocą joński I wiązania wodorowe(Ryż. 1.4).
.jpg)
Ryż. 1.4. Rodzaje wiązań powstających pomiędzy rodnikami aminokwasów podczas tworzenia trzeciorzędowej struktury białka. 1 - wiązanie jonowe; 2 - wiązanie wodorowe; 3 - oddziaływania hydrofobowe; 4 - wiązanie dwusiarczkowe.
|
|
Ryż. 1,5. Wiązania dwusiarczkowe w strukturze insuliny ludzkiej.
Wiązania jonowe, wodorowe i hydrofobowe są słabe: ich energia jest niewiele wyższa od energii ruchu termicznego cząsteczek w temperaturze pokojowej.
Konformacja białka zostaje zachowana dzięki pojawieniu się wielu takich słabych wiązań.
Labilność konformacyjna białek to zdolność białek do ulegania niewielkim zmianom w konformacji w wyniku rozerwania niektórych i utworzenia innych słabych wiązań.
Trzeciorzędowa struktura niektórych białek jest ustabilizowana wiązania disiarczkowe, powstaje w wyniku oddziaływania grup SH dwóch reszt cysteiny.
Większość białek wewnątrzkomórkowych nie ma kowalencyjnych wiązań dwusiarczkowych. Ich obecność jest charakterystyczna dla białek wydzielanych przez komórkę, np. wiązania dwusiarczkowe występują w cząsteczkach insuliny i immunoglobulin.
Insulina- hormon białkowy syntetyzowany w komórkach beta trzustki. Wydzielany przez komórki w odpowiedzi na wzrost stężenia glukozy we krwi. W strukturze insuliny występują 2 wiązania dwusiarczkowe łączące 2 łańcuchy polipeptydowe A i B oraz 1 wiązanie dwusiarczkowe wewnątrz łańcucha A (ryc. 1.5).
Cechy struktury drugorzędowej białek wpływają na charakter oddziaływań międzyrodnikowych i strukturę trzeciorzędową.
4. W wielu białkach o różnych strukturach i funkcjach obserwuje się pewną specyficzną kolejność naprzemienności struktur drugorzędowych i nazywa się to strukturą superwtórną.
Taki struktury uporządkowane nazywane są często motywami strukturalnymi, które mają specyficzne nazwy: „a-helisa-zwrot-helisa”, „zamek leucynowy”, „palce cynkowe”, „struktura P-beczki” itp.
Ze względu na obecność α-helis i β-struktur białka globularne można podzielić na 4 kategorie:
1. Do pierwszej kategorii zaliczają się białka zawierające wyłącznie α-helisy, na przykład mioglobina i hemoglobina (ryc. 1.6).
2. Druga kategoria obejmuje białka zawierające struktury a-helisy i (3). W tym przypadku struktury a i (3) często tworzą ten sam typ kombinacji, występujący w różnych pojedynczych białkach.
Przykład. Struktura nadwtórna typu P-baryłkowego.
Enzym izomeraza triozofosforanowa ma strukturę nadwtórną typu P-beczułka, gdzie każda (3-struktura jest zlokalizowana wewnątrz beczki P i jest powiązana z regionem α-helikalnym polipeptydułańcuchy zlokalizowane na powierzchni cząsteczki (ryc. 1.7, A).
Ryż. 1.7. Struktura nadwtórna typu p-baryłkowego.
a - izomeraza triozofosforanowa; b - domena Piru Vatka Nazy.
.jpg)
Tę samą strukturę superwtórną znaleziono w jednej z domen cząsteczki enzymu kinazy pirogronianowej (ryc. 1.7, b). Domena jest częścią cząsteczki, której struktura przypomina niezależne białko globularne.
Kolejny przykład powstawania struktury superwtórnej, która ma struktury P i o-helisy. W jednej z domen dehydrogenazy mleczanowej (LDH) i kinazy fosfoglicerynianowej struktury P łańcucha polipeptydowego są zlokalizowane pośrodku w postaci skręconego arkusza, a każda struktura P jest powiązana z obszarem α-helikalnym zlokalizowanym na powierzchni cząsteczki (ryc. 1.8).
Ryż. 1.8. Struktura wtórna, charakterystyczna dla wielu fer- gliniarze.
A-domena dehydrogenazy mleczanowej; B- domena kinazy fosfoglicerynianowej.
.jpg) 3. Trzecia kategoria obejmuje białka, które mają zawierający tylko drugorzędową strukturę p. Takie struktury znajdują się w immunoglobulinach, w enzymie dysmutazie ponadtlenkowej (ryc. 1.9).
3. Trzecia kategoria obejmuje białka, które mają zawierający tylko drugorzędową strukturę p. Takie struktury znajdują się w immunoglobulinach, w enzymie dysmutazie ponadtlenkowej (ryc. 1.9).
Ryż. 1.9. Struktura drugorzędowa domeny stałej immunoglobuliny (A)
oraz enzym dysmutaza ponadtlenkowa (B).
.jpg)
4. Czwarta kategoria obejmuje białka zawierające tylko niewielką ilość regularnych struktur drugorzędowych. Białka te obejmują małe białka bogate w cystynę lub metaloproteiny.
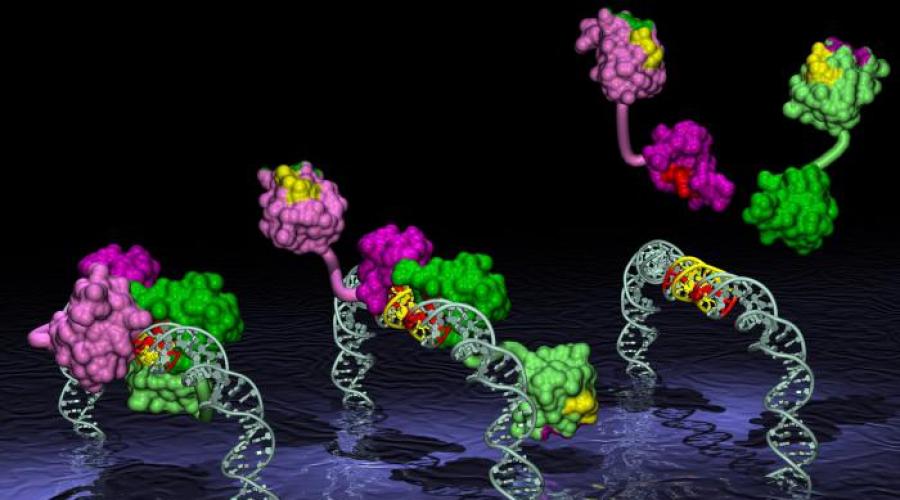
Białka wiążące DNA mają typowe typy struktur superwtórnych: „os-helix-turn-os-helix”, „zamek leucynowy”, „cynk-Twoje palce." Białka wiążące DNA zawierają miejsce wiązania, które jest komplementarne do regionu DNA o określonej sekwencji nukleotydowej. Białka te biorą udział w regulacji działania genów.
« A-
Spirala – obrót – spirala”
Ryż. 1.10. Łączenie szkoły średniej
Struktury typu „a-helisa-zwrot-helisa”.
w głównym rowku D
|
|
.jpg) rowek na szyję dobryprzystosowane do wiązania białek z małymi obszarami helikalnymi.
rowek na szyję dobryprzystosowane do wiązania białek z małymi obszarami helikalnymi.
Ten motyw strukturalny obejmuje 2 helisy: jedną krótszą, drugą dłuższą, połączone zwojem łańcucha polipeptydowego (ryc. 1.10).
Krótsza α-helisa znajduje się w poprzek rowka DNA, a dłuższa α-helisa znajduje się w głównym rowku, tworząc niekowalencyjne specyficzne wiązania rodników aminokwasów z nukleotydami DNA.
Często białka o takiej strukturze tworzą dimery, w rezultacie białko oligomeryczne ma 2 struktury superwtórne.
Znajdują się one w pewnej odległości od siebie i wystają ponad powierzchnię białka (ryc. 1.11).Dwie takie struktury mogą wiązać DNA w sąsiadujących obszarach głównych rowków
bezistotne zmiany w strukturze białek.
„Palec cynkowy”
„Palec cynkowy” to fragment białka zawierający około 20 reszt aminokwasowych (ryc. 1.12).
Atom cynku jest związany z 4 rodnikami aminokwasowymi: 2 resztami cysteiny i 2 resztami histydyny.
W niektórych przypadkach zamiast reszt histydyny występują reszty cysteiny.
Ryż. 1.12. Struktura regionu wiążącego DNAbiałka w formie „palca cynkowego”.
.jpg)
Ten region białka tworzy α-helisę, która może specyficznie wiązać się z regionami regulatorowymi głównego rowka DNA.
Specyficzność wiązania pojedynczego regulatorowego białka wiążącego DNA zależy od sekwencji reszt aminokwasowych zlokalizowanych w regionie palca cynkowego.
„Zamek leucynowy”
Białka oddziałujące mają region α-helikalny zawierający co najmniej 4 reszty leucyny.
Reszty leucyny są oddalone od siebie o 6 aminokwasów.
Ponieważ każdy zwój α-helisy zawiera resztę 3,6-aminokwasową, rodniki leucyny znajdują się na powierzchni co drugiego zwoju.
Reszty leucyny α-helisy jednego białka mogą oddziaływać z resztami leucyny innego białka (oddziaływania hydrofobowe), łącząc je ze sobą (ryc. 1.13).
.jpg) Wiele białek wiążących DNA oddziałuje z DNA w postaci struktur oligomerycznych, gdzie podjednostki są połączone ze sobą „zamkami leucynowymi”. Przykładem takich białek są histony.
Wiele białek wiążących DNA oddziałuje z DNA w postaci struktur oligomerycznych, gdzie podjednostki są połączone ze sobą „zamkami leucynowymi”. Przykładem takich białek są histony.
Histony- białka jądrowe, które zawierają dużą liczbę dodatnio naładowanych aminokwasów - argininę i lizynę (do 80%).
Cząsteczki histonów łączone są w oligomeryczne kompleksy zawierające 8 monomerów za pomocą „zamków leucynowych”, pomimo silnego ładunku dodatniego tych cząsteczek.
Streszczenie. Wszystkie cząsteczki pojedynczego białka, posiadające identyczną strukturę pierwszorzędową, uzyskują w roztworze tę samą konformację.
Zatem, charakter przestrzennego fałdowania łańcucha peptydowego jest określony przez aminokwasskład i naprzemienność reszt aminokwasowych wwięzy. W związku z tym konformacja jest tak samo specyficzną cechą pojedynczego białka, jak jego pierwotna struktura.
03. Budowa cząsteczki białka (pierwotna, wtórna, trzeciorzędowa, czwartorzędowa). Rodzaje połączeń. Związek pomiędzy strukturą a funkcją
Każde białko jest scharakteryzowane specyficzna sekwencja aminokwasów i indywidualna struktura przestrzenna (konformacja). Białka stanowią co najmniej 50% suchej masy związków organicznych w komórce zwierzęcej. W organizmie człowieka istnieje aż 5 milionów różnych typów białek. Cząsteczka białka może składać się z jednego lub większej liczby łańcuchów zawierających od pięćdziesięciu do kilkuset reszt aminokwasowych. Cząsteczki zawierające mniej niż pięćdziesiąt reszt są klasyfikowane jako peptydy. Wiele cząsteczek zawiera reszty cysteiny, których wiązania dwusiarczkowe łączą kowalencyjnie odcinki jednego lub więcej łańcuchów. W rodzimy stan makrocząsteczki białka mają specyficzną konformację. Charakterystykę konformacyjną danego białka określa się poprzez:
- sekwencja reszt aminokwasowych i jest stabilizowana wiązaniami wodorowymi pomiędzy peptydami i grupami bocznymi reszt aminokwasowych,
- oddziaływania elektrostatyczne i hydrofobowe.
Podstawowa struktura białka. Wiązanie peptydowe powstaje, gdy reakcje grupy aminowej jednego aminokwasu i grupy karboksylowej drugiego, prowadzące do uwolnienia cząsteczki wody:
CH3-CH(NH2)-COOH + CH3- CH(NH2)-COOH ^ CH3-CH(NH2)-CO- NH-(CH3) CH-COOH + H2O
Tworzą się aminokwasy połączone wiązaniami peptydowymi łańcuch polipeptydowy. Wiązanie peptydowe ma płaską strukturę:
- atomy C, O i N są w hybrydyzacji sp;
- atom N ma orbital p z wolną parą elektronów;
- powstaje układ sprzężony p-n, co prowadzi do skrócenia wiązania C-N (0,132 nm) i ograniczenia rotacji (bariera rotacji wynosi ~63 kJ/mol).
Wiązanie peptydowe ma głównie konfigurację trans w stosunku do płaszczyzny wiązania peptydowego. Ta struktura wiązania peptydowego wpływa na tworzenie drugorzędowej i trzeciorzędowej struktury białka. Wiązanie peptydowe jest sztywne, kowalencyjne i zdeterminowane genetycznie. We wzorach strukturalnych jest ono przedstawiane jako wiązanie pojedyncze, ale w rzeczywistości to wiązanie pomiędzy węglem i azotem ma charakter częściowo podwójnego wiązania. Jest to spowodowane różną elektroujemnością atomów C, N i O. Rotacja wokół wiązania peptydowego jest niemożliwa, wszystkie cztery atomy leżą w tej samej płaszczyźnie, tj. współpłaszczyznowy. Rotacja innych wiązań wokół szkieletu polipeptydowego jest całkiem swobodna. Sekwencja aminokwasów każdego białka jest unikalna i genetycznie ustalona.
Wyróżnia się je na podstawie liczby reszt aminokwasowych zawartych w cząsteczkach peptydów dipeptydy, tripeptydy, tetrapeptydy itp. Nazywa się peptydy zawierające do dziesięciu reszt aminokwasowych oligopeptydy zawierający więcej niż dziesięć reszt aminokwasowych - polipeptydy. Naturalne polipeptydy o masie cząsteczkowej większej niż 6000 nazywane są białka.
Struktura wtórna - jest to przestrzenne ułożenie łańcucha polipeptydowego w postaci α-helisy lub fałdu P, niezależnie od rodzaju rodników bocznych i ich konformacji. L. Pauling i R. Corey zaproponowali model drugorzędowej struktury białek w postaci a-helisy, w którym wiązania wodorowe są zamknięte pomiędzy co pierwszym i czwartym aminokwasem, co pozwala zachować natywną strukturę białka, spełniać najprostsze funkcje i chronić przed zniszczeniem. Wszystkie grupy peptydowe biorą udział w tworzeniu wiązań wodorowych, co zapewnia maksymalną stabilność, zmniejsza hydrofilowość i zwiększa hydrofobowość cząsteczki białka. α-helisa tworzy się spontanicznie i jest najbardziej stabilną konformacją, odpowiadającą minimalnej energii swobodnej. Najpopularniejszym elementem struktury wtórnej jest prawa a-helisa (aR). Łańcuch peptydowy wygina się tutaj spiralnie. Każdy obrót ma 3,6 reszt aminokwasowych, skok śruby, tj. minimalna odległość między dwoma równoważnymi punktami wynosi 0,54 nm; α-helisa jest stabilizowana przez prawie liniowe wiązania wodorowe pomiędzy grupą NH i grupą CO czwartej reszty aminokwasowej. Niepolarny lub amfifilowyα-helisy z 5-6 zwojami często zapewniają zakotwiczenie białek w błonach biologicznych (helisy transbłonowe). B konstrukcje składane powstają również poprzeczne międzyłańcuchowe wiązania wodorowe. Jeżeli łańcuchy są zorientowane w przeciwnych kierunkach, strukturę nazywa się arkusz złożony antyrównolegle(wa); jeśli łańcuchy są zorientowane w tym samym kierunku, strukturę nazywa się arkusz złożony równolegle(wp). Oprócz zwykłych w łańcuchach polipeptydowych istnieją również nieregularne struktury wtórne, te. standardowe struktury, które nie tworzą długich układów okresowych. Ten - Łuki typu B są one tak zwane, ponieważ często ściągają razem wierzchołki sąsiednich pasm b w antyrównoległe spinki do włosów). Zagięcia zawierają zwykle około połowy reszt, które nie wpadły w regularne struktury białek.
Stabilizacja połączeń struktura trzeciorzędowa :
- elektrostatyczne siły przyciągania pomiędzy grupami R niosącymi przeciwnie naładowane grupy jonogenne (wiązania jonowe);
- wiązania wodorowe pomiędzy polarnymi (hydrofilowymi) grupami R;
- oddziaływania hydrofobowe pomiędzy niepolarnymi (hydrofobowymi) grupami R;
- wiązania dwusiarczkowe między rodnikami dwóch cząsteczek cysteiny.
Wiązania te są kowalencyjne. Zwiększają stabilność struktury trzeciorzędowej, ale nie zawsze są niezbędne do prawidłowego skręcenia cząsteczki. W wielu białkach mogą one być całkowicie nieobecne.
Struktura trzeciorzędowa- unikalne miejsce dla każdego białka w przestrzeni łańcucha polipeptydowego, zależne od liczby i naprzemienności aminokwasów, tj. jest z góry określona przez pierwotną strukturę białka. Konfiguracja cząsteczek białka może być włókniste i kuliste. Trzeciorzędowa struktura wielu białek składa się z kilku zwartych kuleczek, tzw domeny. Domeny są zwykle połączone ze sobą cienkimi mostkami z wydłużonych amorficznych łańcuchów polipeptydowych. Dodatkowo w białkach występują motywy układania łańcucha polipeptydowego, podobne do ozdób na wazach indyjskich i greckich: motyw meandrowy, motyw kluczowy w Grecji. motyw zygzakowatego „zamka błyskawicznego” Podczas składania kulki białka znaczna część (co najmniej połowa) hydrofobowych rodników reszt aminokwasowych jest ukryta przed kontaktem z wodą otaczającą białko. Tworzenie się swoistych wewnątrzcząsteczkowych „ rdzenie hydrofobowe" Zawierają szczególnie duże pozostałości leucyny, izoleucyny, fenyloalaniny i waliny. Wraz z pojawieniem się struktury trzeciorzędowej białko zyskuje nowe właściwości - biologiczny. W szczególności przejaw właściwości katalitycznych jest związany z obecnością struktury trzeciorzędowej w białku. Białka włókniste to białka o wydłużonej strukturze nitkowatej. Większość białek fibrylarnych jest nierozpuszczalna w wodzie, ma dużą masę cząsteczkową i wysoce regularną strukturę przestrzenną, która jest stabilizowana głównie poprzez oddziaływania (w tym kowalencyjne) pomiędzy różnymi łańcuchami polipeptydowymi. Łańcuchy polipeptydowe wielu białek fibrylarnych są ułożone równolegle do siebie, wzdłuż tej samej osi i w tej samej formie długie włókna (fibryle) lub warstwy. Białka globularne- białka, w cząsteczkach których łańcuchy polipeptydowe są ściśle zwinięte w zwarte struktury kuliste - globule (struktury białek trzeciorzędowych).
Struktura czwartorzędowa to formacja supramolekularna składająca się z dwóch lub więcej łańcuchów polipeptydowych połączonych ze sobą niekowalencyjnie, ale za pomocą wiązań wodorowych, oddziaływań elektrostatycznych, dipolowo-dipolowych i hydrofobowych pomiędzy resztami aminokwasowymi znajdującymi się na powierzchni. Każde z białek uczestniczących w strukturze trzeciorzędowej podczas tworzenia struktury czwartorzędowej nazywana podjednostką lub protomerem. Powstała cząsteczka nazywa się oligomer lub multimer. Białka oligomeryczne są często zbudowane z parzystej liczby protomerów o takich samych lub różnych masach cząsteczkowych. W tworzeniu struktury czwartorzędowej białka biorą udział te same wiązania, co w tworzeniu struktury trzeciorzędowej, z wyjątkiem wiązań kowalencyjnych. Charakterystyczną cechą białek o strukturze czwartorzędowej jest ich zdolność do samoorganizacji. Oddziaływanie protomerów odbywa się z dużą specyficznością, dzięki powstaniu kilkunastu słabych wiązań pomiędzy powierzchniami styku podjednostek, dlatego wykluczone są błędy w tworzeniu czwartorzędowej struktury białek.
Prawie wszystko białka enzymatyczne mają strukturę czwartorzędową i składają się z reguły z parzystej liczby protomerów (dwa, cztery, sześć, osiem). Czwartorzędowa struktura białka oznacza taką kombinację białek o strukturze trzeciorzędowej, w której pojawiają się nowe właściwości biologiczne, które nie są charakterystyczne dla białka o strukturze trzeciorzędowej.
Konfiguracja przestrzenna białka te. Nazywa się struktury trzeciorzędowe i czwartorzędowe struktura. Jeśli weźmiesz łańcuch polipeptydowy za końce, rozciągniesz go, a następnie zwolnisz, za każdym razem złoży się on w tę samą strukturę, charakterystyczną dla tego typu polipeptydu. Jednocześnie z tego, co zostało powiedziane, wynika oczywiście, że zmieniając w dowolnym polipeptydzie choćby jeden aminokwas, otrzymamy cząsteczkę o zupełnie innej budowie, a co za tym idzie, o innych właściwościach.
Przez skład chemiczny wszystkie białka są podzielone na prosty, składający się wyłącznie z reszt aminokwasowych, oraz złożony. Złożone mogą zawierać jony metali (metaloproteiny) lub pigment (chromoproteiny), tworzyć silne kompleksy z lipidami (lipoproteiny), kwasami nukleinowymi (nukleoproteiny), a także kowalencyjnie wiązać resztę kwasu fosforowego (fosfoproteiny), węglowodany (glikoproteiny).
Białka proste dzielą się na:
- włókniste, rozpuszczalne w wodzie (aktyna, miozyna) i nierozpuszczalne (keratyna, elastyna, kolagen),
- kuliste (albuminy, globuliny, protaminy, histony, prolaminy).
Jak wykazały badania właściwości białek w roztworach, makrocząsteczki białek mają kształt zwartych kulek (globul) lub wydłużonych struktur - włókienek. Badania wykazały, że w fałdowaniu łańcucha peptydowego nie ma nic przypadkowego ani chaotycznego. Składa się w sposób uporządkowany, specyficzny dla każdego białka. Polarne grupy boczne aminokwasów zwykle znajdują się na powierzchni globuli, gdzie mogą oddziaływać z wodą, a grupy niepolarne znajdują się wewnątrz.
Aby zrozumieć skomplikowany układ (architektonikę) makrocząsteczki białka, należy to rozważyć kilka poziomów organizacji.
Podstawowa struktura białka oznacza pełną sekwencję reszt aminokwasowych w łańcuchu polipeptydowym.
Decyduje o tym genotyp, tj. geny organizmu. W strukturze pierwszorzędowej wszystkie wiązania między resztami aminokwasów są kowalencyjne, a zatem mocne. Różne białka różnią się od siebie strukturą pierwotną: keratyna ma jedną sekwencję aminokwasów, pepsynę - drugą, somatotropinę (hormon wzrostu) - trzecią itd. W pierwszorzędowej strukturze białka można rozróżnić N-koniec łańcucha, zawierający wolną grupę NH2 i C-koniec, zawierający wolną grupę COOH.
Pierwszym białkiem, którego sekwencję aminokwasów zidentyfikowano, był hormon insulina. Badania prowadził na Uniwersytecie Cambridge F. Sanger w latach 1944–1954. Stwierdzono, że cząsteczka insuliny składa się z dwóch łańcuchów polipeptydowych (z 21 i 30 reszt aminokwasowych) połączonych mostkami dwusiarczkowymi.
Jednakże cząsteczka białka w postaci łańcucha aminokwasów połączonych sekwencyjnie wiązaniami peptydowymi nie jest jeszcze zdolna do pełnienia określonych funkcji. Wymaga to wyższego poziomu organizacji strukturalnej, co wyraża się w skomplikowanym układzie przestrzennym monomerów.
Struktura drugorzędowa białka reprezentowana przez helisę, w którą skręcony jest łańcuch polipeptydowy. Grupy N–H i C=O zawarte w wiązaniu peptydowym są zauważalnie spolaryzowane: azot ma większą elektroujemność niż wodór, a tlen ma większą elektroujemność niż węgiel.
Tlen grupy C=O może tworzyć wiązania wodorowe z wodorem grupy N–H (oczywiście umiejscowionym w innym wiązaniu peptydowym).
Jednym z typów struktury wtórnej jest - spirala, gdzie każdy atom tlenu jest związany z atomem wodoru czwartej grupy NH wzdłuż helisy.
Ciekawe, że tę złożoną, piękną strukturę po raz pierwszy przepowiedział teoretycznie słynny biochemik L. Pauling, a dopiero potem odkryto eksperymentalnie.
Alternatywna struktura drugorzędowa - warstwa (lub warstwa złożona) ma wiązanie wodorowe pomiędzy jednostkami sąsiednich łańcuchów polipeptydowych.
Trzeciorzędowa struktura białka to złożone trójwymiarowe opakowanie przestrzenne
-spirale i -warstwy. Ta trójwymiarowa struktura powstaje w wyniku oddziaływania rodników aminokwasów, pomiędzy którymi może powstać kilka rodzajów wiązań:
1) joński, powstające w wyniku oddziaływania elektrostatycznego między ujemnie i dodatnio naładowanymi grupami bocznymi;
2) hydrofobowy(„nie kochający wody”), powstały w wyniku chęci niepolarnych rodników do łączenia się ze sobą, a nie mieszania się z otaczającym je środowiskiem wodnym;
3) dwusiarczek, które powstają pomiędzy atomami siarki grup SH dwóch reszt aminokwasowych cysteiny. Te wiązania S – S mają charakter kowalencyjny;
4) wodór, które również powstają w wyniku interakcji między atomami rodników.
Trzeciorzędowa struktura białka nie jest ostateczna. Niektóre białka, najczęściej regulatorowe, charakteryzują się czwartorzędową budową, która jest im niezbędna do skutecznego wykonywania swojej funkcji.
Struktura czwartorzędowa jest reprezentowany przez skojarzenie składające się z kilku łańcuchów polipeptydowych. Na przykład złożona cząsteczka hemoglobiny składa się z dwóch podjednostek (141 reszt aminokwasowych) i dwóch podjednostek (146 reszt aminokwasowych). Każda podjednostka jest powiązana z cząsteczką hemu zawierającą żelazo. W wyniku ich połączenia powstaje działająca cząsteczka hemoglobiny. Tylko w takim opakowaniu hemoglobina funkcjonuje w pełni, czyli jest w stanie przenosić tlen. Struktura czwartorzędowa jest stabilizowana przez te same wiązania, co trzeciorzędowa.
Konfiguracja przestrzenna białka, tj. Nazywa się struktury trzeciorzędowe i czwartorzędowe struktura. Konformację białka określa jego pierwotna struktura: łańcuch białkowy z określoną sekwencją aminokwasów spontanicznie składa się, tworząc naturalną konfigurację przestrzenną. Nazywa się to „samoorganizacją cząsteczki białka”. Jeśli weźmiesz łańcuch polipeptydowy za końce, rozciągniesz go, a następnie zwolnisz, za każdym razem złoży się on w tę samą strukturę, charakterystyczną dla tego typu polipeptydu.
Jednocześnie z tego, co zostało powiedziane, wynika oczywiście, że zmieniając w dowolnym polipeptydzie choćby jeden aminokwas, otrzymamy cząsteczkę o zupełnie innej budowie, a co za tym idzie, o innych właściwościach.
.jpg)
.jpg)