Opis substancji ciekłej. Stan ciekły. Struktury cieczy i ciał amorficznych są podobne
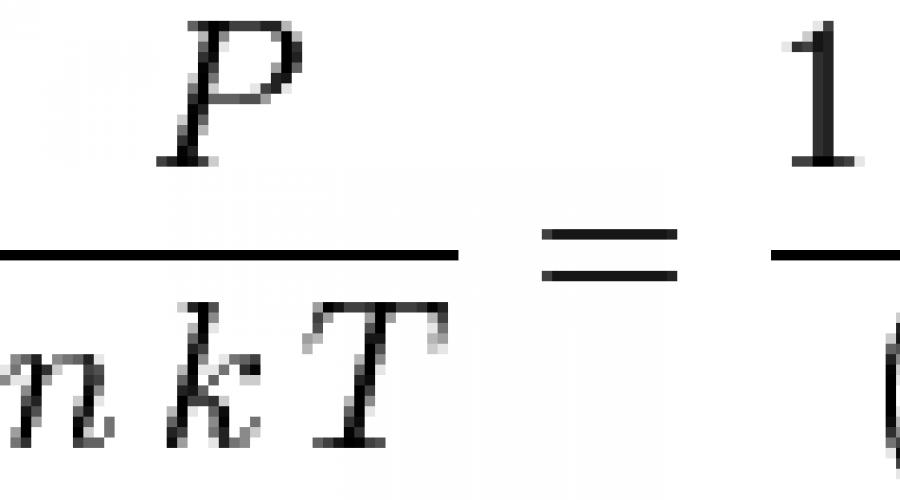
Przeczytaj także
· Równanie Eulera · Naviera – Równania Stokesa · Równanie dyfuzji · Prawo Hooke’a
Z reguły substancja w stanie ciekłym ma tylko jedną modyfikację. (Najważniejszymi wyjątkami są ciecze kwantowe i ciekłe kryształy.) Dlatego w większości przypadków ciecz to nie tylko stan skupienia, ale także faza termodynamiczna (faza ciekła).
Wszystkie ciecze są zwykle podzielone na czyste ciecze i mieszaniny. Niektóre mieszaniny cieczy mają ogromne znaczenie dla życia: krew, woda morska itp. Ciecze mogą działać jako rozpuszczalniki.
Właściwości fizyczne cieczy
- Płynność
Główną właściwością cieczy jest płynność. Jeśli na część cieczy znajdującą się w równowadze zostanie przyłożona siła zewnętrzna, wówczas nastąpi przepływ cząstek cieczy w kierunku, w którym ta siła zostanie przyłożona: ciecz przepływa. Zatem pod wpływem niezrównoważonych sił zewnętrznych ciecz nie zachowuje swojego kształtu i względnego układu części, dlatego przyjmuje kształt naczynia, w którym się znajduje.
W przeciwieństwie do ciał stałych z tworzywa sztucznego, ciecz nie ma granicy plastyczności: wystarczy przyłożyć dowolnie małą siłę zewnętrzną, aby ciecz mogła płynąć.
- Zachowanie objętości
Jedną z charakterystycznych właściwości cieczy jest to, że ma ona określoną objętość (w stałych warunkach zewnętrznych). Ciecz jest niezwykle trudna do sprężenia mechanicznego, ponieważ w przeciwieństwie do gazu pomiędzy cząsteczkami jest bardzo mało wolnej przestrzeni. Ciśnienie wywierane na ciecz zamkniętą w naczyniu przenosi się bez zmiany na każdy punkt objętości tej cieczy (prawo Pascala obowiązuje również dla gazów). Cecha ta, wraz z bardzo niską ściśliwością, stosowana jest w maszynach hydraulicznych.
Ciecze na ogół zwiększają swoją objętość (rozszerzają się) po podgrzaniu i zmniejszają objętość (kurczą się) po ochłodzeniu. Istnieją jednak wyjątki, na przykład woda kurczy się pod wpływem ogrzewania, przy normalnym ciśnieniu i temperaturze od 0°C do około 4°C.
- Lepkość
Ponadto ciecze (takie jak gazy) charakteryzują się lepkością. Definiuje się je jako zdolność przeciwstawiania się ruchowi jednej części względem drugiej – czyli jako tarcie wewnętrzne.
Kiedy sąsiednie warstwy cieczy poruszają się względem siebie, oprócz zderzeń spowodowanych ruchem termicznym nieuchronnie dochodzi do zderzeń cząsteczek. Powstają siły, które utrudniają uporządkowany ruch. W tym przypadku energia kinetyczna uporządkowanego ruchu zamienia się w energię cieplną - energię chaotycznego ruchu cząsteczek.
Ciecz w naczyniu, wprawiona w ruch i pozostawiona sama sobie, będzie stopniowo zatrzymywana, ale jej temperatura wzrośnie.
- Swobodne tworzenie powierzchni i napięcie powierzchniowe
Dzięki zachowaniu objętości ciecz może tworzyć swobodną powierzchnię. Taka powierzchnia stanowi granicę między fazami danej substancji: z jednej strony znajduje się faza ciekła, z drugiej faza gazowa (para) i ewentualnie inne gazy, np. powietrze.
Jeżeli stykają się fazy ciekła i gazowa tej samej substancji, powstają siły, które mają tendencję do zmniejszania powierzchni styku - siły napięcia powierzchniowego. Interfejs zachowuje się jak elastyczna membrana, która ma tendencję do kurczenia się.
Napięcie powierzchniowe można wytłumaczyć przyciąganiem pomiędzy cząsteczkami cieczy. Każda cząsteczka przyciąga inne cząsteczki, stara się „otoczyć” się nimi i w ten sposób opuścić powierzchnię. W związku z tym powierzchnia ma tendencję do zmniejszania się.
Dlatego bańki mydlane i bańki mają tendencję do przybierania kształtu kulistego podczas gotowania: dla danej objętości kula ma minimalną powierzchnię. Jeśli na ciecz działają tylko siły napięcia powierzchniowego, z konieczności przybierze ona kształt kulisty - na przykład krople wody przy zerowej grawitacji.
Małe przedmioty o gęstości większej niż gęstość cieczy mogą „unosić się” na powierzchni cieczy, ponieważ siła ciężkości jest mniejsza niż siła zapobiegająca zwiększeniu pola powierzchni. (Zobacz Napięcie powierzchniowe .)
- Parowanie i kondensacja
- Dyfuzja
Gdy w naczyniu znajdują się dwie zmieszane ciecze, cząsteczki w wyniku ruchu termicznego zaczynają stopniowo przechodzić przez granicę międzyfazową, w wyniku czego ciecze stopniowo się mieszają. Zjawisko to nazywa się dyfuzją (występuje także w substancjach w innych stanach skupienia).
- Przegrzanie i hipotermia
Ciecz można ogrzać powyżej jej temperatury wrzenia, tak aby nie doszło do wrzenia. Wymaga to równomiernego ogrzewania, bez znaczących zmian temperatury w objętości i bez wpływów mechanicznych, takich jak wibracje. Jeśli wrzucisz coś do przegrzanego płynu, natychmiast się zagotuje. Przegrzaną wodę można łatwo uzyskać w kuchence mikrofalowej.
Przechłodzenie to schładzanie cieczy poniżej jej temperatury zamarzania bez przejścia w stały stan skupienia. Podobnie jak w przypadku przegrzania, hipotermia wymaga braku wibracji i znacznych zmian temperatury.
- Fale gęstości
Chociaż ciecz jest niezwykle trudna do sprężenia, jej objętość i gęstość wciąż zmieniają się wraz ze zmianą ciśnienia. To nie dzieje się natychmiast; Tak więc, jeśli jeden obszar jest skompresowany, kompresja ta jest przesyłana do innych obszarów z opóźnieniem. Oznacza to, że fale sprężyste, a dokładniej fale gęstości, mogą rozprzestrzeniać się wewnątrz cieczy. Wraz z gęstością zmieniają się również inne wielkości fizyczne, takie jak temperatura.
Jeśli gęstość zmienia się nieznacznie w miarę rozchodzenia się fali, taką falę nazywa się falą dźwiękową lub dźwiękiem.
Jeśli gęstość zmienia się wystarczająco mocno, wówczas taką falę nazywa się falą uderzeniową. Falę uderzeniową opisują inne równania.
Fale gęstości w cieczy mają charakter podłużny, to znaczy gęstość zmienia się wraz z kierunkiem propagacji fali. W cieczy nie występują poprzeczne fale sprężyste ze względu na niezachowanie kształtu.
Fale sprężyste w cieczy zanikają z czasem, ich energia stopniowo zamienia się w energię cieplną. Przyczynami tłumienia są lepkość, „klasyczna absorpcja”, relaksacja molekularna i inne. W tym przypadku działa tzw. lepkość druga, czyli objętościowa – tarcie wewnętrzne przy zmianie gęstości. Fala uderzeniowa w wyniku tłumienia po pewnym czasie zamienia się w falę dźwiękową.
Fale sprężyste w cieczy ulegają również rozpraszaniu na skutek niejednorodności wynikających z chaotycznego ruchu termicznego cząsteczek.
- Fale na powierzchni
Jeśli przesuniesz odcinek powierzchni cieczy z położenia równowagi, wówczas pod działaniem sił przywracających powierzchnia zacznie wracać do położenia równowagi. Ruch ten jednak nie zatrzymuje się, lecz zamienia się w ruch oscylacyjny w pobliżu położenia równowagi i rozprzestrzenia się na inne obszary. W ten sposób pojawiają się fale na powierzchni cieczy.
Jeśli siłą przywracającą jest przede wszystkim grawitacja, wówczas fale takie nazywane są falami grawitacyjnymi (nie mylić z falami grawitacyjnymi). Fale grawitacyjne na wodzie można zobaczyć wszędzie.
Jeśli siłą przywracającą jest głównie siła napięcia powierzchniowego, wówczas fale takie nazywane są kapilarami.
Jeśli siły te są porównywalne, fale takie nazywane są falami kapilarno-grawitacyjnymi.
Fale na powierzchni cieczy zanikają pod wpływem lepkości i innych czynników.
- Współistnienie z innymi fazami
Formalnie rzecz biorąc, dla równowagowego współistnienia fazy ciekłej z innymi fazami tej samej substancji – gazową lub krystaliczną – wymagane są ściśle określone warunki. Zatem przy danym ciśnieniu potrzebna jest ściśle określona temperatura. Jednak wszędzie w przyrodzie i technologii ciecz współistnieje z parą wodną, a także ze stałym stanem skupienia - na przykład woda z parą, a często z lodem (jeśli weźmiemy pod uwagę parę jako osobną fazę występującą wraz z powietrzem). Dzieje się tak z następujących powodów.
Stan nierównowagi. Odparowanie cieczy zajmuje trochę czasu, aż do całkowitego odparowania cieczy, współistnieje z parą. W naturze woda stale paruje, podobnie jak proces odwrotny – kondensacja.
Zamknięty wolumin. Ciecz w zamkniętym naczyniu zaczyna parować, ale ponieważ objętość jest ograniczona, prężność pary wzrasta, nasyca się ona nawet przed całkowitym odparowaniem cieczy, jeśli jej ilość jest wystarczająco duża. Po osiągnięciu stanu nasycenia ilość odparowanej cieczy jest równa ilości skroplonej cieczy, układ dochodzi do równowagi. W ten sposób w ograniczonej objętości można ustalić warunki niezbędne do równowagowego współistnienia cieczy i pary.
Występowanie atmosfery w warunkach grawitacji ziemskiej. Na ciecz wpływa ciśnienie atmosferyczne (powietrze i para), podczas gdy w przypadku pary należy brać pod uwagę prawie tylko jej ciśnienie cząstkowe. Zatem ciecz i para nad jej powierzchnią odpowiadają różnym punktom na diagramie fazowym, odpowiednio w obszarze występowania fazy ciekłej i odpowiednio w obszarze występowania fazy gazowej. Nie znosi to parowania, ale parowanie wymaga czasu, w którym obie fazy współistnieją. Bez tego warunku ciecze gotowałyby się i odparowywały bardzo szybko.
Teoria
Mechanika
Dział mechaniki poświęcony jest badaniu ruchu i równowagi mechanicznej cieczy i gazów oraz ich oddziaływaniu między sobą oraz z ciałami stałymi - hydroaeromechanika (często nazywana także hydrodynamiką). Aeromechanika płynów jest częścią bardziej ogólnej gałęzi mechaniki, mechaniki ciągłej.
Mechanika płynów to dział hydroaeromechaniki zajmujący się płynami nieściśliwymi. Ponieważ ściśliwość cieczy jest bardzo mała, w wielu przypadkach można ją pominąć. Dynamika gazu poświęcona jest badaniu ściśliwych cieczy i gazów.
Mechanika płynów dzieli się na hydrostatykę, która bada równowagę płynów nieściśliwych, oraz hydrodynamikę (w wąskim znaczeniu), która bada ich ruch.
Ruch płynów przewodzących elektrycznie i magnetycznych bada się w magnetohydrodynamice. Hydraulika służy do rozwiązywania stosowanych problemów.
Podstawowym prawem hydrostatyki jest prawo Pascala.
2. Ciecze z cząsteczek dwuatomowych składające się z identycznych atomów (ciekły wodór, ciekły azot). Takie cząsteczki mają moment kwadrupolowy.
4. Ciecze składające się z cząsteczek polarnych połączonych oddziaływaniem dipol-dipol (ciekły bromowodór).
5. Ciecze towarzyszące lub ciecze z wiązaniami wodorowymi (woda, gliceryna).
6. Ciecze składające się z dużych cząsteczek, dla których istotne są wewnętrzne stopnie swobody.
Ciecze z pierwszych dwóch grup (czasami trzech) nazywane są zwykle prostymi. Proste ciecze zostały zbadane lepiej niż inne; woda jest najlepiej zbadaną spośród cieczy złożonych. Klasyfikacja ta nie obejmuje cieczy kwantowych i ciekłych kryształów, które stanowią przypadki szczególne i należy je rozpatrywać oddzielnie.
Teoria statystyczna
Strukturę i właściwości termodynamiczne cieczy najskuteczniej bada się za pomocą równania Percusa-Yevika.
Jeśli zastosujemy model twardej kuli, to znaczy, że cząsteczki cieczy uznamy za kulki o średnicy D, wówczas równanie Percusa-Yevicka można rozwiązać analitycznie i otrzymać równanie stanu cieczy:
![]() Gdzie N- liczba cząstek na jednostkę objętości,
Gdzie N- liczba cząstek na jednostkę objętości, ![]() - gęstość bezwymiarowa. Przy małych gęstościach równanie to przekształca się w równanie stanu gazu doskonałego:
- gęstość bezwymiarowa. Przy małych gęstościach równanie to przekształca się w równanie stanu gazu doskonałego: ![]() . Dla skrajnie dużych gęstości otrzymuje się równanie stanu płynu nieściśliwego: .
. Dla skrajnie dużych gęstości otrzymuje się równanie stanu płynu nieściśliwego: .
Model kuli pełnej nie uwzględnia przyciągania między cząsteczkami, więc nie ma ostrego przejścia między cieczą a gazem, gdy zmieniają się warunki zewnętrzne.
Jeśli potrzebne są dokładniejsze wyniki, najlepszy opis struktury i właściwości cieczy uzyskuje się za pomocą teorii zaburzeń. W tym przypadku model twardej kuli jest uważany za przybliżenie zerowe, a siły przyciągania pomiędzy cząsteczkami są uważane za zaburzenie i zapewniają poprawki.
Teoria skupień
Jedna ze współczesnych teorii głosi „Teoria skupień”. Opiera się na założeniu, że ciecz jest reprezentowana jako połączenie ciała stałego i gazu. W tym przypadku cząstki fazy stałej (kryształy poruszające się na krótkie odległości) znajdują się w chmurze gazu i tworzą się strukturę klastra. Energia cząstek odpowiada rozkładowi Boltzmanna, natomiast średnia energia układu pozostaje stała (pod warunkiem, że jest izolowana). Powolne cząstki zderzają się z gromadami i stają się ich częścią. Zatem konfiguracja klastrów ciągle się zmienia, system znajduje się w stanie dynamicznej równowagi. Kiedy powstanie wpływ zewnętrzny, system będzie zachowywał się zgodnie z zasadą Le Chateliera. Zatem łatwo jest wyjaśnić przemianę fazową:
- Po podgrzaniu system stopniowo zamieni się w gaz (wrzenie)
- Po ochłodzeniu system stopniowo zmieni się w ciało stałe (zamarzanie).
Eksperymentalne metody badawcze
Strukturę cieczy bada się metodami rentgenowskiej analizy strukturalnej, dyfrakcji elektronów i dyfrakcji neutronów.
Zobacz też
- Cechy powierzchniowej warstwy cieczy
Spinki do mankietów
| Termodynamiczne stany materii | |
|---|---|
| Fizyka: Solidna Płyn Plazma Gazowa | |
- Stan stały
- Stan ciekły
- Stan gazowy
- Zmiana stanu materii
Studia chemiczne mają znaczenie. Co to jest „substancja”? Materia to wszystko, co ma masę i objętość. Substancja może znajdować się w jednym z trzech stanów skupienia: ciało stałe, ciecz, gaz.
1. Stan stały
Cząsteczki (cząsteczki) w ciele stałym łączą się w sztywną, powtarzalną strukturę - sieci krystalicznej. Cząstki w sieci krystalicznej podlegają niewielkim wibracjom wokół środków równowagi. Ciało stałe ma formularz I tom.
2. Stan ciekły
W przeciwieństwie do ciał stałych, ciecze nie mają określonego kształtu, ale mają objętość. Wyjaśnia to fakt, że w cieczach cząstki znajdują się w większej odległości od siebie niż w ciałach stałych i poruszają się aktywniej.
Ponieważ cząstki w cieczach są rozmieszczone mniej gęsto niż w ciałach stałych, nie mogą tworzyć sieci krystalicznej, dlatego ciecze nie mają określonego kształtu.
3. Stan gazowy
W gazach cząsteczki znajdują się w jeszcze większych odległościach niż w cieczach. Co więcej, cząstki znajdują się w ciągłym, chaotycznym (nieuporządkowanym) ruchu. Dlatego gazy mają tendencję do równomiernego wypełniania powierzonej im objętości (stąd gazy nie mają określonego kształtu).
4. Zmiana stanu skupienia
Weźmy banalny przykład i prześledźmy proces zmiany stanu wody.
W stanie stałym woda jest lodem. Temperatura lodu jest niższa niż 0 o C. Po podgrzaniu lód zaczyna się topić i zamieniać w wodę. Wyjaśnia to fakt, że cząsteczki lodu znajdujące się w sieci krystalicznej zaczynają się poruszać po podgrzaniu, w wyniku czego sieć ulega zniszczeniu. Nazywa się temperaturę, w której topi się substancja "temperatura topnienia" Substancje. Temperatura topnienia wody wynosi 0°C.
Należy zauważyć, że dopóki lód nie całkowicie się stopi, jego temperatura będzie wynosić 0 o C.
| Podczas przemian fazowych substancji temperatura pozostaje stała |
Gdy lód całkowicie zamieni się w wodę, będziemy kontynuować ogrzewanie. Temperatura wody wzrośnie, a ruch cząstek pod wpływem ciepła będzie coraz bardziej przyspieszał. Dzieje się tak, dopóki woda nie osiągnie następnego punktu zmiany stanu - wrzenie.
Ten moment następuje, gdy wiązania cząsteczek wody zostają całkowicie zerwane i ich ruch staje się swobodny: woda zamienia się w parę.
| Proces przejścia substancji ze stanu ciekłego w stan gazowy nazywa się wrzenie |
Nazywa się temperaturę, w której wrze ciecz „punkt wrzenia”.
Należy pamiętać, że temperatura wrzenia zależy od ciśnienia. Przy normalnym ciśnieniu (760 mm Hg) temperatura wrzenia wody wynosi 100 o C.
Analogicznie do topienia: dopóki woda całkowicie nie zamieni się w parę, temperatura pozostanie stała.
Podsumować. W wyniku ogrzewania otrzymaliśmy różne stany fazowe wody:
Lód → woda → para Lub N 2 0 (t) → N 2 0 (g) → N 2 0 (g)
Co się stanie, jeśli zaczniemy chłodzić parę wodną? Nie trzeba być „najlepszym uczniem”, aby zgadnąć, że w wodzie będzie zachodził odwrotny proces przemian fazowych:
Para → woda → lód
Istnieją pewne substancje, które przechodzą ze stanu stałego bezpośrednio do stanu gazowego, z pominięciem fazy ciekłej. Proces ten nazywa się sublimacja Lub sublimacja. Tak zachowuje się na przykład „suchy lód” (dwutlenek azotu CO 2). Po podgrzaniu nie zobaczysz ani kropli wody - „suchy lód” będzie wydawał się wyparowywać na twoich oczach.
Nazywa się odwrotny proces sublimacji (przejścia substancji ze stanu gazowego do stanu stałego). desublimacja.
Ciecze zajmują pozycję pośrednią pomiędzy substancjami gazowymi i stałymi. W temperaturach bliskich wrzenia właściwości cieczy zbliżają się do właściwości gazów; w temperaturach bliskich temperatury topnienia właściwości cieczy zbliżają się do właściwości ciał stałych. Jeśli substancje stałe charakteryzują się ścisłym uporządkowaniem cząstek, rozciągającym się na odległości dochodzące do setek tysięcy promieni międzyatomowych lub międzycząsteczkowych, to w substancji ciekłej znajduje się zwykle nie więcej niż kilkadziesiąt uporządkowanych cząstek - tłumaczy się to tym, że Szybko powstaje także porządek pomiędzy cząsteczkami w różnych miejscach ciekłej substancji, gdyż ponownie ulegają one „erozji” pod wpływem drgań termicznych cząstek. Jednocześnie ogólna gęstość upakowania cząstek substancji ciekłej niewiele różni się od gęstości substancji stałej - dlatego ich gęstość jest zbliżona do gęstości ciał stałych, a ich ściśliwość jest bardzo niska. Przykładowo, aby zmniejszyć objętość zajmowaną przez ciekłą wodę o 1%, potrzebne jest ciśnienie ~200 atm, natomiast do takiego samego zmniejszenia objętości gazów wymagane jest ciśnienie około 0,01 atm. W konsekwencji ściśliwość cieczy jest w przybliżeniu 200: 0,01 = 20 000 razy mniejsza niż ściśliwość gazów.
Powyżej zauważono, że ciecze mają pewną objętość i przyjmują kształt naczynia, w którym się znajdują; właściwości te są znacznie bliższe właściwościom ciała stałego niż substancji gazowej. Bliskość stanu ciekłego do stanu stałego potwierdzają także dane dotyczące standardowych entalpii parowania ∆H° eva i standardowych entalpii topnienia ∆H° pl. Standardowa entalpia parowania to ilość ciepła potrzebna do przekształcenia 1 mola cieczy w parę pod ciśnieniem 1 atmosfery (101,3 kPa). Taka sama ilość ciepła jest uwalniana, gdy 1 mol pary wodnej skrapla się do cieczy pod ciśnieniem 1 atm. Nazywa się ilość ciepła zużytego do przekształcenia 1 mola ciała stałego w ciecz pod ciśnieniem 1 atm standardowa entalpia topnienia(taka sama ilość ciepła jest uwalniana, gdy 1 mol cieczy „zamarza” („twardnieje”) pod ciśnieniem 1 atm). Wiadomo, że ∆Н° pl jest znacznie mniejsze niż odpowiadające im wartości ∆Н° isp, co jest łatwe do zrozumienia, ponieważ przejściu ze stanu stałego do stanu ciekłego towarzyszy mniejsze zaburzenie przyciągania międzycząsteczkowego niż przejście ze stanu ciekłego do stanu gazowego.
Szereg innych ważnych właściwości cieczy jest bardziej podobnych do właściwości gazów. Tak więc, podobnie jak gazy, ciecze mogą przepływać - ta właściwość nazywa się płynnością. Opór przepływu zależy od lepkości. Na płynność i lepkość wpływają siły przyciągania pomiędzy cząsteczkami cieczy, ich względna masa cząsteczkowa i szereg innych czynników. Lepkość cieczy jest ~100 razy większa niż lepkość gazów. Podobnie jak gazy, ciecze mogą dyfundować, choć znacznie wolniej, ponieważ cząstki cieczy są upakowane znacznie gęstiej niż cząstki gazu.
Jedną z najważniejszych właściwości cieczy jest jej napięcie powierzchniowe(ta właściwość nie jest nieodłączna ani dla gazów, ani dla ciał stałych). Na cząsteczkę cieczy siły międzycząsteczkowe działają równomiernie ze wszystkich stron. Jednakże na powierzchni cieczy równowaga tych sił zostaje zaburzona, w wyniku czego cząsteczki „powierzchniowe” znajdują się pod wpływem pewnej siły wypadkowej skierowanej do cieczy. Z tego powodu powierzchnia cieczy znajduje się w stanie napięcia. Napięcie powierzchniowe- jest to minimalna siła, która powstrzymuje ruch cząstek cieczy w głąb cieczy, a tym samym zapobiega kurczeniu się powierzchni cieczy. To napięcie powierzchniowe wyjaśnia „kropelkowy” kształt swobodnie opadających cząstek cieczy.
W stanie ciekłym odległość między cząstkami jest znacznie mniejsza niż w stanie gazowym. Cząsteczki zajmują większość objętości, stale stykając się ze sobą i przyciągając. Obserwuje się pewne uporządkowanie cząstek (porządek krótkiego zasięgu). Cząsteczki są względem siebie ruchome.
W cieczach między cząsteczkami zachodzą oddziaływania van der Waalsa: dyspersja, orientacja i indukcja. Nazywa się małe grupy cząstek połączone pewnymi siłami klastry. W przypadku identycznych cząstek nazywane są skupiskami w cieczy współpracownicy
W cieczach tworzenie wiązań wodorowych zwiększa uporządkowanie cząstek. Wiązania wodorowe i siły van der Waalsa są jednak kruche – cząsteczki w stanie ciekłym znajdują się w ciągłym, chaotycznym ruchu, co nazywa się Ruch Browna.
Dla stanu ciekłego obowiązuje rozkład cząsteczek Maxwella-Boltzmanna ze względu na prędkość i energię.
Teoria cieczy jest znacznie mniej rozwinięta niż teoria gazów, ponieważ właściwości cieczy zależą od geometrii i polarności wzajemnie blisko położonych cząsteczek. Dodatkowo brak określonej budowy cieczy utrudnia ich sformalizowany opis – w większości podręczników cieczom poświęca się znacznie mniej miejsca niż gazom i ciałom krystalicznym.
Nie ma ostrej granicy pomiędzy cieczą i gazem – ona całkowicie zanika punkt krytyczny. Dla każdego gazu istnieje znana temperatura, powyżej której nie może on przejść w stan ciekły pod żadnym ciśnieniem; z tym krytyczny temperatury zanika granica (menisk) pomiędzy cieczą a jej nasyconą parą. Istnienie temperatury krytycznej („absolutnej temperatury wrzenia”) ustalił D.I. Mendelejew w 1860 r
Tabela 7.2 - Parametry krytyczne (t k, p k, V k) niektórych substancji
| Substancja | t k, o C | p k, atm | Vc, cm3/mol | t topić się o C | t kip o C |
| On | -267,9 | 2,26 | 57,8 | -271,4 | -268,94 |
| H 2 | -239,9 | 12,8 | 65,0 | -259,2 | -252,77 |
| N 2 2 | -147,0 | 33,54 | 90,1 | -210,01 | -195,82 |
| O 2 2 | -118,4 | 50,1 | -218,76 | -182,97 | |
| CH 4 | -82,1 | 45,8 | 99,0 | -182,49 | -161,58 |
| CO2 | +31,0 | 72,9 | 94,0 | -56,16 | -78,48(sub) |
| NH 3 | 132,3 | 111,3 | 72,5 | -77,76 | -33,43 |
| Cl2 | 144,0 | 76,1 | -101,0 | -34,06 | |
| TAK 2 | 157,5 | 77,8 | -75,48 | -10,02 | |
| H2O | 374,2 | 218,1 | 0,0 | 100,0 |
Ciśnienie pary nasyconej– ciśnienie cząstkowe, przy którym szybkości parowania i skraplania pary są równe:
gdzie A i B są stałymi.
Temperatura wrzenia– temperatura, w której ciśnienie pary nasyconej cieczy jest równe ciśnieniu atmosferycznemu.
Płyny mają płynność– zdolność do przemieszczania się pod wpływem małych sił ścinających; ciecz zajmuje objętość, w której jest umieszczona.
Nazywa się oporem płynu na płynność lepkość,[Rocznie. Z].
Napięcie powierzchniowe[J/m 2 ] – praca potrzebna do wytworzenia jednostki powierzchni.
Stan ciekłokrystaliczny– substancje w stanie ciekłym, które charakteryzują się wysokim stopniem uporządkowania, zajmują pozycję pośrednią pomiędzy kryształami a cieczą. Mają płynność, ale jednocześnie porządek dalekiego zasięgu. Na przykład pochodne kwasu brunatnego, azolityny i steroidy.
Temperatura usuwania– temperatura, w której ciekłe kryształy (LC) przechodzą w normalny stan ciekły.
7,5 Substancje stałe
W stanie stałym cząstki zbliżają się do siebie na tyle, że powstają między nimi silne wiązania, nie ma ruchu translacyjnego i pozostają wibracje wokół ich położenia. Substancje stałe mogą występować w stanie amorficznym lub krystalicznym.
7.5.1 Substancje w stanie amorficznym
W stanie amorficznym substancje nie mają uporządkowanej struktury.
szklisty stan - stały stan amorficzny substancji powstający w wyniku głębokiego przechłodzenia cieczy. Stan ten nie jest w równowadze, ale okulary mogą istnieć przez długi czas. Zmiękczanie szkła następuje w pewnym zakresie temperatur - zakresie zeszklenia, którego granice zależą od szybkości chłodzenia. Wraz ze wzrostem szybkości chłodzenia cieczy lub pary wzrasta prawdopodobieństwo otrzymania tej substancji w stanie szklistym.
Pod koniec lat 60-tych XX wieku uzyskano metale amorficzne (szkła metaliczne) - w tym celu konieczne było chłodzenie stopionego metalu z szybkością 10 6 - 10 8 st./s. Większość metali i stopów amorficznych krystalizuje po podgrzaniu powyżej 300 o C. Jednym z najważniejszych zastosowań jest mikroelektronika (bariery dyfuzyjne na granicy faz metal-półprzewodnik) i magnetyczne urządzenia magazynujące (głowice LCD). To ostatnie wynika z wyjątkowej miękkości magnetycznej (anizotropia magnetyczna jest o dwa rzędy wielkości mniejsza niż w konwencjonalnych stopach).
Substancje amorficzne izotropowy, tj. mają te same właściwości we wszystkich kierunkach.
7.5.2 Substancje w stanie krystalicznym
Solidny krystaliczny Substancje mają uporządkowaną strukturę z powtarzającymi się pierwiastkami, co pozwala na badanie ich metodą dyfrakcji promieni rentgenowskich (metoda dyfrakcji promieni rentgenowskich stosowana od 1912 r.).
Monokryształy (pojedyncze związki) charakteryzują się anizotropią - zależnością właściwości od kierunku w przestrzeni.
Regularny układ cząstek w ciele stałym jest przedstawiany jako sieć krystaliczna. Substancje krystaliczne topią się w określonej temperaturze, tzw temperatura topnienia.
Kryształy charakteryzują się energią, stałą sieciową i liczbą koordynacyjną.
Stała siatka charakteryzuje odległość pomiędzy środkami cząstek zajmujących węzły w krysztale w kierunku charakterystycznych osi.
Numer koordynacyjny zwykle nazywana liczbą cząstek bezpośrednio przylegających do danej cząstki w krysztale (patrz rysunek 7.2 – liczba koordynacyjna ósma zarówno dla cezu, jak i chloru)
Energia sieci krystalicznej to energia potrzebna do zniszczenia jednego mola kryształu i usunięcia cząstek poza granice ich oddziaływania.

Rysunek 7.2 - Struktura kryształu chlorku cezu CsCl (a) i sześciennej komórki elementarnej tego kryształu skupionej wokół ciała (b)
7.5.3 Struktury krystaliczne
Najmniejszą jednostką strukturalną kryształu, która wyraża wszystkie właściwości jego symetrii, jest komórka elementarna. Kiedy komórki powtarza się wielokrotnie w trzech wymiarach, otrzymuje się sieć krystaliczną.
Istnieje siedem podstawowych komórek: sześcienna, czworościenna, sześciokątna, romboedryczna, orto-romboedryczna, jednoskośna i trójskośna. Istnieje siedem pochodnych podstawowych komórek elementarnych, na przykład centrowana na ciele, sześcienna centrowana na ścianie.

a - komórka elementarna kryształu NaCl; b - gęste, sześcienne upakowanie NaCl skupione na ścianie; c – sześcienne upakowanie kryształu CsCl centrowane na ciele Rysunek 7.3 – Komórka elementarna
Substancje izomorficzne– substancje o podobnym charakterze chemicznym, które tworzą identyczne struktury krystaliczne: CaSiO 4 i MgSiO 4
Wielopostaciowość– związki występujące w dwóch lub więcej strukturach krystalicznych, np. SiO2 (w postaci sześciokątnego kwarcu, rombowego trydymitu i sześciennego krystobalitu).
Modyfikacje alotropowe– polimorficzne modyfikacje prostych substancji, np. węgla: diamentu, grafitu, karbinu, fulerenu.
Ze względu na charakter cząstek w węzłach sieci krystalicznej i wiązania chemiczne między nimi kryształy dzielą się na:
1) molekularny– w węzłach znajdują się cząsteczki, pomiędzy którymi działają niskoenergetyczne siły van der Waalsa: kryształki lodu;
2) atomowo– kryształy kowalencyjne– w węzłach kryształów znajdują się atomy, które tworzą ze sobą silne wiązania kowalencyjne i mają wysoką energię sieci, np. diament (węgiel);
3) kryształy jonowe– jednostkami strukturalnymi kryształów tego typu są jony naładowane dodatnio i ujemnie, pomiędzy którymi zachodzi oddziaływanie elektryczne, charakteryzujące się dość dużą energią, np. NaCL, KCL;
4) kryształy metalu– substancje charakteryzujące się wysoką przewodnością elektryczną, przewodnością cieplną, ciągliwością, ciągliwością, połyskiem metalicznym i wysokim współczynnikiem odbicia światła; wiązanie w kryształach jest metaliczne, energia wiązania metalicznego jest pośrednia między energiami kryształów kowalencyjnych i molekularnych;
5) kryształy o wiązaniu mieszanym– istnieją złożone interakcje pomiędzy cząstkami, które można opisać poprzez superpozycję dwóch lub więcej rodzajów wiązań na sobie, na przykład klatraty (w tym związki) – powstające w wyniku włączenia cząsteczek (gości) do wnęk struktury krystalicznej składającej się cząstek innego rodzaju (gospodarzy): klatraty gazowe CH 4 . 6H 2 O, klatraty mocznika.
W przyrodzie woda występuje w trzech stanach:
- stan stały (śnieg, grad, lód);
- stan ciekły (woda, mgła, rosa i deszcz);
- stan gazowy (para).
Już od najmłodszych lat, już w szkole, badają różne stany fizyczne wody: mgłę, opady deszczu, grad, śnieg, lód itp. Jest taki, który jest szczegółowo studiowany w szkole. Spotykają nas każdego dnia i wpływają na nasze życie. – jest to stan wody o określonej temperaturze i ciśnieniu, który charakteryzuje się w określonym przedziale.
Należy wyjaśnić podstawowe pojęcia stanu wody, że stan mgły i stan zachmurzenia nie odnoszą się do tworzenia się gazu. Pojawiają się podczas kondensacji. Jest to wyjątkowa właściwość wody, która może znajdować się w trzech różnych stanach skupienia. Trzy stany wody są niezbędne dla planety; tworzą one cykl hydrologiczny i zapewniają proces obiegu wody w przyrodzie. W szkole pokazują różne eksperymenty dotyczące parowania i. W każdym zakątku natury woda jest uważana za źródło życia. Jest jeszcze czwarty stan, nie mniej ważny – woda Deryagin (wersja rosyjska) lub jak to się obecnie powszechnie nazywa – woda nanorurkowa (wersja amerykańska).
Stan stały wody
Kształt i objętość zostają zachowane. W niskich temperaturach substancja zamarza i zamienia się w ciało stałe. Jeśli ciśnienie jest wysokie, wymagana jest wyższa temperatura krzepnięcia. Ciało stałe może być krystaliczne lub amorficzne. W krysztale położenie atomu jest ściśle uporządkowane. Kształty kryształów są naturalne i przypominają wielościan. W ciele amorficznym punkty są rozmieszczone chaotycznie i oscylują; zachowany jest w nich jedynie porządek bliskiego zasięgu.
Stan ciekły wody
W stanie ciekłym woda zachowuje swoją objętość, ale nie zachowuje swojego kształtu. Rozumiemy przez to, że ciecz zajmuje tylko część objętości i może przepływać po całej powierzchni. Studiując w szkole zagadnienia stanu ciekłego należy pamiętać, że jest to stan pośredni pomiędzy ośrodkiem stałym a gazowym. Ciecze dzielą się na stany czyste i mieszaniny. Niektóre mieszaniny są bardzo ważne dla życia, jak na przykład krew lub woda morska. Ciecze mogą działać jak rozpuszczalniki.
Stan gazu
Kształt i objętość nie są zachowane. Inaczej stan gazowy, którego uczy się w szkole, nazywa się parą wodną. Doświadczenia wyraźnie pokazują, że para jest niewidoczna, rozpuszcza się w powietrzu i wykazuje wilgotność względną. Rozpuszczalność zależy od temperatury i ciśnienia. Para nasycona i punkt rosy są wskaźnikami maksymalnego stężenia. Para i mgła to różne stany skupienia.
Czwartym stanem agregacji jest plazma
Badanie plazmy i nowoczesne eksperymenty zaczęto rozważać nieco później. Plazma jest gazem całkowicie lub częściowo zjonizowanym, występuje w stanie równowagi w wysokiej temperaturze. W warunkach gruntowych powstaje wyładowanie gazowe. Właściwości plazmy determinują jej stan gazowy, z tym że elektrodynamika odgrywa w tym wszystkim ogromną rolę. Spośród stanów skupionych najpowszechniejszą we Wszechświecie jest plazma. Badanie gwiazd i przestrzeni międzyplanetarnej wykazało, że substancje znajdują się w stanie plazmy.
Jak zmieniają się stany skupienia?
Zmiana procesu przejścia z jednego stanu do drugiego:
- ciecz - para (parowanie i gotowanie);
- para - ciecz (kondensacja);
- ciecz - lód (krystalizacja);
- lód - ciecz (topnienie);
- lód - para (sublimacja);
- para - lód, powstawanie szronu (desublimacja).
 Wodę nazwano interesującym naturalnym minerałem ziemnym. Pytania te są złożone i wymagają ciągłych badań. Stan fizyczny w szkole potwierdzają przeprowadzone eksperymenty, a jeśli pojawiają się pytania, eksperymenty wyraźnie pozwalają zrozumieć materiał nauczany na lekcji. Po odparowaniu ciecz zamienia się w proces można rozpocząć od zera stopni. Wraz ze wzrostem temperatury wzrasta. Intensywność tego potwierdzają eksperymenty z gotowaniem w temperaturze 100 stopni. Na pytania dotyczące parowania odpowiada parowanie z powierzchni jezior, rzek, a nawet z lądu. Po ochłodzeniu następuje odwrotny proces przemiany, gdy z gazu tworzy się ciecz. Proces ten nazywa się kondensacją, gdy z pary wodnej zawartej w powietrzu tworzą się małe kropelki chmur.
Wodę nazwano interesującym naturalnym minerałem ziemnym. Pytania te są złożone i wymagają ciągłych badań. Stan fizyczny w szkole potwierdzają przeprowadzone eksperymenty, a jeśli pojawiają się pytania, eksperymenty wyraźnie pozwalają zrozumieć materiał nauczany na lekcji. Po odparowaniu ciecz zamienia się w proces można rozpocząć od zera stopni. Wraz ze wzrostem temperatury wzrasta. Intensywność tego potwierdzają eksperymenty z gotowaniem w temperaturze 100 stopni. Na pytania dotyczące parowania odpowiada parowanie z powierzchni jezior, rzek, a nawet z lądu. Po ochłodzeniu następuje odwrotny proces przemiany, gdy z gazu tworzy się ciecz. Proces ten nazywa się kondensacją, gdy z pary wodnej zawartej w powietrzu tworzą się małe kropelki chmur.
Uderzającym przykładem jest termometr rtęciowy, w którym rtęć występuje w stanie ciekłym w temperaturze -39 stopni rtęć staje się ciałem stałym; Można zmienić stan ciała stałego, ale będzie to wymagało dodatkowego wysiłku, np. przy zginaniu gwoździa. Często uczniowie zadają pytania dotyczące tego, w jaki sposób nadawany jest kształt ciału stałemu. Odbywa się to w fabrykach i specjalistycznych warsztatach przy użyciu specjalnego sprzętu. Absolutnie każda substancja może występować w trzech stanach, w tym w wodzie, zależy to od warunków fizycznych. Kiedy woda przechodzi z jednego stanu do drugiego, zmienia się układ i ruch cząsteczek, ale skład cząsteczki się nie zmienia. Zadania eksperymentalne pomogą Ci zaobserwować takie interesujące stany.