Zapisy informacyjne i metodyczne usprawniające zarządzanie działalnością innowacyjną. Doskonalenie zarządzania działalnością innowacyjną organizacji. organizacyjnym i ekonomicznym - zawiera zagadnienia związane z planowaniem zatrudnienia oraz
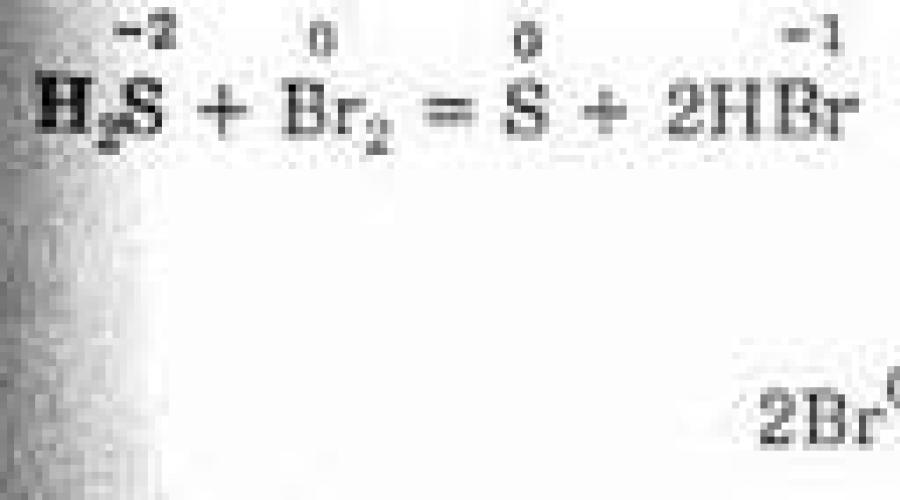
Przeczytaj także
Fluor może być tylko środkiem utleniającym, co można łatwo wytłumaczyć jego pozycją w układzie okresowym pierwiastków chemicznych D.I. Mendelejewa. Jest najsilniejszym środkiem utleniającym, utleniającym nawet niektóre gazy szlachetne:
2F 2 +Xe=XeF 4
Należy wyjaśnić wysoką aktywność chemiczną fluoru
Ale zniszczenie cząsteczki fluoru wymaga znacznie mniej energii niż jest uwalniane podczas tworzenia nowych wiązań.
Tak więc, ze względu na mały promień atomu fluoru, niewspólne pary elektronowe w cząsteczce fluoru zderzają się i osłabiają.
Halogeny oddziałują z prawie wszystkimi prostymi substancjami.
1. Reakcja z metalami przebiega najintensywniej. Po podgrzaniu fluor oddziałuje ze wszystkimi metalami (w tym złotem i platyną); na zimno reaguje z metalami alkalicznymi, ołowiem, żelazem. W przypadku miedzi, niklu reakcja nie przebiega na zimno, ponieważ na powierzchni metalu tworzy się ochronna warstwa fluoru, która chroni metal przed dalszym utlenianiem.
Chlor reaguje energicznie z metalami alkalicznymi, a z miedzią, żelazem i cyną reakcja przebiega po podgrzaniu. Podobnie zachowują się brom i jod.
Oddziaływanie halogenów z metalami jest procesem egzotermicznym i można je wyrazić równaniem:
2M + nHaI 2 \u003d 2MHaI DH<0
Halogenki metali są typowymi solami.
Halogeny w tej reakcji wykazują silne właściwości utleniające. W tym przypadku atomy metali oddają elektrony, a atomy halogenów otrzymują np.:
2. W normalnych warunkach fluor reaguje z wodorem w ciemności w wyniku eksplozji. Oddziaływanie chloru z wodorem zachodzi w jasnym świetle słonecznym.
Brom i wodór oddziałują tylko po podgrzaniu, a jod i wodór reagują po silnym podgrzaniu (do 350°C), ale proces ten jest odwracalny.
H2 + Cl2 \u003d 2HCl H2 + Br2 \u003d 2HBr
H 2 + I 2 "350 ° 2HI
Halogen w tej reakcji jest środkiem utleniającym.
Badania wykazały, że reakcja oddziaływania wodoru z chlorem w świetle ma następujący mechanizm.
Cząsteczka Cl 2 pochłania kwant światła hv i rozkłada się na nieorganiczne rodniki Cl . . Służy to jako początek reakcji (początkowe wzbudzenie reakcji). Następnie kontynuuje samoistnie. Rodnik chloru Cl. reaguje z cząsteczką wodoru. W tym przypadku powstaje rodnik wodorowy H. i HCl. Z kolei rodnik wodorowy H. reaguje z cząsteczką Cl 2 tworząc Hcl i Cl. itp.
Cl2+hv=Cl. +Kl.
kl. + H 2 \u003d Hcl + H.
N. + Cl 2 \u003d Hcl + C1.
Początkowe wzbudzenie spowodowało ciąg następujących po sobie reakcji. Takie reakcje nazywane są reakcjami łańcuchowymi. Rezultatem jest chlorowodór.
3. Halogeny nie oddziałują bezpośrednio z tlenem i azotem.
4. Halogeny dobrze reagują z innymi niemetalami, np.:
2P + 3Cl 2 \u003d 2PCl 3 2P + 5Cl 2 \u003d 2PCl 5 Si + 2F 2 \u003d SiF 4
Halogeny (z wyjątkiem fluoru) nie reagują z gazami obojętnymi. Aktywność chemiczna bromu i jodu w stosunku do niemetali jest mniej wyraźna niż fluoru i chloru.
We wszystkich powyższych reakcjach halogeny wykazują właściwości utleniające.
Oddziaływanie halogenów z substancjami złożonymi. 5. Z wodą.
Fluor reaguje wybuchowo z wodą, tworząc tlen atomowy:
H 2 O + F 2 \u003d 2HF + O
Pozostałe halogeny reagują z wodą według następującego schematu:
Gal 0 2 + H 2 O "NGal -1 + NGal +1 O
Ta reakcja jest reakcją dysproporcjonowania, gdy halogen jest zarówno środkiem redukującym, jak i utleniającym, na przykład:
Cl2 + H2O „HCl + HClO
Cl 2 + H 2 O "H + + Cl - + HClO
Сl°+1e - ®Сl - Cl°-1e - ®Сl +
gdzie HCl jest mocnym kwasem chlorowodorowym; HClO - słaby kwas podchlorawy
6. Halogeny są w stanie pobierać wodór z innych substancji, terpentyna + C1 2 = HC1 + węgiel

Chlor zastępuje wodór w węglowodorach nasyconych: CH 4 + Cl 2 \u003d CH 3 Cl + HCl
i łączy związki nienasycone:
C 2 H 4 + Cl 2 \u003d C 2 H 4 Cl 2
7. Reaktywność halogenów spada w serii F-Cl - Br - I. W związku z tym poprzedni pierwiastek wypiera następny z kwasów typu NG (G - halogen) i ich soli. W tym przypadku aktywność spada: F 2 > Cl 2 > Br 2 > I 2

Podanie
Chlor służy do dezynfekcji wody pitnej, wybielania tkanin i masy papierniczej. Duże jego ilości zużywane są do produkcji kwasu solnego, wybielacza itp. Fluor znalazł szerokie zastosowanie w syntezie materiałów polimerowych - fluoroplasty, które mają wysoką odporność chemiczną, a także jako utleniacz paliwa rakietowego. Niektóre związki fluoru są wykorzystywane w medycynie. Brom i jod są silnymi utleniaczami i są wykorzystywane w różnych syntezach i analizach substancji.
Do produkcji leków wykorzystywane są duże ilości bromu i jodu.
Halogenowodory
Związki halogenów z wodorem HX, gdzie X oznacza dowolny halogen, nazywane są halogenowodorami. Ze względu na dużą elektroujemność halogenów wiążąca para elektronów jest przesunięta w ich kierunku, przez co cząsteczki tych związków są polarne.
Halogenki wodoru to bezbarwne gazy o ostrym zapachu, łatwo rozpuszczalne w wodzie. W temperaturze 0°C rozpuścić 500 objętości HCl, 600 objętości HBr i 450 objętości HI w 1 objętości wody. Fluorowodór jest mieszalny z wodą w dowolnym stosunku. Wysoka rozpuszczalność tych związków w wodzie umożliwia otrzymanie koncentratu
Tabela 16. Stopnie dysocjacji kwasów halogenowodorowych
roztwory do kąpieli. Po rozpuszczeniu w wodzie halogenki wodoru dysocjują jako kwasy. HF należy do słabo zdysocjowanych związków, co tłumaczy się szczególną siłą wiązania w chłodzie. Pozostałe roztwory halogenków wodoru należą do mocnych kwasów.
HF - kwas fluorowodorowy (fluorowodorowy) HC1 - kwas solny (chlorowodorowy) HBr - kwas bromowodorowy HI - kwas jodowodorowy
Wzrasta siła kwasów w serii HF – HCl – HBr – HI, co tłumaczy się spadkiem w tym samym kierunku energii wiązania i wzrostem odległości międzyjądrowej. HI jest najsilniejszym kwasem spośród kwasów halogenowodorowych (patrz Tabela 16).
![]()
Polaryzowalność wzrasta ze względu na polaryzację wody
więcej jest połączenie, którego długość jest dłuższa. Sole kwasów halogenowodorowych mają odpowiednio następujące nazwy: fluorki, chlorki, bromki, jodki.
Właściwości chemiczne kwasów halogenowodorowych
W postaci suchej halogenki wodoru nie działają na większość metali.
1. Wodne roztwory halogenków wodoru mają właściwości kwasów beztlenowych. Energicznie oddziałują z wieloma metalami, ich tlenkami i wodorotlenkami; metale znajdujące się w elektrochemicznej serii napięć metali po wodorze nie są naruszone. Wejdź w interakcję z niektórymi solami i gazami.

Kwas fluorowodorowy niszczy szkło i krzemiany:
SiO 2 + 4HF \u003d SiF 4 + 2H 2 O
Dlatego nie można go przechowywać w szklanych naczyniach.
2. W reakcjach redoks kwasy halogenowodorowe zachowują się jak reduktory, a aktywność redukująca w szeregu Cl - , Br - , I - wzrasta.

Paragon fiskalny
Fluorowodór powstaje w wyniku działania stężonego kwasu siarkowego na fluoryt:
CaF 2 + H 2 SO 4 \u003d CaSO 4 + 2HF
Chlorowodór otrzymuje się przez bezpośrednie oddziaływanie wodoru z chlorem:
H2 + Cl2 \u003d 2HCl
To syntetyczny sposób na zdobycie.
Metoda siarczanowa oparta jest na reakcji koncentratu
kwas siarkowy z NaCl.
Przy niewielkim ogrzewaniu reakcja przebiega z utworzeniem HCl i NaHSO4.
NaCl + H 2 SO 4 \u003d NaHSO 4 + HCl
W wyższej temperaturze przebiega drugi etap reakcji:
NaCl + NaHSO 4 \u003d Na 2 SO 4 + HCl
Ale HBr i HI nie można uzyskać w podobny sposób, ponieważ ich związki z metalami podczas interakcji z koncentracją
utleniony kwasem siarkowym, ponieważ. I - i Br - są silnymi środkami redukującymi.
2NaBr -1 + 2H 2 S +6 O 4 (k) \u003dBr 0 2 + S +4 O 2 + Na2SO4 + 2H2O
![]()
Bromowodór i jodowodór otrzymuje się przez hydrolizę PBr 3 i PI 3: PBr 3 + 3H 2 O \u003d 3HBr + H 3 PO 3 PI 3 + 3H 2 O \u003d 3HI + H 3 PO 3
Halogenki
Halogenki metali są typowymi solami. Charakteryzują się wiązaniem jonowym, w którym jony metali mają ładunek dodatni, a jony halogenowe mają ładunek ujemny. Mają sieć krystaliczną.
Zdolność redukująca halogenków wzrasta w seriach Cl - , Br - , I - (patrz § 2.2).
W serii AgCl - AgBr - AgI rozpuszczalność słabo rozpuszczalnych soli spada; przeciwnie, sól AgF jest wysoce rozpuszczalna w wodzie. Większość soli kwasów halogenowodorowych jest dobrze rozpuszczalna w wodzie.
DEFINICJA
Halogeny- pierwiastki z grupy VIIA - fluor (F), chlor (Cl), brom (Br) i jod (I).
Elektroniczna konfiguracja poziomu energii zewnętrznej halogenów ns 2 np 5 . Ponieważ przed zakończeniem poziomu energetycznego halogenom brakuje tylko jednego elektronu, w OVR najczęściej wykazują one właściwości utleniaczy. Stany utlenienia halogenu: od „-1” do „+7”. Jedyny pierwiastek z grupy halogenów - fluor - wykazuje tylko jeden stopień utlenienia „-1” i jest pierwiastkiem najbardziej elektroujemnym.
Cząsteczki halogenowe są dwuatomowe: F 2 , Cl 2 , Br 2 , I 2 . Wraz ze wzrostem ładunku jądra atomu pierwiastka chemicznego, tj. przy przejściu z fluoru na jod zmniejsza się zdolność utleniania halogenów, co potwierdza zdolność do wypierania niższych halogenów przez wyższe z kwasów halogenowodorowych i ich soli:
Br 2 + 2HI \u003d I 2 + 2HBr
Cl2 + 2KBr = Br2 + 2KCl
Właściwości fizyczne halogenów
Pod nr. Fluor to jasnożółty gaz o ostrym zapachu. Trujący. Chlor jest jasnozielonym gazem, podobnie jak fluor, ma ostry zapach. Silnie trujący. Przy podwyższonym ciśnieniu i temperaturze pokojowej łatwo przechodzi w stan ciekły. Brom to ciężka, czerwono-brązowa ciecz o charakterystycznym nieprzyjemnym, ostrym zapachu. Ciekły brom, jak również jego opary, są wysoce toksyczne. Brom jest słabo rozpuszczalny w wodzie i dobrze w rozpuszczalnikach niepolarnych. Jod jest ciemnoszarym ciałem stałym o metalicznym połysku. Opary jodu mają kolor fioletowy. Jod łatwo sublimuje, tj. przechodzi w stan gazowy ze stałego, z pominięciem stanu ciekłego.
Pozyskiwanie halogenów
Halogeny można otrzymać przez elektrolizę roztworów lub stopów halogenków:
MgCl2 \u003d Mg + Cl2 (stopiony)
Najczęściej halogeny otrzymuje się w reakcji utleniania kwasów halogenowodorowych:
MnO2 + 4HCl \u003d MnCl2 + Cl2 + 2H2O
K 2 Cr 2 O 7 + 14HCl \u003d 3Cl2 + 2KCl + 2CrCl3 + 7H2O
2KMnO4 + 16HCl \u003d 2MnCl2 + 5Cl2 + 8H2O + 2KCl
Właściwości chemiczne halogenów
Fluor ma najwyższą aktywność chemiczną. Większość pierwiastków chemicznych, nawet w temperaturze pokojowej, oddziałuje z fluorem, uwalniając dużą ilość ciepła. Nawet woda pali się w fluorze:
2H 2 O + 2F 2 \u003d 4HF + O 2
Wolny chlor jest mniej reaktywny niż fluor. Nie reaguje bezpośrednio z tlenem, azotem i gazami szlachetnymi. Współdziała ze wszystkimi innymi substancjami, takimi jak fluor:
2Fe + Cl2 = 2FeCl3
2P + 5Cl2 = 2PCl 5
Kiedy chlor wchodzi w interakcję z wodą na zimno, zachodzi reakcja odwracalna:
Cl2 + H2O↔HCl + HClO
Mieszanina będąca produktami reakcji nazywana jest wodą chlorową.
Gdy chlor wchodzi w interakcję z zasadami na zimno, powstają mieszaniny chlorków i podchlorynów:
Cl 2 + Ca (OH) 2 \u003d Ca (Cl) OCl + H 2 O
Po rozpuszczeniu chloru w gorącym roztworze alkalicznym zachodzi następująca reakcja:
3Cl2 + 6KOH \u003d 5KCl + KClO3 + 3H2O
Brom podobnie jak chlor rozpuszcza się w wodzie i częściowo reagując z nią tworzy tzw. „wodę bromową”, natomiast jod jest w wodzie praktycznie nierozpuszczalny.
Jod różni się znacznie aktywnością chemiczną od innych halogenów. Nie reaguje z większością niemetali i reaguje powoli z metalami dopiero po podgrzaniu. Oddziaływanie jodu z wodorem zachodzi tylko przy silnym ogrzewaniu, reakcja jest endotermiczna i wysoce odwracalna:
H 2 + I 2 \u003d 2HI - 53 kJ.
Przykłady rozwiązywania problemów
PRZYKŁAD 1
| Ćwiczenie | Oblicz objętość chloru (n.a.), który przereagował z jodkiem potasu, jeśli jod powstał z masą 508 g | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Decyzja | Napiszmy równanie reakcji: Cl 2 + 2KI \u003d I 2 + 2KCl Znajdź ilość substancji utworzonej jod: v(I 2)=m(I 2)/M(I 2) v (I 2) \u003d 508/254 \u003d 2 mol Zgodnie z równaniem reakcji ilość substancji chloru. Atom wodoru ma wzór elektroniczny zewnętrznego (i jedynego) poziomu elektronowego 1 s jeden . Z jednej strony, dzięki obecności jednego elektronu na zewnętrznym poziomie elektronowym, atom wodoru jest podobny do atomów metali alkalicznych. Jednak, podobnie jak halogenom, brakuje tylko jednego elektronu do wypełnienia zewnętrznego poziomu elektronicznego, ponieważ na pierwszym poziomie elektronicznym mogą znajdować się nie więcej niż 2 elektrony. Okazuje się, że wodór można umieścić jednocześnie zarówno w pierwszej, jak i przedostatniej (siódmej) grupie układu okresowego, co czasami odbywa się w różnych wersjach układu okresowego: Z punktu widzenia właściwości wodoru jako prostej substancji ma on jednak więcej wspólnego z halogenami. Wodór, podobnie jak halogeny, jest niemetalem i podobnie do nich tworzy cząsteczki dwuatomowe (H2). W normalnych warunkach wodór jest substancją gazową, nieaktywną. Niską aktywność wodoru tłumaczy się dużą siłą wiązania między atomami wodoru w cząsteczce, co wymaga albo mocnego ogrzewania, albo użycia katalizatorów, albo obu jednocześnie, aby je rozerwać. Oddziaływanie wodoru z prostymi substancjamiz metalamiSpośród metali wodór reaguje tylko z alkaliami i ziemiami alkalicznymi! Metale alkaliczne obejmują metale z głównej podgrupy grupy I (Li, Na, K, Rb, Cs, Fr), a metale ziem alkalicznych to metale z głównej podgrupy grupy II, z wyjątkiem berylu i magnezu (Ca, Sr, Ba , Ra) W interakcji z metalami aktywnymi wodór wykazuje właściwości utleniające, tj. obniża jego stopień utlenienia. W tym przypadku powstają wodorki metali alkalicznych i metali ziem alkalicznych, które mają strukturę jonową. Reakcja przebiega po podgrzaniu: Należy zauważyć, że oddziaływanie z metalami aktywnymi jest jedynym przypadkiem, w którym wodór cząsteczkowy H2 jest czynnikiem utleniającym. z niemetalamiZ niemetali wodór reaguje tylko z węglem, azotem, tlenem, siarką, selenem i halogenami! Węgiel należy rozumieć jako grafit lub węgiel amorficzny, ponieważ diament jest niezwykle obojętną alotropową modyfikacją węgla. Podczas interakcji z niemetalami wodór może pełnić jedynie funkcję środka redukującego, to znaczy może jedynie zwiększać swój stopień utlenienia: Oddziaływanie wodoru z substancjami złożonymiz tlenkami metaliWodór nie reaguje z tlenkami metali, które są w szeregu metali do aluminium (włącznie), jednak po podgrzaniu jest w stanie zredukować wiele tlenków metali na prawo od aluminium: z tlenkami niemetaliSpośród tlenków niemetali wodór po podgrzaniu reaguje z tlenkami azotu, halogenów i węgla. Spośród wszystkich oddziaływań wodoru z tlenkami niemetali na szczególną uwagę zasługuje jego reakcja z tlenkiem węgla CO. Mieszanina CO i H 2 ma nawet swoją nazwę - „gaz syntezowy”, ponieważ w zależności od warunków można z niej otrzymać tak poszukiwane produkty przemysłowe, jak metanol, formaldehyd, a nawet syntetyczne węglowodory: z kwasamiWodór nie reaguje z kwasami nieorganicznymi! Spośród kwasów organicznych wodór reaguje tylko z kwasami nienasyconymi, a także z kwasami zawierającymi grupy funkcyjne, które można redukować wodorem, w szczególności grupy aldehydowe, ketonowe lub nitrowe. z solamiW przypadku wodnych roztworów soli nie zachodzi ich oddziaływanie z wodorem. Jednak po przepuszczeniu wodoru przez stałe sole niektórych metali o średniej i niskiej aktywności możliwa jest ich częściowa lub całkowita redukcja, np.: Właściwości chemiczne halogenówHalogeny to pierwiastki chemiczne z grupy VIIA (F, Cl, Br, I, At), a także proste substancje, które tworzą. W dalszej części, o ile nie zaznaczono inaczej, halogeny będą rozumiane jako proste substancje. Wszystkie halogeny mają budowę cząsteczkową, co prowadzi do niskich temperatur topnienia i wrzenia tych substancji. Cząsteczki halogenowe są dwuatomowe, tj. ich wzór można zapisać w postaci ogólnej jako Hal 2 . Należy zauważyć tak specyficzną fizyczną właściwość jodu, jak jego zdolność do: sublimacja czyli innymi słowy sublimacja. sublimacja, nazywają zjawisko, w którym substancja w stanie stałym nie topi się po podgrzaniu, ale omijając fazę ciekłą, natychmiast przechodzi w stan gazowy. Struktura elektronowa zewnętrznego poziomu energii atomu dowolnego halogenu ma postać ns 2 np 5, gdzie n jest numerem okresu układu okresowego, w którym znajduje się halogen. Jak widać, w ośmioelektronowej zewnętrznej powłoce atomów halogenu brakuje tylko jednego elektronu. Z tego logiczne jest założenie, że wolne halogeny mają głównie właściwości utleniające, co również znajduje potwierdzenie w praktyce. Jak wiadomo, elektroujemność niemetali zmniejsza się wraz z przechodzeniem w dół podgrupy, a zatem aktywność halogenów zmniejsza się w serii: F 2 > Cl 2 > Br 2 > I 2 Oddziaływanie halogenów z prostymi substancjamiWszystkie halogeny są wysoce reaktywne i reagują z najprostszymi substancjami. Należy jednak zauważyć, że fluor, ze względu na swoją niezwykle wysoką reaktywność, może reagować nawet z tymi prostymi substancjami, z którymi inne halogeny nie mogą reagować. Do takich prostych substancji należą tlen, węgiel (diament), azot, platyna, złoto oraz niektóre gazy szlachetne (ksenon i krypton). Tych. faktycznie, fluor nie reaguje tylko z niektórymi gazami szlachetnymi. Pozostałe halogeny, tj. chlor, brom i jod są również substancjami czynnymi, ale mniej aktywnymi niż fluor. Reagują z prawie wszystkimi prostymi substancjami z wyjątkiem tlenu, azotu, węgla w postaci diamentu, platyny, złota i gazów szlachetnych. Oddziaływanie halogenów z niemetalamiwodórWszystkie halogeny reagują z wodorem, tworząc halogenki wodoru o ogólnym wzorze HHal. Jednocześnie reakcja fluoru z wodorem zaczyna się samoistnie nawet w ciemności i przebiega z wybuchem zgodnie z równaniem: Reakcja chloru z wodorem może być inicjowana przez intensywne promieniowanie ultrafioletowe lub ogrzewanie. Przecieka również z wybuchem: Brom i jod reagują z wodorem dopiero po podgrzaniu, a jednocześnie reakcja z jodem jest odwracalna: fosforOddziaływanie fluoru z fosforem prowadzi do utlenienia fosforu do najwyższego stopnia utlenienia (+5). W takim przypadku następuje tworzenie pięciofluorku fosforu: W przypadku interakcji chloru i bromu z fosforem możliwe jest otrzymanie halogenków fosforu zarówno na stopniu utlenienia +3, jak i na stopniu utlenienia +5, co zależy od proporcji reagentów: W przypadku fosforu białego w atmosferze fluoru, chloru lub ciekłego bromu reakcja rozpoczyna się samoistnie. Oddziaływanie fosforu z jodem może prowadzić do powstania tylko trójjodku fosforu ze względu na znacznie niższą zdolność utleniania niż inne halogeny: szaryFluor utlenia siarkę do najwyższego stopnia utlenienia +6, tworząc sześciofluorek siarki: Chlor i brom reagują z siarką, tworząc związki zawierające siarkę na niezwykle nietypowych dla niej stopniach utlenienia +1 i +2. Te interakcje są bardzo specyficzne i aby zdać egzamin z chemii, umiejętność zapisywania równań tych interakcji nie jest konieczna. W związku z tym jako wskazówkę podano trzy równania: Oddziaływanie halogenów z metalamiJak wspomniano powyżej, fluor może reagować ze wszystkimi metalami, nawet tak nieaktywnymi jak platyna i złoto: Pozostałe halogeny reagują ze wszystkimi metalami z wyjątkiem platyny i złota: Reakcje halogenów z substancjami złożonymiReakcje podstawienia z halogenamiBardziej aktywne halogeny, tj. których pierwiastki chemiczne znajdują się wyżej w układzie okresowym, są w stanie wyprzeć mniej aktywne halogeny z tworzonych przez nie kwasów halogenowodorowych i halogenków metali: Podobnie brom i jod wypierają siarkę z roztworów siarczków i/lub siarkowodoru: Chlor jest silniejszym środkiem utleniającym i utlenia siarkowodór w swoim roztworze wodnym nie do siarki, ale do kwasu siarkowego: Oddziaływanie halogenów z wodąWoda pali się we fluorze niebieskim płomieniem zgodnie z równaniem reakcji: Brom i chlor inaczej reagują z wodą niż fluor. Jeśli fluor działał jako środek utleniający, to chlor i brom w wodzie ulegają dysproporcjonowaniu, tworząc mieszaninę kwasów. W tym przypadku reakcje są odwracalne: Oddziaływanie jodu z wodą postępuje w tak nieznacznym stopniu, że można je pominąć i uznać, że reakcja w ogóle nie zachodzi. Oddziaływanie halogenów z roztworami alkalicznymiFluor w interakcji z wodnym roztworem zasady ponownie działa jako środek utleniający: Umiejętność zapisania tego równania nie jest wymagana do zdania egzaminu. Wystarczy wiedzieć o możliwości takiego oddziaływania i utleniającej roli fluoru w tej reakcji. W przeciwieństwie do fluoru, pozostałe halogeny są nieproporcjonalne w roztworach alkalicznych, to znaczy jednocześnie zwiększają i zmniejszają swój stopień utlenienia. Jednocześnie w przypadku chloru i bromu w zależności od temperatury możliwy jest przepływ w dwóch różnych kierunkach. W szczególności na mrozie reakcje przebiegają w następujący sposób: a po podgrzaniu: Jod reaguje z alkaliami wyłącznie zgodnie z drugą opcją, tj. z powstawaniem jodanu, ponieważ hypojodyt jest niestabilny nie tylko po podgrzaniu, ale także w zwykłych temperaturach, a nawet na mrozie. Chemia pierwiastków Niemetale z podgrupy VIIA Elementy podgrupy VIIA są typowymi niemetalami o wysokim elektroujemność, mają nazwę grupy - „halogeny”. Kluczowe zagadnienia poruszone w wykładzie Ogólna charakterystyka niemetali z podgrupy VIIA. Struktura elektronowa, najważniejsze cechy atomów. Najbardziej charakterystyczny pianka utleniająca. Cechy chemii halogenów. proste substancje. związki naturalne. Związki halogenowe Kwasy chlorowcowodorowe i ich sole. Sól i kwas fluorowodorowy sloty, przyjmowanie i aplikowanie. kompleksy halogenkowe. Binarne związki tlenowe halogenów. Niestabilność ok- Właściwości redoks substancji prostych i ko- jedności. Reakcje dysproporcji. Diagramy Latimerów.
Chemia elementów podgrupy VIIA ogólna charakterystyka
Grupę VIIA tworzą pierwiastki p: fluor F, chlor Cl, brom Br, jod I i astat At. Ogólny wzór na elektrony walencyjne to ns 2 np 5. Wszystkie elementy grupy VIIA są typowymi niemetalami.
utworzyć stabilny ośmioelektronowy lochki, więc mają silna tendencja do dodanie elektronu. Wszystkie elementy łatwo tworzą proste, jednorazowo ładowane nye aniony Г – . W postaci anionów prostych pierwiastki z grupy VIIA występują w wodzie naturalnej oraz w kryształach soli naturalnych np. halitu NaCl, sylwinu KCl, fluorytu CaF2. Wspólna nazwa grupy pierwiastków VIIA- grupy „halogeny”, czyli „rodzące sole”, ze względu na fakt, że większość ich związków z metalami jest przed- jest typową solą (CaF2, NaCl, MgBr2, KI), która które można uzyskać poprzez bezpośrednie wzajemne oddziaływanie metalu z halogenem. Wolne halogeny otrzymuje się z naturalnych soli, więc nazwa „halogeny” jest również tłumaczona jako „zrodzone z soli”.
Minimalny stopień utlenienia (–1) jest najbardziej stabilny wszystkie halogeny. Niektóre cechy atomów pierwiastków grupy VIIA podano w Najważniejsze cechy atomów pierwiastków z grupy VIIA
Halogeny mają wysokie powinowactwo do elektronów (maksymalnie dla Cl) i bardzo wysoka energia jonizacji (maksymalna dla F) i maksymalna możliwa elektroujemność w każdym z okresów. Najwięcej jest fluoru elektroujemny wszystkich pierwiastków chemicznych. Obecność jednego niesparowanego elektronu w atomach halogenu powoduje prowadzi do połączenia atomów w prostych substancjach w cząsteczki dwuatomowe Г2. W przypadku prostych substancji halogenowych najbardziej charakterystyczne są środki utleniające. właściwości, które są najsilniejsze dla F2 i słabną po przejściu do I2. Halogeny charakteryzują się największą reaktywnością spośród wszystkich pierwiastków niemetalicznych. Fluor, nawet wśród halogenów, jest izolowany jest niezwykle aktywny. Najsilniej od pozostałych różni się pierwiastek drugiego okresu, czyli fluor. niektóre elementy podgrupy. Jest to ogólny wzór dla wszystkich niemetali.
Fluor, jako najbardziej elektroujemny pierwiastek, nie pokazuje płci żywe stany utlenienia. We wszelkich połączeniach, w tym z Ki- tlen, fluor jest w stanie utlenienia (-1). Wszystkie inne halogeny wykazują dodatnie stany utlenienia. maksymalnie do +7. Najbardziej charakterystyczne stany utlenienia halogenów: F: -1, 0; Cl, Br, I: -1, 0, +1, +3, +5, +7. Tlenki znane są z Cl, w którym znajduje się na stopniach utlenienia: +4 i +6. Najważniejsze związki halogenowe, dodatnio pianki utleniające to kwasy zawierające tlen i ich sole. Wszystkie związki halogenowe na dodatnich stopniach utlenienia są są silnymi utleniaczami. okropny stan utlenienia. Dysproporcjonowaniu sprzyja środowisko alkaliczne. Praktyczne zastosowanie prostych substancji i związków tlenu halogeny wynikają głównie z ich działania utleniającego. Proste substancje Cl2 znajdują najszersze praktyczne zastosowanie. i F2. Najwięcej chloru i fluoru zużywa się w przemyśle lub synteza organiczna: w produkcji tworzyw sztucznych, czynników chłodniczych, rozpuszczalników, pestycydy, narkotyki. Znaczna ilość chloru i jodu jest wykorzystywana do pozyskiwania metali i ich rafinacji. Używany jest również chlor do bielenia celulozy, do dezynfekcji wody pitnej oraz do produkcji woda z wybielaczem i kwasem solnym. Sole kwasów okso są wykorzystywane do produkcji materiałów wybuchowych.
Kwasy są szeroko stosowane w praktyce - solny i topialny Do dwudziestu najczęstszych pierwiastków należą fluor i chlor tam znacznie mniej bromu i jodu w przyrodzie. Wszystkie halogeny występują w naturze na stopniu utlenienia(-jeden). Tylko jod występuje w postaci soli KIO3, który jako zanieczyszczenie wchodzi w skład saletry chilijskiej (KNO3). Astatyna to sztucznie pozyskiwany pierwiastek promieniotwórczy (nie występuje w naturze). Niestabilność At znajduje odzwierciedlenie w nazwie, która pochodzi z języka greckiego. „astatos” - „niestabilny”. Astatyna jest wygodnym emiterem do radioterapii guzów nowotworowych. Proste substancje Proste substancje halogenów tworzą dwuatomowe cząsteczki G2. W prostych substancjach, podczas przejścia od F2 do I2 ze wzrostem liczby elektronów warstwy elektronowe i wzrost polaryzowalności atomów, następuje wzrost oddziaływanie międzycząsteczkowe, prowadzące do zmiany agregatu stojąc w standardowych warunkach. Fluor (w normalnych warunkach) jest gazem żółtym, w temperaturze -181°C zamienia się w stan ciekły. Chlor jest żółto-zielonym gazem, zamienia się w ciecz w temperaturze -34 ° C. O barwie ha- kojarzy się z nią nazwa Cl, pochodzi ona od greckiego „chloros” – „żółty- Zielony". Gwałtowny wzrost temperatury wrzenia Cl2 w porównaniu do F2, wskazuje na wzrost interakcji międzycząsteczkowych. Brom jest ciemnoczerwoną, bardzo lotną cieczą, wrze w 58,8 °C. tytuł elementu kojarzy się z ostrym nieprzyjemnym zapachem gazu i powstaje z „bromos” - „śmierdzący”. Jod - ciemnofioletowe kryształy, z lekkim „metalicznym” połyskiem skom, który po podgrzaniu łatwo sublimuje, tworząc fioletowe opary;
temperatura wrzenia jodu to 183o C. Jego nazwa pochodzi od koloru pary jodu - „jodos” - „fioletowy”. Wszystkie proste substancje mają ostry zapach i są trujące. Wdychanie ich oparów powoduje podrażnienie błon śluzowych i dróg oddechowych, a przy wysokich stężeniach - uduszenie. Podczas I wojny światowej chlor był używany jako trucizna. Gazowy fluor i ciekły brom powodują oparzenia skóry. Praca z ha- logens, należy przedsięwziąć środki ostrożności. Ponieważ proste substancje halogenów tworzą cząsteczki niepolarne chłodzi, dobrze rozpuszczają się w niepolarnych rozpuszczalnikach organicznych: alkohol, benzen, czterochlorek węgla itp. W wodzie chlor, brom i jod są słabo rozpuszczalne, ich roztwory wodne nazywane są wodą chloru, bromu i jodu. Br2 rozpuszcza się lepiej niż inne, stężenie bromu w sat- roztwór solanki osiąga 0,2 mol/l, a chlor 0,1 mol/l. Fluor rozkłada wodę: 2F2 + 2H2O = O2 + 4HF Halogeny wykazują wysoką aktywność oksydacyjną i przemiany diat na aniony halogenkowe. Г2 + 2e– 2Г– Fluor ma szczególnie wysoką aktywność utleniającą. Fluor utlenia metale szlachetne (Au, Pt). Pt + 3F2 = PtF6 Współdziała nawet z niektórymi gazami obojętnymi (kryptonem, ksenon i radon), na przykład Xe + 2F2 = XeF4 Wiele bardzo stabilnych związków pali się w atmosferze F2, na przykład woda, kwarc (SiO2). SiO2 + 2F2 = SiF4 + O2
W reakcjach z fluorem nawet tak silne utleniacze jak azot i siarka kwas, działają redukująco, podczas gdy fluor utlenia się zawarte w ich składzie O(–2). 2HNO3 + 4F2 = 2NF3 + 2HF + 3O2 H2 SO4 + 4F2 = SF6 + 2HF + 2O2 Wysoka reaktywność F2 stwarza trudności z wyborem kon- materiały konstrukcyjne do pracy z nim. Zwykle do tych celów Zawierają nikiel i miedź, które po utlenieniu tworzą na swojej powierzchni gęstą warstwę ochronną z fluorków. Nazwa F kojarzy się z jego agresywnym działaniem. To znaczy, pochodzi z greckiego. „Ftoros” – „niszczenie”. W seriach F2, Cl2, Br2, I2 zdolność utleniania słabnie na skutek wzrostu zmiana wielkości atomów i zmniejszenie elektroujemności. W roztworach wodnych właściwości utleniające i redukujące substancje są zwykle charakteryzowane za pomocą potencjałów elektrod. W tabeli przedstawiono standardowe potencjały elektrod (Eo, V) dla reakcji połówkowych tworzenie halogenów. Dla porównania wartość Eo dla ki- tlen jest najczęstszym środkiem utleniającym. Standardowe potencjały elektrod dla prostych substancji halogeny
Zmniejszona aktywność oksydacyjna Jak widać ze stołu, F2 - środek utleniający jest znacznie silniejszy, niż O2, dlatego F2 nie występuje w roztworach wodnych utlenia wodę, powrót do F–. Sądząc po wartości Eo, zdolność utleniania Cl2
również wyższy niż w przypadku O2. Rzeczywiście, podczas długotrwałego przechowywania wody chlorowanej rozkłada się z uwolnieniem tlenu i tworzeniem się HCl. Ale reakcja jest powolna (cząsteczka Cl2 jest zauważalnie silniejsza niż cząsteczka F2 i energia aktywacji dla reakcji z chlorem jest wyższa), dyspro- porcjowanie: Cl2 + H2O HCl + HOCl W wodzie nie dochodzi do końca (K = 3,9,10–4), dlatego Cl2 występuje w roztworach wodnych. Br2 i I2 są jeszcze bardziej stabilne w wodzie. Dysproporcjonowanie jest bardzo charakterystycznym utleniaczem reakcja redukcji halogenów. Dysproporcja wylany w środowisku alkalicznym. Dysproporcjonowanie Cl2 w alkaliach prowadzi do powstania anionów Cl– i ClO– . Stała dysproporcji wynosi 7,5. 1015 . Cl2 + 2NaOH = NaCl + NaClO + H2O Kiedy jod jest nieproporcjonalny w alkaliach, tworzą się I– i IO3 –. Ana- Br2 logicznie dysproporcjonuje jod. Zmiana w produkcie jest nieproporcjonalna Jonizacja jest spowodowana tym, że aniony GO– i GO2 – w Br i I są niestabilne. Reakcja dysproporcjonowania chloru jest stosowana w przemyśle sti w celu uzyskania silnego i szybko działającego utleniacza podchlorynowego, wapno bielące, sól bartolitowa. 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Oddziaływanie halogenów z metalami Halogeny silnie oddziałują z wieloma metalami, na przykład: Mg + Cl2 = MgCl2 Ti + 2I2 TiI4 halogenki Na+, w których metal ma niski stopień utlenienia (+1, +2), są związkami podobnymi do soli z głównie wiązaniem jonowym. Jak- lo, halogenki jonowe to ciała stałe o wysokiej temperaturze topnienia Halogenki metali, w których metal ma wysoki stopień utlenienia niya, to związki z przeważającym wiązaniem kowalencyjnym. Wiele z nich w normalnych warunkach to gazy, ciecze lub topliwe ciała stałe. Na przykład WF6 to gaz, MoF6 to ciecz, TiCl4 jest cieczą. Oddziaływanie halogenów z niemetalami Halogeny oddziałują bezpośrednio z wieloma niemetalami: wodór, fosfor, siarka itp. Na przykład: H2 + Cl2 = 2HCl 2P + 3Br2 = 2PBr3 S + 3F2 = SF6 Wiązanie w halogenkach niemetali jest przeważnie kowalencyjne. Związki te mają zwykle niskie temperatury topnienia i wrzenia. W przejściu od fluoru do jodu kowalencyjny charakter halogenków jest wzmocniony. Halogenki kowalencyjne typowych niemetali są związkami kwasowymi; podczas interakcji z wodą hydrolizują, tworząc kwasy. Na przykład: PBr3 + 3H2O = 3HBr + H3PO3 PI3 + 3H2O = 3HI + H3PO3 PCl5 + 4H2O = 5HCl + H3PO4
Pierwsze dwie reakcje służą do otrzymywania bromu i jodowodu kwas noicowy. Interhalogenki. Halogeny, łącząc się ze sobą, tworzą inter- wskazówki. W tych związkach lżejszy i bardziej elektroujemny halogen jest w stanie utlenienia (–1), a cięższy jest w stanie dodatnim. pianka utleniająca. Dzięki bezpośredniemu oddziaływaniu halogenów po podgrzaniu otrzymuje się: ClF, BrF, BrCl, ICl. Istnieją również bardziej złożone interhalogenki: CIF3 , BrF3 , BrF5 , IF5 , IF7 , ICI3 . Wszystkie interhalogenki w normalnych warunkach są substancjami ciekłymi o niskiej temperaturze wrzenia. Interhalogenki mają wysoki poziom utleniania działalność. Na przykład takie chemicznie stabilne substancje jak SiO2, Al2 O3, MgO itp. spalają się w oparach ClF3. 2Al2O3 + 4ClF3 = 4AlF3 + 3O2 + 2Cl2 Fluor ClF 3 to agresywny odczynnik fluorujący, który działa szybko jard F2 . Wykorzystywany jest w syntezach organicznych oraz do otrzymywania folii ochronnych na powierzchni sprzętu niklowego do pracy z fluorem. W wodzie interhalogenki są hydrolizowane do kwasów. Na przykład, ClF5 + 3H2O = HClO3 + 5HF Halogeny w przyrodzie. Pozyskiwanie prostych substancji W przemyśle halogeny pozyskiwane są z ich naturalnych związków. Wszystko procesy otrzymywania wolnych halogenów opierają się na utlenianiu halo- jony nid. 2D – Г2 + 2e– Znaczna ilość halogenów znajduje się w wodach naturalnych w postaci anionów: Cl–, F–, Br–, I–. Woda morska może zawierać do 2,5% NaCl. Brom i jod pozyskiwane są z wody ze studni naftowych i wody morskiej.
DEFINICJA Halogeny- pierwiastki z grupy VII A - fluor (F), chlor (Cl), brom (Br) i jod (I). Elektroniczna konfiguracja poziomu energii zewnętrznej halogenów ns 2 np 5 . Ponieważ przed zakończeniem poziomu energetycznego halogenom brakuje tylko jednego elektronu, w OVR najczęściej wykazują one właściwości utleniaczy. Stany utlenienia halogenu: od „-1” do „+7”. Jedyny pierwiastek z grupy halogenów - fluor - wykazuje tylko jeden stopień utlenienia „-1” i jest pierwiastkiem najbardziej elektroujemnym. Cząsteczki halogenowe są dwuatomowe: F 2 , Cl 2 , Br 2 , I 2 . Właściwości chemiczne halogenówWraz ze wzrostem ładunku jądra atomu pierwiastka chemicznego, tj. przy przejściu z fluoru na jod zmniejsza się zdolność utleniania halogenów, co potwierdza zdolność do wypierania niższych halogenów przez wyższe z kwasów halogenowodorowych i ich soli: Br2 + 2HI = I2 + 2HBr; Cl2 + 2KBr = Br2 + 2KCl. Fluor ma najwyższą aktywność chemiczną. Większość pierwiastków chemicznych, nawet w temperaturze pokojowej, oddziałuje z fluorem, uwalniając dużą ilość ciepła. Nawet woda pali się w fluorze: 2H 2 O + 2F 2 \u003d 4HF + O 2. Wolny chlor jest mniej reaktywny niż fluor. Nie reaguje bezpośrednio z tlenem, azotem i gazami szlachetnymi. Współdziała ze wszystkimi innymi substancjami, takimi jak fluor: 2Fe + Cl2 = 2FeCl3; 2P + 5CI2 = 2PCI5. Kiedy chlor wchodzi w interakcję z wodą na zimno, zachodzi reakcja odwracalna: Cl2 + H2O·HCl + HCIO. Mieszanina będąca produktami reakcji nazywana jest wodą chlorową. Gdy chlor wchodzi w interakcję z zasadami na zimno, powstają mieszaniny chlorków i podchlorynów: Cl 2 + Ca (OH) 2 \u003d Ca (Cl) OCl + H 2 O. Po rozpuszczeniu chloru w gorącym roztworze alkalicznym zachodzi następująca reakcja: 3Cl2 + 6KOH \u003d 5KCl + KClO3 + 3H2O. Brom podobnie jak chlor rozpuszcza się w wodzie i częściowo reagując z nią tworzy tzw. „wodę bromową”, natomiast jod jest w wodzie praktycznie nierozpuszczalny. Jod różni się znacznie aktywnością chemiczną od innych halogenów. Nie reaguje z większością niemetali i reaguje powoli z metalami dopiero po podgrzaniu. Oddziaływanie jodu z wodorem zachodzi tylko przy silnym ogrzewaniu, reakcja jest endotermiczna i wysoce odwracalna: H 2 + I 2 \u003d 2HI - 53 kJ. Właściwości fizyczne halogenówPod nr. Fluor to jasnożółty gaz o ostrym zapachu. Trujący. Chlor jest jasnozielonym gazem, podobnie jak fluor, ma ostry zapach. Silnie trujący. Przy podwyższonym ciśnieniu i temperaturze pokojowej łatwo przechodzi w stan ciekły. Brom to ciężka, czerwono-brązowa ciecz o charakterystycznym nieprzyjemnym, ostrym zapachu. Ciekły brom, jak również jego opary, są wysoce toksyczne. Brom jest słabo rozpuszczalny w wodzie i łatwo rozpuszczalny w rozpuszczalnikach niepolarnych. Jod jest ciemnoszarym ciałem stałym o metalicznym połysku. Opary jodu mają kolor fioletowy. Jod łatwo sublimuje, tj. przechodzi w stan gazowy ze stałego, z pominięciem stanu ciekłego. Pozyskiwanie halogenówHalogeny można otrzymać przez elektrolizę roztworów lub stopów halogenków: MgCl2 = Mg + Cl2 (stopiony). Najczęściej halogeny otrzymuje się w reakcji utleniania kwasów halogenowodorowych: MnO2 + 4HCl \u003d MnCl2 + Cl2 + 2H2O; K2Cr2O7 + 14HCl = 3Cl2 + 2KCl + 2CrCl3 + 7H2O; 2KMnO4 + 16HCl \u003d 2MnCl2 + 5Cl2 + 8H2O + 2KCl. Zastosowanie halogenówHalogeny są wykorzystywane jako surowce do różnych produktów. Tak więc fluor i chlor są wykorzystywane do syntezy różnych materiałów polimerowych, chlor jest również surowcem do produkcji kwasu solnego. Brom i jod są szeroko stosowane w medycynie, brom jest również wykorzystywany w przemyśle farbiarskim. Przykłady rozwiązywania problemówPRZYKŁAD 1
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




