Równanie reakcji benzenu i ozonu. Szkolne Olimpiady Chemiczne. Właściwości fizyczne benzenu
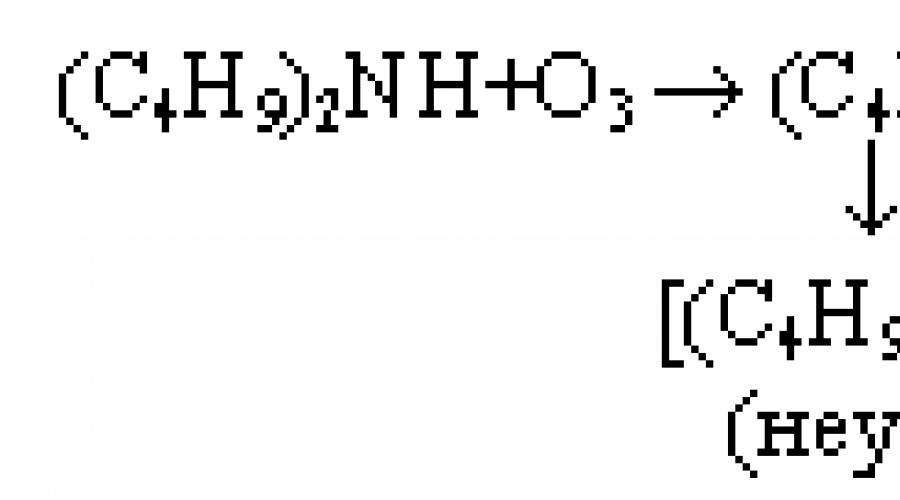
Przeczytaj także
Ogólnorosyjska Olimpiada Chemiczna dla uczniów - 2004
„Zadania z wyboru”
CHEMIA FIZYCZNA
Zadanie 1.
"Jak niewinnie powiedzieliby rok wcześniej –
tak, już przedwczoraj.”
(Bakhyt Kenzheev)
„Na początku 1880 roku Victor Meyer rozpoczął bardzo interesujące eksperymenty dotyczące gęstości par halogenów w bardzo wysokich temperaturach. Doświadczenia te zostały następnie powtórzone przez Craftsa. W ich wyniku okazało się, że gęstości par halogenów, które wydają się normalne w znacznych zakresach temperatur, stają się mniejsze wraz ze wzrostem temperatury, różne dla różnych halogenków.
| Temperatura | Gęstość para chloru | Gęstość para bromu | Gęstość para jodu |
| Poniżej 440 o | 2,45 | 5,52 | 8,78 |
| 440 o | normalna | normalna | 8,72 |
| 900 o | normalna | normalna | 8,11 |
| 1200 o | normalna | 4,5 | 6,07 |
| 1400 o - 1500 o | 2,02 | 3,5 | 5,31 |
Zakładając, że zaobserwowany spadek gęstości par halogenów nie jest zależny od istotnej zmiany współczynników rozszerzalności gazów we wskazanych temperaturach, przedstawione dane można wyjaśnić…”
(„Esej o rozwoju poglądów chemicznych” N. Menshutkina, St. Petersburg, 1888. s. 301-302)
1. Jak można wytłumaczyć tak znaczącą zmianę „gęstości par” halogenów?
2. Oszacuj błąd w określeniu „gęstości pary” (względny %).
3. Oblicz skład „par” jodu we wskazanych temperaturach (ułamki molowe).
4. Oblicz energię wiązania I - I (kJ/mol).
5. Wyznaczyć temperaturę topnienia i wrzenia jodu (o C) oraz obliczyć energię sieci jodu, jeśli ciśnienie pary nad jodem wynosi 1 mm Hg (133,32 Pa) w temperaturze 43,7 o C; 10 mmHg Sztuka. przy 77,0 o; 100 mmHg przy 122,4 o; 400 mmHg przy 162,8 o.
Zadanie 2.
HX- jeden z najsilniejszych kwasów organicznych można otrzymać według następującego schematu:
Informacje o składzie połączeń pokazanych na schemacie:
Substancja |
|||||
Ostatnio wzrosło zainteresowanie zastosowaniem fluoru molekularnego w rozpuszczalnikach. W takim przypadku można kontrolować aktywność utleniającą F2 poprzez wprowadzanie do roztworu różnych substancji. Kwas HX odnosi się do podobnych połączeń. Szacunkowe procesy z jej udziałem:
Równanie Nernsta dla fluoru cząsteczkowego ma postać:
Stosowane rozpuszczalniki (solv): CH 3 CO 2 H, HCO 2 H, CF 3 CH 2 OH, CH 3 OH, CF 3 CO 2 H.
1. Wskaż nieznane substancje na schemacie i zapisz równania reakcji.
2. Zakładając, że całkowite stężenia fluoru (C 1) i kwasu (C 2) są stałe (C 1<0,5С 2):
a) Wyraź E 0 w kategoriach E 0 (F 2 /F -) i Ka (HF). (Załóżmy, że E 0 = E 0 (F 2 , H + /HF), E=E (F 2 , H + /HF).)
b) Wyraź E jako funkcję C2 i C1, jeśli znane jest pH(C2, C1, solv).
(Dopuszczalne przybliżenia pozwalają nam obejść się bez K 1 -K 3.)
3. Do roztworu (p2) dodano (C 3): a) BF 3 (C 3<0,5C 1);
б) NaX(C 3 <
5. Odpowiedni rozpuszczalnik utrzymuje stały potencjał podczas przejścia fluoru do roztworu i tworzy z F 2 wyłącznie związki, które można łatwo oddzielić od docelowego produktu. Zaproponuj odpowiedni rozpuszczalnik z listy i uzasadnij.
6. Zaproponuj jeden sposób uzyskania F 2 w laboratorium, bez uciekania się do elektrolizy.
7.Dlaczego w trakcie eksperymentu nie można dokładnie określić potencjału fluoru?
Zadanie 3.
Ozonowanie benzenu
Reakcję ozonowania wykorzystuje się w chemii organicznej do syntezy różnych klas związków i określenia struktury związków nienasyconych.
Ozonowanie benzenu zachodzi w chlorku metylu w temperaturze –80 o C. Reakcję tę można opisać schematem kinetycznym:
1) Napisz wzory strukturalne ozonków A 1, A 2, A 3. Jaka substancja powstaje, gdy A 3 jest redukowany przez cynk?
2) Innym sposobem otrzymywania ozonków jest odwodnienie tego typu nadtlenków dihydroksy
bezwodnik fosforu. Napisz schematy otrzymywania mono-, di- i poliozonku ze wskazanego diwodoronadtlenku.
Jedną z jakościowych reakcji związków nadtlenkowych o najróżniejszej budowie jest oddziaływanie ich roztworów eterowych z roztworem siarczanu tytanylu w 60% kwasie siarkowym.
3) Co to jest sygnał analityczny i czym jest spowodowany?
Rozważ powyższy schemat kinetyczny. Załóżmy, że ozon jest pobierany w niewielkim nadmiarze w stosunku do całkowitego równania.
4) a) Na jednym wykresie przedstaw zależność stężeń substancji A 1, A 2, A 3 od czasu, zakładając, że k 1
k 2 k 3 .
b) Na jednym wykresie przedstaw zależność stężenia substancji A 1 od czasu w dwóch przypadkach: 1) k 1 << k 2 ;
2) k 1 k 2. c) Które z dwóch przybliżeń - (b1) czy (b2) - jest bardziej prawdziwe? Dlaczego?
d) Wyraź szybkość tworzenia A 3 w kategoriach stężeń ozonu i benzenu, pod warunkiem, że stężenia półproduktów A 1 i A 2 są stacjonarne. Jaki jest ogólny porządek reakcji?
Stężenie ozonu w roztworze można utrzymać na stałym poziomie poprzez ciągłe przepuszczanie przez roztwór mieszaniny ozonu i tlenu. Rozważmy kinetykę reakcji w tych warunkach.
5) a) Wyraź szybkość tworzenia A 3 w kategoriach stężeń ozonu i benzenu, pod warunkiem, że stężenia A 1 i A 2 są stacjonarne. Jaki jest ogólny porządek reakcji?
b) Ile razy zmieni się czas połowicznej przemiany benzenu, gdy jego początkowe stężenie zostanie podwojone?
c) Rozwiąż równanie kinetyczne z (5a) i znajdź zależność stężenia produktu A 3 od czasu. Oznacz początkowe stężenia benzenu i ozonu jako 0 i 0.
Zadanie 4.
Nadtlenek benzoilu (BP) i kwas dinitryl-2,2"-dimetylo-2,2"-azodipropanowy (2,2"-azo-bis-izobutyronitryl, AIBN) są standardowymi inicjatorami rodnikowych procesów łańcuchowych, łatwo rozkładającymi się homolitycznie nawet w niewielkim stopniu wzrost temperatury Energia aktywacji rozkładu w obojętnych rozpuszczalnikach wynosi 129 kJ/mol dla PB i 130 kJ/mol dla AIBN, a wykładnik równania Arrheniusa to ( k = A e – mi A/ CZ) A= 10 14,5 s –1 dla PB i 10 15,0 s –1 dla AIBN. Rozpad następuje w pierwszym rzędzie.
Pytania i zadania.
1. Zapisz wzory na PB i AIBN oraz równania reakcji ich rozkładu w obojętnym rozpuszczalniku. Jakie produkty można formować? Nazwij je.
2. Wiązania C–N i N=N w związkach azowych są dość mocne (odpowiednio 295 i 420 kJ/mol). Dlaczego zatem AIBN łatwo tworzy rodniki po podgrzaniu?
3. W jednym z doświadczeń podczas rozkładu niebieskiego roztworu AIBN w ciągu 1 minuty uwolniło się 0,5 ml gazu (mierzone w temperaturze pokojowej i pod ciśnieniem 735 mm), a po zakończeniu reakcji 1,250 litrów gaz ten został uwolniony, co mierzono w tych samych warunkach. Oblicz stałą szybkości rozpadu AIBN w warunkach doświadczalnych (podaj czas w sekundach).
4. Oszacuj czas rozkładu AIBN w roztworze o 0,1% w temperaturze 25 o C oraz okres półtrwania. W jakiej temperaturze AIBN ulegnie rozkładowi o 50% w ciągu 5 godzin?
5. Oszacuj efekt termiczny rozkładu AIBN. Czy możliwy jest jego wybuchowy rozkład i jeśli tak, to w jakich okolicznościach? Energia rozerwania potrójnego wiązania w cząsteczce azotu wynosi 945 kJ/mol; Przyjmij, że energia wiązania C – C wynosi 340 kJ/mol.
6. W jednym z badań zmierzono początkową szybkość rozkładu PB we wrzącym benzenie. Jeśli z otrzymanych danych obliczymy stałą szybkości zaniku przy założeniu reakcji I rzędu, to okaże się, że tak obliczona stała zależy od początkowego stężenia PB:
Aby wyjaśnić te wyniki, zasugerowano, że równolegle może zachodzić dwumolekularna reakcja rozkładu PB. Na podstawie danych eksperymentalnych obliczyć rzeczywistą stałą szybkości jednocząsteczkowego rozkładu PB (zaleca się stosowanie metody graficznej).
7. Gdy rozkład AIBN prowadzono w ksylenie w temperaturze 108 o C w obecności 2,6-dimetylo- P-benzochinon, widmo elektronowego rezonansu paramagnetycznego (EPR) otrzymanego roztworu wykazało obecność stabilnych wolnych rodników; 7 równomiernie rozmieszczonych linii widma z podziałem 0,573 mT (militesla) wskazywało na obecność 6 równoważnych protonów w rodniku, a podział każdej linii na trzy (przy odległości między nimi 0,137 mT) wskazywał na obecność dwóch równoważne protony (T.L.Simandi i in., European Polymer Journal, 1989, t. 25, s. 501–507). Korzystając z tych danych, narysuj strukturę powstałego rodnika i potwierdź ją danymi EPR (rozszczepienie w widmie jest proporcjonalne do gęstości niesparowanego elektronu na danym atomie). Wyjaśnij trwałość powstałych rodników. Jak myślisz, dlaczego autorzy opublikowali artykuł w wskazanym czasopiśmie?
Notatka. Zależność stężenia od czasu dla reakcji I rzędu: Z
= Z o e –kt lub ln( C o/ C)
= kt. Stała gazowa R= 8,31 J/(mol K).
CHEMIA I ŻYCIE
Zadanie 1.
Jezioro Galich (rejon Kostroma, patrz mapa) ma dość zamulone dno, długość 25 km, szerokość 5 km, średnia głębokość 1,5 m, wymiana wody ~ raz w roku. Do jeziora wpływa kilka rzek, z których najliczniejsze (jeśli możemy mówić o tych nędznych potokach) to Srednyaya i Chelsma. Wypada z rzeki jeziora. Vyoksa. Nad jeziorem położone jest miasto Galich (20 tys. mieszkańców, znajduje się tu fabryka dźwigów samochodowych, fabryka skór, piekarnia, fabryka obuwia i odzieży).
Próbki wody pobrano w czterech punktach (patrz mapa). Próbki pobrano w okresie od 3 do 8 sierpnia 2003 roku. Wyniki analiz przedstawiono w tabeli.
| Kropka | ||||
| Temperatura | ||||
| pH | ||||
| Przezroczystość, cm | ||||
| Kolor, st | ||||
| Całkowita zasadowość, mM | ||||
| Wolna zasadowość, mm | ||||
| Twardość (Ca 2+ + Mg 2+), mM | ||||
| Wapń, mM | ||||
| Chlorki, mM | ||||
| O 2,% nasycenia |
Uwaga: zasadowość wolna to stężenie zasad dających pH > 8,2, zasadowość całkowita to stężenie wszystkich zasad, które można miareczkować kwasem solnym. Różnica między zasadowością całkowitą i wolną wynika zwykle z obecności wodorowęglanów.
Wyniki pokazują, że po pierwsze pH wody w jeziorze jest nienormalnie wysokie, a po drugie stężenie soli w jeziorze jest około 3 razy mniejsze niż w rzekach je zasilających. Zaproponowano dwa wyjaśnienia obu faktów. Po pierwsze: mieszkańcy miasta aktywnie pierzą ubrania, co powoduje przedostawanie się do jeziora węglanów i fosforanów sodu, które alkalizują wodę i wiążą wapń z magnezem. Po drugie: garbarnia odprowadza do jeziora ścieki zawierające wapno.
1. Podaj równania reakcji prowadzące do zmniejszenia stężeń kationów i anionów w jeziorze w porównaniu do rzek zasilających jezioro zgodnie z pierwszą i drugą hipotezą. Zapisz równania w postaci jonowej.
2. Czy spadek stężenia soli w Jeziorze Galich w porównaniu do rzek zasilających je ma charakter lokalny (tylko w obrębie miasta) czy w całym jeziorze? Uzasadnij swoją odpowiedź w jednym zdaniu.
3. Jakie fakty nie pasują do pierwszej hipotezy o wzroście pH?
4. Jakie fakty nie pasują do drugiej hipotezy wzrostu pH?
5. Jakie fakty nie pasują do drugiej hipotezy o spadku stężenia soli?
Istnieje również hipoteza, że spadek stężenia soli w jeziorze w porównaniu do rzek, które je zasilają, wynika z przyczyn naturalnych.
6.Co może być tego przyczyną? Zapisz odpowiednie równanie reakcji.
7. W jaki sposób analiza osadu może potwierdzić lub obalić tę hipotezę?
8. Oszacuj grubość warstwy tych substancji odkładających się w ciągu roku, jeśli przyjmiemy, że osiadają tylko one, a ich gęstość wynosi około 2000 g/dm 3?
Dla porównania: K a (H 2 O + CO 2) = 4,5? 10 -7, Ka (HCO 3 -) = 4,8? 10 -11, K a (H 2 PO 4 -) = 6,2? 10-8, Ka(HPO42-) = 5,0? 10 -13, PR(CaCO3) = 4? 10 -9, PR(MgCO3) = 2? 10 -5, PR(Ca 3 (PO 4) 2) = 2? 10 -29.
Zadanie 2.
Owady są zbyt małe, aby szukać partnera w otaczającym świecie za pomocą oczu, jak to zwykle robią ludzie. W tym celu wydzielają specjalne substancje - atraktanty płciowe, czyli feromony. Wystarczy kilka miligramów feromonu wydzielonego przez samicę motyla, aby zwabić setki samców z odległości kilkudziesięciu kilometrów. W tym przypadku drobne zmiany w budowie feromonu (położenie lub stereoizomeria podwójnego wiązania C=C, zastosowanie innego stereoizomeru chiralnej cząsteczki itp.) mogą doprowadzić do zwabienia owadów o zupełnie innym charakterze gatunku lub do odstraszania osobników własnego gatunku.
Wiadomo, że samice much oliwnych Bacroceraoleae przyciągają samców poprzez krycie A i samce i samice - za pomocą połączenia B. Kiedy te związki traktuje się rozcieńczonym roztworem kwasu, powstaje ta sama substancja W, o którym wiadomo co następuje:
a) zawiera 27,6% tlenu i 62,1% węgla, a po obróbce pięciobromkiem fosforu przekształca się w związek D zawierający 71,75% bromu;
b) po podgrzaniu w obecności ilości katalitycznych para Kwas -toluenosulfonowy (TsOH) łatwo przekształca się w mieszaninę związków A I B;
c) w wyniku ciągu przekształceń:
można go przekształcić w związek Z, który po reakcji z jednym równoważnikiem odczynnika Grignarda tworzy mieszaninę dwóch alkoholi.
Określ możliwe struktury połączeń A – Z i zapisz równania podanych tutaj reakcji
Zadanie 3.
Immobilizowane enzymy
Enzymy są biologicznymi katalizatorami o charakterze białkowym. Aby zastosować enzymy w różnych procesach biotechnologicznych, często konieczne jest utrwalenie (unieruchomienie) enzymu na odpowiednim nierozpuszczalnym nośniku (oryginalny enzym, który jest unieruchomiony, będziemy nazywać enzymem natywnym).
A. Przygotowanie unieruchomionych enzymów.
Do unieruchomienia enzymów stosuje się zazwyczaj nośniki zawierające grupy aminowe, hydroksylowe lub karboksylowe, które w warunkach fizjologicznych nie wykazują dużej reaktywności. Dlatego też, gdy między enzymem a nośnikiem tworzy się wiązanie kowalencyjne, ten ostatni musi najpierw zostać aktywowany. Jednym z rodzajów odczynników aktywujących są dialdehydy, takie jak bursztynian
OHC-(CH2)2-CHO.
1. Napisz reakcje zachodzące, gdy aldehyd bursztynowy reaguje z alkoholem poliwinylowym w środowisku kwaśnym. Aby w dalszej części wskazać media, należy posłużyć się ikoną:
2. Napisz równanie reakcji ubocznej pomiędzy alkoholem poliwinylowym i aldehydem bursztynowym, która zmniejsza wydajność enzymu kowalencyjnie związanego z nośnikiem.
3. Zapisz reakcję pomiędzy nośnikiem aktywowanym aldehydem bursztynowym a enzymem (pH = 8). Na schemacie wskaż grupę funkcyjną enzymu, która będzie oddziaływać. Aby wskazać enzym, użyj ikony:
4. Na grupach bocznych jakich reszt aminokwasowych będzie przebiegać reakcja? Podaj trywialne nazwy i wzory bocznych rodników tych aminokwasów.
5. Jaka inna grupa enzymów, oprócz wskazanych w odpowiedzi na pytanie 4, może oddziaływać z aktywowanym nośnikiem?
6. Wskaż obszary pH, w których tworzy się wiązanie enzym-nośnik:
a) stabilny
b) niestabilny
Aby zwiększyć stabilność wiązania enzym-nośnik, układ powstały w wyniku reakcji opisanej w pytaniu 1 traktuje się borowodorkiem sodu.
7. Podaj schemat tej reakcji. gdzie Vmax = k 2 [E] 0 i K M = (k 2 + k -1)/ k 1
Immobilizacja może wpływać na wartości zarówno stałej katalitycznej k2, jak i stałej Michaelisa KM, która charakteryzuje skuteczność wiązania enzymu z danym substratem. Kataliza z unieruchomionymi enzymami może przebiegać w dwóch trybach:
kinetyczny, w którym obserwowana szybkość zależy od właściwości katalitycznych samego enzymu;
dyfuzja, w której obserwowana szybkość reakcji jest kontrolowana przez dyfuzję (to znaczy określaną przez szybkość dostarczania substratu do enzymu).
Rozważmy układ z unieruchomionym enzymem, w którym zmianę reżimu obserwuje się przy stężeniu substratu równym [S] 0, np.
8. Narysuj na wykresie w tzw. podwójnych współrzędnych odwrotnych (1/v od 1/[S] 0) rodzaj zależności dla tego układu w zakresie stężeń substratów od [S] 0, ex / 2 do 10 [S] 0, np. Na osi odciętych zaznacz punkty odpowiadające stężeniom substratu [S] 0.ex/2, [S] 0.ex i 10[S] 0.ex. Zależność odpowiadająca reżimowi kinetycznemu oznaczona jest cyfrą „1”, a reżimowi dyfuzyjnemu – cyfrą „2”.
9. Wskaż długości odcinków odciętych na osi odciętych i rzędnych w podwójnych współrzędnych odwrotnych, kontynuując zależność dla przypadku reżimu kinetycznego (wykres z odpowiedzi na pytanie 8). Podaj obliczenia.
Immobilizacja na nośnikach polielektrolitowych może wpływać na rozkład protonów w układzie, co prowadzi do zmiany zależności aktywności katalitycznej enzymu (a co za tym idzie szybkości reakcji) od pH (w dalszej części tej zależności będziemy nazywać profil pH ). Niech profil pH jakiegoś natywnego enzymu będzie miał klasyczny wygląd w kształcie dzwonu (patrz poniżej).
10. Przedstaw we współrzędnych (v pH) profile pH odpowiadające enzymowi natywnemu (oznacz każdą gałąź cyfrą 1), temu samemu enzymowi unieruchomionemu na nośniku polianionowym (oznacz każdą gałąź cyfrą 2) i temu samemu enzymowi unieruchomionemu na nośnik polikationowy (oznacz każdą gałąź numerem 3). Załóżmy, że unieruchomienie nie ma żadnego efektu:
a) od szybkości reakcji enzymatycznej przy optymalnym pH (najwyższy punkt dzwonu);
b) od kształtu profilu pH.
(CHEMIA ORGANICZNA)
Reakcje addycji
Ogólnie reakcje addycji przy wiązaniu podwójnym można przedstawić w następujący sposób: Zgodnie z tym schematem do podwójnych wiązań węgiel-węgiel można dodać: wodór (H2), halogeny (Cl2, Br2, ClBr, SP), wodę ( H20), halogenowodory (HC1, HBr, HI), kwas siarkowy (H2S04), tlen (02) itp. Duży...(CHEMIA ORGANICZNA)
Reakcja ozonowania Harriesa
Ozon 03 łatwo łączy się w miejscu wiązania podwójnego, tworząc cykliczne nadtlenki - ozopidy: Ozonki są bardzo niestabilne i łatwo eksplodują. Zwykle nie są one izolowane, ale bezpośrednio po wytworzeniu są rozkładane wodą: Nadtlenek wodoru utlenia powstałe aldehydy do kwasów karboksylowych: Ozonowanie...(CHEMIA ORGANICZNA)
Struktura benzenu
Porównując wszystkie obecnie dostępne informacje dotyczące benzenu i jego homologów, strukturę benzenu można przedstawić w następujący sposób. Wszystkie atomy węgla w benzenie są w stanie sp2- hybrydyzacja. Każde z nich tworzy trzy zwykłe wiązania c (dwa wiązania C-C i jedno C-H o kącie ...(CHEMIA ORGANICZNA)
Częściowe utlenianie w fazie gazowej mieszanin metanu i węglowodorów oraz homologów metanu
Prawdziwe gazy ziemne, w tym wykorzystywane w procesach chemicznych, zawierają domieszki różnych węglowodorów, głównie homologi metanu. Ponieważ ze względu na dużą różnicę w sile wiązań chemicznych, nawet najbliższe homologi metanu różnią się znacznie od niego reaktywnością i wieloma innymi rzeczami...Analiza kinetyczna częściowego utleniania metanu i jego homologów do gazu syntezowego
W ostatnim czasie, obok katalitycznych metod utleniającej przemiany metanu w gaz syntezowy, w szeregu procesów przemysłowych, zwłaszcza w małych kompaktowych instalacjach do produkcji wodoru, zaczęto stosować utlenianie częściowe w fazie gazowej. Jednakże często stosowane metody obliczeń termodynamicznych...(CHEMIA ORGANICZNA: PRZEMIANY UTLENIAJĄCE METAN)
Reakcje ozonu z różnymi związkami aromatycznymi w zakresie temperatur (-40) - (-20)°C pod względem szybkości reakcji podlegają prawu bimolekularnemu. Energia aktywacji reakcji dla benzenu wynosi 50 kJ/mol, a szybkość procesu znacznie wzrasta wraz ze wzrostem polarności ośrodka lub w obecności katalizatorów kwasowych.
Przedstawmy dane dotyczące niektórych parametrów kinetycznych reakcji ozonu z węglowodorami aromatycznymi w CCl4 w temperaturze t = 20°C i początkowym stężeniu ozonu O3 = 10-4¸10-6 mol/l, odpowiednio, współczynnik stechiometryczny; stała szybkości - k, l/mol×s; dla: benzenu - 3; 6×10-2; naftalen - 2; 2,4; fenantren - 1; 0,8 × 102; piren - 2; 0,8 × 102; polinaftalen - 1,6×103; antracen - 3; 5×103 (pierwszy etap) i 43 (drugi etap). Po dodaniu pierwszej cząsteczki ozonu sprzęganie benzenu z naftalenem zostaje przerwane i późniejsze reakcje zachodzą znacznie łatwiej. Porównanie stałych szybkości reakcji różnych związków z ozonem pokazuje, że związki aromatyczne reagują znacznie wolniej niż olefiny, a stałe szybkości reakcji rosną w szeregu: benzen< нафталин < фенантрен < пирен < антрацен. Озониды бензола и нафталина - вступают в характерные реакции с HI, NaOH, NH2OH·HCl, подвергаются термическому разложению с образованием пары: альдегид + кислота, а также способны к образованию полимеров.
Ocenę możliwego indukcyjnego wpływu dodanego wcześniej ozonu na kierunek reakcji sąsiedniego wiązania C=C można rozpatrywać na podstawie składu produktów rozkładu metoksywodoronadtlenków naftalenu: produkty pośrednie po podgrzaniu odpowiednio przekształcają się w ester metylowy semialdehydu kwasu ftalowego i ftalanu dimetylu, a mieszanina produktów pośrednich zawiera do 80%. Zatem indukcyjny efekt cyklu ozonkowego powstałego w poprzednim akcie reakcji objawia się preferencyjnym tworzeniem jonu bipolarnego przy atomie węgla najbardziej oddalonym od miejsca przyłączenia pierwszej cząsteczki ozonu.
Reakcje ozonu bez wpływu na pierścień aromatyczny opierają się na dobrze znanej zasadzie, że w procesach utleniania lub podczas ataku wolnych rodników podstawniki reagują łatwiej niż pierścień aromatyczny. Na przykład stałe szybkości dla podstawionych benzenów w szeregu podstawników CH3< CH3-CH2 < (CH3)2 CH - растут симбатно с увеличением числа реакционноспособных атомов водорода в заместителе и уменьшением прочности C-H связи.
Podstawione alkiloaromatyczne związki mogą reagować z ozonem na dwa sposoby: tworząc wodoronadtlenki poprzez mechanizm utleniania łańcuchowego oraz tworząc ozonki. Co więcej, dominuje pierwszy kierunek, a nie drugi. O reakcji przebiegającej według mechanizmu rodnikowego świadczy intensywna chemiluminescencja powstająca podczas przepuszczania ozonu przez alkilobenzeny, spowodowana wzajemnym oddziaływaniem rodników nadtlenkowych.
Gdy ozon działa na antracen, głównym produktem reakcji jest antrachinon, którego ilość waha się w granicach 20 80%, a wydajność antrachinonu zależy od rodzaju rozpuszczalnika, zwiększając zawartość kwasu octowego i zmniejszając CCl4. Drugim produktem (z wydajnością 18 67%) jest kwas ftalowy – C6H5(COOH)2, a wydajność kwasu 4,3-naftalenodikarboksylowego – C12H10(COOH)2 wynosi (6 8)%. Wiadomo, że antracen łatwo utlenia się pod wpływem tlenu, tworząc antrachinon z dużą wydajnością. Procesy tego samego typu obserwuje się podczas utleniania poliwęglanów i węglowodorów alkiloaromatycznych ozonem.
Zatem w reakcjach ozonu z węglowodorami aromatycznymi występują dwa rodzaje addycji ozonu do wiązań C=C jądra aromatycznego: 1) wszystkie trzy tleny cząsteczki ozonu zostają zatrzymane i powstają ozonki, które mają wiele wspólnego powszechny w przypadku ozonków olefin; 2) w cząsteczce nowego związku zostaje zachowany jeden z trzech atomów.
Reakcję ozonu z węglowodorami aromatycznymi można wykorzystać w następujących syntezach:
1) otrzymywanie kwasu difenowego z fenantrenu:
2) otrzymanie dialdehydu ftalowego i kwasu ftalowego (AS 240700 USSR, 1969, BI nr 13), poprzez dodanie pierwszych dwóch cząsteczek ozonu z pięciu możliwych do naftalenu, po czym reakcja znacznie zwalnia:
3) otrzymanie kwasu glioksalowego (AS 235759 USSR, 1969, BI nr 6) w oparciu o niższy homolog – benzen według reakcji:
1.6. Reakcje oddziaływania ozonu z aminami, siarką i związkami organicznymi,
jak i polimery
Kiedy ozon reaguje z aminami, na przykład trzeciorzędowymi, powstają z dużą wydajnością tlenki amin (patent 437566 Anglia, 1935), a także rodniki nitroksylowe i inne związki (które stosowane są jako modyfikatory i inhibitory niszczenia gumy z O3 ). Schematy reakcji interakcji O3 z aminami trzeciorzędowymi, drugorzędowymi i pierwszorzędowymi są złożone i zawierają wiele równoległych i kolejnych reakcji. Na przykład reakcja ozonu z tributyloaminą w chloroformie spowodowała uwolnienie ponad 40 pośrednich i końcowych produktów reakcji. Kinetyka reakcji ozonu z aminami jest zgodna z prawem dwucząsteczkowym i zależy od charakteru rozpuszczalnika.
I. Oddziaływanie O3 z aminami trzeciorzędowymi przedstawia następujący schemat:
1) R3N: + O=O+-O– → R3N+-O-O-O– (O3 dodaje się do aminy tworząc produkt podobny do reakcji O3 z aldehydami, węglowodorami nasyconymi z wiązaniami wielokrotnymi);
2) R3N+-O-OO– → R3N → O + O2; (tworzenie tlenków amin);
3) R2N-(O-O-O-)-C(H2)-RI®R2N=CH-(HO-O-O-)-R®R2N-CHOHRI + O2 (lub R2N-CH(-O-O-OH)-RI) (występuje utlenianie podstawników).
Wydajność tlenków amin jest maksymalna w rozpuszczalnikach w postaci chlorowanych węglowodorów i alkoholi (CCl4, chloroform, chlorek metylenu). Również obniżenie temperatury reakcji (<25 ºС) благоприятно сказывается на выходе оксидов аминов. Использование n-пентана уменьшает выход почти в 10 раз. Например, при озонировании трибутиламина в метаноле образуются (в %): (C4H9)3N → 0÷53; C4H9N=CH-C3H7 → 2; C4H9NCH=0 → 3; C4H9NCH=CHC2H5 → 11; (C4H9)2NH → 9; C4H9NCOC3H7 → 6.
II. Reakcja O3 z aminami drugorzędowymi prowadzi do powstania rodników nitroksydowych, które w zależności od budowy aminy mogą być głównymi produktami reakcji lub występować w zauważalnych ilościach. Aminy aromatyczne i pochodne n-fenylenodiaminy szczególnie łatwo tworzą rodniki nitroksylowe. Na przykład reakcja ozonu z triacetonaminą, w wyniku której powstaje rodnik nitroksylowy (2,2,6,6-tetrometylo-4-oksopiperydoksyl), jest wysoce stabilna i utrzymuje się przez wiele miesięcy w temperaturze pokojowej bez zauważalnych zmian. Większość amin aromatycznych to antyozonanty stosowane do ochrony wyrobów gumowych przed starzeniem się ozonu.
Reakcję ozonu z aminami drugorzędowymi można przedstawić według następującego schematu (wpływ O3 na di-tert-butyloaminę w pentanie, przy t = -120 şС):

III. Głównymi produktami oddziaływania ozonu z aminami pierwszorzędowymi są związki nitrowe i zasady amonowe. Ich względna zawartość zależy głównie od rodzaju rozpuszczalnika. Przechodząc od węglowodorów do rozpuszczalników zawierających chlor, wydajność nitrozwiązków maleje, ale wydajność soli amonowych wzrasta, tj. W reakcji bierze udział cząsteczka rozpuszczalnika.
Schemat interakcji O3 z aminą pierwszorzędową można ogólnie przedstawić za pomocą równania:
C4H9NH2 + O3 → C4H9NO2 + O2.
Tworzenie końcowego związku nitrowego wymaga zużycia 3 cząsteczek ozonu. Dla porównania stała szybkości reakcji ozonu z amoniakiem w roztworach wodnych (k = 39 l/mol) jest zauważalnie niższa niż w przypadku amin (np. dla aniliny - k = 2,5 · 103 w t = 20°C).
Główne etapy reakcji tributylotiomocznika i jego analogów z ozonem można przedstawić za pomocą uproszczonego schematu:
Najłatwiej reagują rodniki nitroksylowe. Pochłaniając 1 mol ozonu, ulegają przemianie głównie do związków nitrowych.
Kiedy ozon reaguje ze związkami siarki, np. siarczkami (R-(–S–)n-R), tiomocznikami i tiosemikarbazydami (R-(R)-C=S), reakcje zachodzą głównie przy atomie siarki. Do przeprowadzenia reakcji z dwusiarczkami i polisiarczkami stosuje się roztwór w czterochlorku węgla. W tym przypadku początkowe siarczki dość łatwo reagują z ozonem ze stałą szybkości k = 103 l/mol s, zbliżoną do fenoli i znacznie wyższą niż szybkość utleniania grupy -CH2- w podstawnikach alkilowych. Głównym produktem pierwszego etapu reakcji jest sulfotlenek (=S=O), który można następnie utlenić do sulfonu (=S(=O)2), ale ze znacznie mniejszą szybkością (50-100 razy). Stałe szybkości oddziaływania ozonu z siarczkami na przykładzie siarczku dimetylu (CH3-S-CH3) - 1,5 · 103 l/mol s, w porównaniu do siarki (S8) - 5,5 i alkoholu etylowego (CH3CH2OH) - 10. Ponadto następuje spadek reaktywności organicznych związków siarki szeregu: R-S-R, R-(S)2-RS8.
Ozon oddziałuje również ze związkami organicznymi, na przykład krzemem:
(C2H5)3Si-CH2-CH3+O3 ® (C2H5)3Si-CH-(OO·)-CH3 + OH·®(C2H5)3SiOOH + O=CH-CH3
lub zgodnie z drugą reakcją: ® (C2H5)3Si-(-O-O-O)-CH2 ® (C2H5)3SiO2 + OOCH2CH3.
Kiedy ozon działa na materiały polimerowe, szczególnie silne działanie występuje na elastomerach zawierających wiązania C=C w głównym łańcuchu makrocząsteczki (np. gumy). Gdy O3 oddziałuje na polimery o nasyconym łańcuchu węglowodorowym, zwłaszcza na ich roztwory (w CCl4 w temperaturze t = 20°C), obserwuje się spadek masy cząsteczkowej i akumulację grup funkcyjnych zawierających tlen (kwasy, ketony i nadtlenki). Polimery zawierające pierścienie fenylowe w głównym łańcuchu najwolniej reagują z ozonem, natomiast policykliczne (polinaftyleny, poliatraceny) lub polimery z heteroatomami (poliwęglany) reagują znacznie łatwiej. W szeregu polimerów o nasyconym łańcuchu węglowodorowym szybkość reakcji wzrasta od poliizobutylenu do poliwinylocykloheksanu, przy jednoczesnym spadku liczby pęknięć łańcucha. Polibutadien i poliizopren mają największą stałą szybkości, a także mają najmniejszą liczbę pęknięć na zdarzenie reakcji. Niektóre polimery są nierozpuszczalne w powszechnie stosowanych rozpuszczalnikach (np. polietylenie). Ozonowanie różni się od schematu termooksydacyjnego niszczenia polistyrenu tym, że niskie temperatury i duże szybkości powstawania rodników stwarzają warunki, w których udział procesów łańcuchowych w bilansie reakcji wynosi 15–20%, a główna część produktów jest powstający podczas rozkładu rodników nadtlenkowych. Kwasy stanowią niewielką część produktów reakcji i mogą powstawać zarówno w wyniku utlenienia rodników fenoksylowych lub produktów ich przemian, jak i w wyniku rozkładu ozonków aromatycznych. Oddziaływaniu ozonu na inne polimery (polietylen, poliwinylocykloheksan) towarzyszy powstawanie rodników nadtlenkowych. Destrukcja nienasyconych polimerów pod wpływem O3 (np. kauczuków) zachodzi podobnie jak w przypadku monomerów, tj. wzdłuż wiązań C=C.
UKD 541.13: 669.871.4
DS Gurow, A.V. Darovskikh, A.G. Mikow, V.I. Skudaev
Narodowy Uniwersytet Politechniczny w Permie
WIDMO IR PRODUKTÓW OZONOWANIA benzenu
Proces ozonowania benzenu badano za pomocą spektroskopii IR. Odkryto pojawienie się nowych pasm absorpcyjnych związanych z drganiami wzdłuż wiązań C-H i C=0 w produktach ozonowania. Zaobserwowano powstawanie nierozpuszczalnych ozonków benzenu. Poczyniono założenia dotyczące możliwych kierunków procesu.
Węglowodory aromatyczne, do których zalicza się benzen, służą jako surowce do produkcji różnorodnych materiałów, tworzyw sztucznych, barwników, leków, środków ochrony roślin, przy produkcji materiałów wybuchowych, farmaceutyków itp. Jednocześnie benzen i jego pochodne są obecne jako szkodliwe składniki w odpadach pochodzących z przedsiębiorstw wytwarzających te materiały. Reakcja benzenu z ozonem jest interesująca zarówno dla celów otrzymania produktów ozonowania, jak i dla celów unieszkodliwiania odpadów.
Wiadomo, że ozon jest odporny na działanie takich utleniaczy jak HMnO4, H2O2, OsO4 itp. Podczas interakcji z ozonem tworzą się ozonki, które w obecności wody na katalizatorze cynkowym rozkładają się do glioksalu. Proces utleniania węglowodorów w fazie ciekłej przebiega poprzez mechanizm łańcuchowy z powstawaniem wodoronadtlenków w początkowej fazie. Opublikowano pracę dotyczącą badań wpływu ozonowania na zmianę składu składowego benzenu węgla surowego o zawartości benzenu około 30%, z której jednak nie wiadomo, co dzieje się z samym benzenem.
Ozonowanie benzenu przeprowadzono w reaktorze bąbelkowym. Do szklanego reaktora o średnicy 20 mm wlano 30 ml benzenu i w ozonatorze, przez który przepuszczono tlen, uzyskano ozon. Objętościowe natężenie przepływu mieszaniny ozon-tlen wynosiło 100 ml/min przy stężeniu ozonu 1,5% (0,61 mol/m). Proces prowadzono w temperaturze 25°C, próbki produktu pobierano strzykawką i rozpuszczano w czterochlorku węgla w proporcji 5 ml próbki na 100 ml roztworu.
ciało Roztwór próbki umieszczano w kuwecie cieczowej z okienkami KBg o stałej grubości warstwy cieczy wynoszącej 0,171 mm i rejestrowano widmo IR.
Pod koniec procesu na powierzchni roztworu i na ściankach reaktora stwierdzono jasnożółty osad, będący najwyraźniej mieszaniną ozonków benzenu.
Na rysunku przedstawiono widma benzenu przed ozonowaniem oraz próbki produktów ozonowania.
Liczba falowa, cm-1
Ryż. Widma IR roztworu benzenu i produktów jego ozonowania w czterochlorku węgla. Czas ozonowania, h: 1 - 0; 2 - 2
Czterochlorek węgla w obszarze powyżej 1550 cm-1 nie pochłania promieniowania IR. Benzen absorbuje w zakresie od 3000 do 3050 cm-1. Podczas ozonowania w widmach produktów pojawia się pasmo o liczbie falowej 2900 cm-1, względne natężenie tego pasma w porównaniu z pasmem benzenu 3000 cm-1 wzrasta z czasem: po 0,5 godziny - 0,05, po 1 godzinie. - 0,09, po 1,5 godz. - 0,12, po 2 godz. -
0,15, po 2,5 godzinach - 0,16. Według literatury pasmo to można przypisać drganiom w miejscu wiązania C-H lub wiązania OH w produktach utleniania benzenu w grupie niezwiązanej z pierścieniem. Drugi
Kolejne nowe pasmo o zauważalnie wzrastającym natężeniu i liczbie falowej 1700 cm-1 można przypisać drganiom przy podwójnym wiązaniu C=0 w grupie karbonylowej lub karboksylowej. Można zatem oczekiwać, że produkty ozonowania benzenu będą zawierać mieszaninę kwasów karboksylowych, bezwodników, aldehydów i ketonów.
Jako podstawowy schemat procesu oddziaływania benzenu z ozonem w temperaturze 25°C, a także z tlenem w temperaturze 400°C na katalizatorze U205 możliwe jest utworzenie mieszaniny kwasu maleinowego i jego bezwodnika:
Badania wykazały, że pierścień benzenowy, który jest odporny na wiele środków utleniających, ulega zniszczeniu przez ozon w zwykłych temperaturach.
Bibliografia
1. Berezin D.B., Berezin B.D., Kurs współczesnej chemii organicznej. - M.: Szkoła Wyższa, 2001. - 768 s.
2. Razumowski S.D., Zaikov G.E. Ozon i jego reakcje ze związkami organicznymi. - M.: Nauka, 1974. - 322 s.
3. Emanuel N.M., Denisov E.T., Mayzus Z.K. Reakcje łańcuchowe utleniania węglowodorów w fazie ciekłej. - M.: Nauka, 1965. - 280 s.
4. Semenova S.A., Patrakov Yu.F. Wpływ ozonowania na zmianę składu składowego benzenu węgla surowego // Zhurn. przym. chemia. - 2007. - T. 80, wyd. 5. - s. 871-875.
5. Ioffe B.V., Kostikov R.R., Razin V.V. Fizyczne metody wyznaczania struktury związków organicznych: podręcznik. podręcznik do chemii uniwersytety / wyd. B.V. Ioffe. - M.: Szkoła wyższa, 1984. - 336 s.
Spośród różnych reakcji, w które wchodzą związki aromatyczne z udziałem pierścienia benzenowego, na uwagę zasługują przede wszystkim omówione powyżej reakcje podstawienia. Dzieje się tak dlatego, że postępują wbrew oczekiwaniom. Przy stopniu nienasycenia, który jest nieodłączny np. w benzenie, reakcje addycji powinny być bardziej charakterystyczne dla tego węglowodoru. Dzieje się tak w pewnych warunkach; benzen i inne areny dodają atomy wodoru, halogeny, ozon i inne odczynniki zdolne do dodawania.
11.5.5. Uwodornienie. W obecności katalizatorów uwodornienia (platyna, pallad, nikiel) benzen i jego homologi dodają wodór i przekształcają się w odpowiednie cykloheksany. Zatem benzen uwodornia się na katalizatorze niklowym w temperaturze 100-200 0 C i 105 atm:
Uwodornienie arenów ma dwie cechy w porównaniu z alkenami. Po pierwsze, areny są znacznie gorsze od alkenów pod względem reaktywności. Dla porównania z warunkami uwodornienia benzenu zauważamy, że cykloheksen uwodornia się do cykloheksanu już w temperaturze 25°C i pod ciśnieniem 1,4 atm. Po drugie, benzen albo nie dodaje, albo przyłącza trzy cząsteczki wodoru na raz. Nie jest możliwe otrzymanie produktów częściowego uwodornienia, takich jak cykloheksen lub cykloheksadien, poprzez uwodornienie benzenu.
Te cechy podczas uwodornienia, szczególnego przypadku reakcji addycji do pierścienia benzenowego, wynikają z budowy benzenu. Po przekształceniu w cykloheksan benzen przestaje być układem aromatycznym. Cykloheksan zawiera o 150,73 kJ więcej energii (energii rezonansu) i jest mniej stabilny niż benzen. Jest oczywiste, że benzen nie jest skłonny do przejścia w ten termodynamicznie mniej stabilny stan. Wyjaśnia to niższą reaktywność benzenu w stosunku do wodoru w porównaniu z alkenami. Przyłączenie się do układu aromatycznego możliwe jest tylko przy udziale R-elektrony pojedynczej chmury elektronów pierścienia benzenowego. Po rozpoczęciu procesu dodawania układ przestaje być aromatyczny, w wyniku czego powstaje bogata w energię i wysoce reaktywna cząstka, która jest znacznie bardziej podatna na addycję niż arena macierzysta.
11.5.6. Halogenowanie. Wynik oddziaływania halogenu z benzenem zależy od warunków doświadczalnych. Halogenowanie katalityczne prowadzi do powstania produktów podstawienia. Okazało się, że promieniowanie ultrafioletowe inicjuje dodanie atomów halogenu do pierścienia benzenowego arenów. Sam benzen w świetle dodaje 6 atomów chloru i zamienia się w heksachlorocykloheksan, który jest mieszaniną 9 izomerów przestrzennych
Jeden z tych izomerów, w którym 3 chlorki zajmują wiązania osiowe, a kolejne 3 - równikowe (izomer γ, heksachloran), okazał się skutecznym środkiem owadobójczym, środkiem zwalczania szkodliwych owadów. Heksachloran okazał się zbyt stabilny w biosferze i miał zdolność kumulowania się w tkance tłuszczowej zwierząt stałocieplnych, dlatego nie jest obecnie stosowany.
Pod względem reaktywności wobec halogenów i reakcji addycji benzen jest znacznie gorszy od alkenów. Na przykład chlor i brom w czterochlorku węgla, nawet w ciemności, w temperaturze pokojowej, dodaje się do cykloheksenu. W tych warunkach benzen nie reaguje. Dzieje się to tylko w świetle ultrafioletowym.
11.5.7. Ozonowanie. Ozonowanie to kolejny przykład pokazujący, że benzen jako związek nienasycony może ulegać reakcji addycji. Ozonowanie benzenu i badania produktów hydrolizy triozonków przeprowadzono już w 1904 roku ( Harry'ego)
Ciekawe wyniki uzyskano przy ozonowaniu O-ksylen (1941, Wibo). Faktem jest, że skład produktów ozonowania zależy od położenia podwójnych wiązań w pierścieniu benzenowym. Struktura 1 z podwójnymi wiązaniami pomiędzy atomami węgla w pierścieniu benzenowym zawierającym podstawniki metylowe, po ozonowaniu i hydrolizie ozonku, daje 2 cząsteczki metyloglioksalu i cząsteczkę glioksalu
Alternatywna struktura II Dla O-ksylen utworzyłby 2 cząsteczki glioksalu i cząsteczkę diacetylu