Što je kemijski primjer. Najvažnije kemikalije koje se koriste u svakodnevnom životu. Proizvođači i dobavljači industrijskih kemikalija
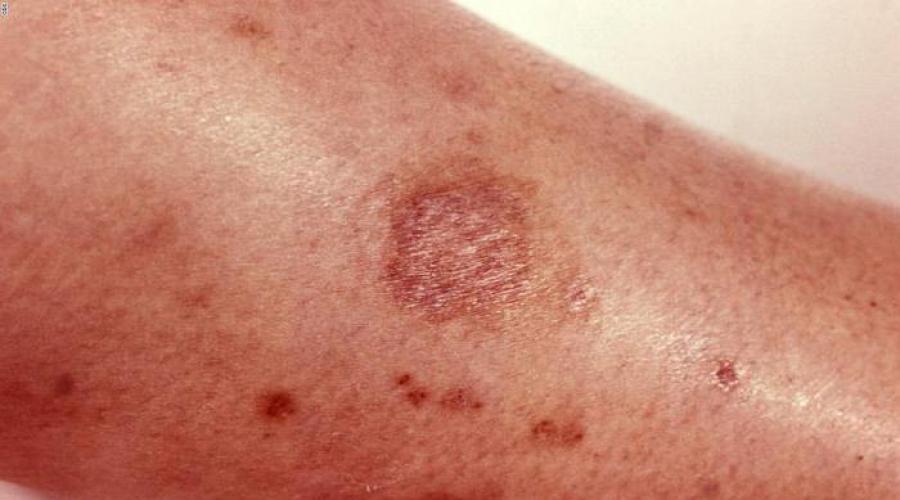
Nemoguće je zamisliti suvremeni život i proizvodnju bez kemikalija. U bliskom kontaktu s njima, na ljudsko tijelo se vrši određeni učinak. Treba napomenuti da postoje i spojevi koji će pokazati svoj utjecaj nakon određenog vremenskog razdoblja. U članku ćemo pokušati shvatiti koji kemijski čimbenici postoje, klase opasnosti štetnih tvari, kao i kako utječu na ljudsko tijelo.
Ljudska uporaba kemikalija
Danas je poznato nekoliko milijuna kemijskih spojeva, a većinu njih ljudi koriste u raznim industrijama. Ako promatramo klase opasnosti kemikalija sa stajališta primjene, popis može izgledati ovako:
- Otrovne tvari koje se koriste u industriji. To uključuje: bojila (anilin), među otapalima je npr. dikloretan.
- Pesticidi se široko koriste u poljoprivrednoj industriji.
- Kemijski spojevi koji se koriste u svakodnevnom životu: proizvodi za higijenu, za dezinfekciju.
- Otrovne tvari prirodnog porijekla, poput biljnih i životinjskih otrova.
- Otrovne tvari: iperit, fosgen i druge.
Različite klase opasnosti štetnih kemikalija mogu ući u tijelo kroz organe dišnog sustava, kožu ili sluznicu. Tvari mogu imati negativan utjecaj selektivno, odnosno na određeni organski sustav. Na primjer, olovo utječe na ljudski reproduktivni sustav, a dušikovi oksidi mogu izazvati oticanje plućnog tkiva.
Toksični učinci kemikalija
Ako uzmemo u obzir klasu opasnosti kemikalija, GOST razlikuje nekoliko skupina. Svaka ima svoje podjele.
Razlikuje se pet klasa ovisno o toksičnom učinku i prosječnoj smrtonosnoj dozi.
- Prva klasa opasnosti uključuje spojeve koji zahtijevaju vrlo malo da oštete tijelo. Na primjer, kada se uzme kroz želudac, ta količina je 50 mg po kilogramu ljudske težine.
- Klasa 2 uključuje tvari čija koncentracija može biti veća da izazove toksični učinak. To može biti između 5 i 50 mg po m3 ako se izlaganje događa kroz kožu ili gastrointestinalni trakt.
- Klase 3 i 4 uključuju spojeve koji zahtijevaju više od prve dvije klase i obično je ta količina do 5000 jedinica.
- Peta klasa uključuje tvari koje uzrokuju duboka toksična oštećenja.
Kemikalije i organ vida
Ako uzmemo u obzir učinak kemikalija na organ vida, razlikuju se sljedeće klase:
- U prvu klasu spadaju spojevi koji dovode do nepovratnih promjena u očnom aparatu, a sve to završava oštećenjem vida.
- Druga klasa sadrži tvari koje uzrokuju patološke promjene vida, ali mogu proći u roku od nekoliko tjedana.
Učinak kemikalija na kožu
Postoji još jedna klasifikacija, ona identificira klase kemikalija koje imaju negativan učinak na kožu. Prilikom podjele spojeva korištena su dva kriterija. S obzirom na prvu, postoje tri razreda:
- Prva skupina uključuje tvari koje uzrokuju vidljivu nekrozu kože.
- Druga klasa uključuje tvari koje uzrokuju reverzibilna oštećenja. Za otprilike dva tjedna koža se obnavlja.
- Tvari koje pripadaju trećoj klasi uzrokuju samo blagu iritaciju kože, koja obično nestaje za nekoliko dana.

Drugi kriterij razvrstavanja koristi se u slučajevima kada nema dovoljno podataka da bi se tvari svrstale u prve tri skupine.
Utjecaj kemijskih spojeva na okoliš
Prema GOST-u, postoji i klasifikacija koja uzima u obzir utjecaj kemijskih spojeva na okoliš. Ova skupina uključuje sljedeće kategorije tvari:
- Štetno za ozonski omotač.
- S akutnim toksičnim djelovanjem na vodeni okoliš.
- Tvari koje imaju postupni toksični učinak na stanovnike vodenih resursa.
Svi ti štetni spojevi također se mogu podijeliti u kategorije prema štetnosti. Za pružanje toksičnog učinka dovoljna je koncentracija od 0,1 mg / l.
Razvrstavanje kemikalija prema razredima opasnosti
U velikom broju poznatih tvari, nisu sve jednako opasne za ljudski organizam. Razlikuju se sljedeće klase:
- Prva klasa uključuje iznimno opasne tvari i spojeve. Za smrtni ishod bit će dovoljno da u želudac uđe 15 mg tvari po kilogramu tjelesne težine. Primjeri uključuju sljedeće: kalij cijanid, živu, nikotin i druge.
- Druga klasa uključuje vrlo opasne tvari. Smrtonosna doza kreće se od 15 do 150 mg po kilogramu tjelesne težine, s obzirom na svojstva tvari. Ovi spojevi imaju negativan utjecaj ne samo na ljude, već i na okoliš. To uključuje: arsen, litij, olovo, kloroform.
- Umjereno opasna je treća klasa opasnosti kemikalija. Za smrtonosni ishod dovoljno je 500-2500 mg / kg. Kada se proguta, smrtonosna doza je 150-5000 mg/kg tjelesne težine. Ova klasa uključuje: benzin, spojeve aluminija i mangana. Budući da se mnoge tvari ove klase često koriste u svakodnevnom životu, s njima se ne smije rukovati nemarno.
- Najbezopasnije su tvari niske opasnosti, jer se razlikuju po niskoj toksičnosti i opasnosti. Te nas tvari često okružuju, na primjer, amonijak se može naći u svakom ormariću s lijekovima, kerozin se koristi u lampama, etanol se koristi u medicini i nalazi se u alkoholnim pićima.

Nije važno koliko klasa opasnosti postoji, važno je sa svim njima postupati s krajnjim oprezom, poštivati sve sigurnosne mjere pri radu s njima.
Klasifikacija tvari prema njihovom učinku na tijelo
Sve dostupne kemikalije i spojevi međusobno se razlikuju ne samo po stupnju toksičnosti, već i po prirodi utjecaja na ljude.
Ovisno o pripadnosti klasi opasnosti, svim tvarima se dodjeljuje određena boja.
- Izuzetno opasne tvari označene su crvenom bojom.
- Visok stupanj opasnosti označen je narančastom bojom.
- Umjereno opasne su žute.
- Tvari koje su klasificirane kao niskorizične označene su zelenom bojom.
Klasifikacija tvari prema toksičnim učincima
Potpuno različite toksičnosti kemikalija, klase opasnosti u tom pogledu, razlikuju se sljedeće:
- U tvari koje djeluju paralitički na živce spadaju: insekticidi, nikotin, sarin.
- Spojevi koji uzrokuju upalne procese i nekrotične promjene u svezi s općim toksičnim učinkom. Primjer je: esencija octa, arsen, živa.
- Spojevi koji uzrokuju konvulzije, komu, cerebralni edem, odnosno imaju opći toksični učinak. To uključuje: cijanovodičnu kiselinu, ugljični monoksid, alkohol.
- Sredstva za gušenje (fosten, dušikovi oksidi).
- Tvari koje izazivaju suzenje i iritaciju sluznice. Primjer je: parovi kiselina i lužina.
- Tvari i spojevi koji utječu na psihu. To uključuje narkotičke tvari, atropin i druge.

Posebnu pozornost treba posvetiti upotrebi ili kontaktu s tim tvarima.
Međunarodna klasifikacija
Razmotrili smo koliko klasa opasnosti kemikalija postoji prema GOST-u, ali postoji i podjela na temelju međunarodnih zahtjeva. Predstavlja 9 grupa, od kojih svaka ima svoja pravila za transport i skladištenje.
- Tvari koje mogu lako eksplodirati ili se zapaliti.
- U drugu klasu spadaju tvari koje su zapaljive, otrovne, kemijski nestabilne.
- Kemikalije u tekućem stanju koje su vrlo zapaljive spadaju u klasu 3.
- Klasa 4 uključuje krute tvari koje se mogu samozapaliti ili zapaliti nakon vanjskog izlaganja.
- Organski oksidanti spadaju u 5. klasu, jer su u stanju otpuštati kisik koji podržava izgaranje.
- Klasa 6 - to su otrovne tvari koje uzrokuju teška trovanja ili dovode do smrti kada se udišu para.
- Sljedeća klasa su radioaktivne tvari.
- Korozivne tvari su osma klasa opasnosti.
- Klasa 9 uključuje sve ostale tvari koje nisu spadale u prethodne razrede, ali donekle mogu biti opasne.

Kako se zaštititi od opasnih tvari
Važno je ne samo poznavati klasu opasnosti kemikalija, već i biti u stanju minimizirati stupanj utjecaja na ljudsko tijelo i prirodu. Da biste to učinili, možete koristiti sljedeće metode:
- Smjestite otrovne i štetne tvari u poduzeća što dalje od radnih mjesta.
- Imati moderan i učinkovit ventilacijski sustav za uklanjanje opasnih tvari.
- Pravovremeno koristite osobnu zaštitnu opremu.
- Prije ispuštanja u okoliš koristite suvremene metode pročišćavanja vode.
- Razrijediti štetne spojeve do prihvatljivih koncentracija.

Korištenje ovih dostupnih metoda omogućit će zaštitu čovjeka i prirode od djelovanja štetnih kemikalija što je više moguće.
Sumirati
Da rezimiramo sve rečeno, moguće je ne samo izdvojiti klasu opasnosti kemikalija, već i zabilježiti sljedeće vrste izloženosti štetnim spojevima:
- Nadražujuće djelovanje, ako dospije na kožu, uzrokuje crvenilo, na primjer, fluor, fosfor itd.
- Kauterizirajuće djelovanje tvari može uzrokovati opekline različitog stupnja. To uključuje: amonijak, klorovodičnu kiselinu.
- Supstance koje guše mogu dovesti do gušenja i smrti. Fozgen i kloropikrin imaju ovaj učinak.
- Tvari s toksičnim djelovanjem mogu uzrokovati trovanje različite težine. To uključuje: sumporovodik, cijanovodičnu kiselinu, etilen oksid i druge.
- Mutagene tvari mogu izazvati pojavu mutacija.
- Izloženost kancerogenim tvarima dovodi do razvoja raka.
Neke klasifikacije također oslobađaju narkotičke tvari, koje, ulazeći u tijelo, uzrokuju ovisnost i postupno trovanje tijela.
Tako smo se upoznali s raznolikošću kemikalija koje nas okružuju gotovo posvuda. Gotovo je nemoguće zamisliti modernu industriju i proizvodnju bez kemije. Ali kako ne biste naštetili svom tijelu u procesu interakcije sa štetnim tvarima, morate biti posebno oprezni i poznavati pravila skladištenja i transporta.
kratice:
T bale. -temperatura ključanja,
T pl. - temperatura topljenja.
Adipinska kiselina (CH 2) 4 (COOH) 2- bezbojni kristali, topljivi u vodi. T. pl. 153 °C. Tvori soli – adipati. Koristi se za uklanjanje kamenca.
Dušična kiselina HNO 3- bezbojna tekućina oštrog mirisa, beskonačno topiva u vodi. T. kip. 82,6 °C. Jaka kiselina, uzrokuje duboke opekline i s njom se mora pažljivo rukovati. Tvori soli – nitrate.
Kalij alum KAl (SO 4) 2,12H 2 O- dvostruka sol, bezbojna kristalna tvar, vrlo topiva u vodi. T pl. 92 °C.
Amil acetat CH 3 COOS 5 H 11 (amil ester octene kiseline)— bezbojna tekućina s voćnim mirisom, organskim otapalom i mirisom.
Aminokiseline- organske tvari u čijim se molekulama nalaze karboksilne skupine COOH i amino skupine NH2. Uključeno u sastav proteina.
Amonijak NH- bezbojni plin oštrog mirisa, vrlo topiv u vodi, tvori amonijak hidrat NH 3 .H 2 O.
Amonijev (amonijev) nitrat, cm.. Anilin (aminobenzen, fenilamin) C 6 H 5 NH 2- viskozna bezbojna tekućina koja potamni na svjetlu i na zraku. Netopljiv u vodi, topiv u etilnom alkoholu i dietil eteru. T bale. 184 °C. Otrovno.
Arahidonska kiselina C 19 H 31 COOH- nezasićena karboksilna kiselina s četiri dvostruke veze u molekuli, bezbojna tekućina. T bale. 160-165 °C. Dio je biljnih masti.
askorbinska kiselina (vitamin C), organska tvar složene strukture - bezbojni kristali, osjetljivi na toplinu. Sudjeluje u redoks procesima živog organizma.
Vjeverice- biopolimeri koji se sastoje od aminokiselinskih ostataka. Oni igraju važnu ulogu u životnim procesima.
Benzin— smjesa lakih ugljikovodika; dobiveni tijekom prerade nafte. T bale. od 30 do 200 °C. Gorivo i organsko otapalo.
Benzojeva kiselina C 6 H 5 COOH- bezbojna kristalna tvar, slabo topiva u vodi. Iznad 100 °C se raspada.
Benzen C 6 H 6- aromatski ugljikovodik. T bale. 80 °C. Zapaljivo, otrovno.
Betain (trimetilglicin) (CH 3) 3 N + CH 2 COO- organska tvar, vrlo topiva u vodi, nalazi se u biljkama (na primjer, u repi).
Borna kiselina B (OH) 3- bezbojna kristalna tvar, slabo topiva u vodi, slaba kiselina.
Natrijev bromat NaBrO 3- bezbojni kristali, topljivi u vodi. Topi se na 384°C uz raspadanje. U kiseloj sredini je jako oksidacijsko sredstvo.
Vosak- amorfna tvar nalik masti biljnog podrijetla, mješavina estera masnih kiselina. Topi se u rasponu od 40-90 °C.
Galaktoza C 6 H 12 O 6 .H 2 O- ugljikohidrat, monosaharid, bezbojna kristalna tvar, topljiva u vodi.
Natrijev hipoklorit (trihidrat) NaClO .ZN 2 O- zelenkasto-žuta kristalna tvar, vrlo topiva u vodi. T. pl. 26 °C, iznad 40 °C se raspada, eksplodira u prisutnosti organskih tvari. Izbjeljivač.
Glicerin CH (OH) (CH 2 OH) 2- bezbojna viskozna tekućina, neograničeno topiva u vodi i upija vlagu iz zraka, trihidrični alkohol. Uključeno u sastav masti u obliku lipida - triglicerida (esteri glicerola s organskim kiselinama).
Glukoza (grožđani šećer) C 6 H 12 O 6- ugljikohidrat, monosaharid, bezbojna kristalna tvar, vrlo topljiva u vodi. T pl. 146 °C. Nalazi se u soku svih biljaka te u krvi ljudi i životinja.
Kalcijev glukonat Ca [CH 2 OH (CHOH) 4 COO] 2. H 2 O (monohidrat)- bijeli kristalni prah, slabo topiv u hladnoj vodi, praktički netopljiv u etilnom alkoholu.
Glukonska (šećerna) kiselina CH 2 (OH) (CHOH) 4 COOH- bezbojna kristalna tvar, topiva u vodi, dobivena oksidacijom glukoze. Tvori soli – glukonate.
Dvostruki superfosfat (kalcij dihidroortofosfat monohidrat) Ca (H 2 PO 4) 2 .H 2 O- bijeli prah, topiv u vodi.
Dibutil ftalat C 6 H 4 (SOOS 4 H 9) 2 (butil ester ftalne kiseline)- bezbojna tekućina s voćnim mirisom, slabo topiva u vodi. Organsko otapalo i repelent.
Amonijev dihidroortofosfat NH 4 H 2 PO 4- bezbojna kristalna tvar, topiva u vodi. Gnojivo (diamo-phos).
Dimetzlftalat C 6 H 4 (COOSH 3) 2 (metil ester ftalne kiseline) je bezbojna hlapljiva tekućina. Organsko otapalo i repelent.
Željezni vitriol (željezni sulfat heptahidrat) F e S O 4 .7H 2 O- zelenkasti kristali, topljivi u vodi. Na zraku postupno oksidira.
Željezni minium- željezov oksid (III) Fe 2 O 3 s nečistoćama. Mineralna boja crveno-smeđe boje.
Žuta krvna sol (kalijev heksacijanoferat (II) trihidrat) K 4 [Fe (CN) 6]. ZN 2 O- svijetložuti kristali, topljivi u vodi. U XVIII stoljeću. Dobiven je iz otpada klaonica, pa otuda i naziv.
Masna kiselina- karboksilne kiseline koje sadrže 13 ili više ugljikovih atoma.
soda pepela, cm..
Kamfor C 10 H 16 O- bezbojni kristali karakterističnog mirisa. T pl. 179 °C, lako sublimira pri zagrijavanju. Topiv u organskim otapalima, slabo topiv u vodi.
Rosin- žuta staklena tvar. T pl. 100 - 140 ° C, sastoji se od smolnih kiselina - organskih tvari cikličke strukture. Topiv u organskim otapalima i octenoj kiselini, netopljiv u vodi.
Amonijev karbonat (NH 4) 2 CO 3- bezbojna kristalna tvar, vrlo topiva u vodi, zagrijavanjem se raspada.
Kerozin- mješavina ugljikovodika, dobivena tijekom rafiniranja nafte. T bale. 150-300 °C. Gorivo i organsko otapalo.
Crvena krvna sol K 3 [Fe (CN) 6] (kalijev heksacijanoferat (SH))- crveni kristali, topljivi u vodi. U XVIII stoljeću. Dobiven je iz otpada klaonica, pa otuda i naziv.
Škrob [C 6 H 10 O 5] n- bijeli amorfni prah, polisaharid. Kod dugotrajnog kontakta s vodom bubri, pretvara se u pastu i zagrijavanjem stvara dekstrin. Sadrži u krumpiru, brašnu, žitaricama.
Lakmus- prirodna organska tvar, kiselinsko-bazni indikator (plava u alkalnoj, crvena u kiseloj sredini).
Maslačna kiselina C 3 H 7 COOH- bezbojna tekućina neugodnog mirisa. T bale. 163 °C.
Merkaptani (tioalkoholi)- organski spojevi koji sadrže SH skupinu, na primjer, metil merkaptan CH 3 SH. Imaju odvratan miris.
Željezov metahidroksid FeO(OH)- smeđe-smeđi prah, netopiv u vodi, osnova hrđe.
Natrijev metasilikat (nonahidrat) Na 2 SiO 3 .9H 2 O- bezbojna tvar, vrlo topiva u vodi. T pl. 47 °C, iznad 100 °C gubi vodu. Vodene otopine (silikatno ljepilo, vodeno staklo) su zbog hidrolize jako alkalne.
Ugljični monoksid (ugljični monoksid) CO- plin bez boje i mirisa, jak otrov. Nastaje tijekom nepotpunog izgaranja organskih tvari.
Mravlja kiselina HCOOH- bezbojna tekućina oštrog mirisa, neograničeno topiva u vodi, jedna od najjačih organskih kiselina. T bale. 100,7 °C. Sadrži u izlučevinama insekata, u koprivama, iglicama. Tvori soli – formate.
Naftalen C 10 H 8- bezbojna kristalna tvar oštrog karakterističnog mirisa, netopiva u vodi. Sublimira na 50 °C. Otrovno.
Amonijak- 5-10% vodena otopina amonijaka.
Nezasićene (nezasićene) masne kiseline Masne kiseline koje imaju jednu ili više dvostrukih veza u svojim molekulama.
Polisaharidi složeni ugljikohidrati (škrob, celuloza itd.).
Propan C 3 H 8- bezbojni zapaljivi plin, ugljikovodik.
Propionska kiselina C 2 H 5 COOH- bezbojna tekućina, topiva u vodi. T bale. 141 °C. Slaba kiselina, stvara soli - propionate.
Jednostavan superfosfat- mješavina u vodi topljivog kalcijevog dihidroortofosfata Ca (H 2 PO 4) 2. H 2 O i netopljivog kalcijevog sulfata CaSO 4.
Rezorcinol C 6 H 4 (OH) 2- bezbojni kristali karakterističnog mirisa, topljivi u vodi i etil alkoholu. T pl. 109 - 110 °C
Salicilna kiselina HOS 6 H 4 COOH- bezbojna kristalna tvar, slabo topiva u hladnoj vodi, vrlo topljiva u etilnom alkoholu. T pl. 160 °C.
Saharoza C 12 H 22 O 11- bezbojna kristalna tvar, dobro topljiva u vodi. T pl. 185 °C.
Crveno olovo Rb 3 O 4- fino kristalna tvar crvene boje, netopiva u vodi. Jaki oksidant. Pigment. Otrovno.
Sumpor S 8- žuta kristalna tvar, netopiva u vodi. T pl. 119,3 °C.
Sumporna kiselina H 2 SO 4- bezbojna uljasta tekućina bez mirisa, neograničeno topiva u vodi (uz jako zagrijavanje). T bale. 338 °C. Jaka kiselina, kaustična tvar, stvara soli - sulfate i hidrosulfate.
Boja sumpora- fino mljeveni sumporni prah.
Sumporovodik H 2 S- pri razgradnji proteina nastaje bezbojni plin s mirisom pokvarenih jaja, topiv u vodi. Snažan restaurator. Otrovno.
Silika gel (polihidrat silicij dioksida) n SiO 2 m H2O- bezbojne granule, netopive u vodi. Dobar adsorbent (apsorber) vlage.
Ugljik tetraklorid (ugljik tetraklorid) CCl 4- bezbojna tekućina, netopiva u vodi. T bale. 77 °C. Otapalo. Otrovno.
Tetraetil olovo Rb (C 2 H 5) 4 je bezbojna zapaljiva tekućina. Dodatak za automobilsko gorivo (do 0,08%). Otrovno.
Natrijev tripolifosfat Na 3 P 3 O 9- bezbojna krutina, neograničeno topiva u vodi, vodene otopine imaju alkalno okruženje zbog hidrolize.
ugljikovodici- organski spojevi sastava C x H y (na primjer, propan C 3 H 8, benzen C 6 H 6).
Ugljična kiselina H 2 CO 3- slaba kiselina, postoji samo u vodenoj otopini, stvara soli - karbonate i bikarbonate.
Octena kiselina CH 3 COOH- bezbojna tekućina. Kristalizira na 17°C. Neograničeno topiv u vodi i etilnom alkoholu. "Ledena" octena kiselina sadrži 99,8% CH 3 COOH.
Octeni aldehid, cm..
Fruktoza (voćni šećer) C 6 H 12 O 6 .H 2 O- monosaharid, bezbojna kristalna tvar, topljiva u vodi. T pl. oko 100 °C. Jedan i pol puta slađi od saharoze, nalazi se u voću, cvjetnom nektaru, medu.
Vodik fluorid HF- bezbojni plin zagušljivog mirisa, dobro ćemo otopiti u vodi uz stvaranje fluorovodične (fluorovodične) kiseline.
citrati- soli limunske kiseline.
Oksalna kiselina (dihidrat) H 2 C 2 O 4 .2H 2 O- bezbojna kristalna tvar, topiva u vodi. Sublimira na 125 °C. Sadrži u kiselici, špinatu, kiselici u obliku kalijeve soli.
Etil acetat (etil acetat) CH 3 COOS 2 H 5- bezbojna tekućina s voćnim mirisom, slabo topiva u vodi. T bale. 77 °C.
Etilen glikol C 2 H 4 (OH) 2 - bezbojna viskozna tekućina, beskonačno topljiva u vodi. T pl. 12,3 °C, Tbp. 197,8 °C. Otrovno.
Etilni alkohol (etanol, vinski alkohol) C 2 H 5 OH— bezbojna tekućina, neograničeno topiva u vodi. T bale. 78 °C. Koristi se kao otapalo i konzervans. U velikim dozama - jak otrov.
Eteri- organske tvari, uključujući fragmente alkohola ili alkohola i kiselina, spojene preko atoma kisika.
Jabučna (oksijantarna) kiselina CH (OH) CH 2 (COOH) 2- bezbojna kristalna tvar, topiva u vodi. T pl. 100 °C.
Jantarna kiselina (CH 2) 2 (COOH) 2- bezbojna kristalna tvar, topiva u vodi. T pl. 183 °C. Tvori soli – sukcinate.
Elementarne čestice fizičke materije na našem planetu su atomi. U slobodnom obliku mogu postojati samo na vrlo visokim temperaturama. U normalnim uvjetima, elementarne čestice teže međusobnom ujedinjavanju uz pomoć kemijskih veza: ionskih, metalnih, kovalentno polarnih ili nepolarnih. Na taj način nastaju tvari, čije ćemo primjere razmotriti u našem članku.
Jednostavne tvari
Procesi interakcije između atoma istog kemijskog elementa završavaju stvaranjem kemikalija koje se nazivaju jednostavnim. Dakle, ugljen tvore samo atomi ugljika, plinoviti vodik tvore atomi vodika, a tekuća živa se sastoji od čestica žive. Pojam jednostavne tvari ne treba poistovjećivati s pojmom kemijskog elementa. Na primjer, ugljični dioksid se ne sastoji od jednostavnih tvari ugljika i kisika, već od elemenata ugljika i kisika. Konvencionalno, spojevi koji se sastoje od atoma istog elementa mogu se podijeliti na metale i nemetale. Razmotrimo neke primjere kemijskih svojstava takvih jednostavnih tvari.
Metali
Na temelju položaja metalnog elementa u periodnom sustavu mogu se razlikovati sljedeće skupine: aktivni metali, elementi glavnih podskupina treće - osme skupine, metali sekundarnih podskupina četvrte - sedme skupine, kao i lantanidi i aktinidi. Metali - jednostavne tvari, čije ćemo primjere dati u nastavku, imaju sljedeća opća svojstva: toplinsku i električnu vodljivost, metalni sjaj, duktilnost i savitljivost. Takve karakteristike su svojstvene željezu, aluminiju, bakru i drugima. S povećanjem serijskog broja u periodima, povećavaju se temperature vrenja i taljenja, kao i tvrdoća metalnih elemenata. To je zbog kompresije njihovih atoma, odnosno smanjenja radijusa, kao i nakupljanja elektrona. Svi parametri metala određeni su unutarnjom strukturom kristalne rešetke ovih spojeva. U nastavku razmatramo kemijske reakcije, a također navodimo primjere svojstava tvari povezanih s metalima.
Značajke kemijskih reakcija
Svi metali s oksidacijskim stanjem 0 pokazuju samo svojstva redukcijskih sredstava. Alkalni i zemnoalkalni elementi u interakciji s vodom tvore kemijski agresivne baze - alkalije:
- 2Na+2H20=2NaOH+H2
Tipična reakcija metala je oksidacija. Kao rezultat veze s atomima kisika nastaju tvari klase oksida:
- Zn + O 2 \u003d ZnO
To su binarni spojevi koji se odnose na složene tvari. Primjeri bazičnih oksida su oksidi natrija Na 2 O, bakra CuO, kalcija CaO. Sposobni su komunicirati s kiselinama, zbog čega se u proizvodima nalaze sol i voda:
- MgO + 2HCl \u003d MgCl 2 + H 2 O

Tvari klasa kiselina, baza, soli složeni su spojevi i pokazuju različita kemijska svojstva. Na primjer, između hidroksida i kiselina dolazi do reakcije neutralizacije, što dovodi do pojave soli i vode. Sastav soli ovisit će o koncentraciji reagensa: na primjer, s viškom kiseline u reakcijskoj smjesi, dobivaju se kisele soli, na primjer, NaHCO 3 - natrijev bikarbonat, a visoka koncentracija alkalija uzrokuje stvaranje bazične soli, kao što je Al (OH) 2 Cl - aluminijev dihidroksoklorid.
nemetali
Najvažniji nemetalni elementi nalaze se u skupinama dušika, ugljika, halogena i halkogena periodnog sustava. Navedimo primjere tvari koje se odnose na nemetale: to su sumpor, kisik, dušik, klor. Sva njihova fizička svojstva suprotna su svojstvima metala. Ne provode električnu struju, ne prenose dobro toplinske zrake i imaju nisku tvrdoću. U interakciji s kisikom, nemetali tvore složene spojeve - kisele okside. Potonji, reagirajući s kiselinama, daju kiseline:
- H 2 O + CO 2 → H 2 CO 3
Tipična reakcija karakteristična za kisele okside je interakcija s lužinama, što dovodi do pojave soli i vode.
Kemijska aktivnost nemetala u tom razdoblju raste, to je zbog povećanja sposobnosti njihovih atoma da privlače elektrone iz drugih kemijskih elemenata. U skupinama promatramo suprotan fenomen: nemetalna svojstva slabe zbog inflacije volumena atoma zbog dodavanja novih energetskih razina.

Dakle, ispitali smo vrste kemikalija, primjere koji ilustriraju njihova svojstva, položaj u periodnom sustavu.
Kemikalije su, po definiciji, neka vrsta opasnosti ako se koriste nepravilno i ako se ne poštuju mjere opreza. Kako bi se točno znalo što se može očekivati od određene tvari, postoje klasifikacije kemikalija prema stupnju opasnosti.
Prema utvrđenim zahtjevima GOST 12.1.007-76 kemikalije se dijele u četiri klase o razini toksičnosti i njihovom utjecaju na žive organizme, posebice na ljude i životinje. Klasa opasnosti ovisi o čimbenicima kao što su MPC, CVIO, prosječna smrtonosna doza pri nanošenju na kožu ili gutanju. Drugi dokument koji regulira razinu opasnosti od kemikalija je SanPiN 2.1.4. 1074-01 (prikaz, stručni).
Razvrstavanje kemijski opasnih tvari
1. klasa opasnosti
1. klasa opasnosti. To su iznimno opasne tvari., MPC koji je manji od 0,1. Doza ingestije za postizanje smrtonosnog ishoda manja je od 15 mg/kg bilo koje tvari u ovoj klasi toksičnosti. Već 100 ili manje miligrama takve tvari po kilogramu dovoljno je da u dodiru s kožom bude smrtonosno. Gore navedene doze tijekom pokusa dovele su do smrti više od polovice pokusnih životinja. U tablicama se spominju kao LD 50 (oralni) i LD 50 (dermalni).
Sljedeći, najvažniji pokazatelj toksičnosti i opasnosti neke tvari je njezin MPC, odnosno najveća dopuštena koncentracija. MPC iznimno opasnih tvari u atmosferi je oko 0,1 miligrama po kubnom metru. Faktor mogućnosti inhalacijskog trovanja je veći od 300, zona akutnog djelovanja je 6,0, zona kroničnog djelovanja je 10, zona biološkog djelovanja je veća od 1000.
Uobičajeno je da se nikotin, kalijev cijanid i druge nazivaju iznimno opasnim tvarima. Prekoračenje gore navedenih pokazatelja dovodi do nepovratnih poremećaja u ekološkom sustavu i smrti živih organizama.2. klasa opasnosti
To su vrlo opasne tvari., LD 50 (oralni) takvih tvari iznosi 15–150 mg/kg, ovisno o prirodi tvari, a LD 50 (dermalni) je 100–500 mg/kg. Ove tvari su zbog svog razornog djelovanja od velike opasnosti za ljude i životinje.
Oni također nose veliku opasnost za, budući da je MPC takvih tvari do 1,0 miligrama, KVIO - od 30 do 300, ZOD - 6, 18, ZKhD - 5-10, ZBD - 100-100.
Vrlo opasne tvari uključuju arsen, kloroform, olovo, litij i tako dalje. Često se te tvari koriste kao otrovi ili sredstva za smirenje. Većina njih ima vrlo ograničen pristup.3. klasa opasnosti
Umjereno opasne tvari. Smrtonosna doza takvih tvari u dodiru s kožom je 501-2500 mg/kg, a ako se progutaju - 151-5000 mg/kg. Maksimalna dopuštena koncentracija u atmosferi je do 10 mg / m3, koeficijent pojave inhalacijskog trovanja na temperaturi od 20 stupnjeva Celzija je od 3 do 30. Ovaj pokazatelj je utvrđen tijekom pokusa na laboratorijskim miševima.
Zona akutnog djelovanja je 18-54, zona kroničnog djelovanja je 5-2,5, biološkog djelovanja je od 10 do 100.
Popis umjereno opasnih tvari uključuje benzin, aluminijsku kiselinu, aluminijeve spojeve, mangan i tako dalje. Unatoč relativno niskim stopama, s takvim tvarima treba postupati s oprezom. Ove tvari se aktivno koriste ne samo u proizvodnji, već iu svakodnevnom životu i zato im morate obratiti posebnu pozornost.4. klasa opasnosti
Nisko opasne tvari. Ove kemikalije predstavljaju najmanju opasnost zbog svoje niske ocjene opasnosti i toksičnosti. LD 50 (oralni) takvih tvari je više od 5000 mg / kg, dermalno - više od 2500 mg / kg, MPC - više od 10, KVIO - manje od 0,3, zona akutnog djelovanja - više od 54, zona kroničnog djelovanja - manje od 2,5, a zona biološkog djelovanja - manje od 10.
Svima su poznate ove tvari, budući da one većinom predstavljaju jednu od komponenti našeg života. Na popisu nisko opasnih tvari nalazi se popularni kerozin za gorivo, amonijak, koji se može naći u gotovo svakom medicinskom ormariću, aluminij, spojevi željeza i etanol. Vrlo često se te tvari koriste za provođenje eksperimenata na satovima kemije.Popis štetnih tvari po prirodi utjecaja na tijelo
Kemijske tvari i elementi mogu se razlikovati ne samo po toksičnosti, već i po prirodi njihovog učinka na tijelo. A kako biste imali potpunu sliku bilo koje tvari ili spoja, morate uzeti u obzir podatke obje klasifikacije, ovisno o klasi, svakoj od tvari dodijeljena je vlastita boja, prema tablici.
Bit će vam korisno znati kako se to provodi u skladu sa SanPiN 2.1.7.2790-10.
U kojim slučajevima se primjenjuju sve veće doplate, pročitajte u novim normama za potrošnju goriva i maziva.
Redoslijed upisa objekata u "Državni registar postrojenja za odlaganje otpada" nalazi se ovdje.
Dakle, utjecaj kemikalija može biti sljedeće prirode:
- Priroda iritansa. Dodir s kožom može uzrokovati malo crvenila. Takve tvari uključuju fosfor, klor, fluor, vodikove okside itd.
- Priroda cauterizirajućeg djelovanja. U slučaju kontakta s kožom ili unutar tijela mogu nastati opekline različite težine. To su tvari poput klorovodične kiseline i amonijaka.
- Supstance za gušenje. Visok sadržaj takvih tvari u zraku može dovesti do gušenja, a potom i smrti. Fozgen i kloropikrin imaju ovaj učinak.
- Otrovne kemikalije. To su tvari koje mogu negativno utjecati na ljudsko tijelo, uzrokujući različite stupnjeve trovanja. Arsen vodik, sumporovodik, etilen oksid, cijanovodična kiselina - to su tvari koje predstavljaju toksičnu opasnost za žive organizme.
- Narkotične tvari. Takve tvari izazivaju ovisnost, ulazeći u tijelo, uništavaju ga. Odustati se od stečene navike ili je vrlo teško ili nemoguće. Takve tvari nazivaju se drogama i prosječna osoba ih treba izbjegavati. Takve tvari mogu biti korisne samo u medicini, ali čak i tamo postoji niz zahtjeva i ograničenja. Lijekovi uključuju nikotin, metil klorid, metil bromid, formaldehid i tako dalje.
- tvar- oblik tvari određenog sastava, koji se sastoji od molekula, atoma, iona.
- Molekula- najmanja čestica određene tvari koja zadržava svoja kemijska svojstva.
- Atom Najmanja čestica koja se ne može kemijski odvojiti.
- I on- električno nabijeni atom (skupina atoma).
Svijet oko nas sastoji se od mnogo različitih objekata (fizičkih tijela): stolova, stolica, kuća, automobila, drveća, ljudi... Zauzvrat, sva ta fizička tijela sastoje se od jednostavnijih spojeva tzv. tvari: staklo, voda, metal, glina, plastika, itd.
Od iste tvari mogu se izraditi različita fizička tijela, npr. od zlata se izrađuju razni nakit (prstenje, naušnice, prstenje), posuđe, elektrode, kovanice.
Moderna znanost poznaje više od 10 milijuna različitih tvari. Budući da se, s jedne strane, od jedne tvari može načiniti nekoliko fizičkih tijela, a s druge strane složena fizička tijela sastoje se od više supstanci, broj različitih fizičkih tijela općenito je teško objasniti.
Bilo koju tvar može se karakterizirati određenim svojstvima svojstvenim samo njoj, koja omogućuju razlikovanje jedne tvari od druge - to je miris, boja, stanje agregacije, gustoća, toplinska vodljivost, krhkost, tvrdoća, topljivost, talište i vrelište, itd.
Razna fizička tijela, koja se sastoje od istih tvari, pod istim uvjetima okoline (temperatura, tlak, vlaga itd.) imaju ista fizikalna i kemijska svojstva.
Tvari mijenjaju svoja svojstva ovisno o vanjskim uvjetima. Najjednostavniji primjer je dobro poznata voda, koja pri negativnim temperaturama u Celzijusima poprima oblik čvrstog tijela (led), u temperaturnom rasponu od 0 do 100 stupnjeva je tekućina, a iznad 100 stupnjeva pri normalnom atmosferskom tlaku pretvara se u paru (plin), u Istodobno, u svakom od ovih agregatnih stanja, voda ima različitu gustoću.
Jedno od najzanimljivijih i najnevjerojatnijih svojstava tvari je njihova sposobnost, pod određenim uvjetima, da stupaju u interakciju s drugim tvarima, zbog čega se mogu pojaviti nove tvari. Takve interakcije se nazivaju kemijske reakcije.
Također, kada se vanjski uvjeti mijenjaju, tvari mogu doživjeti promjene koje se dijele u dvije skupine – fizikalne i kemijske.
Na fizičke promjene tvar ostaje ista, mijenjaju se samo njezine fizičke karakteristike: oblik, agregacijsko stanje, gustoća itd. Na primjer, kada se led topi, nastaje voda, a kada voda proključa, pretvara se u paru, ali sve transformacije odnose se na jednu tvar - vodu.
Na kemijske promjene tvar može komunicirati s drugim tvarima, na primjer, kada se drvo zagrijava, počinje interakciju s kisikom sadržanim u atmosferskom zraku, što rezultira stvaranjem vode i ugljičnog dioksida.
Kemijske reakcije prate vanjske promjene: promjena boje, pojava mirisa, taloženje, oslobađanje svjetlosti, plina, topline itd. svojstva polaznih materijala.