Pouvoir calorifique moyen du gaz naturel. Chaleur spécifique de combustion du combustible et des matériaux combustibles
Lire aussi
PROPRIÉTÉS PHYSIQUES ET CHIMIQUES DES GAZ NATURELS
À gaz naturels il n'y a pas de couleur, d'odeur, de goût.
Les principaux indicateurs des gaz naturels comprennent : la composition, la chaleur de combustion, la densité, la température de combustion et d'inflammation, les limites d'explosivité et la pression d'explosion.
Les gaz naturels provenant des gisements de gaz pur sont principalement constitués de méthane (82 à 98 %) et d'autres hydrocarbures.
Le gaz combustible contient des combustibles et substances non combustibles. Les gaz combustibles comprennent : les hydrocarbures, l'hydrogène, le sulfure d'hydrogène. Les ininflammables comprennent : le dioxyde de carbone, l'oxygène, l'azote et la vapeur d'eau. Leur composition est faible et s'élève à 0,1-0,3% CO 2 et 1-14% N 2 . Après extraction, du sulfure d'hydrogène gazeux toxique est extrait du gaz, dont la teneur ne doit pas dépasser 0,02 g/m3.
Le pouvoir calorifique est la quantité de chaleur dégagée pendant combustion complète 1 m3 de gaz. La chaleur de combustion se mesure en kcal/m3, kJ/m3 de gaz. Le pouvoir calorifique du gaz naturel sec est de 8000-8500 kcal/m 3 .
La valeur calculée par le rapport de la masse d'une substance à son volume s'appelle la densité de la substance. La densité est mesurée en kg/m3. La masse volumique du gaz naturel dépend entièrement de sa composition et se situe entre c = 0,73-0,85 kg/m3.
La caractéristique la plus importante de tout gaz combustible est la production de chaleur, c'est-à-dire Température maximale obtenu avec une combustion complète du gaz, si quantité requise l'air de combustion correspond exactement aux formules chimiques de combustion, et la température initiale du gaz et de l'air est nulle.
La capacité calorifique des gaz naturels est d'environ 2000 -2100 °C, celle du méthane - 2043 °C. La température de combustion réelle dans les fours est bien inférieure à la puissance calorifique et dépend des conditions de combustion.
La température d'inflammation est la température du mélange air-carburant à laquelle le mélange s'enflamme sans source d'inflammation. Pour le gaz naturel, elle se situe entre 645 et 700 °C.
Tous les gaz combustibles sont explosifs, capables de s'enflammer avec une flamme nue ou une étincelle. Distinguer inférieur et supérieur limite de concentration propagation de la flamme , c'est à dire. les concentrations inférieure et supérieure auxquelles une explosion du mélange est possible. limite inférieure l'explosibilité des gaz est de 3÷6%, supérieur 12÷16%.
Limites explosives.
Mélange gaz-air contenant la quantité de gaz :
jusqu'à 5% - ne brûle pas;
de 5 à 15% - explose;
plus de 15% - brûle lorsque l'air est fourni.
La pression lors de l'explosion du gaz naturel est de 0,8 à 1,0 MPa.
Tous les gaz combustibles peuvent provoquer une intoxication du corps humain. Les principales substances toxiques sont : le monoxyde de carbone (CO), le sulfure d'hydrogène (H 2 S), l'ammoniac (NH 3).
Le gaz naturel n'a pas d'odeur. Afin de déterminer une fuite, le gaz est odorisé (c'est-à-dire qu'on lui donne odeur spécifique). La réalisation de l'odorisation est réalisée à l'aide d'éthylmercaptan. Effectuer l'odorisation aux stations de distribution de gaz (GDS). Lorsque 1 % du gaz naturel pénètre dans l'air, son odeur commence à se faire sentir. La pratique montre que le taux moyen d'éthylmercaptan pour l'odorisation du gaz naturel alimentant les réseaux urbains doit être de 16 g pour 1 000 m3 de gaz.
Comparé à dur et combustible liquide le gaz naturel gagne à bien des égards :
Bon marché relatif, qui s'explique par plus la manière facile mines et transports;
Aucune cendre et élimination des particules solides dans l'atmosphère ;
Chaleur de combustion élevée;
Aucune préparation de combustible pour la combustion n'est requise ;
Le travail des travailleurs des services est facilité et les conditions sanitaires et hygiéniques de leur travail sont améliorées ;
Facilite l'automatisation des processus de travail.
En raison d'éventuelles fuites dues à des fuites dans les raccordements et les raccords des gazoducs, l'utilisation du gaz naturel nécessite une attention et une prudence particulières. La pénétration de plus de 20% du gaz dans la pièce peut entraîner une suffocation, et s'il est présent dans un volume clos de 5 à 15%, il peut provoquer une explosion du mélange gaz-air. Une combustion incomplète produit des monoxyde de carbone CO, qui même à de faibles concentrations conduit à l'empoisonnement du personnel de service.
Selon leur origine, les gaz naturels sont divisés en deux groupes : secs et gras.
Sec Les gaz sont des gaz d'origine minérale et se trouvent dans des zones associées à une activité volcanique présente ou passée. Les gaz secs sont constitués presque exclusivement de méthane seul avec des quantités négligeables de constituants de ballast (azote, gaz carbonique) et ont un pouvoir calorifique Qí=7000÷9000 kcal/nm3.
gras les gaz accompagnent les gisements de pétrole et s'accumulent généralement dans les couches supérieures. De par leur origine, les gaz gras sont proches du pétrole et contiennent de nombreux hydrocarbures facilement condensables. Valeur calorifique gaz liquides Qí=8000-15000 kcal/nm3
Les avantages du combustible gazeux comprennent la facilité de transport et de combustion, l'absence d'humidité des cendres et la grande simplicité de l'équipement de la chaudière.
De même que gaz naturels les gaz combustibles artificiels obtenus lors du traitement sont également utilisés combustibles solides, ou à la suite d'un travail installations industrielles comme gaz résiduaires. Les gaz artificiels sont constitués de gaz combustibles de combustion incomplète de carburant, de gaz de ballast et de vapeur d'eau et sont divisés en riches et pauvres, ayant une valeur calorifique moyenne de 4500 kcal/m3 et 1300 kkam3, respectivement. Composition des gaz : hydrogène, méthane, autres composés d'hydrocarbures CmHn, sulfure d'hydrogène H 2 S, gaz non combustibles, dioxyde de carbone, oxygène, azote et une petite quantité de vapeur d'eau. Ballast - azote et dioxyde de carbone.
Ainsi, la composition du combustible gazeux sec peut être représentée comme le mélange d'éléments suivant :
CO + H 2 + ∑CmHn + H 2 S + CO 2 + O 2 + N 2 \u003d 100%.
La composition du combustible gazeux humide s'exprime comme suit :
CO + H 2 + ∑CmHn + H 2 S + CO 2 + O 2 + N 2 + H 2 O \u003d 100%.
Chaleur de combustion sec le combustible gazeux kJ/m3 (kcal/m3) pour 1 m3 de gaz dans des conditions normales est déterminé comme suit :
Qn \u003d 0,01,
Où Qi est le pouvoir calorifique du gaz correspondant.
La chaleur de combustion du combustible gazeux est donnée dans le tableau 3.
Gaz de haut fourneau formé lors de la fusion du fer dans les hauts fourneaux. Son rendement et sa composition chimique dépendent des propriétés de la charge et du combustible, du mode de fonctionnement du four, des méthodes d'intensification du processus et d'autres facteurs. La production de gaz varie de 1 500 à 2 500 m 3 par tonne de fonte brute. La part des composants non combustibles (N 2 et CO 2) dans le gaz de haut fourneau est d'environ 70 %, ce qui explique sa faible performance thermique (le pouvoir calorifique le plus bas du gaz est de 3 à 5 MJ/m 3).
Lors de la combustion de gaz de haut fourneau, la température maximale des produits de combustion (hors pertes de chaleur et consommation de chaleur pour la dissociation de CO 2 et H 2 O) est de 400-1500 0 C. Si le gaz et l'air sont chauffés avant la combustion, la la température des produits de combustion peut être considérablement augmentée.
gaz de ferroalliage formé lors de la fusion des ferroalliages dans les fours de réduction de minerai. Le gaz provenant de fours fermés, peut être utilisé comme combustible SER (ressources énergétiques secondaires). Dans les fours ouverts, en raison du libre accès de l'air, le gaz brûle sur le dessus. Le rendement et la composition du gaz de ferroalliage dépendent de la qualité de la fonte
alliage, composition de la charge, mode de fonctionnement du four, sa puissance, etc. Composition du gaz : 50-90 % CO, 2-8 % H 2 , 0,3-1 % CH 4 , O 2<1%, 2-5% CO 2 , остальное N 2 . Максимальная температура продуктов сгорания равна 2080 ^0 C. Запылённость газа составляет 30-40 г/м^3 .
convertisseur de gaz formé lors de la fusion de l'acier dans les convertisseurs d'oxygène. Le gaz est constitué principalement de monoxyde de carbone, son rendement et sa composition lors de la fusion changent de manière significative. Après purification, la composition du gaz est approximativement la suivante : 70-80 % CO ; 15-20% CO2 ; 0,5-0,8 % O2 ; 3-12% N 2. La chaleur de combustion du gaz est de 8,4-9,2 MJ/m 3 . La température de combustion maximale atteint 2000 0 С.
gaz de cokerie formé lors de la cokéfaction de la charge de charbon. En métallurgie ferreuse, il est utilisé après l'extraction de produits chimiques. La composition du gaz de cokerie dépend des propriétés de la charge de charbon et des conditions de cokéfaction. Les fractions volumiques des composants dans le gaz se situent dans les limites suivantes, % : 52-62H 2 ; 0,3-0,6 O 2 ; 23,5-26,5 CH4 ; 5,5-7,7 CO ; 1,8-2,6 C02. La chaleur de combustion est de 17-17,6 MJ / m ^ 3, la température maximale des produits de combustion est de 2070 0 С.
Le gaz combustible est divisé en naturel et artificiel et est un mélange de gaz combustibles et non combustibles contenant une certaine quantité de vapeur d'eau, et parfois de la poussière et du goudron. La quantité de gaz combustible est exprimée en mètres cubes dans des conditions normales (760 mm Hg et 0 ° C), et la composition est exprimée en pourcentage en volume. Sous la composition du carburant comprendre la composition de sa partie gazeuse sèche.
carburant au gaz naturel
Le gaz combustible le plus courant est le gaz naturel, qui a un pouvoir calorifique élevé. La base du gaz naturel est le méthane, dont la teneur est de 76,7 à 98%. D'autres composés d'hydrocarbures gazeux font partie du gaz naturel de 0,1 à 4,5 %.
Le gaz liquéfié est un produit du raffinage du pétrole - il se compose principalement d'un mélange de propane et de butane.
Gaz naturel (GNC, GN) : méthane CH4 supérieur à 90 %, éthane C2 H5 inférieur à 4 %, propane C3 H8 inférieur à 1 %
Gaz liquéfié (GPL) : propane C3 H8 supérieur à 65 %, butane C4 H10 inférieur à 35 %
Les gaz combustibles comprennent : l'hydrogène H 2, le méthane CH 4, d'autres composés d'hydrocarbures C m H n, le sulfure d'hydrogène H 2 S et des gaz non combustibles, le dioxyde de carbone CO2, l'oxygène O 2, l'azote N 2 et une petite quantité de vapeur d'eau H 2 O. Indices m et P en C et H caractérisent les composés de divers hydrocarbures, par exemple pour le méthane CH 4 t = 1 et n= 4, pour l'éthane С 2 Н b t = 2 et n= b etc...
Composition du combustible gazeux sec (en pourcentage volumique) :
CO + H 2 + 2 C m H n + H2S + CO2 + O2 + N2 = 100 %.
La partie non combustible du combustible gazeux sec - ballast - est l'azote N et le dioxyde de carbone CO 2 .
La composition du combustible gazeux humide s'exprime comme suit :
CO + H 2 + Σ C m H n + H 2 S + CO 2 + O 2 + N 2 + H 2 O \u003d 100%.
La chaleur de combustion, kJ / m (kcal / m 3), 1 m 3 de gaz sec pur dans des conditions normales est déterminée comme suit:
Q n s \u003d 0,01,
où Qco, Q n 2 , Q avec m n n Q n 2 s. - chaleur de combustion des gaz individuels qui composent le mélange, kJ / m 3 (kcal / m 3); CO, H2, Cm H n , H 2 S - composants qui composent le mélange gazeux, % en volume.
La chaleur de combustion de 1 m3 de gaz naturel sec dans des conditions normales pour la plupart des champs domestiques est de 33,29 - 35,87 MJ / m3 (7946 - 8560 kcal / m3). Les caractéristiques du combustible gazeux sont données dans le tableau 1.
Exemple. Déterminez le pouvoir calorifique inférieur du gaz naturel (dans des conditions normales) de la composition suivante :
H2S = 1%; CH4 = 76,7 % ; C2H6 = 4,5 % ; C3H8 = 1,7 % ; C4H10 = 0,8 % ; C 5 H 12 = 0,6 %.
En substituant dans la formule (26) les caractéristiques des gaz du tableau 1, on obtient :
Q ns \u003d 0,01 \u003d 33981 kJ / m 3 ou
Q ns \u003d 0,01 (5585,1 + 8555 76,7 + 15 226 4,5 + 21 795 1,7 + 28 338 0,8 + 34 890 0,6) \u003d 8109 kcal / m 3.
Tableau 1. Caractéristiques du combustible gazeux
|
Gaz |
Désignation |
Chaleur de combustion Q n s |
|
|
KJ/m3 |
kcal/m3 |
||
| Hydrogène | H, | 10820 | 2579 |
| monoxyde de carbone | DONC | 12640 | 3018 |
| sulfure d'hydrogène | H2S | 23450 | 5585 |
| Méthane | CH 4 | 35850 | 8555 |
| Éthane | C 2 H 6 | 63 850 | 15226 |
| Propane | C 3 H 8 | 91300 | 21795 |
| Butane | C 4 H 10 | 118700 | 22338 |
| Pentane | C 5 H 12 | 146200 | 34890 |
| Éthylène | C2H4 | 59200 | 14107 |
| Propylène | C 3 H 6 | 85980 | 20541 |
| Butylène | C 4 H 8 | 113 400 | 27111 |
| Benzène | C 6 H 6 | 140400 | 33528 |
Les chaudières de type DE consomment de 71 à 75 m3 de gaz naturel pour produire une tonne de vapeur. Le coût du gaz en Russie en septembre 2008 est de 2,44 roubles par mètre cube. Par conséquent, une tonne de vapeur coûtera 71 × 2,44 = 173 roubles 24 kopecks. Le coût réel d'une tonne de vapeur dans les usines est pour les chaudières DE d'au moins 189 roubles par tonne de vapeur.
Les chaudières de type DKVR consomment de 103 à 118 m3 de gaz naturel pour produire une tonne de vapeur. Le coût minimum estimé d'une tonne de vapeur pour ces chaudières est de 103 × 2,44 = 251 roubles 32 kopecks. Le coût réel de la vapeur pour les usines est d'au moins 290 roubles par tonne.
Comment calculer la consommation maximale de gaz naturel pour une chaudière à vapeur DE-25 ? C'est la spécification de la chaudière. 1840 cubes par heure. Mais vous pouvez aussi calculer. 25 tonnes (25 000 kg) doivent être multipliées par la différence entre les enthalpies de la vapeur et de l'eau (666,9-105) et tout cela divisé par le rendement de la chaudière de 92,8% et la chaleur de combustion du gaz. 8300. et tout
Carburant gaz artificiel
Les gaz combustibles artificiels sont des combustibles locaux, car ils ont un pouvoir calorifique beaucoup plus faible. Leurs principaux éléments combustibles sont le monoxyde de carbone CO et l'hydrogène H2. Ces gaz sont utilisés dans les limites de la production où ils sont obtenus comme combustible pour les centrales technologiques et électriques.
Tous les gaz combustibles naturels et artificiels sont explosifs, capables de s'enflammer sur une flamme nue ou une étincelle. Il existe des limites inférieures et supérieures d'explosivité des gaz, c'est-à-dire les concentrations en pourcentage les plus élevées et les plus faibles dans l'air. La limite inférieure d'explosivité des gaz naturels varie de 3 % à 6 %, tandis que la limite supérieure varie de 12 % à 16 %. Tous les gaz combustibles peuvent provoquer une intoxication du corps humain. Les principales substances toxiques des gaz combustibles sont : le monoxyde de carbone CO, le sulfure d'hydrogène H2S, l'ammoniac NH3.
Les gaz combustibles naturels, ainsi que les gaz artificiels, sont incolores (invisibles), inodores, ce qui les rend dangereux lorsqu'ils pénètrent à l'intérieur de la chaufferie par des fuites dans les raccords des conduites de gaz. Pour éviter l'empoisonnement, les gaz combustibles doivent être traités avec un odorant - une substance à l'odeur désagréable.
Obtention de monoxyde de carbone CO dans l'industrie par gazéification de combustible solide
À des fins industrielles, le monoxyde de carbone est obtenu par gazéification de combustible solide, c'est-à-dire sa transformation en combustible gazeux. Ainsi, vous pouvez obtenir du monoxyde de carbone à partir de n'importe quel combustible solide - charbon fossile, tourbe, bois de chauffage, etc.
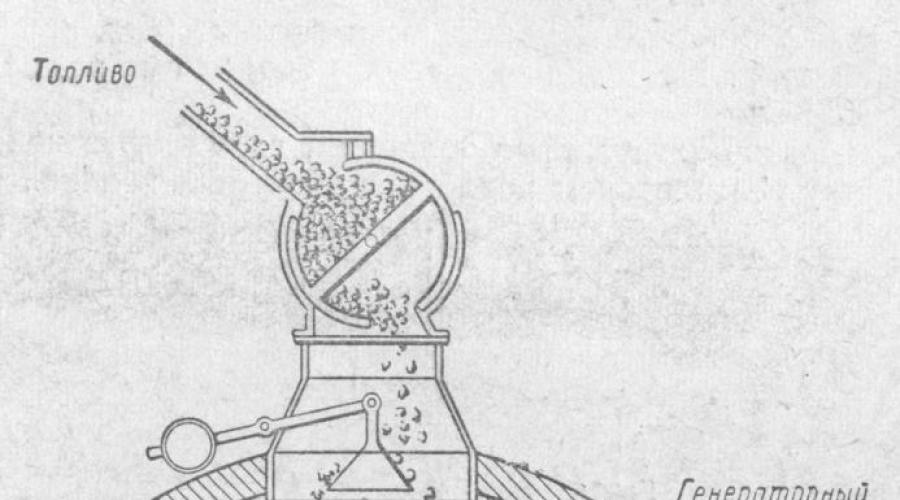
Le processus de gazéification du combustible solide est illustré dans une expérience de laboratoire (Fig. 1). Après avoir rempli le tube réfractaire de morceaux de charbon de bois, on le chauffe fortement et on laisse passer l'oxygène à travers le gazomètre. Laissez les gaz sortant du tube passer à travers un laveur d'eau de chaux, puis mettez-y le feu. L'eau de chaux devient trouble, le gaz brûle avec une flamme bleutée. Ceci indique la présence de dioxyde de CO2 et de monoxyde de carbone CO dans les produits de réaction.
La formation de ces substances s'explique par le fait que lorsque l'oxygène entre en contact avec du charbon chaud, ce dernier est d'abord oxydé en dioxyde de carbone : C + O 2 \u003d CO 2
Ensuite, en passant par le charbon chaud, le dioxyde de carbone est partiellement réduit par celui-ci en monoxyde de carbone : CO2 + C \u003d 2CO
Riz. 1. Obtention de monoxyde de carbone (expérience en laboratoire).
Dans des conditions industrielles, la gazéification des combustibles solides est réalisée dans des fours appelés générateurs de gaz.
Le mélange de gaz résultant est appelé gaz producteur.
Le dispositif générateur de gaz est représenté sur la figure. C'est un cylindre en acier d'une hauteur d'environ 5 m et un diamètre d'environ 3,5 moi, doublé à l'intérieur de briques réfractaires. D'en haut, le générateur de gaz est chargé de carburant; Par le bas, de l'air ou de la vapeur d'eau est fournie par un ventilateur à travers la grille.
L'oxygène de l'air réagit avec le carbone du carburant, formant du dioxyde de carbone qui, s'élevant à travers une couche de carburant chaud, est réduit par le carbone en monoxyde de carbone.
Si seul de l'air est insufflé dans le générateur, on obtient un gaz qui, dans sa composition, contient du monoxyde de carbone et de l'azote de l'air (ainsi qu'une certaine quantité de CO 2 et d'autres impuretés). Ce gaz générateur est appelé gaz de l'air.
Si, toutefois, de la vapeur d'eau est insufflée dans le générateur avec du charbon chaud, du monoxyde de carbone et de l'hydrogène se forment à la suite de la réaction : C + H 2 O \u003d CO + H 2
Ce mélange de gaz est appelé gaz à l'eau. Le gaz à l'eau a une valeur calorifique plus élevée que le gaz à air, car, avec le monoxyde de carbone, il contient également un deuxième gaz combustible - l'hydrogène. Gaz à l'eau (gaz de synthèse), l'un des produits de la gazéification des carburants. Le gaz à l'eau se compose principalement de CO (40 %) et de H2 (50 %). Le gaz à l'eau est un carburant (pouvoir calorifique 10 500 kJ/m3, soit 2 730 kcal/mg) et en même temps une matière première pour la synthèse du méthanol. Le gaz à l'eau, cependant, ne peut pas être obtenu pendant longtemps, car la réaction de sa formation est endothermique (avec absorption de chaleur), et donc le carburant dans le générateur se refroidit. Pour maintenir le charbon chaud, l'injection de vapeur d'eau dans le générateur est alternée avec l'injection d'air dont l'oxygène, comme on le sait, réagit avec le combustible pour dégager de la chaleur.
Récemment, le souffle vapeur-oxygène a été largement utilisé pour la gazéification du carburant. Le soufflage simultané de vapeur d'eau et d'oxygène à travers la couche combustible permet de réaliser le procédé en continu, d'augmenter significativement la productivité du générateur et d'obtenir un gaz à haute teneur en hydrogène et en monoxyde de carbone.
Les générateurs de gaz modernes sont de puissants appareils à action continue.
Pour que lorsque le carburant est fourni au générateur de gaz, les gaz combustibles et toxiques ne pénètrent pas dans l'atmosphère, le tambour de chargement est doublé. Pendant que le carburant entre dans un compartiment du tambour, le carburant est déversé de l'autre compartiment dans le générateur ; lorsque le tambour tourne, ces processus se répètent, tandis que le générateur reste isolé de l'atmosphère tout le temps. La distribution uniforme du carburant dans le générateur est réalisée à l'aide d'un cône, qui peut être installé à différentes hauteurs. Lorsqu'il est abaissé, le charbon se trouve plus près du centre du générateur ; lorsque le cône est relevé, le charbon est projeté plus près des parois du générateur.
L'évacuation des cendres du générateur de gaz est mécanisée. La grille en forme de cône est lentement entraînée en rotation par un moteur électrique. Dans ce cas, la cendre est déplacée vers les parois du générateur et est jetée dans le cendrier avec des dispositifs spéciaux, d'où elle est périodiquement retirée.
Les premières lampes à gaz ont été allumées à Saint-Pétersbourg sur l'île Aptekarsky en 1819. Le gaz utilisé était obtenu par gazéification du charbon. Cela s'appelait le gaz léger.
Le grand scientifique russe D. I. Mendeleev (1834-1907) a été le premier à exprimer l'idée que la gazéification du charbon peut être réalisée directement sous terre, sans le soulever. Le gouvernement tsariste n'a pas apprécié la proposition de Mendeleïev.
L'idée de la gazéification souterraine a été chaleureusement soutenue par V. I. Lénine. Il l'a appelé "l'un des grands triomphes de la technologie". La gazéification souterraine a été réalisée pour la première fois par l'État soviétique. Déjà avant la Grande Guerre patriotique, des générateurs souterrains fonctionnaient dans les bassins houillers de la région de Donetsk et de Moscou en Union soviétique.
La figure 3 donne une idée de l'une des méthodes de gazéification souterraine.Deux puits sont posés dans le filon de charbon, qui sont reliés au fond par un canal. Le charbon est incendié dans un tel canal près de l'un des puits et le souffle y est fourni. Les produits de combustion, se déplaçant le long du canal, interagissent avec le charbon chaud, entraînant la formation de gaz combustible, comme dans un générateur conventionnel. Le gaz remonte à la surface par le second puits.
Le gaz de générateur est largement utilisé pour chauffer les fours industriels - métallurgiques, à coke et comme carburant dans les voitures (Fig. 4).
Riz. 3. Schéma de gazéification souterraine du charbon.
Un certain nombre de produits organiques, tels que les combustibles liquides, sont synthétisés à partir d'hydrogène et de monoxyde de carbone de gaz à l'eau. Carburant liquide synthétique - carburant (principalement de l'essence) obtenu par synthèse à partir de monoxyde de carbone et d'hydrogène à 150-170 degrés Celsius et à une pression de 0,7 - 20 MN / m2 (200 kgf / cm2), en présence d'un catalyseur (nickel, fer , cobalt). La première production de carburants liquides synthétiques a été organisée en Allemagne pendant la 2ème guerre mondiale en raison de la pénurie de pétrole. Les combustibles liquides synthétiques n'ont pas été largement distribués en raison de leur coût élevé. Le gaz à l'eau est utilisé pour produire de l'hydrogène. Pour ce faire, l'eau gazeuse en mélange avec de la vapeur d'eau est chauffée en présence d'un catalyseur et de ce fait, de l'hydrogène est obtenu en plus de celui déjà présent dans l'eau gazeuse : CO + H 2 O \u003d CO 2 + H 2
5. BILAN THERMIQUE DE LA COMBUSTION
Considérez les méthodes de calcul du bilan thermique du processus de combustion des combustibles gazeux, liquides et solides. Le calcul se réduit à résoudre les problèmes suivants.
· Détermination de la chaleur de combustion (pouvoir calorifique) du combustible.
· Détermination de la température de combustion théorique.
5.1. CHALEUR DE BRÛLAGE
Les réactions chimiques s'accompagnent d'un dégagement ou d'une absorption de chaleur. Lorsque de la chaleur est libérée, la réaction est dite exothermique et lorsqu'elle est absorbée, elle est dite endothermique. Toutes les réactions de combustion sont exothermiques et les produits de combustion sont des composés exothermiques.
La chaleur dégagée (ou absorbée) lors d'une réaction chimique est appelée chaleur de réaction. Dans les réactions exothermiques, il est positif, dans les réactions endothermiques, il est négatif. La réaction de combustion s'accompagne toujours d'un dégagement de chaleur. Chaleur de combustion Q g(J / mol) est la quantité de chaleur dégagée lors de la combustion complète d'une mole d'une substance et de la transformation d'une substance combustible en produits de combustion complète. La mole est l'unité SI de base pour la quantité d'une substance. Une mole est une quantité d'une substance qui contient autant de particules (atomes, molécules, etc.) qu'il y a d'atomes dans 12 g de l'isotope du carbone 12. La masse d'une quantité d'une substance égale à 1 mole (masse moléculaire ou molaire) coïncide numériquement avec le poids moléculaire relatif d'une substance donnée.
Par exemple, le poids moléculaire relatif de l'oxygène (O 2 ) est de 32, le dioxyde de carbone (CO 2 ) est de 44, et les poids moléculaires correspondants seraient M = 32 g/mol et M = 44 g/mol. Ainsi, une mole d'oxygène contient 32 grammes de cette substance et une mole de CO 2 contient 44 grammes de dioxyde de carbone.
Dans les calculs techniques, la chaleur de combustion n'est pas souvent utilisée Q g, et le pouvoir calorifique du combustible Q(J/kg ou J/m3). Le pouvoir calorifique d'une substance est la quantité de chaleur dégagée lors de la combustion complète de 1 kg ou 1 m 3 d'une substance. Pour les substances liquides et solides, le calcul est effectué par 1 kg, et pour les substances gazeuses, par 1 m 3.
La connaissance de la chaleur de combustion et du pouvoir calorifique du combustible est nécessaire pour calculer la température de combustion ou d'explosion, la pression d'explosion, la vitesse de propagation de la flamme et d'autres caractéristiques. Le pouvoir calorifique du combustible est déterminé soit expérimentalement, soit par calcul. Dans la détermination expérimentale du pouvoir calorifique, une masse donnée de combustible solide ou liquide est brûlée dans une bombe calorimétrique, et dans le cas du combustible gazeux, dans un calorimètre à gaz. Ces appareils mesurent la chaleur totale Q 0 , libéré lors de la combustion d'un échantillon de carburant pesant m. Valeur calorifique Q g se trouve selon la formule
Relation entre la chaleur de combustion et
pouvoir calorifique du carburant
Pour établir une relation entre la chaleur de combustion et le pouvoir calorifique d'une substance, il est nécessaire d'écrire l'équation de la réaction chimique de combustion.
Le produit de la combustion complète du carbone est le dioxyde de carbone :
C + O2 → CO2.
Le produit de la combustion complète de l'hydrogène est l'eau :
2H2 + O2 → 2H2O.
Le produit de la combustion complète du soufre est le dioxyde de soufre :
S + O2 → SO2.
Dans le même temps, de l'azote, des halogénures et d'autres éléments non combustibles sont libérés sous forme libre.
gaz combustible
A titre d'exemple, on va calculer le pouvoir calorifique du méthane CH 4 dont la chaleur de combustion est égale à Q g=882.6 .
Déterminer le poids moléculaire du méthane selon sa formule chimique (CH 4) :
Ü=1∙12+4∙1=16 g/mol.
Déterminez le pouvoir calorifique de 1 kg de méthane :
Trouvons le volume de 1 kg de méthane, connaissant sa masse volumique ρ=0,717 kg/m 3 dans les conditions normales :
 .
.
Déterminer le pouvoir calorifique de 1 m 3 de méthane :
La valeur calorifique de tous les gaz combustibles est déterminée de la même manière. Pour de nombreuses substances courantes, les valeurs calorifiques et les valeurs calorifiques ont été mesurées avec une grande précision et sont données dans la littérature de référence pertinente. Donnons un tableau des valeurs du pouvoir calorifique de certaines substances gazeuses (tableau 5.1). Évaluer Q dans ce tableau elle est donnée en MJ/m 3 et en kcal/m 3, puisque 1 kcal = 4,1868 kJ est souvent utilisé comme unité de chaleur.
Tableau 5.1
Pouvoir calorifique des combustibles gazeux
|
Substance |
Acétylène |
|||||
|
Q |
||||||
Substance combustible - liquide ou solide
A titre d'exemple, on va calculer le pouvoir calorifique de l'alcool éthylique C 2 H 5 OH, dont la chaleur de combustion Q g= 1373,3 kJ/mol.
Déterminer le poids moléculaire de l'alcool éthylique selon sa formule chimique (C 2 H 5 OH) :
Ü = 2∙12 + 5∙1 + 1∙16 + 1∙1 = 46 g/mol.
Déterminer le pouvoir calorifique de 1 kg d'alcool éthylique :
La valeur calorifique de tous les combustibles liquides et solides est déterminée de la même manière. En tableau. 5.2 et 5.3 montrent les valeurs calorifiques Q(MJ/kg et kcal/kg) pour certaines substances liquides et solides.
Tableau 5.2
Pouvoir calorifique des combustibles liquides
|
Substance |
Alcool méthylique |
Éthanol |
Fioul, huile |
||||
|
Q |
|||||||
Tableau 5.3
Pouvoir calorifique des combustibles solides
|
Substance |
bois frais |
bois sec |
charbon marron |
Tourbe sèche |
Anthracite, coca |
||
|
Q |
|||||||
La formule de Mendeleïev
Si le pouvoir calorifique du carburant est inconnu, il peut être calculé à l'aide de la formule empirique proposée par D.I. Mendeleev. Pour ce faire, vous devez connaître la composition élémentaire du carburant (la formule équivalente du carburant), c'est-à-dire le pourcentage des éléments suivants:
Oxygène (O);
Hydrogène (H);
Carbone (C);
Soufre (S);
Cendres (A);
Eau (W).
Les produits de combustion des carburants contiennent toujours de la vapeur d'eau, qui se forme à la fois en raison de la présence d'humidité dans le carburant et lors de la combustion de l'hydrogène. Les déchets de combustion quittent l'installation industrielle à une température supérieure à la température du point de rosée. Par conséquent, la chaleur dégagée lors de la condensation de la vapeur d'eau ne peut pas être utilisée utilement et ne doit pas être prise en compte dans les calculs thermiques.
Le pouvoir calorifique inférieur est généralement utilisé pour le calcul. Q n carburant, qui prend en compte les pertes de chaleur avec la vapeur d'eau. Pour les combustibles solides et liquides, la valeur Q n(MJ/kg) est approximativement déterminé par la formule de Mendeleev :
Q n=0.339+1.025+0.1085 – 0.1085 – 0.025, (5.1)
où la teneur en pourcentage (% en masse) des éléments correspondants dans la composition du carburant est indiquée entre parenthèses.
Cette formule prend en compte la chaleur des réactions de combustion exothermique du carbone, de l'hydrogène et du soufre (avec un signe plus). L'oxygène, qui fait partie du carburant, remplace partiellement l'oxygène de l'air, de sorte que le terme correspondant dans la formule (5.1) est pris avec un signe moins. Lorsque l'humidité s'évapore, la chaleur est consommée, de sorte que le terme correspondant contenant W est également pris avec un signe moins.
La comparaison des données calculées et expérimentales sur le pouvoir calorifique de différents combustibles (bois, tourbe, charbon, pétrole) a montré que le calcul selon la formule de Mendeleev (5.1) donne une erreur ne dépassant pas 10%.
Valeur calorifique nette Q n(MJ / m 3) de gaz combustibles secs peuvent être calculés avec une précision suffisante comme la somme des produits du pouvoir calorifique des composants individuels et de leur pourcentage dans 1 m 3 de combustible gazeux.
Q n= 0,108[Н 2 ] + 0,126[СО] + 0,358[CH 4 ] + 0,5[С 2 Н 2 ] + 0,234[Н 2 S ]…, (5.2)
où la teneur en pourcentage (% en volume) des gaz correspondants dans le mélange est indiquée entre parenthèses.
Le pouvoir calorifique moyen du gaz naturel est d'environ 53,6 MJ/m 3 . Dans les gaz combustibles produits artificiellement, la teneur en CH 4 méthane est négligeable. Les principaux composants combustibles sont l'hydrogène H 2 et le monoxyde de carbone CO. Dans le gaz de cokerie, par exemple, la teneur en H 2 atteint (55 ÷ 60) %, et le pouvoir calorifique inférieur de ce gaz atteint 17,6 MJ/m 3 . Dans le gaz du générateur, la teneur en CO ~ 30 % et H 2 ~ 15 %, tandis que le pouvoir calorifique inférieur du gaz du générateur Q n= (5,2÷6,5) MJ/m3. Dans le gaz de haut fourneau, la teneur en CO et H 2 est moindre ; ordre de grandeur Q n= (4,0÷4,2) MJ/m3.
Considérons des exemples de calcul de la valeur calorifique de substances à l'aide de la formule de Mendeleïev.
Déterminons le pouvoir calorifique du charbon, dont la composition élémentaire est donnée dans le tableau. 5.4.
Tableau 5.4
Composition élémentaire du charbon
Remplaçons donné dans tab. 5.4 données dans la formule de Mendeleev (5.1) (l'azote N et les cendres A ne sont pas inclus dans cette formule, car ce sont des substances inertes et ne participent pas à la réaction de combustion):
Q n=0,339∙37,2+1,025∙2,6+0,1085∙0,6–0,1085∙12–0,025∙40=13,04 MJ/kg.
Déterminons la quantité de bois de chauffage nécessaire pour chauffer 50 litres d'eau de 10 ° C à 100 ° C, si 5% de la chaleur dégagée lors de la combustion est dépensée pour le chauffage, et la capacité calorifique de l'eau Avec\u003d 1 kcal / (kg ∙ deg) ou 4,1868 kJ / (kg ∙ deg). La composition élémentaire du bois de chauffage est donnée dans le tableau. 5.5 :
Tableau 5.5
Composition élémentaire du bois de chauffage
|
Trouvons le pouvoir calorifique du bois de chauffage selon la formule de Mendeleev (5.1): Q n=0,339∙43+1,025∙7–0,1085∙41–0,025∙7= 17,12 MJ/kg. Déterminez la quantité de chaleur dépensée pour chauffer l'eau lors de la combustion de 1 kg de bois de chauffage (en tenant compte du fait que 5% de la chaleur (a = 0,05) dégagée lors de la combustion est dépensée pour la chauffer): Q 2=un Q n=0,05 17,12=0,86 MJ/kg. Déterminer la quantité de bois de chauffage nécessaire pour chauffer 50 litres d'eau de 10° C à 100° C :
Ainsi, environ 22 kg de bois de chauffage sont nécessaires pour chauffer l'eau. |
Les tableaux présentent la chaleur spécifique massique de combustion du combustible (liquide, solide et gazeux) et de certains autres matériaux combustibles. Les combustibles tels que : charbon, bois de chauffage, coke, tourbe, kérosène, pétrole, alcool, essence, gaz naturel, etc. sont pris en compte.
Liste des tableaux :
Dans une réaction d'oxydation exothermique du combustible, son énergie chimique est convertie en énergie thermique avec dégagement d'une certaine quantité de chaleur. L'énergie thermique qui en résulte est appelée la chaleur de combustion du combustible. Cela dépend de sa composition chimique, de son humidité et c'est le principal. Le pouvoir calorifique du combustible, rapporté à 1 kg de masse ou 1 m 3 de volume, forme le pouvoir calorifique spécifique massique ou volumétrique.
La chaleur spécifique de combustion d'un combustible est la quantité de chaleur dégagée lors de la combustion complète d'une unité de masse ou de volume de combustible solide, liquide ou gazeux. Dans le système international d'unités, cette valeur est mesurée en J / kg ou J / m 3.
La chaleur spécifique de combustion d'un combustible peut être déterminée expérimentalement ou calculée analytiquement. Les méthodes expérimentales de détermination du pouvoir calorifique reposent sur la mesure pratique de la quantité de chaleur dégagée lors de la combustion du carburant, par exemple dans un calorimètre avec un thermostat et une bombe à combustion. Pour un carburant de composition chimique connue, la chaleur spécifique de combustion peut être déterminée à partir de la formule de Mendeleïev.
Il existe des chaleurs spécifiques de combustion supérieures et inférieures. Le pouvoir calorifique supérieur est égal à la quantité maximale de chaleur dégagée lors de la combustion complète du combustible, compte tenu de la chaleur dépensée pour l'évaporation de l'humidité contenue dans le combustible. La valeur calorifique inférieure est inférieure à la valeur supérieure de la valeur de la chaleur de condensation, qui est formée à partir de l'humidité du combustible et de l'hydrogène de la masse organique, qui se transforme en eau lors de la combustion.
Pour déterminer les indicateurs de qualité du carburant, ainsi que dans les calculs d'ingénierie thermique utilisent généralement la plus faible chaleur spécifique de combustion, qui est la caractéristique thermique et opérationnelle la plus importante du combustible et est donnée dans les tableaux ci-dessous.
Chaleur spécifique de combustion des combustibles solides (charbon, bois de chauffage, tourbe, coke)
Le tableau montre les valeurs de la chaleur spécifique de combustion du combustible solide sec dans l'unité de MJ/kg. Le carburant dans le tableau est classé par nom dans l'ordre alphabétique.
Parmi les combustibles solides considérés, le charbon à coke a le pouvoir calorifique le plus élevé - sa chaleur spécifique de combustion est de 36,3 MJ/kg (ou 36,3·10 6 J/kg en unités SI). De plus, le pouvoir calorifique élevé est caractéristique du charbon, de l'anthracite, du charbon de bois et du lignite.
Les combustibles à faible efficacité énergétique comprennent le bois, le bois de chauffage, la poudre à canon, le freztorf, le schiste bitumineux. Par exemple, la chaleur spécifique de combustion du bois de chauffage est de 8,4 ... 12,5 et la poudre à canon - seulement 3,8 MJ / kg.
| Carburant | |
|---|---|
| Anthracite | 26,8…34,8 |
| Granulés de bois (granulés) | 18,5 |
| Bois de chauffage sec | 8,4…11 |
| Bois de chauffage de bouleau sec | 12,5 |
| coke de gaz | 26,9 |
| coke de haut fourneau | 30,4 |
| semi-coca | 27,3 |
| Poudre | 3,8 |
| Ardoise | 4,6…9 |
| Schiste bitumineux | 5,9…15 |
| Propulseur solide | 4,2…10,5 |
| Tourbe | 16,3 |
| tourbe fibreuse | 21,8 |
| Tourbe de broyage | 8,1…10,5 |
| Miettes de tourbe | 10,8 |
| charbon marron | 13…25 |
| Lignite (briquettes) | 20,2 |
| Lignite (poussière) | 25 |
| Charbon de Donetsk | 19,7…24 |
| charbon | 31,5…34,4 |
| Charbon | 27 |
| Charbon à coke | 36,3 |
| Charbon de Kouznetsk | 22,8…25,1 |
| Charbon de Tcheliabinsk | 12,8 |
| Charbon d'Ekibastuz | 16,7 |
| freztorf | 8,1 |
| Scories | 27,5 |
Chaleur spécifique de combustion du combustible liquide (alcool, essence, kérosène, huile)
Le tableau de la chaleur spécifique de combustion du combustible liquide et de certains autres liquides organiques est donné. Il convient de noter que les carburants tels que l'essence, le carburant diesel et l'huile se caractérisent par un dégagement de chaleur élevé lors de la combustion.
La chaleur spécifique de combustion de l'alcool et de l'acétone est nettement inférieure à celle des carburants automobiles traditionnels. De plus, le carburant de fusée liquide a un pouvoir calorifique relativement faible et, avec la combustion complète de 1 kg de ces hydrocarbures, une quantité de chaleur égale à 9,2 et 13,3 MJ, respectivement, sera dégagée.
| Carburant | Chaleur spécifique de combustion, MJ/kg |
|---|---|
| Acétone | 31,4 |
| Essence A-72 (GOST 2084-67) | 44,2 |
| Essence d'aviation B-70 (GOST 1012-72) | 44,1 |
| Essence AI-93 (GOST 2084-67) | 43,6 |
| Benzène | 40,6 |
| Carburant diesel d'hiver (GOST 305-73) | 43,6 |
| Carburant diesel d'été (GOST 305-73) | 43,4 |
| Propulseur liquide (kérosène + oxygène liquide) | 9,2 |
| Kérosène d'aviation | 42,9 |
| Kérosène d'éclairage (GOST 4753-68) | 43,7 |
| xylène | 43,2 |
| Fioul à haute teneur en soufre | 39 |
| Fioul à faible teneur en soufre | 40,5 |
| Fioul à faible teneur en soufre | 41,7 |
| Fioul sulfureux | 39,6 |
| Alcool méthylique (méthanol) | 21,1 |
| Alcool n-butylique | 36,8 |
| Pétrole | 43,5…46 |
| Méthane d'huile | 21,5 |
| Toluène | 40,9 |
| White spirit (GOST 313452) | 44 |
| éthylène glycol | 13,3 |
| Alcool éthylique (éthanol) | 30,6 |
Chaleur spécifique de combustion du combustible gazeux et des gaz combustibles
Un tableau de la chaleur spécifique de combustion du combustible gazeux et de certains autres gaz combustibles dans la dimension de MJ/kg est présenté. Parmi les gaz considérés, la plus grande masse massique de chaleur de combustion diffère. Avec la combustion complète d'un kilogramme de ce gaz, 119,83 MJ de chaleur seront dégagés. De plus, un combustible tel que le gaz naturel a un pouvoir calorifique élevé - la chaleur spécifique de combustion du gaz naturel est de 41 ... 49 MJ / kg (pour 50 MJ / kg purs).
| Carburant | Chaleur spécifique de combustion, MJ/kg |
|---|---|
| 1-Butène | 45,3 |
| Ammoniac | 18,6 |
| Acétylène | 48,3 |
| Hydrogène | 119,83 |
| Hydrogène, mélange avec du méthane (50% H 2 et 50% CH 4 en masse) | 85 |
| Hydrogène, mélange avec du méthane et du monoxyde de carbone (33-33-33 % en poids) | 60 |
| Hydrogène, mélange avec du monoxyde de carbone (50% H 2 50% CO 2 en masse) | 65 |
| Gaz de haut fourneau | 3 |
| gaz de cokerie | 38,5 |
| Gaz hydrocarbure liquéfié GPL (propane-butane) | 43,8 |
| Isobutane | 45,6 |
| Méthane | 50 |
| n-butane | 45,7 |
| n-hexane | 45,1 |
| n-Pentane | 45,4 |
| Gaz associé | 40,6…43 |
| Gaz naturel | 41…49 |
| Propadien | 46,3 |
| Propane | 46,3 |
| Propylène | 45,8 |
| Propylène, mélange avec de l'hydrogène et du monoxyde de carbone (90%-9%-1% en poids) | 52 |
| Éthane | 47,5 |
| Éthylène | 47,2 |
Chaleur spécifique de combustion de certains matériaux combustibles
Un tableau est donné de la chaleur spécifique de combustion de certains matériaux combustibles (, bois, papier, plastique, paille, caoutchouc, etc.). Il convient de noter les matériaux à fort dégagement de chaleur lors de la combustion. Ces matériaux comprennent: le caoutchouc de divers types, le polystyrène expansé (polystyrène), le polypropylène et le polyéthylène.
| Carburant | Chaleur spécifique de combustion, MJ/kg |
|---|---|
| Papier | 17,6 |
| Similicuir | 21,5 |
| Bois (barres avec une teneur en humidité de 14%) | 13,8 |
| Bois en tas | 16,6 |
| bois de chêne | 19,9 |
| Bois d'épicéa | 20,3 |
| bois vert | 6,3 |
| Bois de pin | 20,9 |
| Kapron | 31,1 |
| Produits Carbolite | 26,9 |
| Papier carton | 16,5 |
| Caoutchouc styrène-butadiène SKS-30AR | 43,9 |
| Caoutchouc naturel | 44,8 |
| Caoutchouc synthétique | 40,2 |
| SCS en caoutchouc | 43,9 |
| Caoutchouc chloroprène | 28 |
| Linoléum en chlorure de polyvinyle | 14,3 |
| Linoléum en chlorure de polyvinyle à deux couches | 17,9 |
| Linoléum polychlorure de vinyle à base de feutre | 16,6 |
| Chlorure de polyvinyle de linoléum à chaud | 17,6 |
| Linoléum polychlorure de vinyle à base de tissu | 20,3 |
| Caoutchouc de linoléum (relin) | 27,2 |
| Solide de paraffine | 11,2 |
| Polymousse PVC-1 | 19,5 |
| Polymousse FS-7 | 24,4 |
| Polymousse FF | 31,4 |
| Polystyrène expansé PSB-S | 41,6 |
| mousse de polyurethane | 24,3 |
| panneau de fibres | 20,9 |
| Chlorure de polyvinyle (PVC) | 20,7 |
| Polycarbonate | 31 |
| Polypropylène | 45,7 |
| Polystyrène | 39 |
| Polyéthylène de haute densité | 47 |
| Polyéthylène basse pression | 46,7 |
| Caoutchouc | 33,5 |
| Rubéroïde | 29,5 |
| Canal de suie | 28,3 |
| Foins | 16,7 |
| Paille | 17 |
| Verre organique (plexiglas) | 27,7 |
| Textolite | 20,9 |
| tol | 16 |
| TNT | 15 |
| Coton | 17,5 |
| Cellulose | 16,4 |
| Laine et fibres de laine | 23,1 |
Sources:
- GOST 147-2013 Combustible minéral solide. Détermination du pouvoir calorifique supérieur et calcul du pouvoir calorifique inférieur.
- GOST 21261-91 Produits pétroliers. Méthode de détermination du pouvoir calorifique supérieur et de calcul du pouvoir calorifique inférieur.
- GOST 22667-82 Gaz naturels combustibles. Méthode de calcul pour déterminer le pouvoir calorifique, la densité relative et le nombre de Wobbe.
- GOST 31369-2008 Gaz naturel. Calcul de la valeur calorifique, de la densité, de la densité relative et du nombre de Wobbe en fonction de la composition des composants.
- Zemsky G. T. Propriétés inflammables des matériaux inorganiques et organiques : ouvrage de référence M. : VNIIPO, 2016 - 970 p.
Qu'est-ce que le carburant ?
Il s'agit d'un composant ou d'un mélange de substances capables de transformations chimiques associées au dégagement de chaleur. Différents types de carburant diffèrent par la teneur quantitative de l'oxydant qu'ils contiennent, qui est utilisé pour libérer de l'énergie thermique.
Au sens large, le carburant est un vecteur énergétique, c'est-à-dire un type potentiel d'énergie potentielle.
Classification
Actuellement, les combustibles sont divisés selon leur état d'agrégation en liquide, solide, gazeux.
Pierre et bois de chauffage, l'anthracite est considéré comme une essence naturelle solide. Les briquettes, le coke, la thermoanthracite sont des variétés de combustible solide artificiel.
Les liquides comprennent les substances qui contiennent des substances d'origine organique. Leurs principaux composants sont : l'oxygène, le carbone, l'azote, l'hydrogène, le soufre. Le carburant liquide artificiel sera une variété de résines, de mazout.
C'est un mélange de divers gaz : éthylène, méthane, propane, butane. En plus d'eux, le carburant gazeux contient du dioxyde de carbone et du monoxyde de carbone, du sulfure d'hydrogène, de l'azote, de la vapeur d'eau et de l'oxygène.

Indicateurs de carburant
Le principal indicateur de combustion. La formule de détermination du pouvoir calorifique est considérée en thermochimie. émettent du "carburant de référence", ce qui implique le pouvoir calorifique de 1 kilogramme d'anthracite.
Le mazout domestique est destiné à la combustion dans des appareils de chauffage de faible puissance, qui sont situés dans des locaux d'habitation, des générateurs de chaleur utilisés en agriculture pour le séchage du fourrage, la mise en conserve.
La chaleur spécifique de combustion du carburant est une valeur telle qu'elle démontre la quantité de chaleur qui se forme lors de la combustion complète du carburant avec un volume de 1 m 3 ou une masse d'un kilogramme.
Pour mesurer cette valeur, J / kg, J / m 3, calorie / m 3 sont utilisés. Pour déterminer la chaleur de combustion, utilisez la méthode calorimétrique.
Avec une augmentation de la chaleur spécifique de combustion du carburant, la consommation spécifique de carburant diminue et l'efficacité reste inchangée.
La chaleur de combustion des substances est la quantité d'énergie libérée lors de l'oxydation d'une substance solide, liquide et gazeuse.
Il est déterminé par la composition chimique, ainsi que par l'état d'agrégation de la substance combustible.

Caractéristiques des produits de combustion
Le pouvoir calorifique supérieur et inférieur est associé à l'état d'agrégation de l'eau dans les substances obtenues après la combustion du carburant.
Le pouvoir calorifique supérieur est la quantité de chaleur dégagée lors de la combustion complète d'une substance. Cette valeur inclut la chaleur de condensation de la vapeur d'eau.
Le pouvoir calorifique inférieur est la valeur qui correspond au dégagement de chaleur lors de la combustion sans tenir compte de la chaleur de condensation de la vapeur d'eau.
La chaleur latente de condensation est la valeur de l'énergie de condensation de la vapeur d'eau.

Relation mathématique
Le pouvoir calorifique supérieur et inférieur sont liés par la relation suivante :
Q B = Q H + k(W + 9H)
où W est la quantité en poids (en %) d'eau dans la substance combustible ;
H est la quantité d'hydrogène (% en masse) dans la substance combustible ;
k - coefficient de 6 kcal/kg

Méthodes de calcul
Le pouvoir calorifique supérieur et inférieur est déterminé par deux méthodes principales : calculée et expérimentale.
Les calorimètres sont utilisés pour les calculs expérimentaux. Tout d'abord, un échantillon de carburant y est brûlé. La chaleur qui sera dégagée dans ce cas est entièrement absorbée par l'eau. Ayant une idée de la masse d'eau, il est possible de déterminer la valeur de sa chaleur de combustion en modifiant sa température.
Cette technique est considérée comme simple et efficace, elle suppose uniquement la connaissance des données d'analyse technique.
Dans la méthode de calcul, le pouvoir calorifique le plus élevé et le plus bas sont calculés selon la formule de Mendeleïev.
Q p H \u003d 339C p + 1030H p -109 (O p -S p) - 25 W p (kJ / kg)
Il prend en compte la teneur en carbone, oxygène, hydrogène, vapeur d'eau, soufre dans la composition de travail (en pourcentage). La quantité de chaleur lors de la combustion est déterminée en tenant compte du carburant de référence.
La chaleur de combustion du gaz vous permet de faire des calculs préliminaires, d'identifier l'efficacité de l'utilisation d'un type particulier de combustible.

Caractéristiques d'origine
Afin de comprendre la quantité de chaleur dégagée lors de la combustion d'un certain combustible, il est nécessaire d'avoir une idée de son origine.
Dans la nature, il existe différents types de combustibles solides qui diffèrent par leur composition et leurs propriétés.
Sa formation s'effectue en plusieurs étapes. Tout d'abord, la tourbe est formée, puis la houille brune et dure est obtenue, puis l'anthracite est formée. Les principales sources de formation de combustibles solides sont les feuilles, le bois et les aiguilles. En mourant, des parties de plantes, lorsqu'elles sont exposées à l'air, sont détruites par des champignons, formant de la tourbe. Son accumulation se transforme en une masse brune, puis du gaz brun est obtenu.
À haute pression et température, le gaz brun se transforme en charbon, puis le combustible s'accumule sous forme d'anthracite.
En plus de la matière organique, il y a un lest supplémentaire dans le carburant. Organique considère cette partie qui a été formée à partir de substances organiques: hydrogène, carbone, azote, oxygène. En plus de ces éléments chimiques, il contient du lest : humidité, cendres.
La technologie des fours implique la répartition de la masse de travail, sèche et combustible du combustible brûlé. La masse de travail s'appelle le carburant sous sa forme originale, fournie au consommateur. Le poids sec est une composition dans laquelle il n'y a pas d'eau.

Composition
Les composants les plus précieux sont le carbone et l'hydrogène.
Ces éléments se retrouvent dans tout type de carburant. Dans la tourbe et le bois, le pourcentage de carbone atteint 58%, dans le charbon noir et brun - 80% et dans l'anthracite, il atteint 95% en poids. En fonction de cet indicateur, la quantité de chaleur dégagée lors de la combustion du carburant change. L'hydrogène est le deuxième élément le plus important de tout carburant. Au contact de l'oxygène, il forme de l'humidité, ce qui réduit considérablement la valeur thermique de tout combustible.
Son pourcentage varie de 3,8 dans le schiste bitumineux à 11 dans le mazout. L'oxygène, qui fait partie du carburant, agit comme lest.
Ce n'est pas un élément chimique générateur de chaleur, il affecte donc négativement la valeur de sa chaleur de combustion. La combustion de l'azote contenu sous forme libre ou liée dans les produits de combustion est considérée comme une impureté nocive, sa quantité est donc clairement limitée.
Le soufre entre dans la composition du carburant sous forme de sulfates, de sulfures et également sous forme de gaz de dioxyde de soufre. Lorsqu'ils sont hydratés, les oxydes de soufre forment de l'acide sulfurique, qui détruit l'équipement de la chaudière et nuit à la végétation et aux organismes vivants.
C'est pourquoi le soufre est l'élément chimique dont la présence dans le carburant naturel est hautement indésirable. En pénétrant dans la salle de travail, les composés soufrés provoquent une intoxication importante du personnel d'exploitation.
Il existe trois types de cendres selon leur origine :
- primaire;
- secondaire;
- tertiaire.
La forme primaire est formée à partir des substances minérales contenues dans les végétaux. Les cendres secondaires se forment à la suite de l'ingestion de résidus végétaux par le sable et la terre lors de la formation de la formation.
Les cendres tertiaires s'avèrent faire partie du combustible dans le processus d'extraction, de stockage, mais aussi de son transport. Avec un dépôt important de cendres, il y a une diminution du transfert de chaleur sur la surface chauffante de la chaudière, réduit la quantité de transfert de chaleur à l'eau à partir des gaz. Une énorme quantité de cendres affecte négativement le fonctionnement de la chaudière.
Enfin
Les substances volatiles ont un impact significatif sur le processus de combustion de tout type de carburant. Plus leur puissance est grande, plus le volume du front de flamme sera important. Par exemple, le charbon, la tourbe s'enflamment facilement, le processus s'accompagne de pertes de chaleur insignifiantes. Le coke qui reste après l'élimination des impuretés volatiles ne contient que des composés minéraux et carbonés. Selon les caractéristiques du combustible, la quantité de chaleur varie considérablement.
Selon la composition chimique, on distingue trois étapes de la formation des combustibles solides : tourbe, lignite, charbon.
Le bois naturel est utilisé dans les petites chaufferies. On utilise principalement des copeaux de bois, de la sciure de bois, des dalles, de l'écorce, le bois de chauffage lui-même est utilisé en petites quantités. Selon le type de bois, la quantité de chaleur dégagée varie considérablement.
Au fur et à mesure que le pouvoir calorifique diminue, le bois de chauffage acquiert certains avantages : inflammabilité rapide, teneur minimale en cendres et absence de traces de soufre.
Des informations fiables sur la composition des combustibles naturels ou synthétiques, leur pouvoir calorifique, constituent un excellent moyen de réaliser des calculs thermochimiques.
À l'heure actuelle, il existe une réelle opportunité d'identifier les principales options de combustibles solides, gazeux et liquides qui seront les plus efficaces et les moins coûteuses à utiliser dans une situation particulière.
 kg.
kg.