Un message sur le thème des composés halogènes. Halogènes et leurs composés. Importance biologique des halogènes et de leurs composés
Lire aussi
Halogènes (du grec. halos - sel et gènes - générateur) - éléments du sous-groupe principal VII groupes tableau périodique: fluor, chlore, brome, iode, astatine.
A l'état libre, les halogènes forment des substances constituées de molécules diatomiques F 2, Cl 2, Br 2, I 2.
ÊTRE DANS LA NATURE
Les halogènes sont présents dans la nature uniquement sous forme de composés.
Fluor se présente exclusivement sous forme de sels, dispersés dans divers rochers. La teneur totale en fluor de la croûte terrestre est de 0,02 % des atomes. Les minéraux fluorés sont d'une importance pratique : CaF 2 - spath fluor, Na 2 AlF 6 - cryolite, Ca 5 F(PO 4) 3 - fluorapatite.
Le plus important composé naturel chlore
est le chlorure de sodium (halite), qui sert de principale matière première pour la production d'autres composés chlorés. La majeure partie du chlorure de sodium se trouve dans l’eau des mers et des océans. Les eaux de nombreux lacs contiennent également des quantités importantes de NaCl, comme les lacs Elton et Baskunchak. Il existe d'autres composés chlorés, par exemple KCl - sylvinite, MgCl 2 *KCl*6HO - carnallite, KCl*NaCl - sylvinite.
Brome trouvé dans la nature sous forme de sels de sodium et de potassium ainsi que de sels de chlore, ainsi que dans l'eau des lacs et des mers salés. Les bromures métalliques se trouvent dans eau de mer. Dans les eaux de forage souterraines d'importance industrielle, la teneur en brome varie de 170 à 700 mg/l. Teneur totale en brome dans la croûte terrestre 3*10-5% d'atomes.
Connexions iode
sont présents dans l’eau de mer, mais en si petites quantités que leur isolement direct de l’eau est très difficile. Cependant, certaines algues, comme le varech, accumulent de l'iode dans leurs tissus. Les cendres de ces algues servent de matière première pour la production d'iode. Une quantité importante d'iode (de 10 à 50 mg/l.) est contenue dans les eaux souterraines de forage. La teneur en iode de la croûte terrestre est de 4*10 à 6 % d'atomes. Il existe des gisements mineurs de sels d'iode - KIO 3 et KIO 4 - au Chili et en Bolivie.
poids total astata sur globe estimé à ne pas dépasser 30 g.
Tableau. Structure électronique et certaines propriétés des atomes et molécules d'halogène
|
Symbole élément |
|||||
|
Ordinal Nombre |
|||||
|
Structure externe électronique couche |
2s 2 2p 5 |
3s 2 3p 5 |
4s 2 4p 5 |
5 s 2 5 p 5 |
6 s 2 6 p 5 |
|
Électro relative négativité (EO) |
4,0 |
3,0 |
2,8 |
2,5 |
~2,2 |
|
Rayon atomique, nm |
0,064 |
0,099 |
0,114 |
0,133 |
– |
|
Degrés oxydation |
1, +1, +3, |
– |
|||
|
État d'agrégation |
Vert pâle |
Vert jaune. |
Buraya |
Violet foncé |
Noir |
|
t °pl.(°С) |
219 |
101 |
114 |
227 |
|
|
t °ébullition (°C) |
183 |
185 |
317 |
||
|
(g/cm3) |
1,51 |
1,57 |
3,14 |
4,93 |
– |
|
solubilité dans l'eau (g/100g d'eau) |
réagit |
2,5: 1 |
3,5 |
0,02 |
– |
|
Nom |
Diagramme de structure atomique |
Formule électronique |
|
Fluor |
F +9) 2) 7 |
… 2s 2 2p 5 |
|
Chlore |
Cl +17) 2) 8) 7 |
… 3s 2 3p 5 |
|
Brome |
Fr +35) 2) 8) 18) 7 |
…4s 2 4p 5 |
|
Iode |
Je +53) 2) 8) 18) 18) 7 |
…5s 2 5p 5 |
1) La configuration électronique générale du niveau d'énergie externe est nS 2 nP 5 .
2) Avec une augmentation du nombre atomique des éléments, les rayons des atomes augmentent, l'électronégativité diminue et propriétés métalliques(les propriétés métalliques augmentent); les halogènes sont des agents oxydants puissants, la capacité oxydante des éléments diminue avec l'augmentation masse atomique.
3) À mesure que la masse atomique augmente, la couleur devient plus foncée, les points de fusion et d’ébullition ainsi que la densité augmentent.
OBTENTION D'HALOGÈNES
1. Électrolyse de solutions et de fusions d'halogénures :
2NaCl + 2H 2 O = Cl 2 + H 2 + 2NaOH
2 KF = 2 K + F 2 (la seule façon d'obtenir F2)
2. Oxydation des halogénures d’hydrogène :
2 KMnO 4 +16 HCl =2 KCl +2 MnCl 2 +5 Cl 2 +8 H 2 O – Méthode de laboratoire pour produire du chlore
14HBr+K2Cr2O7 =2KBr+2CrBr3 +3Br2 +7H2O
MnO 2 + 4 HHal = MnHal 2 + Hal 2 + 2 H 2 O – Laboratoire - (Pour la production de chlore, brome, iode)
3. Méthode industrielle - oxydation au chlore (pour le brome et l'iode) :
2KBr+Cl2 =2KCl+Br2
2KI + Cl2 = 2KCl + I2
Propriétés chimiques
Examinons les propriétés des halogènes en utilisant le chlore comme exemple :
|
1. Interaction avec les métaux |
Expérience 2K + Cl 2 → 2KCl Mg + Cl 2 → MgCl 2 |
|
2.Réactions avec les non-métaux |
H 2 + Cl 2 → 2HCl |
|
3. Interaction avec les alcalis par temps froid |
2NaOH + Cl 2 → NaCl + NaClO + H 2 O |
|
4. Interaction avec les alcalis lorsqu'ils sont chauffés |
6NaOH + 3Cl 2 → 5NaCl + NaClO 3 + 3H 2 O |
|
5. Déplacement des halogènes moins actifs des halogénures |
2KBr + Cl2 → 2KCl + Br2 |
|
6. Avec de l'eau |
H 2 O + Cl 2 ↔ HCl + HClO (eau chlorée) |
APPLICATION DES HALOGÈNES
|
Fluor |
est largement utilisé comme agent fluorant dans la production de divers fluorures (SF 6, BF 3, WF 6 et autres), y compris des composés des gaz rares xénon (Xe) et krypton (Kr). L'hexafluorure d'uranium UF 6 est utilisé pour séparer les isotopes de l'uranium (U). Le fluor est utilisé dans la production de téflon, d'autres plastiques fluorés, de caoutchouc fluoré, de produits contenant du fluor matière organique et des matériaux largement utilisés en technologie, notamment dans les cas où une résistance aux environnements agressifs est requise, haute température et ainsi de suite. |
|
Chlore |
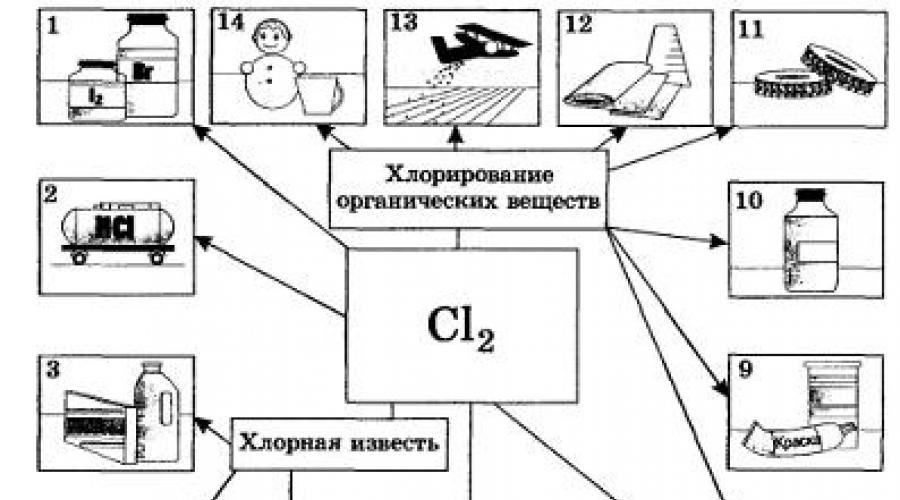
utilisé dans la production de composés organiques contenant du chlore (60-75%), substances inorganiques(10-20%), pour blanchir la cellulose et les tissus (5-15%), pour les besoins sanitaires et la désinfection (chloration) de l'eau. |
|
Brome |
le brome est utilisé dans la préparation d'un certain nombre de substances inorganiques et organiques en chimie analytique. Les composés de brome sont utilisés comme additifs pour carburants, pesticides, retardateurs de flamme et en photographie. Largement connu pour contenir du brome médicaments. A noter que l'expression courante : « le médecin a prescrit du brome une cuillère à soupe après les repas » signifie bien entendu uniquement qu'une solution aqueuse de bromure de sodium (ou de potassium) a été prescrite, et non du brome pur. L'effet calmant des médicaments à base de bromure repose sur leur capacité à améliorer les processus d'inhibition dans le système nerveux central. |
|
Iode |
L'iode est utilisé pour produire du titane (Ti), du zirconium (Zr), du hafnium (Hf), du niobium (Nb) et d'autres métaux de haute pureté (ce qu'on appelle le raffinage des métaux à l'iodure). Lors du raffinage de l'iodure, le métal d'origine contenant des impuretés est converti sous forme d'iodures volatils, puis les iodures résultants sont décomposés sur un fil mince et chaud. Le fil est constitué de métal pré-nettoyé, qui est soumis à un affinage. Sa température est choisie de telle sorte que seul l'iodure du métal purifié puisse se décomposer sur le filament, tandis que les iodures restants restent en phase vapeur. |
DÉFINITION
Halogènes– éléments du groupe VII A – fluor (F), chlore (Cl), brome (Br) et iode (I).
Configuration électronique du niveau d'énergie externe des halogènes ns 2 np 5. Étant donné qu'il ne manque qu'un seul électron aux halogènes avant d'atteindre le niveau d'énergie, ils présentent le plus souvent en ORR les propriétés d'agents oxydants. États d'oxydation des halogènes : de « -1 » à « +7 ». Le seul élément du groupe halogène, le fluor, ne présente qu'un seul état d'oxydation « -1 » et est l'élément le plus électronégatif. Les molécules halogènes sont diatomiques : F 2, Cl 2, Br 2, I 2.
Propriétés chimiques des halogènes
Avec une charge croissante du noyau d'un atome d'un élément chimique, c'est-à-dire lors du passage du fluor à l'iode, la capacité oxydante des halogènes diminue, ce qui est confirmé par la capacité de déplacer les halogènes inférieurs par des halogènes supérieurs à partir des acides halohydriques et de leurs sels :
Br 2 + 2HI = I 2 + 2HBr;
Cl 2 + 2KBr = Br 2 + 2KCl.
Le fluor a la plus grande activité chimique. La plupart des éléments chimiques, même avec température ambiante interagit avec le fluor, libérant un grand nombre de chaleur. Même l’eau brûle dans le fluor :
2H 2 O + 2F 2 = 4HF + O 2.
Le chlore libre est moins réactif que le fluor. Il ne réagit pas directement avec l'oxygène, l'azote et les gaz rares. Il interagit avec toutes les autres substances comme le fluor :
2Fe + Cl2 = 2FeCl3 ;
2P + 5Cl 2 = 2PCl 5.
Lorsque le chlore interagit avec l'eau froide, une réaction réversible se produit :
Cl 2 + H 2 O↔HCl + HClO.
Le mélange de produits de réaction est appelé eau chlorée.
Lorsque le chlore interagit avec les alcalis à froid, des mélanges de chlorures et d'hypochlorites se forment :
Cl 2 + Ca(OH) 2 = Ca(Cl)OCl + H 2 O.
Lorsque le chlore est dissous dans une solution alcaline chaude, la réaction suivante se produit :
3Cl 2 + 6KOH = 5KCl + KClO 3 + 3H 2 O.
Le brome, comme le chlore, se dissout dans l'eau et, réagissant partiellement avec lui, forme ce qu'on appelle « l'eau bromée », tandis que l'iode est pratiquement insoluble dans l'eau.
L'activité chimique de l'iode diffère considérablement de celle des autres halogènes. Il ne réagit pas avec la plupart des non-métaux et réagit lentement avec les métaux uniquement lorsqu'ils sont chauffés. L'interaction de l'iode avec l'hydrogène ne se produit qu'avec un fort chauffage ; la réaction est endothermique et hautement réversible :
H 2 + I 2 = 2HI - 53 kJ.
Propriétés physiques des halogènes
Au non. Le fluor est un gaz jaune clair avec une odeur âcre. Toxique. Le chlore est un gaz vert clair, tout comme le fluor, il a une odeur âcre. Très toxique. À hypertension artérielle et la température ambiante se transforme facilement en état liquide. Le brome est un liquide lourd de couleur rouge-brun avec une odeur piquante désagréable caractéristique. Le brome liquide, ainsi que ses vapeurs, sont hautement toxiques. Le brome est peu soluble dans l'eau et bien dans les solvants non polaires. L'iode est un solide gris foncé avec un éclat métallique. La vapeur d'iode est violette. L'iode se sublime facilement, c'est-à-dire se transforme à l'état gazeux à partir d'un solide, tout en contournant l'état liquide.
Production d'halogènes
Les halogènes peuvent être obtenus par électrolyse de solutions ou de fusions d'halogénures :
MgCl 2 = Mg + Cl 2 (fondu).
Le plus souvent, les halogènes sont obtenus par réaction d'oxydation d'acides halohydriques :
MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O;
K 2 Cr 2 O 7 + 14HCl = 3Cl 2 + 2KCl + 2CrCl 3 + 7H 2 O ;
2KMnO 4 +16HCl = 2MnCl 2 +5Cl 2 +8H 2 O +2KCl.
Application d'halogènes
Les halogènes sont utilisés comme matières premières pour fabriquer divers produits. Ainsi, le fluor et le chlore sont utilisés pour la synthèse de divers matériaux polymères, le chlore est également une matière première dans la production d'acide chlorhydrique. Brome et iode trouvés large application en médecine, le brome est également utilisé par l’industrie des peintures et vernis.
Exemples de résolution de problèmes
EXEMPLE 1
| Exercice | Calculer le volume de chlore (n°) qui a réagi avec l'iodure de potassium si de l'iode pesant 508 g s'est formé | ||||
| Solution | Écrivons l'équation de la réaction entre le chlore et l'iodure de potassium : Cl 2 + 2KI = I 2 + 2KCl Masse molaire de l'iode, calculée à l'aide du tableau des éléments chimiques de D.I. Mendeleev, égal à – 254 g/mol. Trouvons la quantité d'iode formée : v(Je 2) = m(Je 2)/M(Je 2) Les halogènes sont situés à gauche des gaz rares dans le tableau périodique. Ces cinq éléments toxiques non métalliques appartiennent au groupe 7 du tableau périodique. Ceux-ci comprennent le fluor, le chlore, le brome, l'iode et l'astatine. Bien que l'astatine soit radioactive et ne contienne que des isotopes à courte durée de vie, elle se comporte comme l'iode et est souvent classée comme halogène. Puisque les éléments halogènes ont sept électrons de valence, ils n’ont besoin que d’un seul électron supplémentaire pour former un octet complet. Cette caractéristique les rend plus réactifs que les autres groupes de non-métaux. caractéristiques généralesLes halogènes forment des molécules diatomiques (type X2, où X désigne un atome d'halogène) - une forme stable d'existence d'halogènes sous forme d'éléments libres. Les liaisons de ces molécules diatomiques sont non polaires, covalentes et simples. Les propriétés chimiques des halogènes leur permettent de se combiner facilement avec la plupart des éléments, de sorte qu’on ne les trouve jamais non combinés dans la nature. Le fluor est l'halogène le plus actif et l'astate le moins. Tous les halogènes forment des sels du groupe I ayant des propriétés similaires. Dans ces composés, les halogènes sont présents sous forme d'anions halogénures avec une charge de -1 (par exemple, Cl-, Br-). La terminaison -id indique la présence d'anions halogénures ; par exemple Cl- est appelé « chlorure ». En plus, Propriétés chimiques les halogènes leur permettent d'agir comme agents oxydants - métaux oxydants. Majorité réactions chimiques, auquel participent les halogènes - redox dans une solution aqueuse. Les halogènes forment des liaisons simples avec le carbone ou l'azote dans les composés organiques, où leur état d'oxydation (CO) est -1. Lorsqu'un atome d'halogène est remplacé par un atome d'hydrogène lié de manière covalente dans composé organique, le préfixe halo- peut être utilisé dans un sens général, ou les préfixes fluoro-, chloro-, bromo-, iode- pour des halogènes spécifiques. Les éléments halogènes peuvent se réticuler pour former des molécules diatomiques avec des liaisons simples covalentes polaires. Le chlore (Cl2) fut le premier halogène découvert en 1774, suivi de l'iode (I2), du brome (Br2), du fluor (F2) et de l'astate (At, découvert pour la dernière fois en 1940). Le nom « halogène » vient des racines grecques hal- (« sel ») et -gen (« former »). Ensemble, ces mots signifient « formant du sel », soulignant le fait que les halogènes réagissent avec les métaux pour former des sels. L'halite est le nom du sel gemme, un minéral naturel composé de chlorure de sodium (NaCl). Et enfin, les halogènes sont utilisés dans la vie quotidienne - le fluor se trouve dans le dentifrice, le chlore désinfecte boire de l'eau, et l'iode favorise la production d'hormones thyroïdiennes. Éléments chimiquesLe fluor est un élément de numéro atomique 9 et est désigné par le symbole F. Le fluor élémentaire a été découvert pour la première fois en 1886 en l'isolant de l'acide fluorhydrique. À l'état libre, le fluor existe sous forme de molécule diatomique (F2) et constitue l'halogène le plus abondant dans la croûte terrestre. Le fluor est l'élément le plus électronégatif du tableau périodique. À température ambiante, c'est un gaz jaune pâle. Le fluor possède également un rayon atomique relativement petit. Son CO est de -1, sauf à l'état diatomique élémentaire, dans lequel son état d'oxydation est nul. Le fluor est extrêmement réactif et réagit directement avec tous les éléments sauf l'hélium (He), le néon (Ne) et l'argon (Ar). Dans une solution H2O, l'acide fluorhydrique (HF) est un acide faible. Bien que le fluor soit hautement électronégatif, son électronégativité ne détermine pas l’acidité ; Le HF est un acide faible car l’ion fluorure est basique (pH > 7). De plus, le fluor produit des agents oxydants très puissants. Par exemple, le fluor peut réagir avec gaz inerte xénon et forme un agent oxydant puissant, le difluorure de xénon (XeF2). Le fluorure a de nombreuses utilisations. Le chlore est un élément de numéro atomique 17 et de symbole chimique Cl. Découvert en 1774 en l'isolant de l'acide chlorhydrique. Dans son état élémentaire, il forme la molécule diatomique Cl2. Le chlore possède plusieurs CO : -1, +1, 3, 5 et 7. À température ambiante, c'est un gaz vert clair. La liaison qui se forme entre deux atomes de chlore étant faible, la molécule Cl2 a une très grande capacité à former des composés. Le chlore réagit avec les métaux pour former des sels appelés chlorures. Les ions chlore sont les ions les plus courants dans l’eau de mer. Le chlore possède également deux isotopes : 35Cl et 37Cl. Le chlorure de sodium est le composé le plus courant de tous les chlorures. Brome – élément chimique avec le numéro atomique 35 et le symbole Br. Il a été découvert pour la première fois en 1826. Sous sa forme élémentaire, le brome est une molécule diatomique Br2. À température ambiante, c'est un liquide brun rougeâtre. Ses CO sont -1, + 1, 3, 4 et 5. Le brome est plus actif que l'iode, mais moins actif que le chlore. De plus, le brome possède deux isotopes : 79Br et 81Br. Le brome se présente sous forme de sels de bromure dissous dans l’eau de mer. Derrière dernières années La production mondiale de bromure a considérablement augmenté en raison de sa disponibilité et de sa longue durée de conservation. Comme les autres halogènes, le brome est un agent oxydant très toxique. L'iode est un élément chimique de numéro atomique 53 et de symbole I. L'iode a des états d'oxydation : -1, +1, +5 et +7. Existe sous forme de molécule diatomique, I2. A température ambiante, c'est solide violet. L'iode possède un isotope stable - 127I. Découvert pour la première fois en 1811 à l'aide d'algues et d'acide sulfurique. Actuellement, les ions iode peuvent être isolés dans l’eau de mer. Bien que l'iode ne soit pas très soluble dans l'eau, sa solubilité peut être augmentée en utilisant des iodures individuels. L'iode joue un rôle important dans l'organisme, participant à la production d'hormones thyroïdiennes. L'astatine est un élément radioactif de numéro atomique 85 et de symbole At. Ses états d'oxydation possibles sont -1, +1, 3, 5 et 7. Le seul halogène qui n'est pas une molécule diatomique. Dans des conditions normales, c'est un solide métallique noir. L'astatine est un élément très rare, on en sait donc peu. De plus, l'astate a des propriétés très courte période demi-vie, pas plus de plusieurs heures. Obtenu en 1940 grâce à une synthèse. On pense que l’astatine est similaire à l’iode. Diffère par les propriétés métalliques. Le tableau ci-dessous montre la structure des atomes d'halogène et la structure de la couche externe d'électrons. Cette structure de la couche externe d’électrons signifie que les propriétés physiques et chimiques des halogènes sont similaires. Cependant, lorsqu’on compare ces éléments, des différences sont également observées. Propriétés périodiques dans le groupe halogènePropriétés physiques substances simples les halogènes changent avec l'augmentation du numéro atomique de l'élément. Pour une meilleure compréhension et une plus grande clarté, nous vous proposons plusieurs tableaux. Les points de fusion et d'ébullition d'un groupe augmentent à mesure que la taille moléculaire augmente (F Tableau 1. Halogènes. Propriétés physiques : points de fusion et d’ébullition La taille du noyau augmente (F< Cl < Br < I < At), так как увеличивается число протонов и нейтронов. Кроме того, с каждым периодом добавляется всё больше уровней энергии. Это приводит к большей орбитали, и, следовательно, к увеличению радиуса атома. Tableau 2. Halogènes. Propriétés physiques : rayons atomiques Si les électrons de valence externes ne sont pas situés à proximité du noyau, il ne faudra pas beaucoup d'énergie pour les en retirer. Ainsi, l’énergie nécessaire pour éjecter un électron externe n’est pas aussi élevée dans la partie inférieure du groupe d’éléments, car il y a plus de niveaux d’énergie. De plus, une énergie d’ionisation élevée fait que l’élément présente des qualités non métalliques. L'iode et l'astatine d'affichage présentent des propriétés métalliques car l'énergie d'ionisation est réduite (à< I < Br < Cl < F). Tableau 3. Halogènes. Propriétés physiques : énergie d'ionisation Le nombre d’électrons de valence dans un atome augmente avec l’augmentation des niveaux d’énergie à des niveaux progressivement inférieurs. Les électrons s’éloignent progressivement du noyau ; Ainsi, le noyau et les électrons ne sont pas attirés l’un vers l’autre. Une augmentation du blindage est observée. Par conséquent, l’électronégativité diminue avec l’augmentation de la période (à< I < Br < Cl < F). Tableau 4. Halogènes. Propriétés physiques : électronégativité À mesure que la taille atomique augmente avec la période, l’affinité électronique a tendance à diminuer (B< I < Br < F < Cl). Исключение – фтор, сродство которого меньше, чем у хлора. Это можно объяснить меньшим размером фтора по сравнению с хлором. Tableau 5. Affinité électronique des halogènes La réactivité des halogènes diminue avec l'augmentation de la période (At Un halogénure se forme lorsqu'un halogène réagit avec un autre élément moins électronégatif pour former un composé binaire. L'hydrogène réagit avec les halogènes, formant des halogénures de la forme HX : Les halogénures d'hydrogène se dissolvent facilement dans l'eau pour former de l'acide halohydrique (fluorhydrique, chlorhydrique, bromhydrique, iodique). Les propriétés de ces acides sont données ci-dessous. Les acides sont formés par la réaction suivante : HX (aq) + H2O (l) → X- (aq) + H3O+ (aq). Tous les halogénures d'hydrogène forment des acides forts, à l'exception du HF. L'acidité des acides halohydriques augmente : HF L'acide fluorhydrique peut attaquer le verre et certains fluorures inorganiques pendant une longue période. Il peut sembler contre-intuitif que le HF soit l'acide halohydrique le plus faible, puisque le fluor a l'électronégativité la plus élevée. Cependant, la liaison H-F est très forte, ce qui donne un acide très faible. Une liaison forte est déterminée par une courte longueur de liaison et une énergie de dissociation élevée. De tous les halogénures d’hydrogène, le HF possède la longueur de liaison la plus courte et l’énergie de dissociation des liaisons la plus élevée. Les acides oxo halogènes sont des acides contenant des atomes d'hydrogène, d'oxygène et d'halogène. Leur acidité peut être déterminée par analyse structurale. Les acides oxo halogènes sont indiqués ci-dessous : Dans chacun de ces acides, un proton est lié à un atome d’oxygène, il n’est donc pas utile de comparer les longueurs des liaisons protoniques ici. L’électronégativité joue ici un rôle dominant. L'activité acide augmente avec le nombre d'atomes d'oxygène associés à l'atome central. Les propriétés physiques de base des halogènes peuvent être résumées dans le tableau suivant. La couleur des halogènes résulte de l’absorption de la lumière visible par les molécules, ce qui provoque l’excitation des électrons. Le fluor absorbe la lumière violette et apparaît donc en jaune clair. L'iode, quant à elle, absorbe la lumière jaune et apparaît violette (le jaune et le violet sont des couleurs complémentaires). La couleur des halogènes devient plus foncée à mesure que la période augmente. Dans des récipients fermés, le brome liquide et l'iode solide sont en équilibre avec leurs vapeurs, observables sous la forme d'un gaz coloré. Bien que la couleur de l'astate soit inconnue, on suppose qu'elle est plus foncée que l'iode (c'est-à-dire noire) selon le motif observé. Maintenant, si on vous demande : « Caractérisez les propriétés physiques des halogènes », vous aurez quelque chose à dire. L’indice d’oxydation est souvent utilisé à la place du concept de valence halogène. Généralement, l'état d'oxydation est -1. Mais si un halogène est lié à l'oxygène ou à un autre halogène, il peut prendre d'autres états : l'oxygène CO -2 est prioritaire. Dans le cas de deux atomes d'halogène différents liés ensemble, l'atome le plus électronégatif prévaut et accepte le CO -1. Par exemple, dans le chlorure d'iode (ICl), le chlore a CO -1 et l'iode +1. Le chlore est plus électronégatif que l’iode, son CO est donc de -1. Dans l'acide bromique (HBrO4), l'oxygène contient CO -8 (-2 x 4 atomes = -8). L'hydrogène a un état d'oxydation global de +1. L'addition de ces valeurs donne un CO de -7. Puisque le CO final du composé doit être nul, le CO du brome est de +7. La troisième exception à la règle est l’état d’oxydation de l’halogène sous forme élémentaire (X2), où son CO est nul. L'électronégativité augmente avec la période. Le fluor possède donc l'électronégativité la plus élevée de tous les éléments, comme en témoigne sa position dans le tableau périodique. Sa configuration électronique est 1s2 2s2 2p5. Si le fluor gagne un autre électron, les orbitales p les plus externes sont complètement remplies et forment un octet complet. Le fluor ayant une électronégativité élevée, il peut facilement prendre un électron à un atome voisin. Le fluor dans ce cas est isoélectronique avec le gaz inerte (avec huit électrons de valence), toutes ses orbitales externes sont remplies. Dans cet état, le fluor est beaucoup plus stable. Dans la nature, les halogènes sont à l'état d'anions, les halogènes libres sont donc obtenus par oxydation par électrolyse ou à l'aide d'agents oxydants. Par exemple, le chlore est produit par hydrolyse d’une solution de sel de table. L'utilisation des halogènes et de leurs composés est diversifiée. DÉFINITION Halogènes– Éléments du groupe VIIA – fluor (F), chlore (Cl), brome (Br) et iode (I). Configuration électronique du niveau d'énergie externe des halogènes ns 2 np 5. Étant donné qu'il ne manque qu'un seul électron aux halogènes avant d'atteindre le niveau d'énergie, ils présentent le plus souvent en ORR les propriétés d'agents oxydants. États d'oxydation des halogènes : de « -1 » à « +7 ». Le seul élément du groupe halogène, le fluor, ne présente qu'un seul état d'oxydation « -1 » et est l'élément le plus électronégatif. Les molécules halogènes sont diatomiques : F 2, Cl 2, Br 2, I 2. Avec une charge croissante du noyau d'un atome d'un élément chimique, c'est-à-dire lors du passage du fluor à l'iode, la capacité oxydante des halogènes diminue, ce qui est confirmé par la capacité de déplacer les halogènes inférieurs par des halogènes supérieurs à partir des acides halohydriques et de leurs sels : Br 2 + 2HI = I 2 + 2HBr Cl 2 + 2KBr = Br 2 + 2KCl Au non. Le fluor est un gaz jaune clair avec une odeur âcre. Toxique. Le chlore est un gaz vert clair, tout comme le fluor, il a une odeur âcre. Très toxique. À pression élevée et à température ambiante, il se transforme facilement en état liquide. Le brome est un liquide lourd de couleur rouge-brun avec une odeur piquante désagréable caractéristique. Le brome liquide, ainsi que ses vapeurs, sont hautement toxiques. Le brome est peu soluble dans l'eau et bien dans les solvants non polaires. L'iode est un solide gris foncé avec un éclat métallique. La vapeur d'iode est violette. L'iode se sublime facilement, c'est-à-dire se transforme à l'état gazeux à partir d'un solide, tout en contournant l'état liquide. Les halogènes peuvent être obtenus par électrolyse de solutions ou de fusions d'halogénures : MgCl 2 = Mg + Cl 2 (fondre) Le plus souvent, les halogènes sont obtenus par réaction d'oxydation d'acides halohydriques : MnO 2 + 4HCl = MnCl 2 + Cl 2 +2H 2 O K 2 Cr 2 O 7 + 14HCl = 3Cl 2 + 2KCl +2CrCl 3 +7H 2 O 2KMnO 4 +16HCl = 2MnCl 2 +5Cl 2 +8H 2 O +2KCl Le fluor a la plus grande activité chimique. La plupart des éléments chimiques, même à température ambiante, interagissent avec le fluor, libérant une grande quantité de chaleur. Même l’eau brûle dans le fluor : 2H 2 O + 2F 2 = 4HF + O 2 Le chlore libre est moins réactif que le fluor. Il ne réagit pas directement avec l'oxygène, l'azote et les gaz rares. Il interagit avec toutes les autres substances comme le fluor : 2Fe + Cl2 = 2FeCl3 2P + 5Cl2 = 2PCl5 Lorsque le chlore interagit avec l'eau froide, une réaction réversible se produit : Cl 2 + H 2 O↔HCl +HClO Le mélange de produits de réaction est appelé eau chlorée. Lorsque le chlore interagit avec les alcalis à froid, des mélanges de chlorures et d'hypochlorites se forment : Cl 2 + Ca(OH) 2 = Ca(Cl)OCl + H 2 O Lorsque le chlore est dissous dans une solution alcaline chaude, la réaction suivante se produit : 3Cl 2 + 6KOH=5KCl +KClO 3 +3H 2 O Le brome, comme le chlore, se dissout dans l'eau et, réagissant partiellement avec lui, forme ce qu'on appelle « l'eau bromée », tandis que l'iode est pratiquement insoluble dans l'eau. L'activité chimique de l'iode diffère considérablement de celle des autres halogènes. Il ne réagit pas avec la plupart des non-métaux et réagit lentement avec les métaux uniquement lorsqu'ils sont chauffés. L'interaction de l'iode avec l'hydrogène ne se produit qu'avec un fort chauffage ; la réaction est endothermique et hautement réversible : H 2 + I 2 = 2HI - 53 kJ. EXEMPLE 1 Cl 2 + 2KI = I 2 + 2KCl Trouvons la quantité d'iode formée : v(Je 2)=m(Je 2)/M(Je 2) v(I 2)=508/254=2 mole Selon l'équation de réaction, la quantité de substance chlorée. >> Chimie : Production d'halogènes. Importance biologique et application des halogènes et de leurs composés Production d'halogènes
. Le fluor et le chlore sont obtenus par électrolyse de matières fondues ou de solutions de leurs sels. Par exemple, le processus de transformation électrique | La trolyse du chlorure de sodium fondu peut être reflétée par l'équation : Mais si l'hydrogène peut être obtenu par d'autres moyens plus pratiques et moins coûteux, par exemple à partir du gaz naturel, alors l'hydroxyde de sodium est obtenu presque exclusivement par électrolyse d'une solution de sel de table, comme le chlore. Le brome et l'iode sont produits industriellement par réaction de déplacement des bromures et des iodures, respectivement. Importance biologique des halogènes.
Leur candidature. On ne pouvait s'empêcher de remarquer que les étiquettes de nombreuses marques de dentifrices indiquent leur teneur en fluorure - bien sûr, pas de fluorure libre, mais de ses composés. Grâce à ce composant important, impliqué dans la construction de l'émail des dents et des os, des maladies telles que la carie dentaire sont évitées. De plus, le fluor est un élément nécessaire aux processus métaboliques des glandes, des muscles et des cellules nerveuses. Le fluor est également important dans la production industrielle, où ses principaux consommateurs sont l'industrie nucléaire et l'électrotechnique. Son composé Na3AlF6 (comment s'appelle-t-il ?) est utilisé pour produire de l'aluminium. Et dans la vie de tous les jours, les ustensiles de cuisine en téflon, qui doivent leur nom au plastique contenant du fluor - le téflon, sont de plus en plus utilisés. Chlore- l'un des éléments chimiques sans lequel l'existence des organismes vivants est impensable. Sa forme de base. le chlorure de sodium pénètre dans l'organisme. Il stimule le métabolisme, la pousse des cheveux, donne vigueur et force. La majeure partie du NaCl se trouve dans le plasma sanguin. L'acide chlorhydrique HC1, qui fait partie du suc gastrique, joue un rôle particulier dans la digestion. Sans 0,2% de HCl, le processus de digestion des aliments s'arrête pratiquement. Et bien que presque tous les produits alimentaires contiennent une certaine quantité de sel de table, une personne est obligée d'ajouter quotidiennement environ 20 g de sel à ses aliments. En termes d'utilisation industrielle, le chlore dépasse de loin tous les halogènes. Le chlore et ses composés sont nécessaires au blanchiment des tissus en lin et en coton, du papier, etc. Une grande partie est consommée en synthèse organique pour la production de plastiques, de caoutchoucs, de colorants et de solvants (Fig. 20). De nombreux composés contenant du chlore sont utilisés pour lutter contre les ravageurs agricoles. Le chlore est consommé en grande quantité pour désinfecter l’eau potable, mais non sans conséquences négatives (quelle substance est la plus sûre à utiliser à cette fin ?). Dans la métallurgie des non ferreux, certains métaux (titane, niobium, tantale) sont extraits des minerais par chloration. Le chlore a également été utilisé à des fins militaires comme agent de guerre chimique. Plus tard, il a été remplacé par d'autres substances toxiques contenant du chlore, plus efficaces, telles que le phosgène COCl2. Le chlore est contenu dans une substance très dangereuse pour la vie et la santé : la dioxine. Les composés chlorés sont l'une des causes de la destruction de la couche d'ozone sur Terre. Un autre halogène, le brome, est également très important pour le corps humain. Les composés de cet élément régulent les processus d'excitation et d'inhibition du système nerveux central. Par conséquent, pour le traitement des maladies nerveuses (insomnie, hystérie, neurasthénie, etc.), les médecins prescrivent du « brome » - des médicaments contenant du brome. Le brome est activement accumulé par certaines plantes, notamment les algues. C'est dans la mer que se concentre la majeure partie du brome de notre planète, et la mer est le principal fournisseur de brome. On estime qu’environ 4 millions de tonnes de brome sont rejetées dans l’air chaque année, en même temps que l’eau de mer. Il est clair que sa teneur dans l'air des zones côtières est toujours plus élevée que dans les zones éloignées de la mer. C’est l’une des raisons pour lesquelles respirer l’air marin est si bénéfique. Le brome, ou plus précisément le bromure d'argent AgBr, joue un rôle tout aussi important en photographie. Ceux qui sont impliqués dans la photographie se souviendront probablement immédiatement des noms des types de papier photographique - "Uni-bromine", "Bromineportrait", etc. Le papier photographique contient une couche de bromure d'argent appliquée dessus à l'aide de gélatine, qui se décompose facilement sous l'influence de la lumière: 2АgBr = 2Ag + Br2 Et enfin, le dernier des halogènes que nous envisageons - l'iode - est l'élément sans lequel une personne ne peut pas vivre : son manque d'eau et de nourriture réduit la production d'hormones thyroïdiennes et conduit au goitre endémique. Les effets régulateurs de l’hormone thyroïdienne comprennent l’excitation musculaire, le rythme cardiaque, l’appétit, la digestion, les fonctions cérébrales et le tempérament humain. L'iode pénètre dans l'organisme avec les aliments : pain, œufs, lait, eau, algues et avec l'air (surtout l'air marin) lors de la respiration. Une solution alcoolique d'iode (5 à 10 %), appelée teinture d'iode, est utilisée pour traiter les plaies. L'iode est présent dans de nombreux médicaments. Les principaux consommateurs d'iode sont les industries pharmaceutique et chimique, ainsi que la production de matériel photographique photosensible. 1. Production d'halogènes par électrolyse de matières fondues et de solutions salines. 2. Importance biologique des halogènes. 3. L'utilisation de chlore et de composés de fluor, de chlore et d'iode. Quel volume de chlore (n°) et quelle masse de sodium peut-on obtenir par électrolyse de 585 g de chlorure de sodium contenant 2 % d'impuretés ? Calculez combien de grammes d'une solution alcaline à 40 % peuvent être obtenus à partir de sodium, dont vous avez déterminé la masse dans le problème précédent. Le chimiste français Scheele a obtenu le chlore à partir de la réaction de l'oxyde de manganèse (IV) avec l'acide chlorhydrique. À la suite de cette réaction, du chlorure de manganèse (II) et de l’eau se forment également. Écrivez une équation pour cette réaction, considérez les processus redox et calculez la masse d'oxyde de manganèse (IV) et la quantité de chlorure d'hydrogène nécessaire pour produire 100 litres de chlore (n.o.), si son rendement est de 95 % du théoriquement possible. Préparez un message sur l'importance positive et négative des halogènes dans la vie humaine. |
