Le rôle de la pression externe dans les processus d'évaporation et de condensation. Évaporation des liquides Comment la pression dépend de l'évaporation
Lire aussi
Utiliser le phénomène de refroidissement d’un liquide lors de son évaporation ; dépendance du point d'ébullition de l'eau à la pression.
Lors de la vaporisation, la substance passe de état liquide en gazeux (vapeur). Il existe deux types de vaporisation : l'évaporation et l'ébullition.
Évaporation- Il s'agit d'une vaporisation se produisant à partir de la surface libre d'un liquide.
Comment se produit l’évaporation ? Nous savons que les molécules de tout liquide sont en mouvement continu et aléatoire, certaines se déplaçant plus rapidement, d’autres plus lentement. Ils sont empêchés de s'envoler par les forces d'attraction les uns vers les autres. Si, toutefois, il existe une molécule dotée d’une énergie cinétique suffisamment élevée à la surface du liquide, elle sera alors capable de surmonter les forces d’attraction intermoléculaire et de s’envoler hors du liquide. La même chose se répétera avec une autre molécule rapide, avec la deuxième, la troisième, etc. En s'envolant, ces molécules forment de la vapeur au-dessus du liquide. La formation de cette vapeur est une évaporation.
Étant donné que les molécules les plus rapides s'envolent d'un liquide lors de l'évaporation, l'énergie cinétique moyenne des molécules restant dans le liquide diminue de plus en plus. Par conséquent la température du liquide qui s'évapore diminue: Le liquide est refroidi. C'est notamment pourquoi une personne portant des vêtements mouillés a plus froid qu'une personne portant des vêtements secs (surtout en cas de vent).
En même temps, tout le monde sait que si vous versez de l'eau dans un verre et la laissez sur la table, malgré l'évaporation, elle ne refroidira pas continuellement, devenant de plus en plus froide jusqu'à ce qu'elle gèle. Qu'est-ce qui arrête ça ? La réponse est très simple : échange thermique entre l’eau et l’air chaud entourant le verre.
Le refroidissement d'un liquide lors de l'évaporation est plus perceptible dans le cas où l'évaporation se produit assez rapidement (pour que le liquide n'ait pas le temps de retrouver sa température en raison de l'échange thermique avec environnement). Les liquides volatils dotés de faibles forces d'attraction intermoléculaires, tels que l'éther, l'alcool et l'essence, s'évaporent rapidement. Si vous laissez tomber un tel liquide sur votre main, vous aurez froid. En s'évaporant de la surface de la main, un tel liquide se refroidira et lui enlèvera un peu de chaleur.
On trouve des substances qui s'évaporent rapidement large application en technologie. Par exemple, dans la technologie spatiale, les véhicules de descente sont recouverts de telles substances. Lors du passage dans l'atmosphère de la planète, le corps de l'appareil s'échauffe sous l'effet du frottement et la substance qui le recouvre commence à s'évaporer. En s'évaporant, il refroidit vaisseau spatial, l'évitant ainsi de la surchauffe.
Le refroidissement de l'eau lors de son évaporation est également utilisé dans les instruments utilisés pour mesurer l'humidité de l'air - psychromètres(du grec « psychros » – froid). Le psychromètre se compose de deux thermomètres. L'un d'eux (sec) indique la température de l'air, et l'autre (dont le réservoir est noué avec de la batiste, plongé dans l'eau) indique une température plus basse, en raison de l'intensité de l'évaporation de la batiste humide. Plus l’air dont l’humidité est mesurée est sec, plus l’évaporation est importante et donc plus la valeur du thermomètre humide est faible. Et inversement, plus l'humidité de l'air est élevée, moins l'évaporation est intense et donc plus haute température ce thermomètre montre. Sur la base des lectures de thermomètres secs et humidifiés, l'humidité de l'air, exprimée en pourcentage, est déterminée à l'aide d'un tableau spécial (psychrométrique). L'humidité la plus élevée est de 100 % (à cette humidité de l'air, de la rosée apparaît sur les objets). Pour l’homme, l’humidité la plus favorable est considérée comme comprise entre 40 et 60 %.
En utilisant expériences simples Il est facile d'établir que le taux d'évaporation augmente avec l'augmentation de la température du liquide, ainsi qu'avec l'augmentation de la surface libre et en présence de vent.
Pourquoi le liquide s’évapore-t-il plus rapidement lorsqu’il y a du vent ? Le fait est que simultanément à l'évaporation à la surface du liquide, le processus inverse se produit également - condensation. La condensation se produit du fait que certaines molécules de vapeur, se déplaçant de manière aléatoire sur le liquide, y retournent. Le vent emporte les molécules qui s'envolent du liquide et ne leur permet pas de revenir.
La condensation peut également se produire lorsque la vapeur n'est pas en contact avec le liquide. C'est la condensation, par exemple, qui explique la formation des nuages : les molécules de vapeur d'eau s'élevant au-dessus du sol dans les couches les plus froides de l'atmosphère sont regroupées en minuscules gouttelettes d'eau dont les accumulations constituent les nuages. La condensation de la vapeur d'eau dans l'atmosphère entraîne également de la pluie et de la rosée.
Dépendance de la température d'ébullition sur la pression
Le point d'ébullition de l'eau est de 100°C ; on pourrait penser qu’il s’agit d’une propriété inhérente à l’eau, que l’eau, peu importe où et dans quelles conditions elle se trouve, bout toujours à 100°C.
Mais il n’en est rien et les habitants des villages de haute montagne le savent bien.
Près du sommet de l'Elbrouz se trouvent une maison pour touristes et une station scientifique. Les débutants sont parfois surpris de « combien il est difficile de faire bouillir un œuf dans de l’eau bouillante » ou de « pourquoi l’eau bouillante ne brûle-t-elle pas ». Dans ces conditions, on leur dit que l'eau bout déjà à 82°C au sommet de l'Elbrouz.
Quel est le problème? Quel facteur physique interfère avec le phénomène d’ébullition ? Quelle est l’importance de l’altitude au-dessus du niveau de la mer ?
Ce facteur physique est la pression agissant à la surface du liquide. Vous n’avez pas besoin de grimper au sommet d’une montagne pour vérifier la véracité de ce qui a été dit.
En plaçant de l'eau chauffée sous une cloche et en pompant ou en pompant de l'air à partir de là, vous pouvez vous assurer que le point d'ébullition augmente à mesure que la pression augmente et diminue à mesure qu'elle diminue.
L'eau bout à 100°C seulement à une certaine pression - 760 mm Hg. Art. (ou 1 guichet automatique).
La courbe du point d’ébullition en fonction de la pression est présentée sur la figure. 4.2. Au sommet de l'Elbrouz, la pression est de 0,5 atm, et cette pression correspond à un point d'ébullition de 82°C.
Riz. 4.2
Mais l'eau bouillante à 10-15 mm Hg. Art., vous pouvez vous rafraîchir dans temps chaud. A cette pression, le point d'ébullition descendra à 10-15°C.
Vous pouvez même obtenir de l’« eau bouillante », qui a la température de l’eau glacée. Pour ce faire, vous devrez réduire la pression à 4,6 mm Hg. Art.
Une image intéressante peut être observée si vous placez un récipient ouvert avec de l'eau sous la cloche et pompez l'air. Le pompage fera bouillir l’eau, mais l’ébullition nécessite de la chaleur. Il n'y a nulle part où la prendre et l'eau devra renoncer à son énergie. La température de l’eau bouillante commencera à baisser, mais à mesure que le pompage se poursuivra, la pression diminuera également. Par conséquent, l’ébullition ne s’arrêtera pas, l’eau continuera à refroidir et éventuellement à geler.
Une telle ébullition eau froide ne se produit pas seulement lors du pompage de l'air. Par exemple, lorsque l'hélice d'un navire tourne, la pression dans une couche d'eau en mouvement rapide près d'une surface métallique diminue considérablement et l'eau de cette couche bout, c'est-à-dire que de nombreuses bulles remplies de vapeur y apparaissent. Ce phénomène est appelé cavitation (du mot latin cavitas - cavité).
En réduisant la pression, on abaisse le point d'ébullition. Et en l'augmentant ? Un graphique comme le nôtre répond à cette question. Une pression de 15 atm peut retarder l'ébullition de l'eau, elle ne commencera qu'à 200°C, et une pression de 80 atm fera bouillir l'eau seulement à 300°C.
Ainsi, à une certaine pression extérieure correspond un certain point d’ébullition. Mais cette affirmation peut être « inversée » en disant ceci : à chaque point d’ébullition de l’eau correspond sa propre pression spécifique. Cette pression est appelée pression de vapeur.
La courbe représentant le point d'ébullition en fonction de la pression est également une courbe de pression de vapeur en fonction de la température.
Les nombres tracés sur un graphique du point d’ébullition (ou sur un graphique de la pression de vapeur) montrent que la pression de vapeur change très fortement avec la température. À 0°C (soit 273 K), la pression de vapeur est de 4,6 mmHg. Art., à 100°C (373 K) elle est égale à 760 mm Hg. Art., c'est-à-dire augmente 165 fois. Lorsque la température double (de 0°C, soit 273 K, à 273°C, soit 546 K), la pression de vapeur augmente de 4,6 mm Hg. Art. presque jusqu'à 60 atm, soit environ 10 000 fois.
Par conséquent, au contraire, le point d’ébullition change assez lentement avec la pression. Lorsque la pression passe deux fois de 0,5 atm à 1 atm, le point d'ébullition augmente de 82°C (355 K) à 100°C (373 K) et lorsque la pression double de 1 à 2 atm - de 100°C (373 K ) à 120 °C (393 K).
La même courbe que nous examinons maintenant contrôle également la condensation (condensation) de la vapeur en eau.
La vapeur peut être transformée en eau par compression ou refroidissement.
Tant pendant l'ébullition que pendant la condensation, le point ne bougera pas de la courbe jusqu'à ce que la conversion de la vapeur en eau ou de l'eau en vapeur soit terminée. Cela peut aussi se formuler ainsi : dans les conditions de notre courbe et seulement dans ces conditions, la coexistence du liquide et de la vapeur est possible. Si vous n'ajoutez ou ne supprimez pas de chaleur, les quantités de vapeur et de liquide dans un récipient fermé resteront inchangées. On dit que cette vapeur et ce liquide sont en équilibre, et la vapeur qui est en équilibre avec son liquide est dite saturée.
La courbe d'ébullition et de condensation, comme on le voit, a une autre signification : c'est la courbe d'équilibre du liquide et de la vapeur. La courbe d'équilibre divise le champ du diagramme en deux parties. Vers la gauche et vers le haut (vers des températures plus élevées et des pressions plus basses) se trouve la région de l'état stable de la vapeur. À droite et en bas se trouve la région de l’état stable du liquide.
La courbe d'équilibre vapeur-liquide, c'est-à-dire la courbe de dépendance du point d'ébullition à la pression ou, ce qui est la même, la pression de vapeur à la température, est approximativement la même pour tous les liquides. Dans certains cas, le changement peut être un peu plus brusque, dans d'autres un peu plus lent, mais la pression de vapeur augmente toujours rapidement avec l'augmentation de la température.
Nous avons déjà utilisé à plusieurs reprises les mots « gaz » et « vapeur ». Ces deux mots sont assez égaux. On peut dire : l'eau gazeuse est de la vapeur d'eau, l'oxygène gazeux est de la vapeur d'oxygène liquide. Néanmoins, une certaine habitude s’est développée lors de l’utilisation de ces deux mots. Puisque nous sommes habitués à une certaine plage de température relativement petite, nous appliquons généralement le mot « gaz » aux substances dont l'élasticité de la vapeur aux températures ordinaires est supérieure à la pression atmosphérique. Au contraire, on parle de paire lorsque température ambiante et la pression atmosphérique, la substance est plus stable sous forme liquide.
Le processus d'évaporation intense d'un liquide commence à une température où la pression de vapeur du liquide dépasse la pression externe atmosphère gazeuse sur le liquide. Au point d'ébullition, la formation de vapeur se produit dans toute la masse du liquide et s'écoule à une température presque constante jusqu'à transition complète liquides (monocomposant) et vapeur. En abaissant artificiellement la pression, vous pouvez faire bouillir un liquide à plus basses températures, largement utilisé en technologie, car il est plus facile à trouver pour travailler à basse température matériel approprié pour l'équipement. La technologie moderne du vide dispose de puissantes pompes rotatives capables de créer un vide dans lequel la pression résiduelle ne dépasse pas 0,001 mm Hg, et de pompes à diffusion à jet qui créent un vide jusqu'à 10v-7-10v-8 mmHg. Art.La distillation sous vide est utilisée pour obtenir des métaux de haute pureté ; Zn, Cd, Mg, Ca, etc. Fonctionnent généralement à des pressions légèrement supérieures à la pression de vapeur du métal distillé à son point de fusion. Puis distiller métal liquide, obtenir un condensat solide, ce qui permet d'utiliser très conception simple dispositif de distillation représenté sur la Fig. 24. Le dispositif est un cylindre dans la partie inférieure duquel se trouve un récipient contenant du métal distillable liquide. Les vapeurs sont condensées en partie haute du cylindre sur un composé spécial cylindre en métal(condensateur) sous la forme d'une croûte cristalline qui, une fois le processus terminé, est retirée avec le condensateur. Avant de chauffer le métal, commencez par pompe à vide pompez l'air de l'appareil, puis rétablissez de temps en temps le vide, qui change en raison des fuites d'air de l'extérieur dues à des fuites dans l'équipement. Si l'appareil est suffisamment étanche, alors pendant le processus de distillation, étant donné qu'aucun gaz non condensable n'est libéré, Travail à plein temps aucune pompe à vide n'est nécessaire.
Le dispositif décrit est extrêmement simple ; il est réalisé en acier ou en alliages métalliques résistants à la chaleur. Ce qui est particulièrement important est que son couvercle et toutes les pièces d'étanchéité soient refroidis avec de l'eau, c'est-à-dire qu'ils fonctionnent à température ambiante, permettant l'utilisation de joints très avancés - caoutchouc, mastics sous vide, etc. L'utilisation du vide permet un nettoyage par distillation à des températures relativement basses. températures (700 -900°) de métaux chimiquement actifs et très agressifs comme le calcium, le magnésium, le baryum, dont la distillation à pression atmosphérique n'est pas réalisable en raison de l'impossibilité de sélectionner le matériau pour l'équipement.
Considérons les caractéristiques du processus d'évaporation sous vide.
Le diagramme de phase liquide-vapeur avec diminution de pression a le même caractère que les diagrammes de pression atmosphérique, seules les lignes liquide et vapeur se déplacent vers la région des températures les plus basses. Il s'ensuit que l'efficacité de séparation des composants lors de l'évaporation de leur solution sous vide est approximativement la même qu'à pression atmosphérique, mais se produit à des températures plus basses ; Plus la température est basse, plus le vide appliqué est profond. Une particularité du travail sous vide est l'absence d'entraînement de petites gouttes de liquide ainsi que de vapeur, ce qui est toujours observé lorsque l'on travaille sous pression atmosphérique. Lorsqu'un liquide bout rapidement, les bulles de vapeur qui éclatent s'élevant des profondeurs du liquide produisent des éclaboussures qui sont emportées par la vapeur dans le condenseur et contaminent le distillat. Dans le vide (suffisamment profond), la formation d'éclaboussures ne se produit pas, car le processus d'ébullition est fondamentalement différent de l'ébullition à pression atmosphérique. Dans le vide, la formation de vapeur se produit uniquement à la surface du liquide ; aucune bulle ne se forme à l'intérieur du liquide ; la surface est calme et ne bout pas, par conséquent, des éclaboussures ne peuvent pas se produire. Par conséquent, la distillation sous vide produit un distillat plus pur que la distillation à pression atmosphérique.
Utilisons un exemple pour montrer la particularité du processus d'ébullition sous vide. Dans un cas, faites bouillir de l'eau dans un récipient d'une profondeur de couche de 250 mm à la pression atmosphérique (760 mm Hg). Alors la vapeur dégagée par la surface de l’eau doit avoir Pression atmosphérique(760 mmHg), qui se développe à une température de surface de l'eau de 100°. La bulle de vapeur formée au fond de la cuve doit avoir une pression plus élevée, car, en plus de la pression atmosphérique, elle doit vaincre la pression hydrostatique d'une colonne d'eau de 250 mm de hauteur, ce qui correspond à une surpression de 18 mm Hg. Art. Ainsi, la vapeur dégagée par le fond du récipient doit avoir une pression de 760 + 18 = 778 mm Hg. Art., qui correspond à la température de l'eau au fond du récipient étant de 100,6°. Une si légère surchauffe de l'eau au fond (0,6°) est bien réelle, et le processus d'ébullition se déroule de telle manière que de la vapeur se forme dans toute la masse de la couche. L'eau bout vigoureusement et produit des éclaboussures lorsque les bulles à la surface se brisent.
Considérons maintenant l’ébullition de la même couche d’eau dans un vide de 4,58 mmHg. Art. Pour faire bouillir Couche de surface l'eau doit avoir une température de 0°, à laquelle la pression de vapeur saturée est de 4,58 mm Hg. Art. La bulle formée au fond doit vaincre la pression hydrostatique de la colonne d'eau de 250 mm, ce qui correspond à une pression de 18 mm Hg. Art., et ont une pression totale de 4,58 + 18 = 22,58 mm Hg. Art. L'eau aura cette pression de vapeur saturée à une température de ~ 23°, c'est-à-dire que pour qu'une bulle de vapeur se forme au fond du récipient, il faut avoir une température de 23° au fond. Il est impossible d’obtenir une telle différence entre les températures au fond et en surface, car les courants de convection l’empêcheront. Par conséquent, les bulles ne se formeront pas en profondeur dans la couche liquide et la vaporisation se produira uniquement à partir de la surface du liquide.
Les métaux fondus ont une conductivité thermique élevée, ce qui empêche la surchauffe locale du liquide et, par conséquent, l'ébullition avec formation de bulles.
Jusqu'à ce que la pression dans l'appareil devienne très basse, des molécules s'échangent entre la surface du liquide et la vapeur et un équilibre liquide-vapeur mobile s'établit. Un flux de gaz ordinaire de vapeur s'écoule vers le condenseur et les résultats du processus de distillation sont déterminés par le diagramme de phase liquide-vapeur.
Si la pression dans l'appareil est si basse que le libre parcours moyen des molécules devient plus de tailles dispositif, la nature du processus de distillation change radicalement.
Dans ces conditions, il n'y a pas d'échange de molécules entre vapeur et liquide, l'équilibre mobile liquide-vapeur n'est pas établi et le diagramme de phase liquide-vapeur ne décrit pas le processus d'évaporation. Une conduite de gaz ordinaire entre l'évaporateur et le condenseur. Non formées, les molécules de vapeur séparées de la surface du liquide suivent un chemin rectiligne, sans entrer en collision avec d'autres molécules, tombent sur la surface froide du condenseur et y restent - elles se condensent ; le processus d'évaporation est totalement irréversible et présente le caractère d'une évaporation moléculaire. Le résultat de la distillation est déterminé par le taux d'évaporation, qui dépend du type de substance évaporée et de la température et est indépendant de la pression externe dans le système si cette pression est suffisamment basse. Le taux d'évaporation dans ces conditions peut être calculé à l'aide de la formule de Langmuir :
En prenant le taux d'évaporation comme la masse d'une substance s'évaporant par seconde à partir d'une unité de surface, exprimant la pression de vapeur p en millimètres Mercure et en remplaçant les valeurs de R et π par elles valeurs numériques, on obtient l'équation (III, 13) sous une forme différente, pratique pour les calculs pratiques :
Lors de l'évaporation moléculaire, des substances ayant la même pression de vapeur peuvent être séparées si leurs poids moléculaires sont différents, comme le prouvent les expériences de séparation isotopique.
17.10.2019
Dans le segment russe, les activités du groupe Hoffmann sont florissantes. Les partenaires du groupe de sociétés parviennent à augmenter les volumes de ventes dans la Fédération de Russie d'année en année....
17.10.2019
Le plastique est un matériau pratique et bon marché. Cela détermine son utilisation généralisée dans la production d'objets. Cependant, cela a aussi ses inconvénients...
17.10.2019
L'acier inoxydable est largement utilisé dans champs variés industrie et construction. Le métal laminé et les produits qui en sont fabriqués sont utilisés dans la construction navale et...
17.10.2019
Le fil à tricoter est materiel de construction sous la forme d'un fil fin, pour la production duquel on utilise de l'acier laminé à faible teneur en carbone, soumis à...
17.10.2019
Fabrication panneaux de liège depuis matériau naturel. Pour cela, on utilise de l'écorce de chêne (le chêne-liège pousse en Afrique du Nord et dans certaines régions du sud...
17.10.2019
Activité économique la pollution humaine renforce souvent le processus d’érosion naturelle des sols. Le relief évolue progressivement, des canaux se créent, la direction de la rivière, des fossés changent...
17.10.2019
Les fonctions des étiquettes peuvent varier. Une fois les autocollants placés sur le produit, ils deviennent une source d'informations sur le fabricant et le produit, et sont utilisés comme moyen de promotion et...
Évaporation
Évaporation sur une tasse de thé
Évaporation- le processus de transition d'une substance d'un état liquide à un état gazeux, se produisant à la surface d'une substance (vapeur). Le processus d’évaporation est l’inverse du processus de condensation (passage de l’état vapeur à l’état liquide). L'évaporation (vaporisation), le passage d'une substance d'une phase condensée (solide ou liquide) à une phase gazeuse (vapeur) ; transition de phase du premier ordre.
Il existe un concept d'évaporation plus développé en physique supérieure.
Évaporation- il s'agit d'un processus dans lequel des particules (molécules, atomes) s'envolent (s'arrachent) de la surface d'un liquide ou d'un solide, avec E k > E p.
caractéristiques générales
Évaporation solide s'appelle sublimation (sublimation), et la vaporisation dans un volume de liquide s'appelle ébullition. Généralement, l'évaporation fait référence à la formation de vapeur sur la surface libre d'un liquide suite à mouvement thermique ses molécules à une température inférieure au point d'ébullition correspondant à la pression du milieu gazeux situé au-dessus de la surface spécifiée. Dans ce cas, des molécules ayant une énergie cinétique suffisamment élevée s'échappent de la couche superficielle du liquide vers le milieu gazeux ; certains d'entre eux sont réfléchis et capturés par le liquide, tandis que le reste est irrémédiablement perdu par celui-ci.
L'évaporation est un processus endothermique dans lequel la chaleur de transition de phase est absorbée - la chaleur d'évaporation dépensée pour vaincre les forces de cohésion moléculaire dans la phase liquide et pour le travail d'expansion lors de la conversion du liquide en vapeur. Chaleur spécifique l'évaporation se réfère à 1 mole de liquide (chaleur molaire d'évaporation, J/mol) ou par unité de sa masse (chaleur massique d'évaporation, J/kg). Le taux d'évaporation est déterminé par la densité surfacique du flux de vapeur jп pénétrant par unité de temps dans la phase gazeuse à partir d'une unité de surface du liquide [en mol/(s.m 2) ou kg/(s.m 2)]. Valeur la plus élevée jп est réalisé dans le vide. S'il y a un milieu gazeux relativement dense au-dessus du liquide, l'évaporation ralentit du fait que le taux d'élimination des molécules de vapeur de la surface du liquide vers le milieu gazeux devient faible par rapport au taux de leur émission du liquide. Dans ce cas, une couche de mélange vapeur-gaz se forme à l'interface des phases, presque saturée de vapeur. La pression partielle et la concentration de vapeur dans cette couche sont plus élevées que dans la masse du mélange vapeur-gaz.
Le processus d'évaporation dépend de l'intensité du mouvement thermique des molécules : plus les molécules se déplacent rapidement, plus l'évaporation se produit rapidement. De plus, des facteurs importants influençant le processus d'évaporation sont le taux de diffusion externe (par rapport à la substance), ainsi que les propriétés de la substance elle-même. En termes simples, lorsqu’il y a du vent, l’évaporation se produit beaucoup plus rapidement. Quant aux propriétés de la substance, par exemple, l'alcool s'évapore beaucoup plus plus rapide que l'eau. Un facteur important est également la surface du liquide à partir de laquelle l'évaporation se produit : à partir d'une carafe étroite, elle se produira plus lentement qu'à partir d'une assiette large.
Niveau moléculaire
Considérons ce processus au niveau moléculaire : les molécules qui ont suffisamment d'énergie (vitesse) pour vaincre l'attraction des molécules voisines sortent des limites de la substance (liquide). Dans ce cas, le liquide perd une partie de son énergie (refroidit). Par exemple, un liquide très chaud : on souffle sur sa surface pour le refroidir, tout en accélérant le processus d'évaporation.
Equilibre thermodynamique
La violation de l'équilibre thermodynamique entre le liquide et la vapeur contenus dans le mélange vapeur-gaz s'explique par un saut de température à l'interface des phases. Cependant, ce saut peut généralement être négligé et on peut supposer que la pression partielle et la concentration de vapeur à l'interface correspondent à leurs valeurs pour une vapeur saturée ayant la température de la surface du liquide. Si le mélange liquide et vapeur-gaz est stationnaire et que l'influence de la convection libre y est insignifiante, l'élimination de la vapeur formée lors de l'évaporation de la surface du liquide vers le milieu gazeux se produit principalement en raison de la diffusion moléculaire et de l'apparition d'une interface masse-phase provoquée par cette dernière avec une surface semi-perméable (impénétrable au gaz) (appelée Stefanovsky) écoulement d'un mélange vapeur-gaz dirigé de la surface d'un liquide vers un milieu gazeux (voir Diffusion). Répartition de la température à divers modes refroidissement par évaporation du liquide. Les flux de chaleur sont dirigés : a - de la phase liquide vers la surface d'évaporation vers la phase gazeuse ; b - de la phase liquide uniquement à la surface d'évaporation ; c - à la surface d'évaporation des deux phases ; d - à la surface d'évaporation uniquement du côté phase gazeuse.
Baro-, diffusion thermique
Les effets de la pression et de la diffusion thermique ne sont généralement pas pris en compte dans les calculs techniques, mais l'influence de la diffusion thermique peut être significative lorsque le mélange vapeur-gaz est très hétérogène (avec une grande différence dans les masses molaires de ses composants) et significatif gradients de température. Lorsqu'une ou les deux phases se déplacent par rapport à leur interface, le rôle de transfert convectif de matière et d'énergie du mélange vapeur-gaz et du liquide augmente.
En l'absence d'approvisionnement énergétique du système liquide-gaz depuis l'extérieur. sources de chaleur L'évaporation peut être fournie à la couche superficielle du liquide à partir d'une ou des deux phases. Contrairement au flux de matière qui en résulte, qui est toujours dirigé lors de l'évaporation d'un liquide vers un milieu gazeux, les flux de chaleur peuvent avoir différentes directions en fonction des rapports de température de la masse du liquide tl, de la limite de phase tgr et du milieu gazeux tg. Lorsqu'une certaine quantité de liquide entre en contact avec un volume semi-infini ou un flux de milieu gazeux lavant sa surface et à une température du liquide supérieure à la température du gaz (tl > tg > tg), un flux de chaleur se produit du liquide vers l'interface de phase : (Qlg = Ql - Qi, où Qi est la chaleur d'évaporation, Qlg est la quantité de chaleur transférée du liquide au milieu gazeux. Dans ce cas, le liquide est refroidi (ce qu'on appelle refroidissement par évaporation). Si, à la suite d'un tel refroidissement, l'égalité tgr = tg est atteinte, le transfert de chaleur du liquide vers le gaz s'arrête ( Qlg = 0) et toute la chaleur fournie du côté liquide à l'interface est dépensée pour l'évaporation (). Ql = Qi).
Dans le cas d'un milieu gazeux non saturé de vapeur, la pression partielle de cette dernière à l'interface des phases et à Ql = Qi reste supérieure à celle dans la masse du gaz, de sorte que l'évaporation et le refroidissement par évaporation du liquide ne s'arrête pas et tgr devient inférieur à tl et tg. Dans ce cas, la chaleur est fournie à l'interface des deux phases jusqu'à ce que, du fait d'une diminution de tl, l'égalité tgr = tl soit atteinte et que le flux de chaleur du côté liquide s'arrête, et du milieu gazeux Qgl devienne égal à Qi. Une évaporation supplémentaire du liquide se produit à une température constante tm = tl = tgr, appelée limite de refroidissement du liquide pendant le refroidissement par évaporation ou température du bulbe humide (comme le montre le psychromètre à bulbe humide). La valeur de tm dépend des paramètres du milieu vapeur-gaz et des conditions de transfert de chaleur et de masse entre les phases liquide et gazeuse.
Si un milieu liquide et gazeux ayant différentes températures, se trouvent dans un volume limité qui ne reçoit pas d'énergie de l'extérieur et ne la libère pas vers l'extérieur. L'évaporation se produit jusqu'à ce qu'un équilibre thermodynamique se produise entre les deux phases, dans lequel les températures des deux phases sont égalisées à une enthalpie constante du système. , et la phase gazeuse est saturée de vapeur à la température du système tad. Cette dernière, appelée température de saturation adiabatique du gaz, est déterminée uniquement par les paramètres initiaux des deux phases et ne dépend pas des conditions de transfert de chaleur et de masse.
Taux d'évaporation
Le taux d'évaporation isotherme [kg/(m 2 s)] avec diffusion unidirectionnelle de vapeur dans une couche stationnaire d'un mélange binaire vapeur-gaz d'épaisseur d, [m] situé au-dessus de la surface du liquide peut être trouvé à l'aide de la formule de Stefan : , où D est le coefficient de diffusion mutuelle, [m 2 /With] ; - vapeur constante de gaz, [J/(kg K)] ou [m 2 /(s 2 K)] ; T - température du mélange, [K] ; p - pression du mélange vapeur-gaz, [Pa] ; - pressions partielles de vapeur à l'interface et à la limite externe de la couche de mélange, [Pa].
Dans le cas général (liquide et gaz en mouvement, conditions non isothermes), dans la couche limite de liquide adjacente à l'interface, le transfert de quantité de mouvement s'accompagne d'un transfert de chaleur, et dans la couche limite de gaz (mélange vapeur-gaz) chaleur interconnectée et un transfert de masse se produit. Dans ce cas, pour calculer le taux d'évaporation, des coefficients expérimentaux de transfert de chaleur et de masse sont utilisés et, dans des cas relativement plus simples, des méthodes approximatives de solutions numériques du système équations différentielles pour les couches limites conjuguées de phases gazeuses et liquides.
L'intensité du transfert de masse lors de l'évaporation dépend de la différence des potentiels chimiques de la vapeur à l'interface et dans la masse du mélange vapeur-gaz. Cependant, si la diffusion baro- et thermique peut être négligée, la différence de potentiels chimiques est remplacée par la différence de pressions partielles ou de concentrations de vapeur et on prend ce qui suit : jп = bp (рп, gr - рп, basic) = bpp(уп , гр - уп, basique) ou jп = bc( cп, gr - sp, principal), où bp, bc - coefficient de transfert de masse, p - pression du mélange, rp - pression de vapeur partielle, yп = pп/p - concentration molaire de vapeurs, cп = rп/r - concentration massique des vapeurs, rп, r - densités locales des vapeurs et des mélanges ; les indices signifient : « gr » - à la limite de phase, « basique » - dans l'ensemble. poids du mélange. La densité du flux thermique dégagé par le liquide lors de l'évaporation est [en J/(m2 s)] : q = azh(tl - tg) = rjп + ag (tg - tg), où azh, ag - coefficient de transfert de chaleur du liquide et gaz , [W/(m 2 K)] ; r - Évaporation de la chaleur, [J/kg].
Pour de très petits rayons de courbure de la surface d'évaporation (par exemple, lors de l'évaporation de petites gouttes de liquide), l'influence de tension superficielle liquide, ce qui conduit au fait que la pression de vapeur à l'équilibre au-dessus de l'interface est supérieure à la pression de vapeur saturée du même liquide au-dessus d'une surface plane. Si tgr ~ tl, alors lors du calcul de l'évaporation, seuls les transferts de chaleur et de masse en phase gazeuse peuvent être pris en compte. À une intensité de transfert de masse relativement faible, l'analogie entre les processus de transfert de chaleur et de masse est approximativement valable, d'où il résulte : Nu/Nu0 = Sh*/Sh0, où Nu = ag l/lg est le nombre de Nusselt, l est la taille caractéristique de la surface d'évaporation, lg est le coefficient de conductivité thermique du mélange vapeur-gaz, Sh* = bpyг, grl/Dp = bccг, grl/D - Nombre de Sherwood pour la composante de diffusion du flux de vapeur, Dp = D/ RпT - coefficient de diffusion lié au gradient de pression partielle de la vapeur. Les valeurs de bp et bc sont calculées à partir des relations ci-dessus, les nombres Nu0 et Sh0 correspondent à jп : 0 et peuvent être déterminés à partir de données pour des processus de transfert de chaleur et de masse se produisant séparément. Le nombre Sh0 pour le flux de vapeur total (de diffusion et de convection) est obtenu en divisant Sh* par la concentration molaire (yg, g) ou massique (cg, g) de gaz à l'interface, selon laquelle force motrice le transfert de masse est affecté au coefficient b.
Équations
Les équations de similarité pour Nu et Sh* lors de l'évaporation incluent, outre les critères habituels (nombres de Reynolds Re, Archimède Ar, Prandtl Pr ou Schmidt Sc et paramètres géométriques), des paramètres qui prennent en compte l'influence du flux transversal de vapeur et le degré d'hétérogénéité du mélange vapeur-gaz (rapports de masses molaires ou constantes de gaz de ses composants) sur les profils, vitesses, températures ou concentrations dans la section transversale de la couche limite.
Aux petits jp, qui ne perturbent pas significativement le régime hydrodynamique de mouvement du mélange vapeur-gaz (par exemple, lors de l'évaporation de l'eau dans air atmosphérique) et la similarité des conditions aux limites des champs de température et de concentration, l'influence d'arguments supplémentaires dans les équations de similarité est insignifiante et peut être négligée, en supposant que Nu = Sh. Lorsque les mélanges à plusieurs composants s’évaporent, ces schémas deviennent beaucoup plus compliqués. Dans ce cas, la chaleur d'évaporation des composants du mélange et les compositions des phases liquide et vapeur-gaz, qui sont en équilibre les unes avec les autres, sont différentes et dépendent de la température. Lorsqu'un mélange liquide binaire s'évapore, le mélange de vapeurs résultant est relativement plus riche en composant le plus volatil, excluant uniquement les mélanges azéotropiques qui s'évaporent aux points extrêmes (maximum ou minimum) des courbes d'état sous forme de liquide pur.
Conceptions d'appareils
La quantité totale de liquide qui s'évapore augmente avec l'augmentation de la surface de contact des phases liquide et gazeuse, c'est pourquoi les conceptions des dispositifs dans lesquels l'évaporation se produit prévoient une augmentation de la surface d'évaporation en créant grand miroir liquide, le divisant en jets et en gouttes ou formant Films minces, s'écoulant à la surface des buses. Une augmentation de l'intensité du transfert de chaleur et de masse lors de l'évaporation est également obtenue en augmentant la vitesse du milieu gazeux par rapport à la surface du liquide. Toutefois, une augmentation de cette vitesse ne doit pas conduire à un entraînement excessif de liquide par le milieu gazeux et à une augmentation significative de la résistance hydraulique de l'appareil.
Application
L'évaporation est largement utilisée dans pratique industrielle pour la purification de substances, le séchage de matériaux, la séparation de mélanges liquides, la climatisation. Le refroidissement par évaporation l'eau est utilisée dans les systèmes d'approvisionnement en eau de circulation des entreprises.
voir également
Littérature
- // Dictionnaire encyclopédique de Brockhaus et Efron : En 86 volumes (82 volumes et 4 supplémentaires). - Saint-Pétersbourg. , 1890-1907.
- Berman L.D., Refroidissement par évaporation de l'eau en circulation, 2e éd., M.-L., 1957 ;
- Fuks N.A., Évaporation et croissance de gouttelettes dans environnement gazeux, M., 1958 ;
- Bird R., Stewart W., Lightfoot E., Phénomènes de transfert, trans. de l'anglais, M., 1974 ;
- Berman L.D., " Base théorique chimie. technologie", 1974, vol. 8, n° 6, p. 811-22 ;
- Sherwood T., Pigford R., Wilkie C., Transfert de masse, trad. de l'anglais, M., 1982. L. D. Berman.
Liens
Fondation Wikimédia. 2010.
Synonymes:Voyez ce qu'est « évaporation » dans d'autres dictionnaires :
Transition vers l'eau à partir d'un liquide ou d'un solide état d'agrégation en gazeux (vapeur). Généralement, la fluidisation est comprise comme la transition d'un liquide en vapeur qui se produit à la surface libre du liquide. I. les corps solides sont appelés. sublimation ou sublimation. Dépendance à la pression... ... Encyclopédie physique
Vaporisation se produisant à la surface libre d'un liquide. L'évaporation de la surface d'un solide est appelée sublimation... Grand Dictionnaire encyclopédique
COMBUSTION DE LIQUIDES
La combustion des liquides est caractérisée par deux phénomènes interdépendants : l'évaporation et la combustion d'un mélange vapeur-air au-dessus de la surface du liquide. Par conséquent, la combustion des liquides s'accompagne non seulement réaction chimique(l'oxydation se transforme en combustion flamboyante), mais aussi des phénomènes physiques (évaporation et formation d'un mélange vapeur-air au-dessus de la surface du liquide), sans lesquels la combustion est impossible.
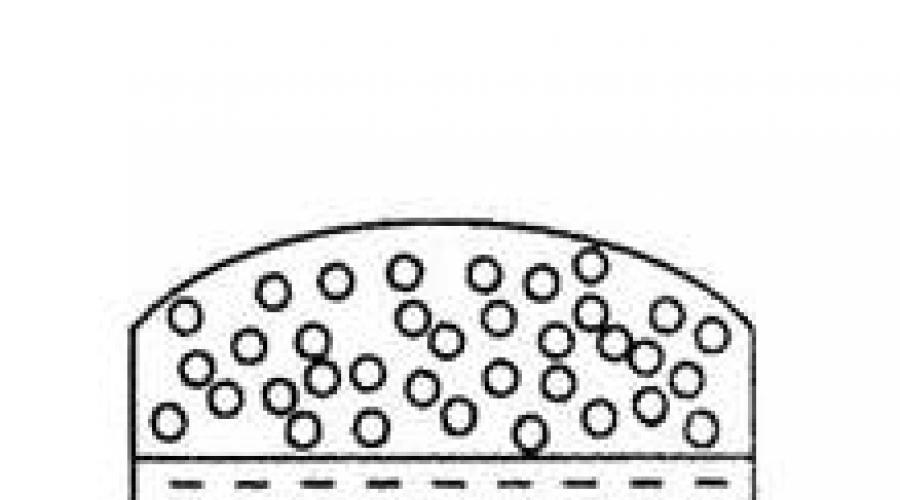
La transition d’une substance de l’état liquide à l’état vapeur est appelée vaporisation. Il existe deux formes de ce processus : l'évaporation et l'ébullition. Évaporation est la transition du liquide en vapeur à partir d'une surface libre à une température inférieure au point d'ébullition du liquide (voir Fig. 4.1). L'évaporation résulte du mouvement thermique des molécules liquides. La vitesse de déplacement des molécules fluctue dans une large plage, s'écartant considérablement dans les deux sens de sa valeur moyenne. Certaines molécules qui ont une énergie cinétique suffisamment élevée s'échappent de la couche superficielle du liquide dans le milieu gazeux (air). L'excès d'énergie des molécules perdu par le liquide est dépensé pour surmonter les forces d'interaction entre les molécules et le travail d'expansion (augmentation de volume) lorsque le liquide se transforme en vapeur. Ébullition- il s'agit de l'évaporation non seulement de la surface, mais aussi du volume du liquide par formation de bulles de vapeur dans tout le volume et leur libération. L'évaporation se produit à n'importe quelle température du liquide. L'ébullition se produit uniquement à une température à laquelle la pression de vapeur saturée atteint la pression externe (atmosphérique).
En raison de mouvement brownien dans la zone gazière, le processus inverse a également lieu – condensation. Si le volume au-dessus du liquide est fermé, alors à n'importe quelle température du liquide, un équilibre dynamique s'établit entre les processus d'évaporation et de condensation.
La vapeur en équilibre avec un liquide est appelée vapeur saturée. L'état d'équilibre correspond à la concentration de vapeur déterminée pour une température donnée. La pression de la vapeur en équilibre avec un liquide est appelée pression de vapeur saturée.

Riz. 4.1. Schéma d'évaporation du liquide dans : a) un récipient ouvert, b) un récipient fermé
La pression de vapeur saturée (p.p.) d'un liquide donné à température constante est pour celui-ci une valeur constante et immuable. La valeur de la pression de vapeur saturée est déterminée par la température du liquide : avec l'augmentation de la température, la pression de vapeur saturée augmente. Cela est dû à la croissance énergie cinétique molécules liquides avec une température croissante. Dans ce cas, une proportion croissante de molécules s’avèrent posséder une énergie suffisante pour se transformer en vapeur.
Ainsi, au-dessus de la surface (miroir) d'un liquide se trouve toujours un mélange vapeur-air qui, en état d'équilibre, est caractérisé par la pression des vapeurs saturées du liquide ou leur concentration. Avec l'augmentation de la température, la pression de vapeur saturée augmente selon l'équation de Clayperon-Clasius :
 , (4.1)
, (4.1)
ou sous forme intégrale :
 , (4.2)
, (4.2)
où p n.p. – pression de vapeur saturée, Pa ;
L'évaporation DH est la chaleur d'évaporation, la quantité de chaleur nécessaire pour convertir une unité de masse de liquide à l'état vapeur, en kJ/mol ;
T – température du liquide, K.
La concentration de vapeur saturée au-dessus de la surface du liquide est liée à sa pression par la relation :
 . (4.3)
. (4.3)
De (4.1 et 4.2), il s'ensuit qu'avec l'augmentation de la température du liquide, la pression des vapeurs saturées (ou leur concentration) augmente de façon exponentielle. À cet égard, à une certaine température au-dessus de la surface du liquide, une concentration de vapeur est créée égale à la plus faible limite de concentration la flamme s'est propagée. Cette température est appelée la plus basse limite de température propagation de la flamme (NTRP).
Par conséquent, pour tout liquide, il existe toujours une plage de température à laquelle la concentration de vapeur saturée au-dessus du miroir sera dans la région d'inflammation, c'est-à-dire HKPRP £ j p £ VKPRP.
Pour réguler la pression d'évaporation, utiliser le régulateur KVP, installé sur la conduite d'aspiration en aval de l'évaporateur (Fig. 6.13).
En plus de sa fonction principale, le régulateur de pression d'évaporation assure une protection en cas de forte chute de pression d'évaporation afin d'éviter le gel de l'eau refroidie dans le trajet d'échange thermique des évaporateurs des groupes frigorifiques à eau.
Le régulateur fonctionne comme suit : lorsque la pression augmente au-dessus de la pression réglée, le régulateur s'ouvre et lorsque la pression descend en dessous de la valeur réglée, il se ferme. Le signal de commande est uniquement la pression à l’entrée du régulateur.
Dans les installations comprenant plusieurs évaporateurs et fonctionnant à différentes pressions d'évaporation, le régulateur est installé derrière l'évaporateur, dont la pression est la plus élevée. Pour éviter la condensation du réfrigérant lors des arrêts, un clapet anti-retour est installé sur la conduite d'aspiration immédiatement après l'évaporateur avec une pression minimale. Dans les installations avec évaporateurs parallèles et compresseur commun, le régulateur est installé sur la conduite d'aspiration pour maintenir la même pression dans les évaporateurs.
En plus de ce type de régulateur, la pression d'évaporation est stabilisée à l'aide de systèmes de contrôle électronique d'un ou plusieurs chambres frigorifiques, armoires, etc., offrant une grande précision de maintien de la température de consigne (±0,5 K) dans une large plage de capacité de refroidissement - de 10 à 100 % de la valeur nominale.
8. Régulateurs de performances.
Les régulateurs de capacité (Fig. 6.14) permettent d'adapter la puissance frigorifique du compresseur aux changements de charge thermique sur l'évaporateur dans les installations avec une charge de réfrigérant très faible. Ils évitent les faibles pressions d'aspiration et les démarrages inutiles.

Au fur et à mesure que la charge thermique sur l'évaporateur diminue, la pression d'aspiration diminue, provoquant une dépression dans le circuit, ce qui entraîne un risque de pénétration d'humidité dans l'installation. Lorsque la pression d'aspiration descend en dessous de la valeur réglée, le régulateur s'ouvre, provoquant le passage d'un certain volume de gaz chauds du tuyau de refoulement dans le tuyau d'aspiration. En conséquence, la pression d'aspiration augmente et la capacité de refroidissement diminue. Le régulateur réagit uniquement à la pression dans la conduite d'aspiration, c'est-à-dire à la sortie de celui-ci.
9. Démarrage des régulateurs.
Les régulateurs de démarrage permettent d'éviter de faire fonctionner et de démarrer le compresseur lorsque la pression d'aspiration est trop élevée, ce qui se produit après un arrêt prolongé de la machine ou après un dégivrage de l'évaporateur.
Le régulateur de démarrage KVL est un type de régulateur de pression de papillon « après lui-même ». Il maintient une pression constante dans la conduite d'aspiration entre le régulateur et le compresseur et décharge le compresseur au démarrage.
La pression à l'entrée du régulateur agit sur le soufflet par le bas et sur la plaque à clapet par le haut. La surface effective du soufflet étant équivalente à la surface d'écoulement, la pression d'entrée est neutralisée. La plaque de soupape est sollicitée par le bas par la pression de sortie (dans le carter moteur), neutralisant la force de tension du ressort réglable. Ces deux forces sont forces actives régulateur Lorsque la pression de sortie régulée (carter) diminue, la vanne s'ouvre, permettant à la vapeur de réfrigérant de pénétrer dans le compresseur. Pour unités de réfrigération une installation parallèle haute performance de régulateurs de démarrage KVL est possible. Dans ce cas, les régulateurs sont sélectionnés en fonction de la même chute de pression dans chaque canalisation et de performances équivalentes. 
Le régulateur est réglé aux valeurs maximales, sans toutefois dépasser les valeurs recommandées par le constructeur pour le compresseur ou l'unité compresseur-condensation. Le réglage s'effectue en fonction des indications du manomètre sur la conduite d'aspiration du compresseur.
Le régulateur de démarrage est installé sur la conduite d'aspiration entre l'évaporateur et le compresseur (Fig. 6.15).
Ce régulateur offre la possibilité de connecter une ligne de prélèvement de vapeurs à travers un robinet manométrique sur le tuyau d'entrée ayant un diamètre de débit de 1/4". Avec cette méthode de régulation, le prélèvement de vapeurs s'effectue "après lui-même".
Le choix du régulateur de démarrage est déterminé par cinq indicateurs principaux :
Type de réfrigérant
La performance du système,
Pression d'aspiration de conception,
Pression de conception maximale,
Chute de pression dans le régulateur.
La différence entre la pression d'aspiration de conception et la pression d'aspiration maximale de conception détermine la durée d'ouverture de la vanne. La chute de pression du régulateur est un facteur important car la perte de pression dans la conduite d'aspiration affecte les performances de la machine. Par conséquent, la chute de pression à travers le régulateur doit être maintenue au minimum. Généralement, dans les systèmes de réfrigération à basse température, la chute de pression est de 3 à 7 kPa. La chute de pression maximale pour la plupart des systèmes de réfrigération est de 14 kPa.
Lorsque la vanne est ouverte au maximum, le régulateur, d'une part, fournit des performances maximales, et d'autre part, provoque d'importantes pertes de charge, ce qui réduit les performances du système. Par conséquent, la chute de pression à travers le régulateur doit être maintenue au minimum.