Propriétés de base de l'électron. De quoi est constitué un électron ? Masse et charge d'un électron. Propriétés fondamentales et quantiques de l'électron
Lire aussi
Un électron est une particule élémentaire qui constitue l’une des principales unités de la structure de la matière. La charge électronique est négative. Les mesures les plus précises ont été réalisées au début du XXe siècle par Millikan et Ioffe.
La charge électronique est égale à moins 1,602176487 (40)*10 -1 9 C.
La charge électrique des autres plus petites particules est mesurée grâce à cette valeur.
Concept général de l'électron
La physique des particules dit que l’électron est indivisible et n’a aucune structure. Il est impliqué dans les processus électromagnétiques et gravitationnels et appartient au groupe des leptons, tout comme son antiparticule, le positon. Parmi les autres leptons, il est le plus léger. Si des électrons et des positons entrent en collision, cela entraîne leur annihilation. Une telle paire peut provenir d’un quantum gamma de particules.
Avant la mesure des neutrinos, l’électron était considéré comme la particule la plus légère. En mécanique quantique, il est classé comme fermion. L'électron possède également un moment magnétique. Si un positron y est également inclus, alors le positron est divisé en particule chargée positivement et l'électron est appelé négatron, en tant que particule avec une charge négative.

Propriétés sélectionnées des électrons
Les électrons sont classés comme la première génération de leptons, possédant les propriétés des particules et des ondes. Chacun d'eux est doté d'un état quantique, déterminé en mesurant l'énergie, l'orientation du spin et d'autres paramètres. Son appartenance aux fermions se révèle à travers l'impossibilité d'avoir deux électrons dans le même état quantique en même temps (selon le principe de Pauli).
Elle est étudiée de la même manière qu'une quasiparticule dans un potentiel cristallin périodique, dont la masse effective peut différer significativement de la masse au repos.
Grâce au mouvement des électrons, le courant électrique, le magnétisme et la force électromotrice thermique se produisent. La charge d'un électron en mouvement forme un champ magnétique. Cependant, un champ magnétique externe dévie la particule de la direction droite. Lorsqu’il est accéléré, un électron acquiert la capacité d’absorber ou d’émettre de l’énergie sous forme de photon. Sa multitude est constituée de coquilles atomiques électroniques dont le nombre et la position déterminent les propriétés chimiques.
La masse atomique est principalement constituée de protons et de neutrons nucléaires, tandis que la masse des électrons représente environ 0,06 % du poids atomique total. La force électrique de Coulomb est l'une des principales forces capables de maintenir un électron proche du noyau. Mais lorsque des molécules sont créées à partir d’atomes et que des liaisons chimiques apparaissent, les électrons sont redistribués dans le nouvel espace formé.
Les nucléons et les hadrons participent à l'apparition des électrons. Les isotopes dotés de propriétés radioactives sont capables d'émettre des électrons. Dans les laboratoires, ces particules peuvent être étudiées à l'aide d'instruments spéciaux et, par exemple, des télescopes peuvent en détecter le rayonnement dans les nuages de plasma.

Ouverture
L'électron a été découvert par des physiciens allemands au XIXe siècle alors qu'ils étudiaient les propriétés cathodiques des rayons. Puis d’autres scientifiques ont commencé à l’étudier plus en détail, l’élevant au rang de particule à part entière. Les rayonnements et d'autres phénomènes physiques connexes ont été étudiés.
Par exemple, l'équipe dirigée par Thomson a estimé la charge de l'électron et la masse du rayon cathodique, dont la relation, comme ils l'ont découvert, ne dépend pas de la source matérielle.
Et Becquerel a découvert que les minéraux émettent des rayonnements par eux-mêmes et que leurs rayons bêta peuvent être déviés par l'action d'un champ électrique, et que la masse et la charge conservent la même relation que celle des rayons cathodiques.

Théorie atomique
Selon cette théorie, un atome est constitué d’un noyau et d’électrons autour de lui, disposés en nuage. Ils se trouvent dans certains états d'énergie quantifiés dont le changement s'accompagne du processus d'absorption ou d'émission de photons.
Mécanique quantique
Au début du XXe siècle, une hypothèse a été formulée selon laquelle les particules matérielles possèdent à la fois les propriétés des particules elles-mêmes et des ondes. La lumière peut également apparaître sous forme d’onde (on l’appelle onde de Broglie) et de particules (photons).
En conséquence, la célèbre équation de Schrödinger a été formulée, décrivant la propagation des ondes électroniques. Cette approche s'appelait la mécanique quantique. Il a été utilisé pour calculer les états électroniques de l’énergie dans l’atome d’hydrogène.
Propriétés fondamentales et quantiques de l'électron
La particule présente des propriétés fondamentales et quantiques.
Les fondamentaux incluent la masse (9,109 * 10 -31 kilogrammes), la charge électrique élémentaire (c'est-à-dire la partie minimale de la charge). D’après les mesures effectuées jusqu’à présent, l’électron ne contient aucun élément pouvant révéler sa sous-structure. Mais certains scientifiques estiment qu’il s’agit d’une particule chargée ponctuelle. Comme indiqué en début d'article, la charge électrique électronique est de -1,602 * 10 -19 C.

Tout en étant une particule, un électron peut en même temps être une onde. Une expérience avec deux fentes confirme la possibilité de son passage simultané à travers les deux. Cela entre en conflit avec les propriétés d’une particule, où le passage à travers une seule fente à la fois est possible.
Les électrons sont considérés comme ayant les mêmes propriétés physiques. Par conséquent, leur réarrangement, du point de vue de la mécanique quantique, n'entraîne pas de changement dans l'état du système. La fonction d'onde électronique est antisymétrique. Par conséquent, ses solutions disparaissent lorsque des électrons identiques tombent dans le même état quantique (principe de Pauli).
La charge spécifique d'un électron (c'est-à-dire le rapport) a été mesurée pour la première fois par Thomson en 1897 à l'aide du tube à décharge illustré sur la figure. 74.1. Le faisceau d'électrons sortant du trou de l'anode A (rayons cathodiques ; voir § 85) passait entre les armatures d'un condensateur plat et frappait l'écran fluorescent, créant sur celui-ci une tache lumineuse.
En appliquant une tension aux plaques du condensateur, il a été possible d'influencer le faisceau avec un champ électrique presque uniforme. Le tube a été placé entre les pôles d'un électro-aimant, à l'aide duquel il a été possible de créer un champ magnétique uniforme perpendiculaire au champ électrique sur la même section du trajet des électrons (l'aire de ce champ est encerclée sur la Fig. . 74.1 avec un cercle en pointillé). Lorsque les champs étaient éteints, le faisceau frappait l'écran au point O. Chacun des champs faisait séparément déplacer le faisceau dans la direction verticale. Les valeurs de déplacement sont déterminées par les formules (73.3) et (73.4) obtenues au paragraphe précédent.
En activant le champ magnétique et en mesurant le déplacement de la trace du faisceau provoqué par celui-ci
![]()
Thomson a également activé le champ électrique et a sélectionné sa valeur pour que le faisceau atteigne à nouveau le point O. Dans ce cas, les champs électriques et magnétiques ont agi simultanément sur les électrons du faisceau avec des forces égales mais dirigées de manière opposée. Dans ce cas, la condition était remplie
En résolvant ensemble les équations (74.1) et (74.2), Thomson a calculé .
Bush a utilisé la méthode de focalisation magnétique pour déterminer la charge spécifique des électrons. L'essence de cette méthode est la suivante. Supposons que dans un champ magnétique uniforme, un faisceau d'électrons légèrement divergent, symétrique par rapport à la direction du champ, ayant la même vitesse v, s'envole d'un certain point. Les directions dans lesquelles les électrons sont émis forment de petits angles a avec la direction B. Au § 72, il a été constaté que les électrons se déplacent dans ce cas le long de trajectoires en spirale, complétant en même temps
![]()
révolution complète et déplacement dans la direction du champ à une distance égale à
![]()

En raison de la petite taille de l'angle a, les distances (74,3) pour différents électrons s'avèrent pratiquement identiques et égales (pour les petits angles). Par conséquent, un faisceau légèrement divergent sera focalisé en un point situé à distance du point d'émission des électrons.
![]()
Dans l'expérience de Bush, les électrons émis par la cathode chaude K (Fig. 74.2) sont accélérés par une différence de potentiel U appliquée entre la cathode K et l'anode A. En conséquence, ils acquièrent une vitesse u dont la valeur peut être trouvée à partir de la relation
Après s'être ensuite envolés du trou de l'anode, les électrons forment un faisceau étroit dirigé le long de l'axe du tube sous vide inséré à l'intérieur du solénoïde. Un condensateur est placé à l'entrée du solénoïde, auquel une tension alternative est appliquée. Le champ créé par le condensateur dévie les électrons du faisceau de l'axe du dispositif selon de petits angles a qui changent avec le temps. Cela conduit à un « tourbillon » du faisceau : les électrons commencent à se déplacer le long de différentes trajectoires en spirale. Un écran fluorescent est placé à la sortie du solénoïde. Si vous sélectionnez l'induction magnétique B pour que la distance Г du condensateur à l'écran satisfasse à la condition
(l est le pas de la spirale, est un nombre entier), alors le point d'intersection des trajectoires des électrons atteindra l'écran - le faisceau d'électrons sera focalisé à ce point et excitera un point lumineux pointu sur l'écran. Si la condition (74.6) n'est pas remplie, la tache lumineuse sur l'écran sera floue. Après avoir résolu ensemble les équations (74.4), (74.5) et (74.6), nous pouvons trouver
La valeur la plus précise de la charge électronique spécifique, établie en tenant compte des résultats obtenus par différentes méthodes, est égale à
La valeur (74,7) donne le rapport entre la charge électronique et sa masse au repos. Dans les expériences de Thomson, Bush et d'autres expériences similaires, le rapport charge/masse relativiste a été déterminé égal à
![]()

Dans les expériences de Thomson, la vitesse des électrons était d'environ 0,1 s. À cette vitesse, la masse relativiste dépasse la masse au repos de 0,5 %. Dans les expériences ultérieures, la vitesse des électrons a atteint des valeurs très élevées. Dans tous les cas, une diminution des valeurs mesurées avec l'augmentation de v a été constatée, ce qui s'est produit exactement conformément à la formule (74.8).
La charge d'un électron a été déterminée avec une grande précision par Millikan en 1909. Millikan a introduit de minuscules gouttelettes d'huile dans l'espace fermé entre les plaques du condensateur situées horizontalement (Fig. 74.3). Lorsqu'elles sont éclaboussées, les gouttelettes s'électrifient et peuvent être placées immobiles en sélectionnant la valeur et le signe de la tension sur le condensateur.
L'équilibre s'est produit sous la condition
voici la charge de la gouttelette, P est la résultante de la gravité et de la force d'Archimède, égale à
![]() (74.10)
(74.10)
( - la densité des gouttelettes, - son rayon, - la densité de l'air).
A partir des formules (74.9) et (74.10), connaissant , il était possible de trouver . Pour déterminer le rayon, la vitesse de chute uniforme des gouttelettes en l’absence de champ a été mesurée. Un mouvement uniforme de la gouttelette s'établit à condition que la force P soit équilibrée par la force de résistance (voir formule (78.1) du 1er volume ; - viscosité de l'air) :
![]() (74.11)
(74.11)
Le mouvement de la gouttelette a été observé à l’aide d’un microscope. Pour la mesure, le temps nécessaire à une gouttelette pour parcourir la distance entre deux fils visibles dans le champ de vision du microscope a été déterminé.
Il est très difficile de déterminer avec précision l’équilibre d’une gouttelette. Par conséquent, au lieu d'un champ qui remplissait la condition (74.9), un champ a été activé, sous l'influence duquel la gouttelette a commencé à se déplacer vers le haut à faible vitesse. La vitesse de montée constante est déterminée à partir de la condition selon laquelle la force P et la force totale équilibrent la force
En excluant P et des équations (74.10), (74.11) et (74.12), on obtient une expression pour
![]()
(Milliken a apporté une modification à cette formule, en tenant compte du fait que la taille des gouttelettes était comparable au libre parcours des molécules d'air).

Ainsi, en mesurant la vitesse de chute libre d'une gouttelette et la vitesse de sa montée dans un champ électrique connu, il a été possible de retrouver la charge de la gouttelette e. Après avoir mesuré la vitesse à une certaine valeur de charge, Millikan a provoqué l'ionisation. de l'air en irradiant l'espace entre les plaques avec des rayons X. Les ions individuels, collant à la gouttelette, ont modifié sa charge, ce qui a également modifié sa vitesse. Après avoir mesuré la nouvelle valeur de vitesse, l'espace entre les plaques a été à nouveau irradié, etc.
Les modifications de la charge de la gouttelette et de la charge elle-même mesurées par Millikan se sont révélées à chaque fois être des multiples entiers de la même valeur. Ainsi, le caractère discret de la charge électrique a été prouvé expérimentalement, c'est-à-dire le fait que chaque charge est composée de charges élémentaires de même taille.
La valeur de la charge élémentaire, établie en tenant compte des mesures de Millikan et des données obtenues par d'autres méthodes, est égale à
BASES PHYSIQUES DU FONCTIONNEMENT IONIQUE |
|||
ET DISPOSITIFS SEMI-CONDUCTEURS |
|||
1.1. Propriétés de l'électron |
|||
Le champ électrique dans les appareils électroniques accélère ou torse- |
|||
affecte le mouvement des électrons. Soit l'électron e situé dans |
|||
champ électrique d'intensité E, la force F agit (Fig. 1.1) |
|||
F = − eE, |
|||
dirigé contre la force de terrain. |
|||
D'après la deuxième loi de Newton, la force F est égale au produit |
|||
masse électronique m par accélération a conférée à l'électron par la force F |
|||
dans un champ d'intensité E : |
|||
F = ma. |
|||
D’après (1.1) et (1.2), l’accélération de l’électrique |
|||
une = E e , |
|||
d’après l’équation (1.3), il est clair que c dû à |
|||
changement de tension électrique |
Riz. 1.1. Électron en homogène |
||
les changements sur le terrain s’accélèrent |
champ électrique |
||
niélectron. En outre, |
|||
lorsque l'intensité du champ diminue dans la direction de la vitesse initiale v 0 |
électron |
||
se déplace accéléré et acquiert la vitesse et la cinétique les plus élevées |
|||
l'énergie physique à la fin de son voyage. |
|||
Nous trouverons la vitesse v de l'électron en fonction des positions connues |
|||
la physique. Premièrement, le travail des forces de terrain pour y déplacer l'électricité |
|||

le flux du point A au point B est le produit de la charge |
|||
électron e à la différence de potentiel de ces points : |
|||
Nous e = (− e )(U A − U B ). |
|||
Puisque U B > U A, alors |
|||
U UNE − U B = − U . |
|||
Donc le travail |
|||
Nous = (e)(− U ) = eU. |
|||
Deuxièmement, selon la loi de conservation de l'énergie, le travail que nous avons dépensé |
|||
induit par le champ pour déplacer l'électron est égal à l'incrément de la cinétique |
|||
énergie en peigne d'un électron se déplaçant dans un champ électrique : |
|||
W = m (v 2 - v 2 ) / 2 . |
|||
En prenant la vitesse initiale v 0 = 0, à partir de (5) on trouve la valeur |
|||
vitesse terminale des électrons |
|||
2 Nous e = |
2 U e . |
||
La vitesse des électrons dans les appareils électroniques est nettement inférieure - |
|||
plus rapide que la vitesse de la lumière, donc le rapport des quantités e /m ≈ e /m 0 |
|||
v ≈ 600 |
|||
D’après (1.9), il est clair que la vitesse de déplacement des électrons dans un |
|||
Le champ sk (km/s) dépend uniquement de la différence de potentiel entre |
|||
les points de départ et d'arrivée du chemin parcouru par l'électron, et |
|||
ne dépend pas de la forme du chemin. Parfois, la vitesse d'un électron est mesurée en |
|||
volts Par exemple : la vitesse de l'électron est de 100 V. Cela signifie que l'électron |
|||
le trône a acquis une telle vitesse après avoir traversé une différence de potentiel de 100 V. |
|||
Si un électron commence son mouvement à partir d'un état de repos, il |
|||
se déplacera uniformément accéléré, rectiligne contre les forces |
|||
lignes de champ électrique, absorbant l’énergie du champ. Électrique |
|||
Le champ électrique d’un électron s’accélère. |
|||
Si la vitesse initiale coïncide avec la direction de la force |
|||
lignes de champ électrique, un tel champ pour un électron est un tore |
|||
humide. La vitesse de l'électron va diminuer, l'énergie de l'électron |
|||
Le rhona diminuera également (sera remis sur le terrain). Si |
|||

la taille du champ le permet, l'électron s'arrêtera puis commencera à se déplacer contre les lignes de force de ce champ.
Si la vitesse initiale est dirigée à l'opposé des lignes de champ électrique, un tel champ pour l'électron s'accélère. Le champ électrique déplace les charges positives dans la direction des lignes de champ.
1.2. Types d'émission électronique
Le phénomène d'émission d'électrons depuis la surface d'un solide est appelé émission d'électrons, et la source d'électrons elle-même est appelée émetteur. Selon les méthodes d'influence de l'énergie externe sur les électrons, les faisant quitter l'émetteur, on distingue plusieurs types d'émission d'électrons.
Émission thermoionique se produit à la suite du chauffage de l’émetteur. Avec l'augmentation de la température, des vibrations thermiques du réseau solide se produisent. Grâce à cette énergie d'excitation thermique, une partie des électrons quitte l'émetteur et forme un courant d'émission. Plus la température de l'émetteur est élevée, plus les électrons acquièrent cette énergie, ce qui entraîne une augmentation du courant d'émission thermoionique. La température minimale à laquelle apparaît le courant d'émission est dite critique. Cela dépend du matériau de l'émetteur.
Émission d'électrons secondaires - émission d'électricité secondaire
électrons de la surface de l’émetteur lorsqu’il est irradié par un flux d’électrons primaires. Le flux d'électrons primaire incident sur l'émetteur secondaire est partiellement réfléchi par sa surface et y pénètre partiellement en profondeur. Ici, les électrons primaires entrent en collision avec les électrons du réseau cristallin de l'émetteur et leur cèdent une partie de leur énergie, les excitant. Certains des électrons excités s’échappent dans l’environnement extérieur ; ces électrons sont secondaires.
Émission d'électrons électrostatiques (émission de champ)
naît de la surface d’un corps solide ou liquide sous l’influence d’un champ électrique externe accélérateur de forte intensité (107 V/m). Plus l'intensité du champ est élevée, plus le courant d'émission de champ est important.
Émission photoélectronique se produit lorsque l’émetteur est irradié par la lumière. L'efficacité de ce type d'émission dépend de la longueur d'onde (relation inverse) et de l'ampleur du flux lumineux (relation directe).
Un électron est une particule fondamentale, une de celles qui constituent les unités structurelles de la matière. Selon la classification, il s'agit d'un fermion (particule à spin demi-entier, du nom du physicien E. Fermi) et d'un lepton (particules à spin demi-entier qui ne participent pas à l'interaction forte, l'un des quatre principes fondamentaux ceux en physique). Le baryon est égal à zéro, comme les autres leptons.
Jusqu'à récemment, on croyait que l'électron était une particule élémentaire, c'est-à-dire indivisible et sans structure, mais les scientifiques ont désormais un avis différent. De quoi est constitué un électron selon les physiciens modernes ?
Histoire du nom
Même dans la Grèce antique, les naturalistes ont remarqué que l'ambre, préalablement frotté avec de la laine, attirait les petits objets, c'est-à-dire qu'il présentait des propriétés électromagnétiques. L'électron tire son nom du grec ἤλεκτρον, qui signifie « ambre ». Le terme a été proposé par J. Stoney en 1894, bien que la particule elle-même ait été découverte par J. Thompson en 1897. Il était difficile de le détecter, en raison de sa faible masse, et la charge de l'électron est devenue décisive dans l'expérience de découverte. Les premières images de la particule ont été prises par Charles Wilson à l'aide d'un appareil photo spécial, utilisé même dans les expériences modernes et qui porte son nom.
Un fait intéressant est que l’une des conditions préalables à la découverte de l’électron est une déclaration de Benjamin Franklin. En 1749, il développe l’hypothèse selon laquelle l’électricité est une substance matérielle. C'est dans son travail que des termes tels que charges positives et négatives, condensateur, décharge, batterie et particule d'électricité ont été utilisés pour la première fois. La charge spécifique d’un électron est considérée comme négative et celle d’un proton est considérée comme positive.
Découverte de l'électron
En 1846, le concept d'« atome d'électricité » a commencé à être utilisé dans ses travaux par le physicien allemand Wilhelm Weber. Michael Faraday a découvert le terme « ion », que tout le monde connaît peut-être maintenant depuis ses années d'école. La question de la nature de l'électricité a été étudiée par de nombreux scientifiques éminents, tels que le physicien et mathématicien allemand Julius Plücker, Jean Perrin, le physicien anglais William Crookes, Ernst Rutherford et d'autres.
Ainsi, avant que Joseph Thompson ne termine avec succès sa célèbre expérience et prouve l'existence d'une particule plus petite qu'un atome, de nombreux scientifiques travaillaient dans ce domaine, et la découverte n'aurait pas été possible s'ils n'avaient pas fait ce travail colossal.

En 1906, Joseph Thompson reçut le prix Nobel. L'expérience consistait en ce qui suit : des faisceaux de rayons cathodiques traversaient des plaques métalliques parallèles qui créaient un champ électrique. Ensuite, ils devaient parcourir le même chemin, mais à travers un système de bobines qui créait un champ magnétique. Thompson a découvert que lorsqu'ils étaient exposés à un champ électrique, les rayons étaient déviés, et la même chose était observée sous influence magnétique, mais les faisceaux de rayons cathodiques ne changeaient pas de trajectoire s'ils étaient soumis à l'action de ces deux champs dans certains rapports, ce qui dépend de la vitesse des particules.
Après des calculs, Thompson a appris que la vitesse de ces particules était nettement inférieure à la vitesse de la lumière, ce qui signifiait qu'elles avaient une masse. À partir de ce moment, les physiciens ont commencé à croire que les particules ouvertes de matière faisaient partie de l’atome, ce qui a été confirmé plus tard. Il l’a appelé le « modèle planétaire de l’atome ».
Paradoxes du monde quantique
La question de savoir en quoi consiste un électron est assez complexe, du moins à ce stade du développement scientifique. Avant d’y réfléchir, nous devons aborder l’un des paradoxes de la physique quantique que même les scientifiques eux-mêmes ne peuvent expliquer. C’est la fameuse expérience de la double fente qui explique la double nature de l’électron.
Son essence est que devant le "pistolet" qui tire des particules, il y a un cadre avec un trou rectangulaire vertical. Derrière elle se trouve un mur sur lequel on observera des traces de coups. Il faut donc d’abord comprendre comment se comporte la matière. La façon la plus simple d'imaginer comment une machine lance des balles de tennis. Certaines balles tombent dans le trou et les marques sur le mur forment une bande verticale. Si vous ajoutez un autre trou similaire à une certaine distance, les pistes formeront respectivement deux bandes.
Les vagues se comportent différemment dans une telle situation. Si des traces d'une collision avec une vague sont affichées sur le mur, dans le cas d'un trou, il y aura également une bande. Cependant, tout change dans le cas de deux fentes. La vague traversant les trous est divisée en deux. Si le haut de l'une des ondes rencontre le bas de l'autre, elles s'annulent et un motif d'interférence (plusieurs franges verticales) apparaît sur le mur. Les endroits où les vagues se croisent laisseront une marque, mais pas les endroits où l'annulation mutuelle s'est produite.

Découverte étonnante
Avec l’aide de l’expérience décrite ci-dessus, les scientifiques peuvent clairement démontrer au monde la différence entre la physique quantique et la physique classique. Lorsqu’ils ont commencé à tirer des électrons sur le mur, celui-ci a montré le motif vertical habituel : certaines particules, tout comme des balles de tennis, sont tombées dans l’espace, et d’autres non. Mais tout a changé lorsque le deuxième trou est apparu. Il est apparu sur le mur. Tout d’abord, les physiciens ont décidé que les électrons interféraient les uns avec les autres et ont décidé de les laisser entrer un à la fois. Cependant, après quelques heures (la vitesse de déplacement des électrons est encore bien inférieure à la vitesse de la lumière), le motif d'interférence a recommencé à apparaître.
Tour inattendu
L'électron, ainsi que d'autres particules telles que les photons, présentent une dualité onde-particule (le terme « dualité onde quantique » est également utilisé). Tout comme il est à la fois vivant et mort, l’état d’un électron peut être à la fois corpusculaire et ondulatoire.
Cependant, l'étape suivante de cette expérience a donné lieu à encore plus de mystères : une particule fondamentale, sur laquelle tout semblait être connu, a présenté une incroyable surprise. Les physiciens ont décidé d'installer un dispositif d'observation au niveau des trous afin d'enregistrer par quelle fente passent les particules et comment elles se manifestent sous forme d'onde. Mais dès l'installation du mécanisme d'observation, seules deux bandes sont apparues sur le mur, correspondant à deux trous, et aucune figure d'interférence ! Dès que la « surveillance » a été supprimée, la particule a recommencé à présenter des propriétés ondulatoires, comme si elle savait que personne ne la regardait plus.
Une autre théorie
Le physicien Born a suggéré qu'une particule ne se transforme pas en onde au sens littéral du terme. L'électron « contient » une onde de probabilité ; c'est cette onde qui donne la figure d'interférence. Ces particules ont la propriété de superposition, c'est-à-dire qu'elles peuvent être localisées n'importe où avec un certain degré de probabilité, c'est pourquoi elles peuvent être accompagnées d'une « onde » similaire.
Néanmoins, le résultat est évident : le fait même de la présence d'un observateur affecte le résultat de l'expérience. Cela semble incroyable, mais ce n’est pas le seul exemple de ce genre. Les physiciens ont également mené des expériences sur de plus grandes parties de matière ; une fois que l'objet est devenu le morceau de feuille d'aluminium le plus fin. Les scientifiques ont noté que le simple fait de certaines mesures affectait la température de l'objet. Ils ne sont pas encore en mesure d’expliquer la nature de tels phénomènes.

Structure
Mais de quoi est constitué un électron ? À l’heure actuelle, la science moderne ne peut répondre à cette question. Jusqu'à récemment, elle était considérée comme une particule fondamentale indivisible, mais les scientifiques sont désormais enclins à croire qu'elle est constituée de structures encore plus petites.
La charge spécifique d'un électron était également considérée comme élémentaire, mais des quarks ayant une charge fractionnaire ont maintenant été découverts. Il existe plusieurs théories sur la composition d’un électron.
Aujourd’hui, vous pouvez voir des articles affirmant que des scientifiques ont réussi à diviser un électron. Toutefois, cela n’est que partiellement vrai.
Nouvelles expériences
Dans les années 80 du siècle dernier, des scientifiques soviétiques ont suggéré qu'il serait possible de diviser un électron en trois quasi-particules. En 1996, il a été possible de la séparer en spinon et en holon, et récemment, le physicien Van den Brink et son équipe ont séparé la particule en spinon et en orbiton. Toutefois, le fractionnement ne peut être réalisé que dans des conditions particulières. L'expérience peut être réalisée dans des conditions de température extrêmement basses.
Lorsque les électrons « refroidissent » jusqu'au zéro absolu, soit environ -275 degrés Celsius, ils s'arrêtent pratiquement et forment entre eux quelque chose comme de la matière, comme s'ils fusionnaient en une seule particule. Dans de telles conditions, les physiciens parviennent à observer les quasiparticules qui composent l'électron.

Porteurs d'informations
Le rayon de l'électron est très petit, il est égal à 2,81794. 10 -13 cm, mais il s'avère que ses composants sont de taille beaucoup plus petite. Chacune des trois parties en lesquelles l'électron a été « divisé » porte des informations à son sujet. Orbiton, comme son nom l'indique, contient des données sur l'onde orbitale d'une particule. Le spinon est responsable du spin de l’électron et le holon nous renseigne sur la charge. De cette manière, les physiciens peuvent observer séparément les différents états des électrons dans une substance fortement refroidie. Ils ont pu retracer les paires holon-spinon et spinon-orbite, mais pas l’ensemble du trio.
Nouvelles technologies
Les physiciens qui ont découvert l’électron ont dû attendre plusieurs décennies avant que leur découverte ne soit mise en pratique. De nos jours, les technologies sont utilisées en quelques années ; rappelez-vous simplement le graphène, un matériau étonnant constitué d'atomes de carbone en une seule couche. En quoi la division électronique sera-t-elle utile ? Les scientifiques prédisent la création d'une vitesse qui, à leur avis, est plusieurs dizaines de fois supérieure à celle des ordinateurs modernes les plus puissants.
Quel est le secret de la technologie informatique quantique ? Cela peut être appelé une simple optimisation. Dans un ordinateur conventionnel, l’information minimale et indivisible est un bit. Et si nous considérons les données comme quelque chose de visuel, alors pour une machine, il n'y a que deux options. Un bit peut contenir soit un zéro, soit un un, c'est-à-dire des parties du code binaire.
Nouvelle méthode
Imaginons maintenant qu'un bit contienne à la fois un zéro et un un - c'est un « bit quantique » ou « coudée ». Le rôle de variables simples sera joué par le spin de l'électron (il peut tourner dans le sens des aiguilles d'une montre ou dans le sens inverse). Contrairement à un simple bit, une coudée peut remplir plusieurs fonctions simultanément, de ce fait la vitesse de fonctionnement augmentera ; la faible masse et la charge de l'électron n'ont pas d'importance ici.
Cela peut être expliqué en utilisant l'exemple d'un labyrinthe. Pour vous en sortir, vous devez essayer de nombreuses options différentes, dont une seule sera correcte. Un ordinateur traditionnel peut résoudre des problèmes rapidement, mais ne peut néanmoins traiter qu’un seul problème à la fois. Il parcourra tous les chemins possibles un par un et finira par trouver une issue. Un ordinateur quantique, grâce à la dualité de la coudée, peut résoudre de nombreux problèmes simultanément. Il examinera toutes les options possibles non pas tour à tour, mais à un moment donné, et résoudra également le problème. La seule difficulté jusqu’à présent est de faire travailler de nombreux quanta sur une seule tâche – ce sera la base d’un ordinateur de nouvelle génération.

Application
La plupart des gens utilisent un ordinateur au quotidien. Les PC conventionnels font encore un excellent travail, mais pour prédire des événements qui dépendent de milliers, voire de centaines de milliers de variables, la machine doit être tout simplement énorme. il peut facilement gérer des choses comme les prévisions météorologiques mensuelles, le traitement et la prévision des données sur les catastrophes naturelles, et effectuer des calculs mathématiques complexes avec de nombreuses variables en une fraction de seconde, le tout avec un processeur de la taille de quelques atomes. Peut-être que très bientôt nos ordinateurs les plus puissants seront aussi fins qu’une feuille de papier.

Rester en bonne santé
La technologie informatique quantique apportera une énorme contribution à la médecine. L'humanité aura l'opportunité de créer des nanomécanismes dotés du potentiel le plus puissant ; avec leur aide, il sera possible non seulement de diagnostiquer des maladies simplement en regardant le corps entier de l'intérieur, mais aussi de prodiguer des soins médicaux sans intervention chirurgicale : la plus petite des robots dotés du « cerveau » d’un excellent ordinateur seront capables d’effectuer toutes les opérations.
Une révolution dans le domaine des jeux informatiques est inévitable. Des machines puissantes capables de résoudre des problèmes instantanément pourront jouer à des jeux avec des graphismes incroyablement réalistes, et des mondes informatiques totalement immersifs sont à nos portes.
Structure de la matière.
La structure de l'atome.
Un atome est la plus petite particule d'un élément chimique, porteuse de toutes ses propriétés chimiques. Un atome est chimiquement indivisible. Les atomes peuvent exister soit à l'état libre, soit en combinaison avec des atomes du même élément ou d'un autre élément.
L'unité de masse atomique et moléculaire est actuellement considérée comme étant 1/12 de la masse d'un atome de carbone ayant une masse atomique de 12 (isotope). Cette unité est appelée unité carbone.
Masse et taille des atomes. Le numéro d'Avogadro.
Un atome-gramme, tout comme une molécule-gramme de n'importe quelle substance, contient respectivement 6,023 10^23 atomes ou molécules. Ce numéro est appelé numéro d'Avogadro (N0). Ainsi, dans 55,85 g de fer, 63,54 g de cuivre, 29,98 g d’aluminium, etc., il y a un nombre d’atomes égal au nombre d’Avogadro.
Connaissant le nombre d'Avogadro, il n'est pas difficile de calculer la masse d'un atome de n'importe quel élément. Pour ce faire, la masse atomique-gramme d'un atome doit être divisée par 6,023 10^23. Ainsi, la masse de l'atome d'hydrogène (1) et la masse de l'atome de carbone (2) sont respectivement égales : 
A partir du nombre d'Avogadro, on peut estimer le volume d'un atome. Par exemple, la densité du cuivre est de 8,92 g/cm^3 et la masse atomique-gramme est de 63,54 g. Cela signifie qu'un atome-gramme de cuivre occupe le volume.  , et pour un atome de cuivre il y a un volume
, et pour un atome de cuivre il y a un volume  .
.
Structure atomique.
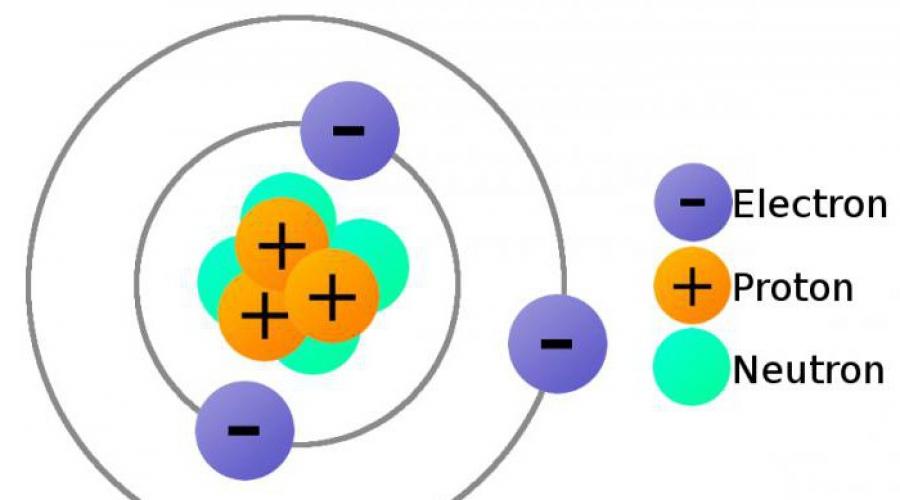
Un atome est une formation complexe constituée d’un certain nombre de particules plus petites. Les atomes de tous les éléments sont constitués d'un noyau chargé positivement et d'électrons - des particules chargées négativement et de très faible masse. Le noyau occupe une part négligeable du volume total de l’atome. Le diamètre d'un atome est de cm et le diamètre du noyau est de cm.
Bien que le diamètre du noyau d’un atome soit 100 000 fois plus petit que le diamètre de l’atome lui-même, la quasi-totalité de la masse de l’atome est concentrée dans son noyau. Il s’ensuit que la densité des noyaux atomiques est très élevée. S'il était possible de collecter 1 cm3 de noyaux atomiques, sa masse serait alors d'environ 116 millions de tonnes.
Le noyau est constitué de protons et de neutrons. Ces particules ont un nom commun : les nucléons.
Proton- - particule élémentaire stable de masse proche de l'unité carbone. La charge du proton est égale à la charge de l’électrode, mais de signe opposé. Si la charge d’un électron est considérée comme étant de -1, alors la charge d’un proton est de +1. Un proton est un atome d'hydrogène auquel il manque un électron.
Neutron– une coque atomique dont la charge négative compense la charge positive du noyau due à la présence de protons dans celui-ci.
Ainsi, le nombre d’électrons d’un atome est égal au nombre de protons de son noyau.
La relation entre le nombre de protons, le nombre de neutrons et le nombre de masse d'un atome est exprimée par l'équation : N=A-Z
Par conséquent, le nombre de neutrons dans le noyau d’un atome de n’importe quel élément est égal à la différence entre son nombre de masse et le nombre de protons.
Donc le nombre de neutrons dans le noyau d'un atome de radium de masse 226 N=A-Z=226-88=138
Masse et charge d'un électron.
Tous les processus chimiques de formation et de destruction de composés chimiques se produisent sans modification des noyaux des atomes des éléments qui composent ces composés. Seules les coques électroniques subissent des modifications. L'énergie chimique est donc liée à l'énergie des électrons. Pour comprendre les processus de formation et de destruction des composés chimiques, il faut avoir une idée des propriétés de l'électron en général et en particulier des propriétés et du comportement de l'électron dans l'atome.
Électron est une particule élémentaire qui possède une charge électrique élémentaire négative, c’est-à-dire la plus petite quantité d’électricité qui puisse exister. La charge d'un électron est égale à el. Art. unités ou pendentif. La masse au repos de l'électron est égale à g, c'est-à-dire 1837,14 fois inférieure à la masse d'un atome d'hydrogène. La masse d'un électron est une unité carbone.
Le modèle de Bohr de l'atome.
Au début du 20e siècle, M. Planck A. Einstein a créé la théorie quantique de la lumière, selon laquelle la lumière est un flux de quanta d'énergie individuels transportés par des particules de lumière - photons.
Ampleur du quantum d'énergie(E) est différent pour différents rayonnements et est proportionnel à la fréquence d'oscillation :
,
où h est la constante de Planck.
M. Planck a montré que les atomes n'absorbent ou n'émettent de l'énergie rayonnante que dans des portions séparées et bien définies - quanta.
En essayant de relier les lois de la mécanique classique à la théorie quantique, le scientifique danois N. Bohr pensait qu'un électron dans un atome d'hydrogène ne peut se trouver que sur certaines orbites constantes, dont les rayons sont liés les uns aux autres comme des carrés de nombres entiers. ![]() Ces orbites ont été qualifiées de stationnaires par N. Bohr.
Ces orbites ont été qualifiées de stationnaires par N. Bohr.
L'énergie n'est émise que lorsqu'un électron passe d'une orbite plus éloignée à une orbite plus proche du noyau. Lorsqu’un électron passe d’une orbite proche à une orbite plus lointaine, l’énergie est absorbée par l’atome. ![]() , où sont les énergies des électrons dans les états stationnaires.
, où sont les énergies des électrons dans les états stationnaires.
Lorsque Ei > Ek, de l’énergie est libérée.
Quand Ei< Ек энергия поглощается.
La solution au problème de la répartition des électrons dans un atome repose sur l'étude des spectres linéaires des éléments et de leurs propriétés chimiques. Le spectre de l'atome d'hydrogène a presque entièrement confirmé la théorie de N. Bohr. Cependant, la théorie de N. Bohr ne pouvait pas expliquer la division observée des raies spectrales dans les atomes multiélectroniques ni l'intensification de cette division dans les champs magnétiques et électriques.
Propriétés ondulatoires de l'électron.
Les lois de la physique classique opposent les concepts de « particule » et d’« onde ». La théorie physique moderne, appelée quantique, ou mécanique des vagues, a montré que le mouvement et l'interaction de particules de petite masse - les microparticules - se produisent selon des lois différentes des lois de la mécanique classique. Une microparticule possède simultanément certaines propriétés de corpuscules (particules) et certaines propriétés d'ondes. D'une part, un électron, un proton ou une autre microparticule se déplace et agit comme un corpuscule, par exemple lorsqu'il entre en collision avec une autre microparticule. En revanche, lorsqu'une microparticule se déplace, se révèlent les phénomènes d'interférence et de diffraction typiques des ondes électromagnétiques.
Ainsi, dans les propriétés de l'électron (ainsi que d'autres microparticules), dans les lois de son mouvement, la continuité et l'interconnexion de deux formes d'existence qualitativement différentes de la matière, de la substance et du champ se manifestent. Une microparticule ne peut être considérée ni comme une particule ordinaire, ni comme une onde ordinaire. La microparticule a une dualité onde-particule.
En parlant de la relation entre la matière et le champ, nous pouvons arriver à la conclusion que si chaque particule matérielle a une certaine masse, alors, apparemment, cette même particule doit également avoir une certaine longueur d'onde. La question se pose de la relation entre masse et onde. En 1924, le physicien français Louis de Broglie a suggéré que chaque électron en mouvement (et en général chaque particule matérielle en mouvement) est associé à un processus ondulatoire dont la longueur d'onde est , où est la longueur d'onde en cm (m), h est la constante de Planck , égal à ![]() erg. sec (), m - masse des particules en g (kg), - vitesse des particules, en cm/sec.
erg. sec (), m - masse des particules en g (kg), - vitesse des particules, en cm/sec.
De cette équation, il ressort clairement qu'une particule au repos doit avoir une longueur d'onde infiniment longue et que la longueur d'onde diminue à mesure que la vitesse de la particule augmente. La longueur d’onde d’une particule en mouvement de grande masse est très petite et ne peut pas encore être déterminée expérimentalement. C’est pourquoi nous parlons uniquement des propriétés ondulatoires des microparticules. Un électron a des propriétés ondulatoires. Cela signifie que son mouvement dans un atome peut être décrit par une équation d’onde.
Le modèle planétaire de la structure de l'atome d'hydrogène, créé par N. Bohr, qui partait de l'idée de l'électron uniquement en tant que particule classique, ne peut expliquer un certain nombre de propriétés de l'électron. La mécanique quantique a montré que l'idée du mouvement d'un électron autour d'un noyau sur certaines orbites, similaire au mouvement des planètes autour du Soleil, devrait être considérée comme intenable.
Un électron, ayant les propriétés d'une onde, se déplace dans tout le volume, formant un nuage d'électrons, qui peut avoir une forme différente pour les électrons situés dans un atome. La densité de ce nuage électronique dans l'une ou l'autre partie du volume atomique n'est pas la même.
Caractéristiques d'un électron par quatre nombres quantiques.
La principale caractéristique qui détermine le mouvement d’un électron dans le champ d’un noyau est son énergie. L'énergie d'un électron, comme l'énergie d'une particule de flux lumineux - un photon, ne prend aucune, mais seulement certaines valeurs discrètes, discontinues ou, comme on dit, quantifiées.
Un électron en mouvement possède trois degrés de liberté de mouvement dans l'espace (correspondant à trois axes de coordonnées) et un degré de liberté supplémentaire, dû à la présence de ses propres moments mécaniques et magnétiques, qui prennent en compte la rotation de l'électron autour de son axe. Par conséquent, pour une caractéristique énergétique complète de l'état d'un électron dans un atome, il est nécessaire et suffisant d'avoir quatre paramètres. Ces paramètres sont appelés nombres quantiques. Les nombres quantiques, tout comme l’énergie d’un électron, ne peuvent pas atteindre toutes les valeurs, mais seulement certaines valeurs. Les valeurs adjacentes des nombres quantiques diffèrent d'un.
Nombre quantique principal n caractérise la réserve d'énergie totale d'un électron ou son niveau d'énergie. Le nombre quantique principal peut prendre des valeurs entières de 1 à . Pour un électron situé dans le champ du noyau, le nombre quantique principal peut prendre des valeurs de 1 à 7 (correspondant au numéro de la période du système périodique dans laquelle se trouve l'élément). Les niveaux d'énergie sont désignés soit par des chiffres en fonction des valeurs du nombre quantique principal, soit par des lettres :
P. | |||||||
Désignation du niveau |
Si, par exemple, n = 4, alors l’électron est au quatrième niveau d’énergie, à partir du noyau atomique, ou au niveau N.
Nombre quantique orbital l, parfois appelé nombre quantique secondaire, caractérise les différents états énergétiques d'un électron à un niveau donné. La structure fine des raies spectrales indique que les électrons de chaque niveau d'énergie sont regroupés en sous-niveaux. Le nombre quantique orbital est lié au moment cinétique d'un électron lorsqu'il se déplace par rapport au noyau atomique. Le nombre quantique orbital détermine également la forme du nuage électronique. Le nombre quantique l peut prendre toutes les valeurs entières de 0 à (n-1). Par exemple, avec n=4, l=0, 1, 2, 3. Chaque valeur de l correspond à un sous-niveau spécifique. Les désignations par lettres sont utilisées pour les sous-niveaux. Ainsi, lorsque l = 0, 1, 2, 3, les électrons sont respectivement sur les sous-niveaux s-, p-, d-, f-. Les électrons de différents sous-niveaux sont respectivement appelés électrons s-, p-, d-, f. Le nombre possible de sous-niveaux pour chaque niveau d'énergie est égal au nombre de ce niveau, mais ne dépasse pas quatre. Le premier niveau d'énergie (n=1) se compose d'un sous-niveau s, les deuxième (n=2), troisième (n=3) et quatrième (n=4) niveaux d'énergie se composent respectivement de deux (s, p), trois (s, p, d) et quatre (s, p, d, f) sous-niveaux. Il ne peut y avoir plus de quatre sous-niveaux, puisque les valeurs l = 0, 1, 2, 3 décrivent les électrons des atomes des 104 éléments actuellement connus.
Si l = 0 (électrons s), alors le moment cinétique de l'électron par rapport au noyau atomique est nul. Cela ne peut se produire que lorsque l'électron avance non pas autour du noyau, mais du noyau vers la périphérie et vice-versa. Le nuage électronique de l’électron s a la forme d’une sphère.
Nombre quantique magnétique- Le moment cinétique d'un électron est également associé à son moment magnétique. Le nombre quantique magnétique caractérise le moment magnétique d'un électron. Le nombre quantique magnétique caractérise le moment magnétique de l'électron et indique l'orientation du nuage électronique par rapport à la direction choisie ou par rapport à la direction du champ magnétique. Le nombre quantique magnétique peut prendre n’importe quelle valeur entière positive et négative, y compris zéro, allant de – l à + l. Par exemple, si l=2, alors il a 2 l+1=5 valeurs (-2, -1, 0, +1, +2). Lorsque l=3 le nombre de valeurs est 2 l+1=7 (-3, -2, -1, 0, +1, +2, +3). Le nombre de valeurs du nombre quantique magnétique, qui est égal à 2 l+1, est le nombre d'états énergétiques dans lesquels les électrons d'un sous-niveau donné peuvent exister. Ainsi, les électrons s n'ont qu'un seul état (2 l+1=1), les électrons p ont 3 états (2 l+1=3), les électrons d- et f ont respectivement 5 et 7 états. Les états énergétiques sont généralement représentés schématiquement par des cellules énergétiques, les représentant sous forme de rectangles, et les électrons sous forme de flèches dans ces cellules.
Nombre quantique de rotation- caractérise le mouvement interne de l'électron - spin. Il est associé au moment magnétique de l’électron, provoqué par son mouvement autour de son axe. Ce nombre quantique ne peut prendre que deux valeurs : + 1/2 et -1/2, selon que le champ magnétique du spin de l'électron est orienté parallèlement ou antiparallèlement au champ magnétique provoqué par le mouvement de l'électron autour du noyau.
Deux électrons (paires) avec les mêmes valeurs de nombres quantiques : n, I, mais avec des spins de direction opposée (↓) sont appelés une paire d'électrons appariés ou isolés. Les électrons avec des spins insaturés () sont appelés non appariés.
Principe de Pauli, principe de moindre énergie, règle de Hund.
La répartition des électrons dans les atomes des éléments est déterminée par trois principes principaux : le principe de Pauli, le principe de moindre énergie et la règle de Hund.
Le principe de Pauli. En étudiant de nombreux spectres d'atomes, le physicien suisse W. Pauli est arrivé en 1925 à une conclusion appelée principe ou interdiction de Pauli : « Il est interdit à deux électrons d'un atome d'être semblables l'un à l'autre à tous égards » ou, quel est le de même, "dans un atome, il n'y a pas, il peut même y avoir deux électrons avec les mêmes valeurs des quatre nombres quantiques." Les états énergétiques des électrons caractérisés par les mêmes valeurs de trois nombres quantiques : n, I et m1 sont généralement désignés par une cellule énergétique.
Selon le principe de Pauli, une cellule énergétique ne peut avoir que deux électrons, de spins opposés.
La présence d’un troisième électron dans une cellule énergétique signifierait que deux d’entre elles auraient les quatre nombres quantiques identiques. Le nombre d'états électroniques possibles (Fig. 4) à un sous-niveau donné est égal au nombre de valeurs de nombres quantiques magnétiques pour ce sous-niveau, soit 21+ 1. Le nombre maximum d'électrons à ce sous-niveau, selon le principe de Pauli , sera 2(21+ 1). Ainsi, 2 électrons sont possibles dans le sous-niveau s ; le sous-niveau p a 6 électrons ; le sous-niveau d a 10 électrons ; il y a 14 électrons dans le sous-niveau f. Le nombre d'états possibles des électrons à n'importe quel niveau est égal au carré du nombre quantique principal, et le nombre maximum d'électrons à ce niveau
Principe de moindre énergie.
La séquence de placement des électrons dans un atome doit correspondre à leur plus grande connexion avec le noyau, c'est-à-dire que l'électron doit avoir l'énergie la plus basse. Par conséquent, un électron n’a pas besoin d’occuper un niveau d’énergie plus élevé s’il existe des endroits dans le niveau inférieur où l’électron aurait moins d’énergie s’il se trouvait.
Étant donné que l'énergie électronique est principalement déterminée par les valeurs des nombres n principaux et orbitaux/quantiques, les sous-niveaux pour lesquels la somme des valeurs des nombres quantiques n et / sont plus petites sont remplis en premier. Par exemple, la réserve d'énergie au sous-niveau 4s(n +/ = 4 +0 = 4) est inférieure à celle au sous-niveau 3d(n + /= 3 + 2 = 5) ; 5s (n + / = 5 + 0 = 5) inférieur à 4d(n + / = 4 + 2 = 6) ; 5p(n + / = 5 +1 =6) inférieur à 4f(n + 1 = 4+3 = 7). Si pour deux niveaux les sommes des valeurs n et / sont égales, alors le sous-niveau avec la plus petite valeur n est rempli en premier. Par exemple, aux sous-niveaux 3d, 4p, 5s les sommes des valeurs n et / sont. égal à cinq, dans ce cas les sous-niveaux avec des valeurs plus petites du nombre quantique principal sont remplis en premier n, c'est-à-dire dans l'ordre suivant : 3d-4р-5s.
Lorsque les énergies de sous-niveaux proches diffèrent très peu les unes des autres, il existe quelques exceptions à cette règle. Ainsi, le sous-niveau 5d est rempli d'un électron 5dl avant 4f ; 6d1-2 avant 5f.
Le remplissage des niveaux et sous-niveaux d'énergie se produit dans la séquence suivante : ls→2s→2p→3s→3p→4s→ 3d → 4p→ 5s → 4d → 5p→ 6s →(5dl) →4f→ 5d→6p→ 7s→ (6d1 - 2 )→5f→6d→7p
La règle de Hund.
Les électrons au sein d’un sous-niveau donné sont d’abord localisés, chacun dans une cellule distincte, sous la forme d’électrons « inactifs » non appariés. En d’autres termes, pour une valeur donnée de I, les électrons de l’atome sont localisés de telle manière que leur total. le nombre de spin est maximum. Par exemple, si trois cellules p doivent accueillir trois électrons, chacune d'entre elles sera située dans une cellule distincte de cette manière :
Formules électroniques d'atomes et de diagrammes.
Compte tenu des dispositions considérées, il est facile d'imaginer la répartition des électrons selon les niveaux et sous-niveaux d'énergie dans les atomes de n'importe quel élément. Cette répartition des électrons dans un atome est écrite sous la forme de formules électroniques. Dans les formules électroniques, les lettres s, p, d, f désignent les sous-niveaux d'énergie des électrons ; Les chiffres devant les lettres indiquent le niveau d'énergie dans lequel se trouve un électron donné, et l'index en haut à droite est le nombre d'électrons dans un sous-niveau donné. Par exemple, la notation 5p3 signifie que 3 électrons sont situés au sous-niveau p du cinquième niveau d'énergie.
Pour composer la formule électronique d'un atome de n'importe quel élément, il suffit de connaître le numéro de cet élément dans le tableau périodique et de suivre les principes de base qui régissent la répartition des électrons dans l'atome.
Supposons, par exemple, que vous deviez créer des formules électroniques pour les atomes de soufre, de calcium, de scandium, de fer et de lanthane. A partir du tableau périodique on détermine les nombres de ces éléments, qui sont respectivement 16, 20, 21, 26, . Cela signifie que les niveaux et sous-niveaux d’énergie des atomes de ces éléments contiennent respectivement 16, 20, 21, 26, 57 électrons. En observant le principe de Pauli et le principe de moindre énergie, c'est-à-dire la séquence de niveaux et sous-niveaux d'énergie de remplissage, il est possible de composer des formules électroniques pour les atomes de ces éléments :

La structure de la couche électronique d'un atome peut également être représentée sous la forme d'un diagramme de la disposition des électrons dans les cellules énergétiques.
Pour les atomes de fer, ce schéma a la forme suivante :

Ce diagramme montre clairement la mise en œuvre de la règle de Hund. Au sous-niveau 3D, le nombre maximum de cellules (quatre) est rempli d'électrons non appariés. L'image de la structure de la couche électronique dans un atome sous forme de formules électroniques et sous forme de diagrammes ne reflète pas clairement les propriétés ondulatoires de l'électron. Cependant, il ne faut pas oublier que chaque électron s, p, d et f possède son propre nuage électronique. Une forme différente d'un nuage d'électrons indique qu'un électron a une probabilité différente de se trouver dans une région donnée de l'espace atomique. En fonction de la valeur du nombre quantique magnétique m1, l'orientation du nuage électronique dans l'espace sera également différente.