Mn dans le tableau périodique. Tableau périodique des éléments chimiques
Lire aussi
Le XIXe siècle de l’histoire de l’humanité est un siècle au cours duquel de nombreuses sciences ont été réformées, dont la chimie. C'est à cette époque qu'apparaît le système périodique de Mendeleïev, et avec lui la loi périodique. C'est lui qui est devenu la base chimie moderne. Le système périodique de D.I. Mendeleïev est une systématisation d'éléments qui établit la dépendance des propriétés chimiques et physiques de la structure et de la charge de l'atome d'une substance.
Histoire
Le début de la période périodique a été posé par le livre « La corrélation des propriétés avec le poids atomique des éléments », écrit dans le troisième quart du XVIIe siècle. Il présentait les concepts de base d'un éléments chimiques(à cette époque ils n’étaient que 63). D’ailleurs, beaucoup d’entre eux masses atomiques ont été mal définis. Cela a grandement gêné la découverte de D.I. Mendeleev.
Dmitry Ivanovich a commencé son travail en comparant les propriétés des éléments. Il a d’abord travaillé sur le chlore et le potassium, puis ensuite sur les métaux alcalins. Armé de cartes spéciales sur lesquelles étaient représentés des éléments chimiques, il a tenté à plusieurs reprises d'assembler cette « mosaïque » : il l'a disposée sur sa table à la recherche des combinaisons et des correspondances nécessaires.
Après de nombreux efforts, Dmitry Ivanovich a finalement trouvé le motif qu'il recherchait et a disposé les éléments en rangées périodiques. Ayant reçu des cellules vides entre les éléments, le scientifique s'est rendu compte que tous les éléments chimiques n'étaient pas connus des chercheurs russes et que c'était lui qui devait donner à ce monde les connaissances dans le domaine de la chimie qui n'avaient pas encore été données par son prédécesseurs.

Tout le monde connaît le mythe selon lequel le tableau périodique est apparu à Mendeleïev dans un rêve et il a collecté les éléments de mémoire. système unifié. C'est, en gros, un mensonge. Le fait est que Dmitri Ivanovitch a travaillé assez longtemps et s'est concentré sur son travail, ce qui l'a beaucoup épuisé. Alors qu'il travaillait sur le système des éléments, Mendeleïev s'est endormi un jour. Lorsqu'il s'est réveillé, il s'est rendu compte qu'il n'avait pas fini le tableau et a plutôt continué à remplir les cellules vides. Sa connaissance, un certain Inostrantsev, professeur d'université, a décidé que le tableau périodique avait été rêvé par Mendeleïev et a répandu cette rumeur parmi ses étudiants. C’est ainsi qu’est née cette hypothèse.
Notoriété
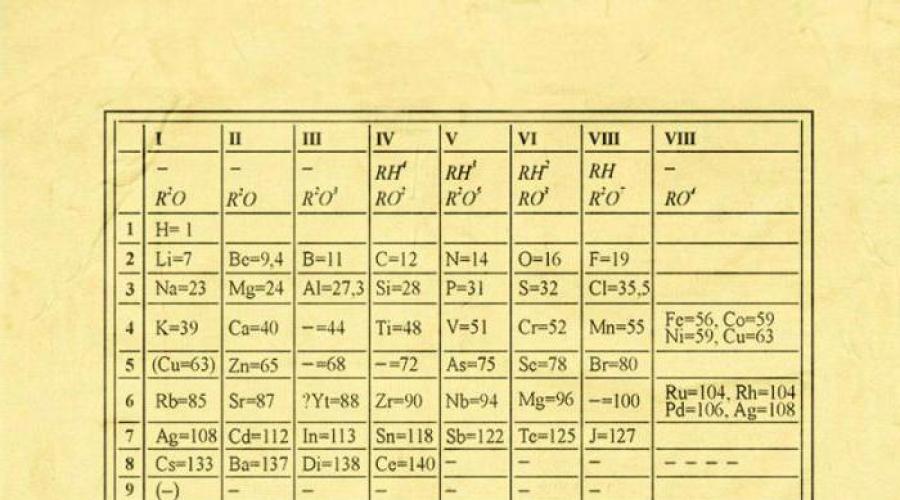
Les éléments chimiques de Mendeleev sont le reflet de la loi périodique créée par Dmitri Ivanovitch dans le troisième quart du XIXe siècle (1869). C’est en 1869 que la notification de Mendeleïev concernant la création d’une certaine structure fut lue lors d’une réunion de la communauté chimique russe. Et la même année, le livre « Fondements de la chimie » a été publié, dans lequel le système périodique des éléments chimiques de Mendeleïev a été publié pour la première fois. Et dans le livre " Système natureléléments et son utilisation pour indiquer les qualités d'éléments non découverts » D.I. Mendeleev a mentionné pour la première fois le concept de « loi périodique ».

Structure et règles de placement des éléments
Les premiers pas dans la création de la loi périodique ont été faits par Dmitri Ivanovitch en 1869-1871, à cette époque il travaillait dur pour établir la dépendance des propriétés de ces éléments sur la masse de leur atome. Version moderne représente des éléments résumés dans un tableau à deux dimensions.
La position d'un élément dans le tableau a une certaine signification chimique et physique. Par l'emplacement d'un élément dans le tableau, vous pouvez découvrir quelle est sa valence et déterminer d'autres caractéristiques chimiques. Dmitry Ivanovich a tenté d'établir un lien entre des éléments, à la fois similaires en propriétés et différents.

Il a basé la classification des éléments chimiques connue à cette époque sur la valence et la masse atomique. En comparant les propriétés relatives des éléments, Mendeleïev a tenté de trouver un modèle qui unirait tous les éléments chimiques connus en un seul système. En les organisant en fonction de masses atomiques croissantes, il a néanmoins obtenu une périodicité dans chacune des rangées.
Développement ultérieur du système
Le tableau périodique, paru en 1969, a été affiné à plusieurs reprises. Avec l'avènement des gaz rares dans les années 1930, il a été possible de révéler une nouvelle dépendance des éléments - non pas à la masse, mais au numéro atomique. Plus tard, il a été possible d'établir le nombre de protons dans les noyaux atomiques et il s'est avéré qu'il coïncide avec le numéro atomique de l'élément. Les scientifiques du 20e siècle ont étudié l’énergie électronique et il s’est avéré qu’elle affecte également la périodicité. Cela a considérablement changé les idées sur les propriétés des éléments. Ce point a été reflété dans les éditions ultérieures du tableau périodique de Mendeleïev. Chaque nouvelle découverte des propriétés et des caractéristiques des éléments s'inscrit organiquement dans le tableau.
Caractéristiques du système périodique de Mendeleïev
Le tableau périodique est divisé en périodes (7 lignes disposées horizontalement), qui, à leur tour, sont divisées en grandes et petites. La période commence par un métal alcalin et se termine par un élément aux propriétés non métalliques.
Le tableau de Dmitry Ivanovich est divisé verticalement en groupes (8 colonnes). Chacun d'eux dans le tableau périodique se compose de deux sous-groupes, à savoir les principaux et les secondaires. Après de nombreux débats, sur proposition de D.I. Mendeleïev et de son collègue U. Ramsay, il a été décidé d'introduire le groupe dit zéro. Il comprend les gaz inertes (néon, hélium, argon, radon, xénon, krypton). En 1911, les scientifiques F. Soddy ont été invités à placer des éléments indiscernables, appelés isotopes, dans le tableau périodique - des cellules distinctes leur ont été attribuées.

Malgré l'exactitude et l'exactitude du système périodique, la communauté scientifique n'a pas voulu reconnaître cette découverte pendant longtemps. De nombreux grands scientifiques ont ridiculisé les travaux de D.I. Mendeleev et ont estimé qu'il était impossible de prédire les propriétés d'un élément qui n'avait pas encore été découvert. Mais après la découverte des éléments chimiques supposés (par exemple le scandium, le gallium et le germanium), le système de Mendeleïev et sa loi périodique sont devenus la science de la chimie.
La table à l'époque moderne
Le tableau périodique des éléments de Mendeleev est à la base de la plupart des découvertes chimiques et physiques liées à la science atomique et moléculaire. Concept moderne L'élément s'est formé précisément grâce au grand scientifique. L'émergence du système périodique de Mendeleïev a introduit des changements fondamentaux dans les idées sur diverses connexions Et substances simples Oh. La création du tableau périodique par les scientifiques a eu un impact énorme sur le développement de la chimie et de toutes les sciences qui y sont liées.
Vous avez probablement tous vu le tableau périodique des éléments. Il est possible qu'elle vous hante encore dans vos rêves, ou peut-être que pour l'instant elle n'est qu'un arrière-plan visuel décorant le mur. classe d'école. Cependant, cette collection apparemment aléatoire de cellules cache bien plus qu’il n’y paraît.
Le tableau périodique (ou PT, comme nous l'appellerons de temps en temps tout au long de cet article) et les éléments qui le composent possèdent des caractéristiques que vous n'auriez peut-être jamais devinées. De la création du tableau à l’ajout des éléments finaux, voici dix faits que la plupart des gens ignorent.
10. Mendeleev a reçu de l'aide
Le tableau périodique est utilisé depuis 1869, date à laquelle il a été compilé par Dimitri Mendeleïev, très barbu. La plupart des gens pensent que Mendeleïev était le seul à avoir travaillé sur cette table et qu'il est ainsi devenu le chimiste le plus brillant du siècle. Cependant, ses efforts ont été aidés par plusieurs scientifiques européens qui ont apporté d’importantes contributions à la réalisation de cet ensemble colossal d’éléments.
Mendeleïev est largement connu comme le père tableau périodique, mais lorsqu'il l'a compilé, tous les éléments du tableau n'étaient pas déjà ouverts. Comment est-ce devenu possible ? Les scientifiques sont célèbres pour leur folie...
9. Derniers éléments ajoutés

Croyez-le ou non, le tableau périodique n'a pas beaucoup changé depuis les années 1950. Cependant, le 2 décembre 2016, quatre nouveaux éléments ont été ajoutés d'un coup : le nihonium (élément n° 113), le moscovium (élément n° 115), la tennessine (élément n° 117) et l'oganesson (élément n° 118). Ces nouveaux éléments n’ont reçu leur nom qu’en juin 2016, car un examen de cinq mois était nécessaire avant d’être officiellement ajoutés au PT.
Trois éléments portent le nom des villes ou des États dans lesquels ils ont été obtenus, et Oganesson doit son nom au physicien nucléaire russe Yuri Oganesyan pour sa contribution à l'obtention de cet élément.
8. Quelle lettre ne figure pas dans le tableau ?

Il y a 26 lettres dans l’alphabet latin et chacune d’elles est importante. Cependant, Mendeleev a décidé de ne pas s'en apercevoir. Jetez un œil au tableau et dites-moi quelle lettre porte malheur ? Astuce : recherchez dans l'ordre et pliez vos doigts après chaque lettre que vous trouvez. En conséquence, vous retrouverez la lettre « manquante » (si vous avez les dix doigts sur les mains). L'avez-vous deviné ? Il s'agit de la lettre numéro 10, la lettre "J".
On dit que « un » est le nombre de personnes seules. Alors peut-être devrions-nous appeler la lettre « J » la lettre des célibataires ? Mais voici un fait amusant : la majorité des garçons nés aux États-Unis en 2000 ont reçu des prénoms commençant par cette lettre. Ainsi, cette lettre n’est pas restée sans attention.
7. Éléments synthétisés

Comme vous le savez peut-être déjà, le tableau périodique compte actuellement 118 éléments. Pouvez-vous deviner combien de ces 118 éléments ont été obtenus en laboratoire ? De tout liste générale V conditions naturelles seuls 90 éléments peuvent être trouvés.
Pensez-vous que 28 éléments créés artificiellement, c'est beaucoup ? Eh bien, croyez-moi sur parole. Ils sont synthétisés depuis 1937 et les scientifiques continuent de le faire aujourd'hui. Vous pouvez retrouver tous ces éléments dans le tableau. Regardez les éléments 95 à 118, tous ces éléments sont introuvables sur notre planète et ont été synthétisés en laboratoire. Il en va de même pour les éléments numérotés 43, 61, 85 et 87.
6. 137ème élément

Au milieu du 20e siècle, un scientifique célèbre nommé Richard Feynman a fait une déclaration assez bruyante qui a choqué tout le monde. monde scientifique de notre planète. Selon lui, si jamais nous découvrons l'élément 137, nous ne pourrons pas déterminer le nombre de protons et de neutrons qu'il contient. Le nombre 1/137 est remarquable car il s’agit de la valeur de la constante de structure fine, qui décrit la probabilité qu’un électron absorbe ou émette un photon. Théoriquement, l’élément n°137 devrait avoir 137 électrons et 100 % de chances d’absorber un photon. Ses électrons tourneront à la vitesse de la lumière. Encore plus incroyable, les électrons de l'élément 139 doivent tourner plus vite que la vitesse de la lumière pour exister.
Êtes-vous déjà fatigué de la physique ? Vous serez peut-être intéressé de savoir que le nombre 137 regroupe trois domaines importants de la physique : la théorie de la vitesse de la lumière, la mécanique quantique et l'électromagnétisme. Depuis le début des années 1900, les physiciens spéculent que le nombre 137 pourrait être à l'origine du Grand théorie unifiée, qui comprendra les trois domaines ci-dessus. Certes, cela semble aussi incroyable que les légendes des ovnis et du Triangle des Bermudes.
5. Que pouvez-vous dire à propos des noms ?

Presque tous les noms d’éléments ont une signification, même si cela n’est pas immédiatement clair. Les noms des nouveaux éléments ne sont pas donnés arbitrairement. Je nommerais simplement l'élément avec le premier mot qui me vient à l'esprit. Par exemple, "kerflump". Je pense que ce n'est pas mal.
En règle générale, les noms d’éléments appartiennent à l’une des cinq catégories principales. Le premier concerne les noms de scientifiques célèbres, version classique- l'einsteinium. De plus, les éléments peuvent recevoir leur nom en fonction de l'endroit où ils ont été enregistrés pour la première fois, par exemple le germanium, l'américium, le gallium, etc. option supplémentaire les noms des planètes sont utilisés. L'élément uranium a été découvert pour la première fois peu de temps après la découverte de la planète Uranus. Les éléments peuvent avoir des noms associés à la mythologie, par exemple il y a le titane, du nom des anciens titans grecs, et le thorium, du nom du dieu nordique du tonnerre (ou étoile « vengeur », selon ce que vous préférez).
Et enfin, il existe des noms qui décrivent les propriétés des éléments. Argon vient du mot grec « argos », qui signifie « paresseux » ou « lent ». Le nom suggère que ce gaz n’est pas actif. Le brome est un autre élément dont le nom vient d'un mot grec. « Bromos » signifie « puanteur » et décrit assez bien l'odeur du brome.
4. La création de la table a-t-elle été un « moment eurêka » ?

si tu aimes jeux de cartes, alors ce fait est pour vous. Mendeleev devait d'une manière ou d'une autre ordonner tous les éléments et trouver un système pour cela. Naturellement, pour créer un tableau de catégories, il s'est tourné vers le solitaire (enfin, quoi d'autre ?). Mendeleev a noté le poids atomique de chaque élément sur une carte séparée, puis a commencé à présenter son jeu de solitaire avancé. Il a disposé les éléments selon leurs propriétés spécifiques puis les a disposés dans chaque colonne en fonction de leur poids atomique.
Beaucoup de gens ne peuvent pas jouer au solitaire classique, ce jeu de solitaire est donc impressionnant. Que va-t-il se passer ensuite? Probablement quelqu'un, avec l'aide des échecs, révolutionnera l'astrophysique ou créera une fusée capable d'atteindre la périphérie de la galaxie. Il semble qu'il n'y ait rien d'inhabituel à cela, étant donné que Mendeleïev a pu obtenir un résultat aussi ingénieux avec un simple jeu de cartes à jouer.
3. Des gaz nobles malchanceux

Rappelez-vous comment nous avons classé l'argon comme l'élément le plus paresseux et le plus lent de l'histoire de notre univers ? Il semble que Mendeleïev ait été envahi par les mêmes sentiments. Lorsque l’argon pur a été obtenu pour la première fois en 1894, il ne rentrait dans aucune des colonnes du tableau. Ainsi, au lieu de chercher une solution, le scientifique a décidé de simplement nier son existence.
Plus frappant encore, l’argon n’est pas le seul élément à avoir initialement subi ce sort. Outre l’argon, cinq autres éléments restent non classés. Cela concernait le radon, le néon, le krypton, l'hélium et le xénon - et tout le monde a nié leur existence simplement parce que Mendeleev ne pouvait pas leur trouver une place dans le tableau. Après plusieurs années de regroupement et de reclassement, ces éléments (appelés des gaz inertes) a quand même eu la chance de rejoindre un club digne et reconnu comme réellement existant.
2. L'amour atomique

Conseils pour tous ceux qui se considèrent comme des romantiques. Prenez une copie papier du tableau périodique et découpez toutes les colonnes du milieu compliquées et relativement inutiles afin de vous retrouver avec 8 colonnes (vous aurez une forme « courte » du tableau). Pliez-le au milieu du groupe IV - et vous découvrirez quels éléments peuvent former des composés les uns avec les autres.
Les éléments qui « s’embrassent » lorsqu’ils sont pliés sont capables de former des composés stables. Ces éléments ont des structures électroniques complémentaires et vont se combiner entre eux. Et si ce n’est pas le véritable amour, comme Roméo et Juliette ou Shrek et Fiona, alors je ne sais pas ce qu’est l’amour.
1. Règles carbone

Carbon essaie d’être au centre du jeu. Vous pensez tout savoir sur le carbone, mais ce n'est pas le cas ; c'est bien plus important que vous ne le pensez. Saviez-vous qu’il est présent dans plus de la moitié de tous les composés connus ? Et qu’en est-il du fait que 20 % du poids de tous les organismes vivants est constitué de carbone ? C'est vraiment bizarre, mais préparez-vous : chaque atome de carbone de votre corps faisait autrefois partie d'une faction. gaz carbonique dans l'atmosphère. Le carbone n’est pas seulement le surélément de notre planète, c’est le quatrième élément le plus abondant dans tout l’Univers.
Si le tableau périodique est comme une fête, alors le carbone en est l’hôte principal. Et il semble qu'il soit le seul à savoir tout organiser correctement. Eh bien, entre autres choses, c'est l'élément principal de tous les diamants, donc malgré tout son caractère intrusif, il scintille aussi !
La découverte du tableau périodique des éléments chimiques par Dmitri Mendeleïev en mars 1869 fut une véritable avancée en chimie. Le scientifique russe a réussi à systématiser les connaissances sur les éléments chimiques et à les présenter sous la forme d'un tableau que les écoliers doivent encore étudier dans les cours de chimie. Le tableau périodique est devenu la base du développement rapide de cette science complexe et intéressante, et l'histoire de sa découverte est entourée de légendes et de mythes. Pour tous ceux qui s’intéressent à la science, il sera intéressant de connaître la vérité sur la façon dont Mendeleïev a découvert le tableau des éléments périodiques.
Histoire du tableau périodique : comment tout a commencé
Des tentatives de classification et de systématisation des éléments chimiques connus ont été faites bien avant Dmitri Mendeleïev. Des scientifiques célèbres tels que Döbereiner, Newlands, Meyer et d'autres ont proposé leurs systèmes d'éléments. Cependant, en raison du manque de données sur les éléments chimiques et leurs masses atomiques correctes, les systèmes proposés n'étaient pas entièrement fiables.
L'histoire de la découverte du tableau périodique commence en 1869, lorsqu'un scientifique russe lors d'une réunion de la Société chimique russe a parlé de sa découverte à ses collègues. Dans le tableau proposé par le scientifique, les éléments chimiques étaient classés en fonction de leurs propriétés, assurées par la taille de leur poids moléculaire.
Une caractéristique intéressante du tableau périodique était également la présence de cellules vides, qui à l'avenir étaient remplies d'éléments chimiques ouverts prédits par le scientifique (germanium, gallium, scandium). Depuis la découverte du tableau périodique, des ajouts et des modifications y ont été apportés à de nombreuses reprises. Avec le chimiste écossais William Ramsay, Mendeleïev a ajouté au tableau un groupe de gaz inertes (groupe zéro).
Par la suite, l'histoire du tableau périodique de Mendeleïev était directement liée aux découvertes d'une autre science : la physique. Les travaux sur le tableau des éléments périodiques se poursuivent encore aujourd'hui et les scientifiques modernes ajoutent de nouveaux éléments chimiques au fur et à mesure de leur découverte. L’importance du système périodique de Dmitri Mendeleïev est difficile à surestimer, car grâce à lui :
- La connaissance des propriétés des éléments chimiques déjà découverts a été systématisée ;
- Il devint possible de prédire la découverte de nouveaux éléments chimiques ;
- Des branches de la physique telles que la physique atomique et la physique nucléaire ont commencé à se développer ;
Il existe de nombreuses options pour représenter les éléments chimiques selon la loi périodique, mais l'option la plus connue et la plus courante est le tableau périodique familier à tous.
Mythes et faits sur la création du tableau périodique
L'idée fausse la plus répandue dans l'histoire de la découverte du tableau périodique est que le scientifique l'a vu dans un rêve. En fait, Dmitri Mendeleev lui-même a réfuté ce mythe et a déclaré qu'il réfléchissait à la loi périodique depuis de nombreuses années. Pour systématiser les éléments chimiques, il a écrit chacun d'eux sur une carte séparée et les a combinés à plusieurs reprises les uns avec les autres, les disposant en rangées en fonction de leurs propriétés similaires.
Le mythe du rêve « prophétique » du scientifique peut s’expliquer par le fait que Mendeleïev travaillait à la systématisation des éléments chimiques pendant des journées entières, interrompues par un court sommeil. Cependant, seuls le travail acharné et le talent naturel du scientifique ont donné le résultat tant attendu et ont conféré à Dmitri Mendeleïev une renommée mondiale.
De nombreux étudiants à l'école, et parfois à l'université, sont obligés de mémoriser ou du moins de parcourir grossièrement le tableau périodique. Pour ce faire, une personne doit non seulement avoir bonne mémoire, mais aussi penser logiquement, en reliant les éléments en groupes et classes séparés. Étudier la table est plus facile pour les personnes qui maintiennent constamment leur cerveau en forme en suivant une formation sur BrainApps.
Quiconque est allé à l’école se souvient que l’une des matières obligatoires était la chimie. Vous pourriez l’aimer ou ne pas l’aimer – cela n’a pas d’importance. Et il est probable qu’une grande partie des connaissances dans cette discipline ont déjà été oubliées et ne sont pas utilisées dans la vie. Cependant, tout le monde se souvient probablement du tableau des éléments chimiques de D.I. Mendeleev. Pour beaucoup, il s'agit d'un tableau multicolore, où certaines lettres sont écrites dans chaque carré, indiquant les noms des éléments chimiques. Mais ici nous ne parlerons pas de chimie en tant que telle, mais décrirons des centaines réactions chimiques et les processus, mais nous vous raconterons comment le tableau périodique est apparu en premier lieu - cette histoire intéressera toute personne, et même tous ceux qui ont soif d'informations intéressantes et utiles.
Un peu de contexte
En 1668, l'éminent chimiste, physicien et théologien irlandais Robert Boyle a publié un livre dans lequel de nombreux mythes sur l'alchimie ont été démystifiés et dans lequel il a évoqué la nécessité de rechercher des éléments chimiques indécomposables. Le scientifique en a également donné une liste, composée de seulement 15 éléments, mais a admis l'idée qu'il pourrait y avoir plus d'éléments. Ce fut le point de départ non seulement de la recherche de nouveaux éléments, mais aussi de leur systématisation.
Cent ans plus tard, le chimiste français Antoine Lavoisier a dressé une nouvelle liste qui comprenait déjà 35 éléments. 23 d’entre eux se sont révélés plus tard indécomposables. Mais la recherche de nouveaux éléments s'est poursuivie par les scientifiques du monde entier. ET Le rôle principal Le célèbre chimiste russe Dmitri Ivanovitch Mendeleïev a joué un rôle dans ce processus. Il a été le premier à émettre l'hypothèse selon laquelle il pourrait y avoir une relation entre la masse atomique des éléments et leur emplacement dans le système.
Grâce à un travail minutieux et à la comparaison des éléments chimiques, Mendeleev a pu découvrir la connexion entre les éléments, dans laquelle ils peuvent ne faire qu'un, et leurs propriétés ne sont pas considérées comme acquises, mais représentent un phénomène qui se répète périodiquement. En conséquence, en février 1869, Mendeleïev formula la première loi périodique et, déjà en mars, son rapport «Relation des propriétés avec le poids atomique des éléments» fut présenté à la Société chimique russe par l'historien de la chimie N. A. Menshutkin. Puis, la même année, la publication de Mendeleïev fut publiée dans la revue « Zeitschrift fur Chemie » en Allemagne, et en 1871, une autre revue allemande « Annalen der Chemie » publia une nouvelle publication approfondie du scientifique consacrée à sa découverte.
Création du tableau périodique

En 1869, l'idée principale avait déjà été formée par Mendeleïev, et dans un laps de temps assez court, mais pendant longtemps, il ne put la formaliser dans un système ordonné qui afficherait clairement ce qui était quoi. Lors d'une conversation avec son collègue A.A. Inostrantsev, il a même déclaré qu'il avait déjà tout réglé dans sa tête, mais qu'il ne pouvait pas tout mettre dans un tableau. Après cela, selon les biographes de Mendeleïev, il commença un travail minutieux sur sa table, qui dura trois jours sans interruption pour dormir. Ils ont essayé toutes sortes de façons d'organiser les éléments dans un tableau, et le travail était également compliqué par le fait qu'à cette époque la science ne connaissait pas encore tous les éléments chimiques. Mais malgré cela, le tableau a quand même été créé et les éléments ont été systématisés.
La légende du rêve de Mendeleïev
Beaucoup ont entendu l'histoire selon laquelle D.I. Mendeleïev rêvait de sa table. Cette version a été activement diffusée par A. A. Inostrantsev, associé de Mendeleïev susmentionné, sous le nom de histoire drôle avec lequel il divertissait ses élèves. Il a dit que Dmitri Ivanovitch s'était couché et avait clairement vu dans un rêve sa table, dans laquelle tous les éléments chimiques étaient disposés dans dans le bon ordre. Après cela, les étudiants ont même plaisanté en disant que la vodka à 40° avait été découverte de la même manière. Mais il y avait encore de réelles conditions préalables à l'histoire avec le sommeil : comme déjà mentionné, Mendeleïev travaillait sur la table sans dormir ni se reposer, et Inostrantsev le trouva un jour fatigué et épuisé. Pendant la journée, Mendeleïev a décidé de se reposer un peu et, quelque temps plus tard, il s'est réveillé brusquement, a immédiatement pris un morceau de papier et y a dessiné un tableau tout fait. Mais le scientifique lui-même a réfuté toute cette histoire avec le rêve, en disant : « J'y pense, peut-être depuis vingt ans, et vous pensez : j'étais assis et tout d'un coup... c'est prêt. La légende du rêve est peut-être très séduisante, mais la création de la table n’a été possible que grâce à un travail acharné.

La poursuite des travaux
Entre 1869 et 1871, Mendeleïev développe les idées de périodicité vers lesquelles penche la communauté scientifique. Et l'un des étapes importantes ce processus il y avait une compréhension que tout élément du système devrait avoir, sur la base de la totalité de ses propriétés par rapport aux propriétés d'autres éléments. Sur cette base, et en s'appuyant également sur les résultats de recherches sur l'évolution des oxydes vitreux, le chimiste a pu apporter des corrections aux valeurs des masses atomiques de certains éléments, dont l'uranium, l'indium, le béryllium et d'autres.
Mendeleev, bien sûr, voulait remplir rapidement les cellules vides qui restaient dans le tableau et, en 1870, il prédit que des éléments chimiques inconnus de la science seraient bientôt découverts, dont il serait capable de calculer les masses et les propriétés atomiques. Les premiers d'entre eux étaient le gallium (découvert en 1875), le scandium (découvert en 1879) et le germanium (découvert en 1885). Ensuite, les prédictions ont continué à se réaliser et huit autres nouveaux éléments ont été découverts, parmi lesquels : le polonium (1898), le rhénium (1925), le technétium (1937), le francium (1939) et l'astatine (1942-1943). À propos, en 1900, D.I. Mendeleev et le chimiste écossais William Ramsay sont arrivés à la conclusion que le tableau devrait également inclure des éléments du groupe zéro - jusqu'en 1962, ils étaient appelés gaz inertes, et après cela - gaz rares.
Organisation du tableau périodique
Les éléments chimiques du tableau de D.I. Mendeleev sont disposés en rangées, en fonction de l'augmentation de leur masse, et la longueur des rangées est choisie de manière à ce que les éléments qu'ils contiennent aient des propriétés similaires. Par exemple, les gaz rares tels que le radon, le xénon, le krypton, l'argon, le néon et l'hélium réagissent difficilement avec d'autres éléments et ont également une faible réactivité chimique, c'est pourquoi ils se trouvent dans la colonne la plus à droite. Et les éléments de la colonne de gauche (potassium, sodium, lithium, etc.) réagissent bien avec d'autres éléments, et les réactions elles-mêmes sont explosives. En termes simples, au sein de chaque colonne, les éléments ont des propriétés similaires qui varient d'une colonne à l'autre. Tous les éléments jusqu'au n° 92 se trouvent dans la nature, et à partir du n° 93 ils commencent éléments artificiels, qui ne peut être créé que dans des conditions de laboratoire.
Dans sa version originale, le système périodique n'était compris que comme le reflet de l'ordre existant dans la nature, et il n'y avait aucune explication quant à la raison pour laquelle tout devrait être ainsi. Et seulement quand elle est apparue mécanique quantique, la véritable signification de l’ordre des éléments dans le tableau est devenue claire.
Leçons dans le processus créatif
Parler de quelles leçons processus créatif peut être extrait de toute l'histoire de la création du tableau périodique par D.I. Mendeleïev, on peut citer en exemple les idées d'un chercheur anglais dans le domaine la pensée créative Graham Wallace et le scientifique français Henri Poincaré. Donnons-les brièvement.
Selon les études de Poincaré (1908) et Graham Wallace (1926), il existe quatre étapes principales dans la pensée créatrice :
- Préparation– l'étape de formulation du problème principal et les premières tentatives pour le résoudre ;
- Incubation– une étape au cours de laquelle il y a une distraction temporaire du processus, mais le travail pour trouver une solution au problème est effectué à un niveau subconscient ;
- Aperçu– l’étape où se situe la solution intuitive. De plus, cette solution peut être trouvée dans une situation qui n'a aucun rapport avec le problème ;
- Examen– l'étape de test et de mise en œuvre d'une solution, au cours de laquelle cette solution est testée et son éventuel développement ultérieur.
Comme on peut le voir, dans le processus de création de son tableau, Mendeleïev a suivi intuitivement précisément ces quatre étapes. L'efficacité de cette méthode peut être jugée par les résultats, c'est-à-dire par le fait que la table a été créée. Et étant donné que sa création a constitué un grand pas en avant non seulement pour la science chimique, mais aussi pour l'ensemble de l'humanité, les quatre étapes ci-dessus peuvent être appliquées à la fois à la mise en œuvre petits projets, et à la mise en œuvre de plans globaux. La principale chose à retenir est qu'aucune découverte, aucune solution à un problème ne peut être trouvée par elle-même, peu importe à quel point nous voulons les voir dans un rêve et peu importe combien nous dormons. Pour que quelque chose fonctionne, qu'il s'agisse de créer un tableau d'éléments chimiques ou d'élaborer un nouveau plan marketing, vous devez posséder certaines connaissances et compétences, ainsi qu'utiliser habilement votre potentiel et travailler dur.
Nous vous souhaitons du succès dans vos efforts et une mise en œuvre réussie de vos projets !
Même à l'école, pendant les cours de chimie, nous nous souvenons tous de la table accrochée au mur de la classe ou du laboratoire de chimie. Ce tableau contenait une classification de tous les éléments chimiques connus de l'humanité, ces composants fondamentaux qui composent la Terre et l'Univers entier. Alors nous ne pouvions même pas penser que Tableau de Mendeleïev est sans aucun doute l'un des plus grands découvertes scientifiques, qui est le fondement de notre connaissances modernes sur la chimie.
Tableau périodique des éléments chimiques par D. I. Mendeleev
À première vue, son idée semble d’une simplicité trompeuse : organiser éléments chimiques par ordre croissant de poids de leurs atomes. De plus, dans la plupart des cas, il s'avère que les produits chimiques et propriétés physiques chaque élément est similaire à son élément précédent dans le tableau. Ce modèle apparaît pour tous les éléments sauf les tout premiers, simplement parce qu’ils n’ont pas devant eux des éléments similaires en poids atomique. C'est grâce à la découverte de cette propriété que l'on peut placer une séquence linéaire d'éléments dans un tableau à la manière d'un calendrier mural, et ainsi combiner un très grand nombre de types d'éléments chimiques sous une forme claire et cohérente. Bien entendu, nous utilisons aujourd’hui la notion de numéro atomique (le nombre de protons) pour ordonner le système d’éléments. Cela a aidé à résoudre ce que l'on appelle problème technique« une paire de permutations » n'a cependant pas conduit à un changement fondamental dans l'apparence du tableau périodique.
DANS tableau périodique tous les éléments sont classés en fonction de leur numéro atomique, de leur configuration électronique et de leurs propriétés chimiques répétitives. Les lignes du tableau sont appelées périodes et les colonnes sont appelées groupes. La première table, datant de 1869, ne contenait que 60 éléments, mais il a fallu maintenant agrandir la table pour accueillir les 118 éléments que nous connaissons aujourd'hui.
Le tableau périodique de Mendeleïev systématise non seulement les éléments, mais aussi leurs propriétés les plus diverses. Il suffit souvent à un chimiste d'avoir le tableau périodique sous les yeux pour répondre correctement à de nombreuses questions (non seulement des questions d'examen, mais aussi des questions scientifiques).
L'identifiant YouTube de 1M7iKKVnPJE n'est pas valide.
Loi périodique
Il existe deux formulations loi périodiqueéléments chimiques : classiques et modernes.
Classique, tel que présenté par son découvreur D.I. Mendeleev : les propriétés des corps simples, ainsi que les formes et propriétés des composés d'éléments, dépendent périodiquement des valeurs des poids atomiques des éléments.
Moderne : les propriétés des substances simples, ainsi que les propriétés et les formes des composés d'éléments, dépendent périodiquement de la charge du noyau des atomes des éléments (nombre ordinal).
Une représentation graphique de la loi périodique est le système périodique d'éléments, qui représente classification naturelleéléments chimiques, basés sur des changements réguliers des propriétés des éléments en fonction des charges de leurs atomes. Les images les plus courantes du tableau périodique des éléments sont D.I. Les formes de Mendeleev sont courtes et longues.

Groupes et périodes du tableau périodique
En groupes sont appelées lignes verticales dans le tableau périodique. Dans les groupes, les éléments sont combinés par attribut plus haut degré oxydation en oxydes. Chaque groupe est constitué d'un sous-groupe principal et secondaire. Les principaux sous-groupes comprennent des éléments de petites périodes et des éléments de grandes périodes ayant les mêmes propriétés. Les sous-groupes latéraux sont constitués uniquement d'éléments de grandes périodes. Les propriétés chimiques des éléments des sous-groupes principaux et secondaires diffèrent considérablement.
Période appelé une rangée horizontale d’éléments disposés par ordre croissant de numéros atomiques. Il y a sept périodes dans le système périodique : les première, deuxième et troisième périodes sont dites petites, elles contiennent respectivement 2, 8 et 8 éléments ; les périodes restantes sont appelées grandes : dans les quatrième et cinquième périodes, il y a 18 éléments, dans la sixième - 32 et dans la septième (pas encore terminée) - 31 éléments. Chaque période, sauf la première, commence par un métal alcalin et se termine par un gaz noble.
Signification physique du numéro de sérieélément chimique : nombre de protons dans le noyau atomique et nombre d'électrons en orbite autour de lui noyau atomique, sont égaux au numéro ordinal de l’élément.
Propriétés du tableau périodique
Rappelons que groupes sont appelés lignes verticales dans le tableau périodique et Propriétés chimiques les éléments des sous-groupes principaux et secondaires diffèrent considérablement.
Les propriétés des éléments des sous-groupes changent naturellement de haut en bas :
- s'intensifient propriétés métalliques et les non métalliques s'affaiblissent ;
- le rayon atomique augmente ;
- la force des bases et des acides sans oxygène formés par l'élément augmente ;
- l'électronégativité diminue.
Tous les éléments, à l'exception de l'hélium, du néon et de l'argon, forment des composés oxygénés ; il n'existe que huit formes de composés oxygénés. Dans le tableau périodique, ils sont souvent représentés formules générales, situé sous chaque groupe par ordre croissant de l'état d'oxydation des éléments : R 2 O, RO, R 2 O 3, RO 2, R 2 O 5, RO 3, R 2 O 7, RO 4, où le symbole R désigne un élément de ce groupe. Les formules des oxydes supérieurs s'appliquent à tous les éléments du groupe, sauf cas exceptionnels où les éléments ne présentent pas un état d'oxydation égal au numéro du groupe (par exemple, le fluor).
Les oxydes de composition R 2 O présentent de fortes propriétés basiques, et leur basicité augmente avec l'augmentation du numéro atomique ; les oxydes de composition RO (à l'exception de BeO) présentent des propriétés basiques. Les oxydes de composition RO 2, R 2 O 5, RO 3, R 2 O 7 présentent des propriétés acides et leur acidité augmente avec l'augmentation du numéro atomique.
Les éléments des sous-groupes principaux, à partir du groupe IV, forment des composés hydrogène gazeux. Il existe quatre formes de ces composés. Ils sont situés sous les éléments des sous-groupes principaux et sont représentés par des formules générales dans la séquence RH 4, RH 3, RH 2, RH.
Les composés RH 4 sont de nature neutre ; RH 3 - faiblement basique ; RH 2 - légèrement acide ; RH - caractère fortement acide.
Rappelons que période appelé une rangée horizontale d’éléments disposés par ordre croissant de numéros atomiques.
Dans un délai croissant avec le numéro de série de l'élément :
- l'électronégativité augmente ;
- les propriétés métalliques diminuent, les propriétés non métalliques augmentent ;
- le rayon atomique diminue.

Éléments du tableau périodique
Éléments alcalins et alcalino-terreux
Ceux-ci incluent des éléments des premier et deuxième groupes du tableau périodique. Métaux alcalins du premier groupe - métaux mous, de couleur argentée, faciles à couper au couteau. Ils possèdent tous un seul électron dans leur enveloppe externe et réagissent parfaitement. Métaux alcalino-terreux du deuxième groupe ont également une teinte argentée. Deux électrons sont placés au niveau externe et, par conséquent, ces métaux interagissent moins facilement avec d'autres éléments. Comparés aux métaux alcalins, les métaux alcalino-terreux fondent et bout à des températures plus élevées.
Afficher/Masquer le texte
Lanthanides (éléments des terres rares) et actinides
Lanthanides- un groupe d'éléments trouvés à l'origine dans des minéraux rares ; d'où leur appellation d'éléments « terres rares ». Il s’est avéré par la suite que ces éléments ne sont pas aussi rares qu’on le pensait initialement, c’est pourquoi le nom de lanthanides a été donné aux éléments des terres rares. Lanthanides et actinides occupent deux blocs situés sous la table principale des éléments. Les deux groupes comprennent les métaux ; tous les lanthanides (sauf le prométhium) sont non radioactifs ; les actinides, au contraire, sont radioactifs.
Afficher/Masquer le texte
Halogènes et gaz rares
Les halogènes et les gaz rares sont regroupés dans les groupes 17 et 18 du tableau périodique. Halogènes sont des éléments non métalliques, ils ont tous sept électrons dans leur enveloppe externe. DANS gaz nobles Tous les électrons se trouvent dans la couche externe et ne participent donc pratiquement pas à la formation des composés. Ces gaz sont appelés gaz « nobles » car ils réagissent rarement avec d’autres éléments ; c'est-à-dire qu'ils font référence aux membres de la caste noble qui ont traditionnellement évité les autres personnes de la société.
Afficher/Masquer le texte
Métaux de transition
Métaux de transition occupent les groupes 3 à 12 dans le tableau périodique. La plupart d'entre eux sont denses, durs, avec une bonne conductivité électrique et thermique. Leurs électrons de valence (à l'aide desquels ils sont connectés à d'autres éléments) sont situés dans plusieurs couches électroniques.
Afficher/Masquer le texte
| Métaux de transition |
| Scandium Sc21 |
| TitanTi22 |
| Vanadium V23 |
| Chrome Cr 24 |
| Manganèse Mn 25 |
| Fer Fe 26 |
| Cobalt Co27 |
| Nickel Ni 28 |
| Cuivre Cu 29 |
| ZincZn 30 |
| Yttrium Y 39 |
| Zirconium Zr 40 |
| Niobium Nb41 |
| Molybdène Mo 42 |
| Technétium Tc 43 |
| Ruthénium Ru 44 |
| Rhodié Rh 45 |
| Palladium Pd46 |
| Argent Ag 47 |
| Cadmium Cd 48 |
| Lutétium Lu 71 |
| Hafnium Hf 72 |
| Tantale Ta 73 |
| Tungstène W 74 |
| Rhénium Re 75 |
| Osmium Os 76 |
| Iridium Ir77 |
| Platine Pt 78 |
| Or Au 79 |
| Mercure Hg 80 |
| Laurent Lr 103 |
| Rutherfordium Rf 104 |
| Dubnium DB 105 |
| Seaborgium Sg106 |
| Borium Bh 107 |
| Hassiy Hs 108 |
| Meitnérium Mont 109 |
| Darmstadt Ds110 |
| Rayons X Rg 111 |
| Copernicium Cn 112 |
Métalloïdes
Métalloïdes occupent les groupes 13 à 16 du tableau périodique. Les métalloïdes tels que le bore, le germanium et le silicium sont des semi-conducteurs et sont utilisés pour fabriquer puces informatiques et les frais.
Afficher/Masquer le texte
Métaux post-transition
Éléments appelés métaux post-transition, appartiennent aux groupes 13 à 15 du tableau périodique. Contrairement aux métaux, ils n’ont pas de brillance mais une couleur mate. Comparés aux métaux de transition, les métaux post-transition sont plus mous et ont plus de propriétés. basse température fusion et ébullition, électronégativité plus élevée. Leurs électrons de valence, avec lesquels ils attachent d'autres éléments, sont situés uniquement sur la couche électronique externe. Les éléments du groupe des métaux post-transition ont beaucoup plus haute température point d'ébullition que les métalloïdes.
Consolidez maintenant vos connaissances en regardant une vidéo sur le tableau périodique et plus encore.
Génial, le premier pas sur le chemin de la connaissance a été franchi. Vous êtes maintenant plus ou moins orienté dans le tableau périodique et cela vous sera très utile, car le système périodique de Mendeleev est le fondement sur lequel repose cette science étonnante.