chimie colloïdale. Chimie physique et colloïdale. Phénomènes de surface et adsorption
Planifier:
systèmes dispersés.
La structure d'une micelle colloïdale.
Méthodes d'obtention de colloïdes lyophobes (SR).
Le sujet et la signification de la chimie colloïdale.
chimie des colloïdes- c'est la science des systèmes dispersés et des phénomènes de surface qui se produisent aux interfaces.
la chimie des colloïdes est chimie des corps réels, étant donné que les objets réels de nature animée et inanimée, les produits et matériaux créés et utilisés par l'homme sont presque toujours à l'état dispersé, c'est-à-dire qu'ils contiennent de petites particules, des films minces, des membranes, des fibres aux interfaces clairement définies. Dans le même temps, des phénomènes de surface et des systèmes dispersés sont également rencontrés bien au-delà de la Terre. Par exemple, la matière interstellaire est constituée de nuages de gaz et de poussière. Les phénomènes météorologiques - décharges de foudre, pluie, neige, grêle, brouillard et autres - sont des processus colloïdaux.
chimie des colloïdes constitue la base scientifique production de matières plastiques, caoutchouc, fibres synthétiques, adhésifs, peintures et vernis et matériaux de construction, produits alimentaires, médicaments, etc. Il n'y a pratiquement aucune industrie qui, à un degré ou à un autre, ne traiterait pas des systèmes colloïdaux.
Le rôle de la chimie des colloïdes est également important dans la résolution d'un complexe de problèmes de protection de l'environnement. y compris le traitement des eaux usées, le traitement de l'eau, la capture des aérosols, le contrôle de l'érosion des sols, etc.
chimie des colloïdes ouvre de nouvelles approchesà l'étude de l'histoire de la croûte terrestre, l'établissement des liens entre les propriétés colloïdes-chimiques du sol et sa fertilité, l'élucidation des conditions d'émergence de la vie, les mécanismes de l'activité vitale ; elle est est l'une des principales fondations biologie moderne, pédologie, géologie, météorologie. Avec la biochimie et la physicochimie des polymères, il est la base de la doctrine de l'origine et du développement de la vie sur Terre. Le fait que tous les systèmes vivants soient fortement dispersés souligne l'importance de la chimie colloïdale pour le développement de la chimie moderne en général.
L'importance des processus colloïdaux dans l'agriculture (création de fumées et de brouillards pour la lutte contre les ravageurs agricoles, granulation d'engrais, amélioration de la structure du sol, etc.) est énorme. Procédés culinaires : le vieillissement des gelées (rassis du pain, séparation du liquide des kissels, de la gelée, etc.), l'adsorption (clarification des bouillons) sont des procédés colloïdaux qui sous-tendent la boulangerie, la vinification, la brasserie et d'autres industries alimentaires.
2. Systèmes dispersés.
Systèmes dispersés- ce sont des systèmes dans lesquels une substance sous forme de particules de différentes tailles est distribuée dans une autre substance.
Dans les systèmes dispersés, on distingue une phase dispersée (DF) - une substance finement divisée et un milieu de dispersion (DS) - une substance homogène dans laquelle la phase dispersée est distribuée (dans une eau boueuse contenant de l'argile, les DF sont des particules solides d'argile, et DS est de l'eau).
Une caractéristique importante des systèmes dispersés est le degré de dispersité, c'est-à-dire la taille moyenne des particules de la phase dispersée.
Selon le degré de dispersion, on distingue généralement les classes suivantes de systèmes dispersés :
Systèmes grossiers– les systèmes dans lesquels la granulométrie de la phase dispersée dépasse 10 -7 m (suspensions et émulsions).
systèmes colloïdaux- des systèmes dont la granulométrie de la phase dispersée est de 10 -7 - 10 -9 m Ce sont des systèmes microhétérogènes avec une interface bien développée entre les phases. Leurs particules ne se déposent pas sous l'action de la gravité, elles traversent des filtres en papier, mais sont retenues par des membranes végétales et animales. Par exemple, les solutions protéiques, les colloïdes du sol, etc.
Parfois, des systèmes dispersés moléculaires (ioniques) sont isolés, qui, à proprement parler, sont vraies solutions, c'est à dire. des systèmes homogènes, puisqu'ils n'ont pas d'interfaces entre les phases. La granulométrie de la phase dispersée est inférieure à 10 -9 M. La substance dissoute se présente sous forme de molécules ou d'ions. Par exemple, des solutions d'électrolytes, de sucre.
Les systèmes colloïdaux, à leur tour, sont divisés en deux groupes, très différents dans la nature des interactions entre les particules de la phase dispersée et le milieu de dispersion - solutions colloïdales lyophobes (sols) et des solutions de composés macromoléculaires (HMC), qui étaient auparavant appelés colloïdes lyophiles.
À colloïdes lyophobes comprennent des systèmes dans lesquels les particules de la phase dispersée interagissent faiblement avec le milieu de dispersion ; ces systèmes ne peuvent être obtenus qu'avec dépense d'énergie et ne sont stables qu'en présence de stabilisants.
Solutions stériles se forment spontanément du fait de la forte interaction des particules de la phase dispersée avec le milieu de dispersion et sont capables de maintenir une stabilité sans stabilisants.
Les colloïdes lyophobes et les solutions de DIU diffèrent par les constituants de la phase dispersée. Pour les colloïdes lyophobes unité de structure est un agrégat multicomposant complexe de composition variable - micelle, pour les solutions DIU - macromolécule.
Les systèmes dispersés sont divisés en groupes qui diffèrent par la nature et l'état d'agrégation de la phase dispersée et du milieu de dispersion :
Si le milieu de dispersion est un liquide et que la phase dispersée est constituée de particules solides, le système est appelé suspension ou suspension;
Si la phase dispersée est constituée de gouttelettes liquides, le système est appelé émulsion. Les émulsions, à leur tour, sont divisées en deux types: droit, ou "l'huile dans l'eau"(lorsque la phase dispersée est un liquide non polaire et le milieu de dispersion est un liquide polaire) et inverse, ou "l'eau dans l'huile"(lorsqu'un liquide polaire est dispersé dans un liquide non polaire).
Parmi les systèmes dispersés, il y a aussi mousse(gaz dispersé dans un liquide) et corps poreux(phase solide dans laquelle un gaz ou un liquide est dispersé). Les principaux types de systèmes dispersés sont donnés dans le tableau.
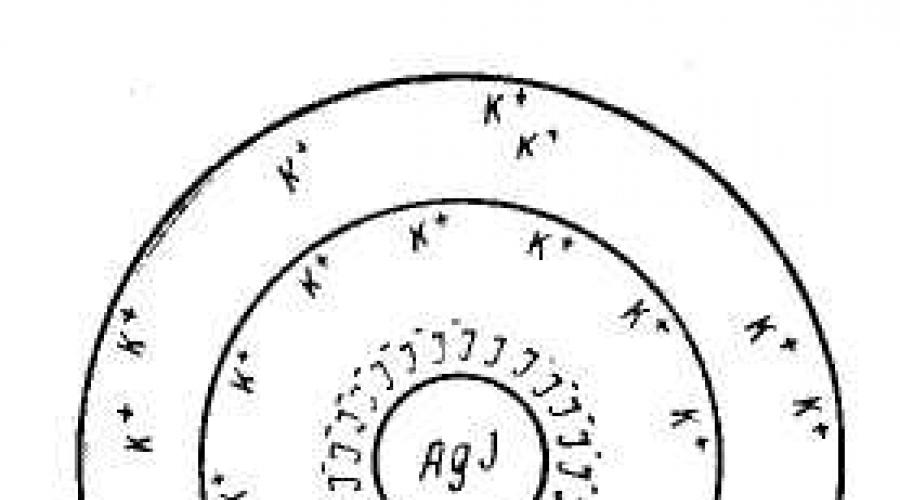
3. Structure d'une micelle colloïdale.
Les particules de DF dans les colloïdes lyophobes ont une structure complexe, en fonction de la composition du DF, du DS et des conditions d'obtention d'une solution colloïdale. Une condition nécessaire pour obtenir des sols stables est la présence du troisième composant, qui joue le rôle de stabilisant.
Une particule dispersée - une micelle se compose de :
noyaux, qui est à l'état cristallin ou liquide ;
couche d'adsorption monomoléculaire ions déterminant le potentiel;
une coque liquide, plus compactée près de la surface de la particule et se transformant progressivement en un milieu de dispersion ordinaire ;
fermement lié couche de contre-ion, c'est à dire. les ions portant une charge opposée au signe de la charge des ions déterminant le potentiel ;
couche de diffusion contre-ions, se déplaçant librement pendant l'électrophorèse ou l'électroosmose.
La structure de l'unité structurelle des colloïdes lyophobes - micelles– ne peut être représentée que schématiquement, car la micelle n'a pas de composition définie. Considérons la structure d'une micelle colloïdale en utilisant l'exemple hydrolat d'iodure d'argent obtenu par l'interaction de solutions diluées de nitrate d'argent et d'iodure de potassium :
AgNO 3 + KI ––> AgI + KNO 3
La micelle colloïdale du sol d'iodure d'argent est formée par un microcristal AgI, qui est capable d'adsorption sélective des cations Ag + ou I - de l'environnement. Pour obtenir un sol stable, il est nécessaire que l'un des électrolytes AgNO 3 ou KI soit présent en excès comme stabilisant.
Si la réaction est effectuée dans un excès d'iodure de potassium, alors le cristal va adsorber I - ; avec un excès de nitrate d'argent, le microcristal adsorbe les ions Ag+. En conséquence, le microcristal acquiert une charge négative ou positive.
1. Excès de KI
Molécules insolubles AgI formulaire noyau de particules colloïdales (micelles) m[ AgI].
À la surface du noyau, les ions I - sont adsorbés (généralement les ions qui font partie du noyau sont adsorbés, c'est-à-dire dans ce cas Ag + ou I -), ce qui lui confère une charge négative. Ils complètent le réseau cristallin du noyau, pénétrant fermement dans sa structure, formant couche d'adsorption m[ AgI] · nI – . Les ions adsorbés à la surface du noyau et lui conférant la charge correspondante sont appelés ions déterminants potentiels.
Les ions déterminant le potentiel adsorbés attirent les ions de signe opposé de la solution contre-ions(K +), et une partie d'entre eux (n-x) est adsorbée sur la particule { m[ AgI] · nI – · (n- X) K + } X – . Noyau + couche d'adsorption = granule.
Le reste des contre-ions forme couche diffuse d'ions.
Le noyau avec les couches d'adsorption et diffuses est micelle.
Schématiquement, une micelle d'un sol d'iodure d'argent obtenue en excès d'iodure de potassium (ions déterminants du potentiel - anions I -, contre-ions - ions K +) peuvent être représentés comme suit:
(m nI – (n-x)K + ) x– xK +

2. Dès réception du sol d'iodure d'argent en excès de nitrate d'argent les particules colloïdales auront une charge positive :
(m nAg + (n-x)NO 3 -) x+ x NO 3 -


S.V. Egorov, E.S. Orobeiko, E.S. Mukhacheva
Chimie des colloïdes, aide-mémoire
1. L'émergence et les grandes étapes du développement de la chimie colloïdale. Sujet et objets de la recherche en chimie des colloïdes
L'émergence de la science de la chimie des colloïdes est associée aux recherches du chimiste anglais T.Graham . Après des recherches pionnières M. Faraday (1857), lorsque des solutions colloïdales stables d'or hautement dispersées ont été obtenues pour la première fois, en 1861, Graham a étudié la diffusion de diverses substances dans des solutions aqueuses et a constaté que certaines d'entre elles (gélatine, agar-agar, etc.) diffusent dans l'eau beaucoup plus lentement que , par exemple, les sels et les acides. De plus, ces substances ne cristallisaient pas lorsque les solutions étaient sursaturées, mais formaient une masse gélatineuse et collante. T. Graham a appelé ces substances colloïdes (du grec kolla - "colle", eidos - "vue"). Alors le nom de la science est apparu - "chimie colloïdale". T. Graham a avancé une hypothèse sur l'existence dans la nature de deux classes opposées de produits chimiques - les cristalloïdes et les colloïdes. Cette idée a intrigué de nombreux chercheurs et dans la seconde moitié du XIXe siècle. a commencé le développement rapide de la chimie colloïdale. En Russie à cette époque, la chimie des colloïdes a également fait l'objet d'une grande attention, en grande partie sous l'influence de D. I. Mendeleïev . Études de la dépendance à la température de la tension superficielle des liquides organiques (1861) conduit Mendeleev à la découverte du concept de température critique des substances. Mendeleev a également exprimé l'idée d'une relation entre la tension superficielle et d'autres propriétés de la matière. Au cours de ces années, de nombreuses substances aux propriétés colloïdales ont été découvertes, diverses méthodes de purification et de stabilisation des colloïdes ont été développées et des méthodes pour leur étude ont été créées. Au fur et à mesure de la découverte de nouveaux colloïdes, l'hypothèse de T. Graham a été remplacée dans la première moitié du XXe siècle. est venu à le concept d'universalité de l'état colloïdal (dispersé) de la matière :"L'état colloïdal n'est pas dû aux particularités de la composition de la substance. Sous certaines conditions, chaque substance peut être à l'état colloïdal. Ce concept a été formulé par le professeur de l'Institut des mines de Saint-Pétersbourg PP Weimarn dans 1906-1910. Il a montré que les colloïdes typiques (par exemple, la gélatine) peuvent être isolés sous forme cristalline et, inversement, une solution colloïdale peut être préparée à partir de substances cristalloïdes (par exemple, le sel commun dans le benzène). Il y a eu un changement dans les priorités de la chimie des colloïdes. La direction principale était l'étude de l'état dispersé (colloïdal) des substances. Vers les années 1920. les problèmes fondamentaux de la chimie colloïdale sont conditionnellement divisés en trois groupes : composition, structure et propriétés des particules colloïdales ; interaction de particules avec un milieu dispersé ; interactions de contact des particules entre elles, conduisant à la formation de structures colloïdales. Au cours de cette période, les lois fondamentales de la chimie colloïdale ont été découvertes - la loi du mouvement brownien et de la diffusion des particules colloïdales (A. Einstein) , nature hétérogène des solutions colloïdales (R. Zsigmondy) , équilibre sédimentation-diffusion des dispersions dans le champ de pesanteur (J.Perrin) et dans une centrifugeuse (T. Svedberg) , diffusion de la lumière (J. Rayleigh) , coagulation des sols par les électrolytes (G. Schulze et V. Hardy) . Apparition dans la seconde moitié du XXe siècle. les méthodes à haute résolution d'étude de la structure des substances (RMN, microscopie électronique et à force atomique, simulation informatique, spectroscopie de corrélation de photons, etc.) ont permis de procéder à une étude systématique de la structure et des propriétés des systèmes colloïdaux. La définition moderne de cette science est la suivante : chimie des colloïdes- c'est la doctrine des propriétés et des transformations des substances à l'état dispersé et ultradispersé et des phénomènes de surface dans les systèmes dispersés. Les objets d'étude de la chimie des colloïdes ont une surface très développée et sont divers sols, suspensions, émulsions, mousses, films de surface, membranes et corps poreux, systèmes nanostructurés (nanotubes, films de Langmuir-Blodgett, matériaux composites hybrides organiques-inorganiques, nanocomposites) .
2. Principales caractéristiques des systèmes dispersés. Caractéristiques de l'état ultramicrohétérogène (nanoétat)
Systèmes dispersés formé de deux ou plusieurs phases avec une interface très développée entre elles, et au moins une des phases - phase dispersée– répartis sous forme de petites particules (cristaux, gouttes, bulles, etc.) dans une autre phase continue – milieu de dispersion. Des exemples sont les roches, les sols, les sols, la fumée, les nuages, les précipitations, les tissus végétaux et animaux, etc. La caractéristique la plus importante des systèmes dispersés est hétérogénéité. Une caractéristique des systèmes dispersés– une surface interfaciale très développée et, par conséquent, une énergie libre élevée ; par conséquent, les systèmes généralement dispersés (à l'exception des systèmes lyophiles) sont thermodynamiquement instables. Ils ont une capacité d'adsorption, une activité chimique et parfois biologique accrue. Les systèmes dispersés sont caractérisés par une augmentation de la surface avec une dispersion croissante et une augmentation du rôle des phénomènes de surface. Les systèmes dispersés se caractérisent par une très grande surface spécifique O phase dispersée.
O < K/dr,
où K est le coefficient sans dimension (pour les particules sphériques et cubiques K = 6); r est la densité de la phase dispersée.
D'autres paramètres thermodynamiques importants caractérisant les systèmes colloïdaux sont l'énergie de surface libre spécifique σ (tension de surface), l'entropie de surface h et adsorption spécifique g. Caractéristique importante systèmes dispersés réside dans le fait qu'une proportion importante de la masse totale et de l'énergie libre du système sont concentrées dans les couches superficielles interfaciales. La propriété associée à cette fonctionnalité est irreproductibilité(ou individualité) systèmes en relation avec la surface inégale des particules de la phase dispersée, qui ont des énergies de surface différentes même avec la même surface spécifique ; formation de structures associée à la tendance à l'instabilité thermodynamique. La propriété fondamentale des systèmes dispersés est leur capacité d'évolution progressive, qui est associée à la nature de l'état dispersé de la matière, principalement au non-équilibre thermodynamique. Un excès d'énergie libre, dû à la présence d'une interface très développée entre la phase dispersée et le milieu de dispersion, stimule l'apparition de divers processus (physiques, physico-chimiques), conduisant à une diminution de l'énergie libre de Helmholtz F. Un signe tel que labilité, est une conséquence de l'instabilité thermodynamique et d'une tendance à réduire l'énergie libre par la formation de structures moins dispersées. Caractéristique principale systèmes dispersés - tailles de particules (ou dispersion), qui est déterminé par le rapport de la surface totale de la surface interfaciale au volume de la phase dispersée. Sur cette base, grossièrement dispersé (faiblement dispersé) (les particules ont une taille de 10-4 cm et plus) et finement dispersé (hautement dispersé) (les particules ont une taille de 10-4 à 10-5-10-7 cm), ou des systèmes colloïdaux (colloïdes) . Le degré limite de dispersion, auquel le système colloïdal conserve la propriété principale - l'hétérogénéité, se situe dans la plage de 1 à 100 nm. Les particules ultrafines occupent une position intermédiaire entre les molécules (atomes, ions) et les corps macroscopiques (phases). La taille de la phase dispersée de la particule ré est proche du maximum possible, plus l'effet des effets d'échelle sera fort - la dépendance des propriétés à la taille des particules. Si pour les systèmes à degré de dispersion moyen, la tension superficielle s n'est déterminée que par la composition chimique, alors pour les nanosystèmes, il est déjà nécessaire de prendre en compte la dépendance de la tension superficielle à la taille des particules dispersées.
3. Différents types de classification des systèmes dispersés. Systèmes dispersés lyophiles et lyophobes
Systèmes dispersés hétérogène et se compose de deux phases, dont l'une (phase dispersée) sous forme de particules de différentes tailles réparties dans une autre phase - continue milieu de dispersion. Les systèmes dispersés sont classés principalement par la taille des particules de la phase dispersée (ou par le degré de dispersion). De plus, ils sont divisés en groupes qui diffèrent par la nature et l'état d'agrégation de la phase dispersée et du milieu de dispersion (ils peuvent être solides, liquides et gazeux), par leur structure et par la nature des interactions interfaciales. Si le milieu de dispersion est un liquide et que la phase dispersée est constituée de particules solides, le système est appelé une suspension ou une suspension ; si la phase dispersée est constituée de gouttelettes liquides, alors le système est appelé une émulsion. Parmi les systèmes dispersés, on distingue également les mousses (le gaz est dispersé dans les liquides), les aérosols (le liquide est dans le gaz) et les corps poreux (phase solide dans laquelle le gaz ou le liquide sont dispersés). En bref, le type d'un système dispersé, en fonction de l'état d'agrégation, s'écrit sous forme de fraction, où la phase dispersée est au numérateur et le milieu de dispersion est au dénominateur (par exemple, T / T (solide colloïdal solutions - minéraux, alliages), T/L (sols - suspensions), T/G (aérosols - poussières, fumées); L/T (corps poreux - gels), L/L (émulsions), L/G (aérosols - brouillards); G/T (systèmes poreux et capillaires), G/J (mousses - émulsions gazeuses)). Les systèmes G/G n'apparaissent généralement pas dans la classification, car la condition nécessaire à la formation d'un système dispersé est la solubilité limitée d'une substance dans un milieu.
La chimie colloïdale est la science des propriétés physicochimiques des systèmes dispersés et des phénomènes de surface.
Un système dispersé (DS) est un système dans lequel au moins une substance à l'état plus ou moins broyé (dispersé) est uniformément répartie dans la masse d'une autre substance. Le DS est hétérogène, il est composé d'au moins deux phases. La phase fragmentée est appelée phase dispersée. Un milieu continu dans lequel la phase dispersée est fragmentée est appelé milieu de dispersion. Une propriété caractéristique du DW est la présence d'une grande surface interfaciale. A cet égard, les propriétés de la surface, et non de l'ensemble des particules, sont déterminantes. Les DS sont caractérisés par des processus se produisant à la surface plutôt qu'à l'intérieur de la phase.
Phénomènes de surface et adsorption
Les phénomènes de surface sont des phénomènes qui se produisent à l'interface des phases des systèmes dispersés. Celles-ci incluent : la tension superficielle, le mouillage, l'adsorption, etc. Les processus techniques les plus importants sont basés sur des phénomènes de surface : purification de l'air et des eaux usées des impuretés nocives, enrichissement des minerais (flottation), soudage des métaux, nettoyage, lubrification, peinture des diverses surfaces, et bien d'autres.
Tension superficielle
Toute interface de phase a des propriétés spéciales qui diffèrent des propriétés des parties internes des phases adjacentes. Cela est dû au fait que les couches superficielles présentent un excès d'énergie libre. Considérons un système composé d'un liquide et d'un gaz (Fig. 1).
par molécule MAIS, situé à l'intérieur du liquide, les forces d'attraction mutuelle de toutes les molécules voisines qui l'entourent agissent. La résultante de ces forces est nulle. Pour une molécule À situé à la surface du liquide, toutes les forces d'attraction moléculaire ne seront pas compensées. Cela est dû au fait que dans un gaz les molécules sont éloignées les unes des autres, les forces d'attraction entre elles sont négligeables. Ainsi, les molécules À ne sont attirés que par le liquide. Pour eux, la résultante des forces d'attraction moléculaire n'est pas nulle et est dirigée profondément dans la phase liquide. Cette force est appelée Pression interne. Une telle pression a tendance à tirer toutes les molécules de la surface vers la profondeur du liquide. Sous cette pression, le fluide se contracte et se comporte comme s'il avait une "peau". Plus les interactions intermoléculaires dans les phases adjacentes diffèrent, plus la pression interne est élevée.
Afin de créer une nouvelle interface de phase, par exemple, pour étirer un liquide en un film, il faut travailler contre les forces de pression interne. Plus la pression interne est élevée, plus l'énergie nécessaire est importante. Cette énergie est concentrée dans des molécules situées à la surface, et s'appelle énergie de surface libre.
Le travail consacré à la formation de 1 cm 2 de l'interface de phase, ou l'énergie de surface libre qui lui est équivalente, est appelé tension superficielle et dénoter , J / m 2. Alors le stock d'énergie libre (F s) concentré sur l'interface (S) est égal à : F s = S. Par conséquent, plus la taille des particules est petite, plus la surface S est grande et plus énergie de surface libre ce système dispersé a par rapport aux corps massifs ordinaires.
Il est connu de la thermodynamique que condition d'équilibre stable du système est l'énergie libre minimale. À cet égard, les systèmes dispersés sont thermodynamiquement instables : en eux des processus spontanés ont lieu associée à une diminution de l'interface de phase due au grossissement des particules. Évidemment, l'état d'équilibre correspond stratification du système (par exemple, une émulsion se sépare en deux liquides, et une suspension en un liquide et un précipité). De plus, puisque la valeur tend vers un minimum, le liquide à l'état libre prend forme de sphère, (gouttes de liquide). Cela est dû au fait que la surface de la boule est minimale pour un volume de matière donné.
Le minimum de la valeur F s , c'est-à-dire l'état d'équilibre du système, peut également être atteint en tendant vers le minimum de la valeur . De cette façon, spontané dans les systèmes dispersés, il existe également des processus associés à une diminution de l'amplitude de la tension superficielle. Pour les solides , qui ne peuvent pas changer de forme aussi facilement que les liquides, l'énergie de surface libre F s peut diminuer une seule façon ─ en réduisant la tension superficielle . Cela se passe ainsi : les molécules se trouvant dans la couche superficielle sont capables d'attirer et parfois de retenir très fermement d'autres molécules de l'environnement entourant le solide. Ce phénomène est appelé adsorption.
La tension superficielle est influencée par :
1. La nature de la matière . Évaluer est déterminé par la structure de la phase condensée, c'est-à-dire la nature des forces agissant entre les particules. Plus la polarité des liaisons chimiques dans une substance est grande, plus les valeurs sont élevées caractéristique de cette substance. Parmi les liquides (à la frontière avec l'air), l'eau a la plus grande valeur. Des valeurs encore plus élevées sont observés dans les cristaux ioniques fondus et dans les métaux solides.
2.Température. Lorsque la température augmente, la valeur diminue, car le mouvement thermique des particules lors du chauffage affaiblit l'action des forces interparticulaires dans la substance.
3.Concentrations d'additifs. Évaluer dépend de la concentration des substances dissoutes dans le liquide d'essai. Il existe deux types de substances. Surface ─ substances inactives (SIS), en augmentant tension superficielle d'une solution par rapport à un solvant pur. Ceux-ci incluent la plupart des électrolytes forts.
Substances tensioactives (tensioactif), fortement abaissement tension superficielle de la solution résultante. Avec une augmentation de la concentration de tensioactif dans la solution, la valeur diminue fortement, car la substance est concentrée (sorbée) dans la couche superficielle de la solution et n'est pas répartie uniformément dans le volume de la solution. Dans les solutions aqueuses, les composés organiques polaires présentent une activité de surface ─ alcools, acides, sels, etc. Les molécules de ces composés comprennent simultanément des groupes polaires (O, OH, COOH, NH 2) et une chaîne hydrocarbonée non polaire. Schématiquement, une molécule de tensioactif est classiquement désignée comme suit : « O──── ». Un exemple typique de tensioactif est le sel de sodium de l'acide stéarique C 17 H 35 COONa (savon solide).
Sujet de chimie des colloïdes
Systèmes colloïdaux et sujet de la chimie des colloïdes
systèmes colloïdaux
Référence historique
Au départ, la chimie des colloïdes n'était que le chef de file de la chimie physique. Aujourd'hui, c'est une discipline indépendante avec sa propre gamme d'idées. Des méthodes de recherche colloïdo-chimiques spécifiques ont été développées : ultramicroscopie, microscopie électronique, ultracentrifugation, électrophorèse, etc. La pratique a montré la grande importance de la chimie des colloïdes pour la technologie moderne. Il est impossible de désigner une branche de l'économie nationale dans laquelle les systèmes colloïdaux et les procédés colloïdaux ne seraient pas utilisés. L'homme a affaire à des systèmes colloïdaux depuis des temps immémoriaux. Cependant, leur étude a commencé relativement récemment.
On pense généralement que le fondateur de la chimie des colloïdes est le scientifique anglais Thomas Graham (*) (1805-1869), qui a introduit les concepts de base de la chimie des colloïdes dans les années 50-60 du siècle dernier. Cependant, il ne faut pas oublier qu'il a eu des prédécesseurs, et surtout - Jacob Berzelius (*) et le chimiste italien Francesco Selmi (*) . Dans les années 30 du XIXe siècle, Berzelius décrit un certain nombre de précipités traversant le filtre lors du lavage (acides silicique et vanadique, chlorure d'argent, bleu de Prusse, etc.). Berzelius appelait ces précipités traversant le filtre « solutions », mais il signalait en même temps leur étroite affinité avec les émulsions et les suspensions, dont il connaissait bien les propriétés. Francesco Selmi a poursuivi ses travaux dans cette direction dans les années 1950, en recherchant les différences physico-chimiques entre les systèmes formés par les sédiments traversant un filtre (il les appelait "pseudo-solutions") et les vraies solutions ordinaires.
Le scientifique anglais Michael Faraday (*) en 1857 a synthétisé des solutions colloïdales d'or - une suspension d'Au dans l'eau avec des tailles de particules de 1 à 10 nm. et développé des méthodes pour leur stabilisation.
Ces «pseudo-solutions» diffusent la lumière, les substances qui y sont dissoutes précipitent lorsque de petites quantités de sels sont ajoutées, la transition d'une substance dans une solution et sa précipitation ne s'accompagnent pas d'un changement de température et de volume du système, ce qui est généralement observé lorsque des substances cristallines sont dissoutes.
Thomas Graham a développé ces idées sur la différence entre les "pseudo-solutions" et les vraies solutions et a introduit le concept de "colloïde". Graham a découvert que les substances capables de former des précipités gélatineux amorphes, telles que l'hydroxyde d'aluminium, l'albumine, la gélatine, diffusent dans l'eau à une vitesse lente par rapport aux substances cristallines (NaCl, saccharose). Dans le même temps, les substances cristallines traversent facilement les coquilles de parchemin en solution ("dialyse"), tandis que les substances gélatineuses ne traversent pas ces coquilles. Prenant la colle comme représentant typique des substances gélatineuses, non diffusantes et non dialysantes, Graham leur a donné le nom commun de "colloïde", c'est-à-dire semblable à de la colle (du mot grec colla - colle). Il a appelé les substances cristallines et les substances bonnes pour la diffusion et la dialyse "cristalloïdes".
Énumérons les propriétés anormales de certaines solutions, que nous appelons maintenant systèmes colloïdaux.
Propriétés des systèmes colloïdaux :
1. diffusion de la lumière (opalescence) (indique l'hétérogénéité, la nature multiphase du système).
L'opalescence devient particulièrement perceptible si, comme Tyndall l'a fait (*), un faisceau de rayons convergents est passé à travers une solution colloïdale, en plaçant une lentille entre la source lumineuse et la cuvette avec la solution. Dans ce cas, les solutions transparentes en lumière transmise présentent toutes les propriétés des milieux troubles en éclairage latéral. Dans un liquide colloïdal observé de côté, un cône lumineux brillant (cône de Tyndall) se forme.
2. diffusion lente
3. faible pression osmotique
(les points 2 et 3 indiquent la présence de grosses particules dans le système)
4. les solutions colloïdales sont capables de dialyse, c'est-à-dire peut être séparé des impuretés au moyen d'une membrane
5. capable de coagulation (destruction) du système lors de : ajout d'impuretés, changement de T, mélange, etc.
6. parfois ils découvrent le phénomène d'électrophorèse, découvert par Reiss (6) en Russie en 1808, c'est-à-dire les particules du système peuvent avoir une charge.
Pour imaginer ce que fait la science de la « chimie des colloïdes », il est nécessaire de répondre à la question, que sont les colloïdes ou les systèmes colloïdaux ?
Sujet de chimie des colloïdes
chimie des colloïdes – la science des phénomènes de surface et des systèmes dispersés.
À phénomènes de surface comprennent les processus se produisant à l'interface, dans la couche de surface interfaciale et résultant de l'interaction de phases conjuguées.
Rappeler que phase appelée partie d'un système thermodynamique qui possède certaines propriétés physiques et chimiques et est séparée des autres parties du système par une interface.
Dans les vraies solutions, la substance est fragmentée à un état moléculaire et il n'y a pas d'interface entre le soluté et le solvant.
Cause des phénomènes superficiels est l'existence à l'interface des phases de contact d'un champ insaturé de forces interatomiques et intermoléculaires, qui se produit en raison de la composition et de la structure différentes des phases de contact et des différences dans les liaisons de leurs atomes et molécules de surface.
Les couches superficielles de corps liquides et solides adjacentes à l'interface de phase diffèrent fortement par de nombreux paramètres physico-chimiques des propriétés des phases dans la profondeur de leur volume (énergie spécifique, densité, viscosité, conductivité électrique spécifique, etc.). Les différences sont également liées à une certaine orientation des molécules dans les couches superficielles et à leur état énergétique différent par rapport aux molécules dans la masse. De plus, dans les systèmes multicomposants (solutions), la composition de la couche de surface ne coïncide pas avec la composition des phases en vrac.
Les caractéristiques des couches superficielles sont dues à la présence d'un excès d'énergie de surface. Les propriétés de l'interface, plus l'effet sur le comportement du système dans son ensemble est fort, plus la surface (Ssp) est grande. Ceci explique le rôle prépondérant des phénomènes de surface dans les propriétés des systèmes très dispersés, dont la Ssp atteint des valeurs énormes.
La présence d'un excès d'énergie dans la couche superficielle des molécules est due à la compensation incomplète des forces d'attraction intermoléculaires des molécules de la couche superficielle du fait de leur faible interaction avec la phase adjacente.
études de chimie des colloïdes systèmes dispersés - systèmes hétérogènes constitués de deux phases ou plus, dont l'une phase dispersée - fragmenté (discontinu), et l'autre - milieu de dispersion - est une partie continue du système.
La position sur la nature microhétérogène des solutions colloïdales et autres systèmes dispersés est d'une importance fondamentale. Pour sa découverte, le scientifique autrichien Zsigmondy (*) a remporté le prix Nobel de chimie en 1925.
La séparation des particules dispersées en un groupe spécial est causée par leur différence de propriétés physiques et chimiques par rapport aux propriétés similaires de gros objets de la même substance. Ces propriétés comprennent la résistance, la capacité thermique, la Tm, les caractéristiques magnétiques et électriques et la réactivité.
Ces différences sont dues à des effets de taille. Des propriétés spéciales sont exprimées plus la taille des particules est petite, ce qui est particulièrement évident dans les nanoparticules. Ces propriétés ouvrent des applications pratiques fondamentalement nouvelles en chimie, physique et biologie. L'étude des propriétés des particules dispersées (méthodes de préparation, structure, physique et chimie) est l'une des tâches les plus urgentes et les plus prometteuses dans de nombreuses disciplines.
Les particules dispersées peuvent avoir une variété de formulaire : cylindrique, sphérique, rectangulaire, irrégulier. Par exemple, les particules dispersées comprennent :
systèmes avec des particules de forme cubique et sphérique - sols, émulsions, suspensions, pâtes;
filamenteux - fibres de cellules nerveuses, fibres musculaires bidimensionnelles, capillaires, pores (bois, tissus, cheveux, peau),
films - couches superficielles aux interfaces dans les émulsions, les mousses, dans les pores des catalyseurs et des adsorbants, les membranes.
Ainsi, 1 m 3 de la substance d'origine peut être broyé en cubes d'une longueur d'arête un, tirer dans un fil avec une section transversale un ou aplatir en une épaisseur de film un.
Si les particules ont une forme irrégulière, alors pour utiliser le concept de "taille transversale", leur forme est assimilée à une forme sphérique de diamètre équivalent.
Caractéristiques quantitatives du système dispersé:
1. Taille des particules d cf, d min , d max
2. Concentration de particules ν = n d /V, où n d est le nombre de particules de la phase dispersée par unité de volume du milieu de dispersion V
3. La fragmentation du système se caractérise par la dispersion ré et la valeur de la surface spécifique de la phase dispersée Ssp:
La première variante de l'évaluation quantitative - de base
J= 1/j et S bat \u003d S / V,(1.1)
où ré est la taille minimale des particules, S- surface interfaciale totale, V- volumes corporels.
La chimie colloïdale moderne est une science à l'intersection de la chimie, de la physique et de la biologie. La position interdisciplinaire particulière de la chimie des colloïdes est soulignée par le fait que dans la littérature de langue anglaise, le nom de "colloid science" est souvent utilisé (eng. science des colloïdes).
Histoire de la chimie des colloïdes
La chimie colloïdale en tant que science a une courte histoire, mais les propriétés des systèmes colloïdaux et des processus colloïdo-chimiques sont utilisées par l'homme depuis l'Antiquité. Ce sont, par exemple, des métiers tels que l'obtention de peintures, de céramiques, d'émaux, le filage du lin, du coton, de la laine, l'habillage du cuir.
À partir du XVIIIe siècle, des descriptions d'études individuelles sont apparues, plus tard incluses dans les sections correspondantes de la chimie des colloïdes. Ceux-ci incluent les travaux de M. V. Lomonosov sur la cristallisation, la production de verres colorés utilisant une dispersion métallique (1745-1755). Chez K. Scheele et F. Fontana, indépendamment l'un de l'autre, le phénomène d'adsorption des gaz par le charbon a été découvert. Dans T. E. Lovitz a découvert le phénomène d'adsorption à partir de solutions. P. Laplace dans la ville a reçu les premières relations quantitatives pour la pression capillaire. En 1808, F.F. Reiss, tout en menant des expériences avec l'élément Volta, découvrit les phénomènes d'électrophorèse et d'électroosmose.
L'une des premières études sur les systèmes colloïdaux a été réalisée par l'Italien F. Selmi en 1845. Il a étudié les systèmes que sont le chlorure d'argent, le soufre, le bleu de Prusse, répartis dans le volume d'eau. Ces systèmes obtenus par Selmi sont très similaires aux vraies solutions, cependant, Selmi croyait que ni les études qu'il a faites, ni d'autres substances similaires ne peuvent être dans l'eau sous la forme des mêmes petites particules que celles formées dans les vraies solutions, c'est-à-dire dans la forme de molécules individuelles ou d'ions.
Des opinions proches de Selmi ont été exprimées par K. Naegeli, qui croyait que dans de tels systèmes, les particules de soufre, de chlorure d'argent et d'autres substances sont des agrégats plus gros que les molécules individuelles. Pour les agrégats polymoléculaires, il a introduit le concept de "micelle". Pour distinguer les systèmes contenant des micelles des solutions, où le soluté se présente sous la forme de molécules individuelles, Naegeli a appelé les systèmes contenant des micelles "sols". Les termes "micelle", "sol" sont devenus généralement acceptés.
État actuel
Les principales directions de la chimie colloïdale moderne :
- Thermodynamique des phénomènes de surface.
- L'étude de l'adsorption des tensioactifs.
- Etude de la formation et de la stabilité des systèmes dispersés, de leurs propriétés moléculaires-cinétiques, optiques et électriques.
- Mécanique physique et chimique des structures dispersées.
- Développement de la théorie et des mécanismes moléculaires des processus se produisant dans des systèmes dispersés sous l'influence de tensioactifs, de charges électriques, d'effets mécaniques, etc.
Étant donné que l'état dispersé de la matière est universel et que les objets d'étude de la chimie colloïdale sont très divers, la chimie colloïdale est étroitement liée à la physique, la biologie, la géologie, la pédologie, la médecine, etc.
Il y a l'Institut de chimie des colloïdes et de chimie de l'eau. A. V. Dumansky NASU (Kyiv).
Le "Colloid Journal" scientifique est publié.
Littérature
- Manuel de chimie des surfaces et des colloïdes / Ed. KS Birdi. - 2e éd. - N.Y. : CRC Press, 2003. - 765 p.
- Ablesimov N. E. Synopsis of Chemistry: Reference and textbook on general chemistry - Khabarovsk: Publishing House of the Far Eastern State University of Railway Engineering, 2005. - 84 p.
- Ablesimov N.E. Combien y a-t-il de chimies dans le monde ? partie 1. // Chimie et vie - XXIe siècle. - 2009. - N° 5. - S. 49-52.
- Summ B. D. Fondamentaux de la chimie colloïdale : manuel. allocation pour les étudiants. plus haut cahier de texte institutions / B. D. Somm. - 2e éd., effacé. - M. : Centre d'édition "Académie", 2007. - 240 p.
- Encyclopédie chimique. - M. : "BRE", 1998.
- Friedrichsberg D. A. Cours de chimie des colloïdes. L. : Chimie, 1984. - 352 p.
- Zakharchenko V. N. Chimie des colloïdes : Proc. pour le biologiste médical. spécialiste. universités.-2e éd., révisée. et add.-M. : Vyssh.shk., 1989.-238 p. : ill.
Fondation Wikimédia. 2010 .
Voyez ce qu'est la "chimie des colloïdes" dans d'autres dictionnaires :
CHIMIE DES COLLOÏDES, étudie les systèmes dispersés avec un haut degré de fragmentation (taille des particules de 102 à 107 cm) et une surface énorme (par exemple, dans le charbon actif, la surface spécifique atteint des milliers de m2 / g), ce qui les détermine ... ... Encyclopédie moderne
Grand dictionnaire encyclopédique
chimie des colloïdes- - une branche de la chimie qui a pour objet des systèmes hautement dispersés et des systèmes qui y circulent. Dictionnaire de Chimie Analytique... Termes chimiques
CHIMIE DES COLLOÏDES- la science qui étudie la physique chim. propriétés des systèmes dispersés et de certains produits de haut poids moléculaire, ainsi que des phénomènes physiques de surface. chim. processus se produisant à l'interface (voir) ... Grande Encyclopédie Polytechnique
Nom traditionnel de la chimie physique des systèmes dispersés (Voir Systèmes dispersés) et des phénomènes de surface (Voir Phénomènes de surface). K.x. en tant que science indépendante est née dans les années 60 du 19ème siècle. Depuis lors, son sujet et ses méthodes ont été considérablement ... ... Grande Encyclopédie soviétique
Terme chimie des colloïdes Terme anglais chimie des colloïdes Synonymes science des colloïdes Abréviations Termes associés adhésion, adsorption, double couche électrique, dispersion, sol, solution colloïdale, concentration critique… … Dictionnaire encyclopédique des nanotechnologies
Domaine de la chimie qui étudie les systèmes dispersés et les phénomènes de surface qui se produisent à l'interface. Étant donné que les particules de la phase dispersée et le milieu de dispersion qui les entoure ont une très grande surface de séparation de phase (dans les systèmes hautement dispersés ... ... Encyclopédie chimique
Le nom traditionnel de la science des systèmes dispersés et des phénomènes de surface. Il étudie des processus et des phénomènes tels que l'adhésion, l'adsorption, le mouillage, la coagulation, l'électrophorèse. Développe les principes scientifiques de la technologie des matériaux de construction, du forage… Dictionnaire encyclopédique
chimie des colloïdes- koloidų chemija statusas T sritis chemija apibrėžtis Dispersinių sistemų ir paviršinių reiškinių chemija. atitikmenys : angl. chimie des colloïdes. chimie colloïdale... Chemijos terminų aiskinamasis žodynas
La science des phénomènes de surface et des systèmes dispersés. Toute la nature - la croûte terrestre et le sous-sol, l'atmosphère et l'hydrosphère, les organismes animaux et végétaux - est un ensemble complexe de divers systèmes dispersés. L'universalité de l'état dispersé détermine ... ... Grand dictionnaire polytechnique encyclopédique
Livres
- chimie colloïdale. Physico-chimie des systèmes dispersés. Manuel pour les étudiants des établissements d'enseignement professionnel supérieur. Vautour du ministère de la Défense de la Fédération de Russie, Ershov Yuri Alekseevich. Le manuel présente les bases de la physico-chimie des systèmes dispersés (chimie colloïdale) conformément au programme approximatif de la discipline "Chimie physique et colloïdale" pour la spécialité 060301 ...