Comment se déroule le processus d’évaporation de l’eau ? Évaporation - écrivez à Antoshka
Lire aussi
> Évaporation
Évaporation et vaporisation dans les liquides : transformation solides en liquide et en gaz, comment se produit l'évaporation, la vitesse de mouvement des molécules et énergie cinétique.
Évaporation– un processus permettant aux molécules d’un liquide de gagner suffisamment d’énergie pour se transformer en gaz.
Objectif d'apprentissage
- Identifiez les causes de l’évaporation près de la surface du liquide.
Points principaux
- L'évaporation transforme le liquide en gaz.
- L'évaporation se produit à des températures inférieures au point d'ébullition, car les molécules du liquide ont des énergies différentes.
- Lorsque des molécules dans un liquide entrent en collision, certaines deviennent grande quantitéénergie et éclata. Cela réduit l'énergie des molécules restantes et provoque un refroidissement des liquides qui s'évaporent.
Terme
- La vaporisation est la transformation d'un solide ou d'un liquide en gaz.
Qu’est-ce que l’évaporation et pourquoi se produit-elle ? L'évaporation est un type de transformation liquide qui se produit à la surface. Généralement, les molécules contenues dans un verre d’eau n’ont pas assez d’énergie pour s’échapper du liquide. Mais si le chauffage nécessaire est présent, le liquide se transforme rapidement en vapeur.
Lors de l’impact, les molécules se transfèrent de l’énergie. Parfois, cela se produit dans une seule direction et la molécule parvient à s'échapper. Les trois conditions d'évaporation sont la chaleur, la pression atmosphérique et le mouvement de l'air. Pour que les molécules liquides s’évaporent, elles doivent être aussi proches que possible de la surface, se déplacer dans la bonne direction et disposer d’une énergie cinétique suffisante pour vaincre les forces intermoléculaires. Si un petit nombre de molécules répondent à ces critères, alors le taux d'évaporation est faible.
Lorsque les molécules accélèrent, les autres ont une énergie cinétique moyenne inférieure et la température du liquide baisse. Ce processus est appelé refroidissement par évaporation. L’évaporation de la sueur refroidit donc notre corps. Avec plus vitesses élevées l'évaporation s'accélère également.
(a) – En raison de la répartition des vitesses et de certaines énergies cinétiques, une certaine partie des molécules a la possibilité de s'échapper de l'état de vapeur même à des températures inférieures au point d'ébullition. (b) – Si le récipient est scellé, l'évaporation se poursuivra jusqu'à ce que la densité du condensat atteigne un taux de condensation égal au taux d'évaporation. La densité de vapeur et la pression proportionnelle créée sont les valeurs de saturation. Ils augmentent avec la température et n'ont aucun lien avec d'autres gaz (air). Ils ne peuvent être affectés que par la pression de vapeur de l'eau
Le processus d’évaporation du liquide joue un rôle important dans le cycle de l’eau. Le soleil stimule l'évaporation de l'eau des océans, des mers, des lacs, du sol et d'autres sources. En hydrologie, l'évaporation et la transpiration sont combinées en évapotranspiration. L'eau s'évapore lorsque la surface survit à l'impact et permet aux molécules de se détacher, créant ainsi de la vapeur d'eau. Il est capable de s'élever et de former des nuages.
À n’importe quelle température, certaines molécules s’envolent de la surface du liquide, formant de la vapeur au-dessus. Le processus de transfert de matière de état liquide gazeux s'appelle vaporisation. La formation de vapeur qui se produit à n’importe quelle température à partir de la surface ouverte d’un liquide est appelée évaporation. Sa vitesse dépend du type de liquide, de la taille de sa surface libre, de la température, de la pression extérieure et de la présence d'un flux d'air au-dessus du liquide, entraînant de la vapeur.
L'élimination de molécules de la surface d'un liquide lors de l'évaporation est associée à des coûts énergie interne sur le travail de travail A dans lequel la molécule doit effectuer pour vaincre les forces d'attraction moléculaire et les forces de pression externes. Ce travail est effectué grâce à l’énergie cinétique des molécules. Une molécule ne quittera le liquide que si son énergie cinétique est égale ou supérieure au travail de sortie : (m est la masse de la molécule, v est la composante de la vitesse de la molécule dirigée perpendiculairement à la surface du liquide). Lors de la vaporisation, le liquide se refroidit, puisque les molécules émises emportent une partie de son énergie interne.
Pour qu’un liquide s’évapore sans changer sa température, de l’énergie doit être fournie au liquide. Une quantité scalaire mesurée par la quantité d'énergie nécessaire pour convertir une unité de masse de liquide en vapeur à une température constante est appelée chaleur spécifique vaporisation.
Pour convertir une unité de masse de liquide en vapeur à température constante, on lui donne une quantité de chaleur égale à la chaleur spécifique de vaporisation. Lors de la vaporisation, le volume de la substance augmente. Ainsi, la vapeur d'eau à 100°C occupe un volume près de 1 700 fois supérieur au volume de la même masse d'eau à 100°C. Par conséquent, lorsqu'une substance s'évapore, une partie de la chaleur spécifique de vaporisation est dépensée pour travailler contre la vapeur d'eau. force de pression externe, et partie sur son augmentation énergie potentielle interne. Par conséquent, à la même température, l’énergie interne d’une unité de masse d’une substance à l’état gazeux est supérieure à celle à l’état liquide. Donc, 1 kg la vapeur d'eau à 100°C a allumé 2*10 6j plus d'énergie interne que 1 kg eau à la même température.
Des expériences ont montré que la chaleur spécifique de vaporisation d'une substance dépend de sa température. Plus la température d’une substance est élevée, plus sa chaleur spécifique de vaporisation est faible. Par exemple, à 0°C, la chaleur spécifique de vaporisation de l'eau est 2499 kJ/kg, à 50°C - 2385 kJ/kg,à 100°C - 2257 kJ/kg,à 200°C - 1943 kJ/kg. La diminution de la chaleur de vaporisation s'explique par le fait que plus la température d'une substance est élevée, plus l'énergie cinétique de ses molécules est grande et moins il faut en outre transmettre d'énergie au liquide pour que ses molécules s'envolent dans le environnement.
Nom de la chaleur spécifique de vaporisation r kg/j. Transformer m kg La transformation d'une masse de liquide en vapeur nécessite une certaine quantité d'énergie, notamment de chaleur. Q = RM.
Supposons qu'un liquide s'évapore dans un récipient fermé. En raison du mouvement thermique, une partie des molécules de vapeur, s'approchant de la surface du liquide, y retourne. Dans un récipient fermé, le processus d'évaporation et le processus de condensation se produisent simultanément. Si le nombre de molécules quittant le liquide est supérieur au nombre de molécules qui y reviennent, alors la vapeur au-dessus du liquide est appelée. insaturé. Des expériences avec des vapeurs insaturées ont montré qu'elles obéissent aux lois des gaz.
Dans le processus d'évaporation et de condensation, arrive un moment où le nombre de molécules sortant du liquide par unité de temps sera égal au nombre de molécules retournant au liquide, c'est-à-dire qu'un équilibre dynamique se produira entre le liquide et la vapeur. La vapeur qui est en équilibre dynamique avec son liquide est appelée vapeur saturée. Il peut être saturé non seulement dans un récipient fermé, mais aussi dans l'atmosphère. Ainsi, lors d'un brouillard, la vapeur d'eau présente dans l'air est saturée.

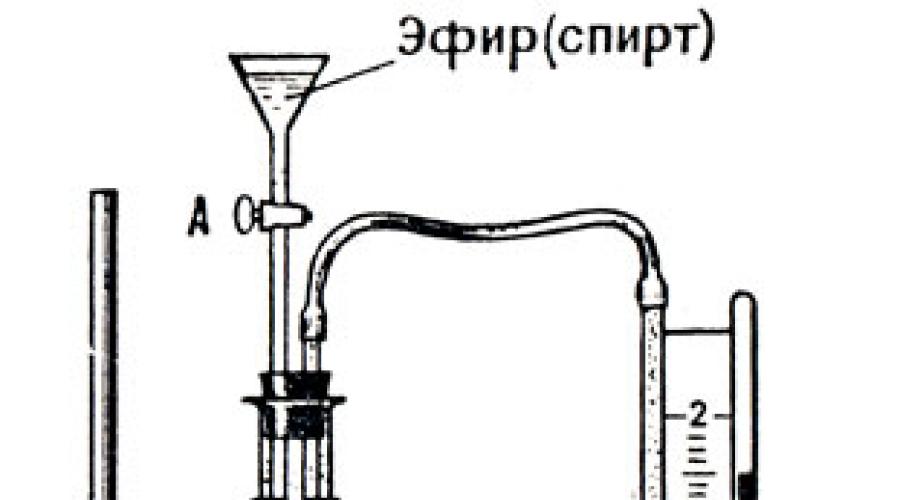
Ouvrons le robinet A (Fig. 35) et versons quelques gouttes d'éther dans le ballon, qui s'évapore en formant de la vapeur insaturée. Plus nous laissons d’éther dans le ballon, plus la pression de sa vapeur insaturée augmente. On laisse entrer l'éther jusqu'à ce qu'il y ait un peu d'éther liquide au fond du ballon. L'apparition de ce dernier indique que les vapeurs d'éther sont devenues saturées. À partir de ce moment, le manomètre cesse d'indiquer une augmentation de la pression - elle est devenue constante, malgré l'ajout ultérieur d'éther. Ainsi, la pression et la densité de la vapeur à une température donnée sont plus élevées lorsque la vapeur est saturée.
Si différents liquides sont placés alternativement dans un ballon et que la pression de leurs vapeurs saturées est mesurée, il s'avère que à la même température, la pression de vapeur saturée des différents liquides est différente. La vapeur d'éther a la pression la plus élevée, la vapeur d'alcool a la pression la plus faible et la vapeur d'eau a encore moins de pression.
A une température de 20°C, la pression de vapeur saturée de ces liquides est égale à (en mmHg) :

Voyons si la pression de la vapeur saturée à température constante dépend de son volume. Sous le piston d'un cylindre relié à un manomètre, se trouvent du liquide et sa vapeur saturée (Fig. 36). En changeant son volume en déplaçant le piston vers le haut puis vers le bas, selon la lecture du manomètre on voit que à température constante, la pression de vapeur saturée ne dépend pas du volume, et à une température donnée pour un liquide donné c'est une valeur constante. Cela signifie que les paires saturées n'obéissent pas à la loi de Boyle-Marriott. Oui, manomètre chaudière à vapeurà une température donnée, il affiche toujours la même pression, quel que soit le volume qu'y occupe la vapeur saturée.

Cela s'explique par le fait que lorsque le volume de vapeur saturée change, sa masse change. À mesure que le volume augmente, la masse de vapeur augmente (une évaporation supplémentaire du liquide se produit) ; lorsque le volume diminue, la masse de vapeur diminue (une partie se condense).
Voyons si, à volume constant, la pression de la vapeur saturée dépend de sa température. Chauffeons la vapeur saturée dans le ballon (voir Fig. 35) en la plaçant dans l'eau chaude. Nous voyons À mesure que la température augmente, la pression de vapeur saturée augmente. Par exemple, la pression de vapeur saturée de l’eau à 50°C est 92,5 mmHg. Art., et à 100°C - 760 mmHg Art.
Des expériences et des calculs sur la variation de la pression de vapeur saturée due au chauffage montrent que la pression augmente plusieurs fois plus qu'elle ne le devrait selon la loi de Charles, c'est-à-dire que la dépendance de la pression sur la température n'obéit pas à cette loi. Ceci s'explique par le fait que la pression de la vapeur saturée augmente lorsqu'elle est chauffée, d'une part, en raison d'une augmentation de l'énergie cinétique moyenne des molécules de cette vapeur et, d'autre part, en raison d'une augmentation de la concentration des molécules de vapeur, c'est-à-dire une augmentation de la masse totale des molécules.
Tant que la vapeur reste saturée, une modification de sa température ou de son volume s'accompagne toujours d'une modification de la masse de la vapeur, c'est-à-dire vaporisation ou condensation.
La propriété de la vapeur d'eau saturée d'augmenter sa pression avec l'augmentation de la température est utilisée dans chaudières à vapeur pour produire de la vapeur à haute pression, par exemple 100 atm, au point d'ébullition de l'eau 310°C. Pour utiliser la vapeur dans les machines à vapeur, elle est retirée de la chaudière, chauffée et transformée en vapeur insaturée. Une telle paire s'appelle surchauffé, il dispose d'une grande réserve d'énergie interne. Si la vapeur n’est pas surchauffée, elle contient des gouttelettes de liquide.
Après avoir reçu de la vapeur d'éther dans un tube à essai, on commence à la refroidir en la plaçant dans un mélange de glace et de sel. Une couche d'éther liquide apparaît sur les parois du tube à essai, car lors du refroidissement, ses vapeurs se sont transformées en liquide. Il existe deux manières de transformer la vapeur en liquide : augmenter la pression sur la vapeur, la comprimer (voir Fig. 36) et abaisser la température de la vapeur, la refroidir. Des expériences montrent que les gaz peuvent également être transformés en liquides (liquéfaction des gaz). Pour ce faire, ils doivent être simultanément compressés et refroidis jusqu'à ce qu'ils se transforment en liquide.
Si vous laissez un récipient d'eau découvert, l'eau s'évaporera au bout d'un moment. Si vous faites la même expérience avec de l'alcool éthylique ou de l'essence, le processus est un peu plus rapide. Si vous faites chauffer une casserole d’eau sur un brûleur suffisamment puissant, l’eau bout.
Tous ces phénomènes sont un cas particulier de vaporisation, de transformation d'un liquide en vapeur. Il existe deux types de vaporisationévaporation et ébullition.
Qu'est-ce que l'évaporation
L'évaporation est la formation de vapeur à la surface d'un liquide. L'évaporation peut s'expliquer comme suit.
Lors des collisions, les vitesses des molécules changent. Il existe souvent des molécules dont la vitesse est si élevée qu'elles surmontent l'attraction des molécules voisines et se détachent de la surface du liquide. (Structure moléculaire de la matière). Étant donné que même dans un petit volume de liquide, il y a beaucoup de molécules, de tels cas se produisent assez souvent et il existe un processus d'évaporation constant.
Les molécules séparées de la surface du liquide forment de la vapeur au-dessus de celui-ci. Certains d'entre eux, en raison d'un mouvement chaotique, retournent dans le liquide. Par conséquent, l'évaporation se produit plus rapidement s'il y a du vent, car il éloigne la vapeur du liquide (ici se produit également le phénomène de « capture » et de séparation des molécules de la surface du liquide par le vent).
Ainsi, dans un récipient fermé, l'évaporation s'arrête rapidement : le nombre de molécules qui « se détachent » par unité de temps devient égal au nombre de molécules qui « reviennent » dans le liquide.
Taux d'évaporation dépend du type de liquide : moins il y a d'attraction entre les molécules du liquide, plus l'évaporation est intense.
Plus la surface d’un liquide est grande, plus les molécules ont la possibilité d’en sortir. Cela signifie que l'intensité de l'évaporation dépend de la surface du liquide.
À mesure que la température augmente, la vitesse des molécules augmente. Ainsi, plus la température est élevée, plus l’évaporation est intense.
Qu'est-ce qui bout
L'ébullition est une vaporisation intense qui résulte du chauffage d'un liquide, de la formation de bulles de vapeur à l'intérieur, flottant à la surface et y éclatant.
Lors de l'ébullition, la température du liquide reste constante.
Le point d'ébullition est la température à laquelle bout un liquide. Habituellement, lorsque nous parlons du point d'ébullition d'un liquide donné, nous entendons la température à laquelle ce liquide bout à pression atmosphérique normale.
Lors de la vaporisation, les molécules séparées du liquide lui enlèvent une partie de son énergie interne. Par conséquent, à mesure que le liquide s’évapore, il se refroidit.
Chaleur spécifique de vaporisation
Une grandeur physique caractérisant la quantité de chaleur nécessaire pour évaporer une unité de masse d’une substance est appelée chaleur spécifique de vaporisation. (suivez le lien pour en savoir plus analyse détaillée ce sujet)
Dans le système SI, l’unité de mesure de cette quantité est le J/kg. Il est désigné par la lettre L.
L'évaporation d'un liquide se produit à n'importe quelle température et plus la température est rapide, plus la surface libre du liquide qui s'évapore est grande et plus les vapeurs formées au-dessus du liquide sont éliminées rapidement.
A une certaine température, selon la nature du liquide et la pression sous laquelle il se trouve, la vaporisation commence dans toute la masse du liquide. Ce processus est appelé ébullition.
Il s'agit d'un processus de vaporisation intense non seulement à partir de la surface libre, mais également dans le volume du liquide. Des bulles remplies de vapeur saturée se forment dans le volume. Ils s'élèvent sous l'action de la poussée d'Archimède et éclatent à la surface. Les centres de leur formation sont de minuscules bulles de gaz étrangers ou de particules d'impuretés diverses.
Si la bulle a des dimensions de l'ordre de plusieurs millimètres ou plus, alors le deuxième terme peut être négligé et, par conséquent, pour les grosses bulles à pression externe constante, le liquide bout lorsque la pression de vapeur saturée dans les bulles devient égale à la pression externe. .
À la suite d'un mouvement chaotique au-dessus de la surface du liquide, la molécule de vapeur, tombant dans la sphère d'action des forces moléculaires, retourne dans le liquide. Ce processus est appelé condensation.
Évaporation et ébullition

L'évaporation et l'ébullition sont deux façons par lesquelles un liquide peut se transformer en gaz (vapeur). Le processus d’une telle transition est appelé vaporisation. Autrement dit, l’évaporation et l’ébullition sont des méthodes de vaporisation. Il existe des différences significatives entre ces deux méthodes.
L'évaporation se produit uniquement à la surface du liquide. C’est le résultat du fait que les molécules de tout liquide sont constamment en mouvement. De plus, la vitesse des molécules est différente. Des molécules ayant une vitesse suffisamment élevée, une fois à la surface, peuvent vaincre la force d'attraction d'autres molécules et se retrouver dans l'air. Les molécules d'eau, individuellement dans l'air, forment de la vapeur. Il est impossible de voir les couples à travers leurs yeux. Ce que nous considérons comme du brouillard d’eau est déjà le résultat de la condensation (le processus opposé à la vaporisation), lorsque, une fois refroidie, la vapeur s’accumule sous forme de minuscules gouttelettes.
En raison de l’évaporation, le liquide lui-même se refroidit à mesure que les molécules les plus rapides le quittent. Comme vous le savez, la température est précisément déterminée par la vitesse de déplacement des molécules d'une substance, c'est-à-dire leur énergie cinétique.
Le taux d'évaporation dépend de nombreux facteurs. Tout d’abord, cela dépend de la température du liquide. Plus la température est élevée, plus l’évaporation est rapide. Cela est compréhensible, car les molécules se déplacent plus rapidement, ce qui signifie qu'il leur est plus facile de s'échapper de la surface. Le taux d'évaporation dépend de la substance. Dans certaines substances, les molécules sont attirées plus fortement et il leur est donc plus difficile de s'envoler, tandis que dans d'autres, elles sont plus faibles et sortent donc du liquide plus facilement. L'évaporation dépend également de la surface, de la saturation de l'air en vapeur et du vent.
La chose la plus importante qui distingue l'évaporation de l'ébullition est que l'évaporation se produit à n'importe quelle température et qu'elle se produit uniquement à partir de la surface du liquide.
Contrairement à l’évaporation, l’ébullition ne se produit qu’à une certaine température. Chaque substance à l’état liquide a son propre point d’ébullition. Par exemple, l’eau à pression atmosphérique normale bout à 100 °C et l’alcool à 78 °C. Cependant, avec une diminution pression atmosphérique Le point d'ébullition de toutes les substances diminue légèrement.
Lorsque l'eau bout, l'air qui y est dissous est libéré. Étant donné que le récipient est généralement chauffé par le bas, la température dans les couches d'eau inférieures est plus élevée et des bulles s'y forment d'abord. L'eau s'évapore dans ces bulles et celles-ci se saturent de vapeur d'eau.
Comme les bulles sont plus légères que l’eau elle-même, elles montent vers le haut. Du fait que les couches supérieures d'eau ne se sont pas réchauffées jusqu'au point d'ébullition, les bulles se refroidissent et la vapeur qu'elles contiennent se condense à nouveau en eau, les bulles deviennent plus lourdes et coulent à nouveau.
Lorsque toutes les couches de liquide sont portées à ébullition, les bulles ne descendent plus, mais remontent à la surface et éclatent. Leur vapeur se retrouve dans l'air. Ainsi, lors de l'ébullition, le processus de vaporisation ne se produit pas à la surface du liquide, mais dans toute son épaisseur dans les bulles d'air qui se forment. Contrairement à l’évaporation, l’ébullition n’est possible qu’à une certaine température.
Il faut comprendre que lorsqu'un liquide bout, une évaporation normale de sa surface se produit également.
Qu'est-ce qui détermine le taux d'évaporation du liquide ?

Une mesure du taux d’évaporation est la quantité de substance s’échappant par unité de temps d’une unité de surface libre du liquide. Physicien et chimiste anglais D. Dalton en début XIX V. a constaté que le taux d'évaporation est proportionnel à la différence entre la pression de la vapeur saturée à la température du liquide qui s'évapore et la pression réelle de la vapeur réelle qui existe au-dessus du liquide. Si le liquide et la vapeur sont en équilibre, alors le taux d’évaporation est nul. Plus précisément, cela se produit, mais le processus inverse se produit également à la même vitesse - condensation(transition d'une substance d'un état gazeux ou vaporeux à un liquide). Le taux d'évaporation dépend également du fait qu'elle se produise dans une atmosphère calme ou en mouvement ; sa vitesse augmente si la vapeur résultante est soufflée par un courant d'air ou pompée par une pompe.
Si l'évaporation se produit à partir d'une solution liquide, différentes substances s'évaporent avec à des vitesses différentes. Le taux d'évaporation d'une substance donnée diminue avec l'augmentation de la pression des gaz étrangers, comme l'air. Par conséquent, l’évaporation dans le vide se produit à la vitesse la plus élevée. Au contraire, en ajoutant une substance étrangère dans le récipient, gaz inerte, vous pouvez ralentir considérablement l’évaporation.
Parfois, l'évaporation est aussi appelée sublimation, ou sublimation, c'est-à-dire la transition d'un solide à l'état gazeux. Presque tous leurs modèles sont vraiment similaires. La chaleur de sublimation est supérieure à la chaleur d’évaporation d’environ la chaleur de fusion.
Ainsi, le taux d'évaporation dépend de :
- Une sorte de liquide. Le liquide dont les molécules s’attirent avec moins de force s’évapore plus rapidement. En effet, dans ce cas, un plus grand nombre de molécules peuvent vaincre l'attraction et s'envoler hors du liquide.
- L'évaporation se produit d'autant plus rapidement que la température du liquide est élevée. Plus la température d'un liquide est élevée, plus il contient de molécules à déplacement rapide qui peuvent vaincre les forces d'attraction des molécules environnantes et s'éloigner de la surface du liquide.
- Le taux d'évaporation d'un liquide dépend de sa surface. Cette raison s'explique par le fait que le liquide s'évapore de la surface et que plus la surface du liquide est grande, plus le nombre de molécules volant simultanément dans l'air est élevé.
- L'évaporation du liquide se produit plus rapidement avec le vent. Simultanément à la transition des molécules du liquide à la vapeur, le processus inverse se produit également. En se déplaçant de manière aléatoire à la surface du liquide, certaines des molécules qui l'ont quitté y retournent. Par conséquent, la masse du liquide dans un récipient fermé ne change pas, bien que le liquide continue de s'évaporer.
conclusions

On dit que l'eau s'évapore. Mais qu'est-ce que ça veut dire? L'évaporation est le processus par lequel un liquide présent dans l'air devient rapidement un gaz ou une vapeur. De nombreux liquides s’évaporent très rapidement, bien plus vite que l’eau. Ceci s'applique à l'alcool, à l'essence, ammoniac. Certains liquides, comme le mercure, s'évaporent très lentement.
Qu’est-ce qui cause l’évaporation ? Pour comprendre cela, vous devez comprendre quelque chose sur la nature de la matière. À notre connaissance, toute substance est constituée de molécules. Deux forces agissent sur ces molécules. L’un d’eux est la cohésion, qui les attire les uns vers les autres. L’autre est le mouvement thermique des molécules individuelles, qui les fait se séparer.
Si la force d’adhérence est plus élevée, la substance reste à l’état solide. Si le mouvement thermique est si fort qu’il dépasse la cohésion, alors la substance devient ou est un gaz. Si les deux forces sont à peu près équilibrées, alors nous avons un liquide.
L’eau est bien entendu un liquide. Mais à la surface d’un liquide se trouvent des molécules qui se déplacent si vite qu’elles surmontent la force d’adhésion et s’envolent dans l’espace. Le processus de sortie des molécules est appelé évaporation.
Pourquoi l’eau s’évapore-t-elle plus rapidement lorsqu’elle est exposée au soleil ou réchauffée ? Plus la température est élevée, plus le mouvement thermique dans le liquide est intense. Cela signifie que de plus en plus de molécules gagnent suffisamment de vitesse pour s'envoler. À mesure que les molécules les plus rapides s’envolent, la vitesse des molécules restantes ralentit en moyenne. Pourquoi le liquide restant refroidit-il par évaporation ?
Ainsi, lorsque l’eau s’assèche, cela signifie qu’elle s’est transformée en gaz ou en vapeur et qu’elle fait désormais partie de l’air.
élève de la classe 9B Chernyshova Kristina MBOU de l'école secondaire n°27 de Stavropol.
Sujet de ceci travail de recherche- étude de la dépendance du taux d'évaporation sur divers conditions extérieures. Ce problème reste d'actualité dans divers domaines technologiques et dans la nature qui nous entoure. Il suffit de dire que le cycle de l’eau dans la nature se déroule à travers les phases d’évaporation et de condensation volumétrique. Le cycle de l'eau, à son tour, détermine des phénomènes aussi importants que l'influence solaire sur la planète ou simplement l'existence normale des êtres vivants en général.
Hypothèse: le taux d'évaporation dépend du type de substance, de la surface du liquide et de la température de l'air, de la présence de mouvements flux d'air au-dessus de sa surface.
Télécharger:
Aperçu:
INSTITUTION D'ENSEIGNEMENT BUDGÉTAIRE MUNICIPAL
ÉCOLE SECONDAIRE N°27
Travail de recherche:
"L'évaporation et les facteurs influençant ce processus"
Complété par : élève de 9B
Tchernychova Kristina.
Enseignant : Vetrova L.I.
Stavropol
2013
I.Introduction…………………………………………………………………………………....…….3
II Partie théorique……………………………………………………….4
1. Principes de base de la théorie de la cinétique moléculaire…………………4
2. Température………………………………………………………..………...6
3. Caractéristiques de l'état liquide d'une substance…………………………….....7
4. Énergie interne…………………………………………………….……..8
5. Évaporation………………………………………………………………………………..10
III.Partie recherche……………………………..…………………..14
IV.Conclusion……………………………………………………………………………….…..21
V. Littérature……………………………………………………………………………….22
Introduction
Le sujet de ce travail de recherche est d'étudier la dépendance du taux d'évaporation à diverses conditions externes. Ce problème reste d'actualité dans divers domaines technologiques et dans la nature qui nous entoure. Il suffit de dire que le cycle de l’eau dans la nature se déroule à travers les phases d’évaporation et de condensation volumétrique. Le cycle de l'eau, à son tour, détermine des phénomènes aussi importants que l'influence solaire sur la planète ou simplement l'existence normale des êtres vivants en général.
L'évaporation est largement utilisée dans pratique industrielle pour la purification de substances, le séchage de matériaux, la séparation de mélanges liquides, la climatisation. Le refroidissement par évaporation l'eau est utilisée dans les systèmes d'approvisionnement en eau de circulation des entreprises.
Dans les moteurs à carburateur et diesel, la distribution granulométrique des particules de carburant détermine leur taux de combustion, et donc le processus de fonctionnement du moteur. Les brouillards de condensation forment non seulement de la vapeur d'eau lors de la combustion de divers carburants, mais de nombreux noyaux de condensation se forment, qui peuvent servir de centres de condensation pour d'autres vapeurs. Ces processus complexes déterminent le coefficient action utile moteurs et perte de carburant. Réalisation meilleurs résultats dans l'étude de ces phénomènes pourrait servir d'information pour le mouvement Le progrès technique dans notre pays.
Donc , le but de ce travail- étudier la dépendance du taux d'évaporation sur divers facteurs environnement et, grâce à des graphiques et à une observation minutieuse, remarquez des modèles.
Hypothèse : le taux d'évaporation dépend du type de substance, de la surface du liquide et de la température de l'air, de la présence de courants d'air en mouvement au-dessus de sa surface.
Lors de la réalisation de la recherche, nous avons utilisé divers instruments simples, tels qu'un thermomètre, ainsi que des ressources Internet et d'autres documents.
II Partie théorique.
1. Principes de base de la théorie de la cinétique moléculaire
Les propriétés des substances présentes dans la nature et la technologie sont diverses et variées : le verre est transparent et fragile, l'acier est élastique et opaque, le cuivre et l'argent sont bons guides la chaleur et l'électricité, mais la porcelaine et la soie sont mauvaises, etc.
A quoi ça ressemble structure interne une substance ? Est-il solide (continu) ou a-t-il une structure granulaire (discrète), semblable à la structure d'un tas de sable ?
La question de la structure de la matière a été soulevée dès La Grèce ancienne, cependant, le manque de données expérimentales a rendu sa solution impossible, et pendant longtemps(sur deux mille ans), il n'a pas été possible de vérifier les brillantes suppositions sur la structure de la matière exprimées par penseurs grecs anciens Leucippe et Démocrite (460-370 av. J.-C.), qui ont enseigné que tout dans la nature est constitué d'atomes en mouvement continu. Leur enseignement fut ensuite oublié et au Moyen Âge, la matière était déjà considérée comme continue, et les changements et les états des corps étaient expliqués à l'aide de liquides en apesanteur, dont chacun personnifiait une certaine propriété de la matière et pouvait à la fois entrer et sortir du corps. . Par exemple, on croyait que l'ajout de calories à un corps le faisait chauffer, au contraire, le refroidissement du corps se produisait en raison du flux calorique, etc.
DANS milieu du XVIIe siècle V. Le scientifique français P. Gassendi (1592-1655) est revenu sur les vues de Démocrite. Il croyait qu’il existe des substances dans la nature qui ne peuvent être décomposées en composants plus simples. De telles substances sont désormais appelées éléments chimiques, par exemple l'hydrogène, l'oxygène, le cuivre, etc. Selon Gassendi, chaque élément est constitué d'atomes d'un certain type.
Il existe relativement peu d'éléments différents dans la nature, mais leurs atomes, se combinant en groupes (parmi eux il peut y avoir des atomes identiques), donnent la plus petite particule d'un nouveau type de substance - une molécule. Selon le nombre et le type d'atomes d'une molécule, on obtient des substances aux propriétés diverses.
Au XVIIIe siècle Les travaux de M.V. Lomonosov sont apparus, jetant les bases de la théorie cinétique moléculaire de la structure de la matière. Lomonossov s'est battu de manière décisive pour l'expulsion de la physique des liquides en apesanteur comme le calorique, ainsi que les atomes de froid, d'odeur, etc., qui étaient largement utilisés à cette époque pour expliquer les phénomènes correspondants. Lomonossov a prouvé que tous les phénomènes s'expliquent naturellement par le mouvement et l'interaction des molécules de matière. - |Au début du XIXe siècle, le scientifique anglais D. Dalton (1766-1844) montra qu'en utilisant uniquement des idées sur les atomes et les molécules, il était possible de déduire et d'expliquer les lois chimiques connues par l'expérience. Ainsi, il a scientifiquement prouvé structure moleculaire substances. Après les travaux de Dalton, l'existence d'atomes et de molécules a été reconnue par la grande majorité des scientifiques.
Au début du 20e siècle. les tailles, les masses et les vitesses de mouvement des molécules de matière ont été mesurées, l'emplacement des atomes individuels dans les molécules a été déterminé, en un mot, la construction d'une théorie cinétique moléculaire de la structure de la matière a finalement été achevée, dont les conclusions ont été confirmé par de nombreuses expériences.
Les principales dispositions de cette théorie sont les suivantes :
1) toute substance est constituée de molécules entre lesquelles se trouvent des espaces intermoléculaires ;
2) les molécules sont toujours en mouvement désordonné (chaotique) continu ;
3) des forces attractives et répulsives agissent entre les molécules. Ces forces dépendent de la distance entre les molécules. Ils ne sont significatifs qu’à de très courtes distances et diminuent rapidement à mesure que les molécules s’éloignent les unes des autres. La nature de ces forces est électrique.
2. Température.
Si tous les corps sont constitués de molécules en mouvement continu et aléatoire, alors comment le changement de la vitesse de mouvement des molécules, c'est-à-dire leur énergie cinétique, se manifestera-t-il, et quelles sensations ces changements provoqueront-ils chez une personne ? Il s'avère que le changement d'énergie cinétique moyenne mouvement vers l'avant Les molécules sont associées au chauffage ou au refroidissement des corps.
Souvent, une personne détermine la chaleur du corps au toucher, par exemple en touchant un radiateur de chauffage avec sa main, on dit : le radiateur est froid, tiède ou chaud. Cependant, déterminer si un corps est chaud au toucher est souvent trompeur. Lorsqu'une personne touche des corps en bois et en métal avec sa main en hiver, il lui semble que objet métallique plus froid que le bois, même si en réalité leur chauffage est le même. Il est donc nécessaire d’établir une valeur qui permettrait d’évaluer objectivement l’échauffement du corps et de créer un appareil pour le mesurer.
La grandeur caractérisant le degré d’échauffement d’un corps est appelée température. Un appareil permettant de mesurer la température s’appelle un thermomètre. L'action des thermomètres les plus courants est basée sur l'expansion des corps lorsqu'ils sont chauffés et sur leur compression lorsqu'ils sont refroidis. Quand deux corps entrent en contact différentes températures l'échange d'énergie se produit entre les corps. Dans ce cas, un corps plus chauffé (avec une température élevée) perd de l'énergie, et un corps moins chauffé (avec une température basse) en gagne. Cet échange d'énergie entre les corps conduit à l'égalisation de leurs températures et se termine lorsque les températures des corps deviennent égales.
La sensation de chaleur d’une personne se produit lorsqu’elle reçoit de l’énergie des corps environnants, c’est-à-dire lorsque leur température est supérieure à la température d’une personne. La sensation de froid est associée à la libération d'énergie par une personne vers les corps environnants. Dans l'exemple ci-dessus, un corps en métal semble plus froid à une personne qu'un corps en bois, car l'énergie est transférée aux corps métalliques de la main plus rapidement qu'aux corps en bois, et dans le premier cas, la température de la main diminue plus rapidement.
3. Caractéristiques de l'état liquide d'une substance.
Les molécules liquides oscillent autour d’une position d’équilibre aléatoire pendant un certain temps t, puis sautent vers une nouvelle position. Le temps pendant lequel la molécule oscille autour de la position d’équilibre est appelé temps de « vie stable » de la molécule. Cela dépend du type de liquide et de sa température. Lorsque le liquide est chauffé, le temps de « durée de vie » diminue.
Si un volume suffisamment petit est isolé dans un liquide, alors pendant la période de « vie sédentaire », la disposition ordonnée des molécules liquides y est préservée, c'est-à-dire qu'il existe un semblant de réseau cristallin de solides. Cependant, si l’on considère la disposition des molécules liquides les unes par rapport aux autres dans un grand volume de liquide, elle s’avère chaotique.
Par conséquent, nous pouvons dire que dans un liquide, il existe un « ordre à courte portée » dans la disposition des molécules. L'arrangement ordonné de molécules liquides en petits volumes est appelé quasicristallin (cristallin). Avec des effets à court terme sur le liquide, inférieurs au temps de « vie réglée », on constate grande ressemblance propriétés d'un liquide avec les propriétés d'un solide. Par exemple, lorsqu'une petite pierre à surface plane heurte brusquement l'eau, la pierre rebondit dessus, c'est-à-dire que le liquide présente des propriétés élastiques. Si un nageur sautant d'une plate-forme heurte la surface de l'eau avec tout son corps, il sera gravement blessé, car dans ces conditions le liquide se comporte comme un corps solide.
Si le temps d'exposition au liquide est plus long que le temps de « durée de vie réglée » des molécules, alors la fluidité du liquide est détectée. Par exemple, une personne entre librement dans l'eau depuis la rive d'une rivière, etc. Les principales caractéristiques d'un état liquide sont la fluidité du liquide et la conservation du volume. La fluidité d’un liquide est étroitement liée à la durée de « vie stable » de ses molécules. Plus ce temps est court, plus la mobilité des molécules liquides est grande, c'est-à-dire plus la fluidité du liquide est grande et ses propriétés se rapprochent de celles d'un gaz.
Plus la température d'un liquide est élevée, plus ses propriétés diffèrent de celles d'un solide et se rapprochent de celles des gaz denses. Ainsi, l’état liquide d’une substance est intermédiaire entre l’état solide et gazeux de cette même substance.
4. Énergie interne
Chaque corps est un ensemble d’un très grand nombre de particules. Selon la structure de la substance, ces particules sont des molécules, des atomes ou des ions. Chacune de ces particules possède à son tour une structure assez complexe. Ainsi, une molécule est constituée de deux atomes ou plus, les atomes sont constitués d'un noyau et d'une couche électronique ; le noyau est constitué de protons et de neutrons, etc.
Les particules qui composent un corps sont en mouvement continu ; de plus, ils interagissent les uns avec les autres d’une certaine manière.
L'énergie interne d'un corps est la somme des énergies cinétiques des particules qui le composent et des énergies de leur interaction entre elles (énergies potentielles).
Découvrons sous quels processus l'énergie interne d'un corps peut changer.
1. Tout d’abord, il est évident que l’énergie interne d’un corps change lorsqu’il se déforme. En effet, lors de la déformation, la distance entre les particules change ; par conséquent, l’énergie d’interaction entre eux change également. Ce n'est que dans un gaz parfait, où les forces d'interaction entre les particules sont négligées, que l'énergie interne est indépendante de la pression.
2. L'énergie interne change pendant les processus thermiques. Les processus thermiques sont des processus associés à des changements à la fois de la température d'un corps et de son état d'agrégation - fusion ou solidification, évaporation ou condensation. Lorsque la température change, l'énergie cinétique de mouvement de ses particules change. Il convient toutefois de souligner qu'en même temps
est d'accord et énergie potentielle leurs interactions (sauf dans le cas des gaz raréfiés). En effet, une augmentation ou une diminution de la température s'accompagne d'une modification de la distance entre les positions d'équilibre aux nœuds du réseau cristallin d'un corps, que nous enregistrons comme dilatation thermique des corps. Naturellement, l’énergie d’interaction des particules change dans ce cas. Le passage d'un état d'agrégation à un autre est le résultat d'un changement structure moleculaire corps, ce qui provoque une modification à la fois de l'énergie d'interaction des particules et de la nature de leur mouvement.
3. L'énergie interne du corps change lors de réactions chimiques. En effet, réactions chimiques représentent des processus de restructuration de molécules, leur désintégration en parties plus simples ou, à l'inverse, l'émergence de molécules plus complexes à partir de molécules plus simples ou d'atomes individuels (réactions d'analyse et de synthèse). Dans ce cas, les forces d'interaction entre les atomes et, par conséquent, les énergies de leur interaction changent de manière significative. De plus, la nature du mouvement des molécules et de l'interaction entre elles change, car les molécules de la substance nouvellement apparue interagissent entre elles différemment des molécules des substances d'origine.
4. Dans certaines conditions, les noyaux des atomes subissent des transformations appelées réactions nucléaires. Quel que soit le mécanisme des processus qui se produisent dans ce cas (et ils peuvent être très différents), ils sont tous associés à un changement significatif dans l'énergie des particules en interaction. Par conséquent, les réactions nucléaires s'accompagnent d'une modification de l'énergie interne de l'organisme qui contient ces noyaux.
5. Évaporation
La transition d'une substance d'un état liquide à un état gazeux est appelée vaporisation, et la transition d'une substance d'un état gazeux à un état liquide est appelée condensation.
Un type de formation de vapeur est l’évaporation. L'évaporation est la formation de vapeur qui se produit uniquement à partir de la surface libre d'un liquide bordant un milieu gazeux. Découvrons comment l'évaporation s'explique sur la base de la théorie de la cinétique moléculaire.
Étant donné que les molécules d'un liquide subissent un mouvement chaotique, parmi les molécules de sa couche superficielle, il y aura toujours des molécules qui se déplacent dans la direction du liquide vers environnement gazeux. Cependant, toutes ces molécules ne seront pas capables de s’envoler hors du liquide, car elles sont soumises à des forces moléculaires qui les ramènent dans le liquide. Ainsi, seules celles de ses molécules qui possèdent une énergie cinétique suffisamment élevée pourront s’échapper au-delà de la couche superficielle du liquide.
En effet, lorsqu'une molécule traverse Couche de surface, il doit lutter contre les forces moléculaires en utilisant son énergie cinétique. Les molécules dont l'énergie cinétique est inférieure à ce travail sont réintroduites dans le liquide, et seules les molécules dont l'énergie cinétique est supérieure à ce travail sont extraites du liquide. Les molécules libérées par un liquide forment de la vapeur au-dessus de sa surface. Puisque les molécules s'échappant d'un liquide acquièrent de l'énergie cinétique à la suite de collisions avec d'autres molécules du liquide, vitesse moyenne le mouvement chaotique des molécules à l'intérieur du liquide lors de son évaporation devrait diminuer. Ainsi, une certaine énergie doit être dépensée pour transformer la phase liquide d’une substance en phase gazeuse. Les molécules de vapeur situées au-dessus de la surface du liquide, lors de leur mouvement chaotique, peuvent retourner dans le liquide et lui restituer l'énergie qu'elles ont emportée lors de l'évaporation. Par conséquent, lors de l'évaporation, la condensation de la vapeur se produit toujours simultanément, accompagnée d'une augmentation de l'énergie interne du liquide.
Quelles raisons influencent le taux d'évaporation du liquide ?
1. Si vous versez des volumes égaux d'eau, d'alcool et d'éther dans des soucoupes identiques et observez leur évaporation, il s'avérera que l'éther s'évaporera en premier, puis l'alcool et l'eau en dernier. Par conséquent, la vitesse
l'évaporation dépend du type de liquide.
2. Plus sa surface libre est grande, plus le même liquide s'évapore rapidement. Par exemple, si les mêmes volumes d'eau sont versés dans une soucoupe et dans un verre, l'eau s'évaporera plus rapidement de la soucoupe que du verre.
3. Il est facile de voir que eau chaude s'évapore plus vite que le froid.
La raison en est claire. Plus la température du liquide est élevée, plus l'énergie cinétique moyenne de ses molécules est élevée et, par conséquent, plus elles sont nombreuses à quitter le liquide en même temps.
4. De plus, le taux d'évaporation du liquide est d'autant plus grand que plus le pression extérieure sur un liquide et plus la densité de vapeur de ce liquide au-dessus de sa surface est faible.
Par exemple, lorsqu'il y a du vent, le linge sèche plus vite que par temps calme, car le vent emporte la vapeur d'eau, ce qui contribue à réduire la condensation de vapeur sur le linge.
Étant donné que l'énergie est dépensée pour l'évaporation d'un liquide en raison de l'énergie de ses molécules, la température du liquide diminue pendant le processus d'évaporation. C'est pourquoi une main trempée dans de l'éther ou de l'alcool se refroidit sensiblement. Cela explique également la sensation de froid chez une personne lorsqu'elle sort de l'eau après avoir nagé par une journée chaude et venteuse.
Si le liquide s'évapore lentement, alors en raison des échanges thermiques avec les corps environnants, la perte de son énergie est compensée par l'afflux d'énergie de environnement, et sa température reste en réalité égale à la température de l'environnement. Cependant, si le liquide s’évapore à un rythme élevé, sa température peut être nettement inférieure à la température ambiante. À l'aide de liquides « volatils », tels que l'éther, une diminution significative de la température peut être obtenue.
Notons également que beaucoup solides, contournant la phase liquide, peut passer directement dans la phase gazeuse. Ce phénomène est appelé sublimation, ou sublimation. L'odeur des solides (par exemple camphre, naphtalène) s'explique par leur sublimation (et diffusion). La sublimation est typique pour la glace, par exemple, le linge sèche à des températures inférieures à 0° G.
6. Hydrosphère et atmosphère de la Terre
1. Les processus d'évaporation et de condensation de l'eau jouent un rôle décisif dans la formation des conditions météorologiques et climatiques sur notre planète. À l'échelle mondiale, ces processus se résument à l'interaction de l'hydrosphère et de l'atmosphère terrestre.
L'hydrosphère est constituée de toute l'eau disponible sur notre planète dans toutes ses états d'agrégation; 94 % de l'hydrosphère tombe sur l'océan mondial, dont le volume est estimé à 1,4 milliard de m3. Il occupe 71 % de la superficie totale de la surface terrestre, et si la surface solide de la terre était une sphère lisse, alors l'eau la recouvrirait d'une couche continue de 2,4 km de profondeur ; 5,4% de l'hydrosphère est occupée Les eaux souterraines, ainsi que les glaciers, l'humidité atmosphérique et celle du sol. Et seulement 0,6% provient de l'eau douce des rivières, lacs et réservoirs artificiels. De là, il est clair quelle importance la protection a eau fraiche de la pollution provenant des déchets industriels et des transports.
2. L’atmosphère terrestre est généralement divisée en plusieurs couches, chacune ayant ses propres caractéristiques. La couche d’air inférieure et superficielle s’appelle la troposphère. Sa limite supérieure aux latitudes équatoriales passe à une altitude de 16 à 18 km et aux latitudes polaires à une altitude de 10 km. La troposphère contient 90 % de la masse de l'atmosphère entière, soit 4,8 1018 kg. La température dans la troposphère diminue avec l'altitude. D'abord, de 1 °C tous les 100 m, puis, à partir d'une altitude de 5 km, la température descend jusqu'à -70 °C.
La pression et la densité de l'air diminuent continuellement. La couche la plus externe de l'atmosphère, à une altitude d'environ 1 000 km, passe progressivement dans l'espace interplanétaire.
3. Des recherches ont montré que chaque jour environ 7·10 3km3 l'eau et à peu près la même quantité tombe sous forme de précipitations.
Emportée par les courants d'air ascendants, la vapeur d'eau s'élève et tombe dans les couches froides de la troposphère. À mesure que la vapeur monte, elle se sature puis se condense pour former des gouttes de pluie et des nuages.
Au cours du processus de condensation de la vapeur dans l'atmosphère, en moyenne par jour, la quantité de chaleur dégagée est de 1,6 10 22 J, qui est des dizaines de milliers de fois supérieure à l’énergie générée sur la planète Terre pendant la même période. Cette énergie est absorbée par l'eau lors de son évaporation. Ainsi, entre l’hydrosphère et l’atmosphère terrestre, il y a un échange continu non seulement de matière (cycle de l’eau), mais aussi d’énergie.
III. PARTIE RECHERCHE.
Étudier les processus d'évaporation et déterminer la dépendance du taux d'évaporation sur diverses conditions un certain nombre d'expériences ont été réalisées.
Expérience 1. Etude de la dépendance du taux d'évaporation sur la température de l'air.
Matériaux: Plaques de verre, 3% solution de peroxyde hydrogène, huile végétale, alcool, eau, chronomètre, thermomètre, réfrigérateur.
Déroulement de l'expérience :À l'aide d'une seringue, nous appliquons des substances sur des plaques de verre et observons l'évaporation des substances.
Volume d'alcool 0,5·10 -6 m 3
Température de l'air : +24.
Le résultat de l'expérience : il a fallu 3 heures pour que le liquide s'évapore complètement ;
Eau. Volume 0,5·10 -6 m 3
Température de l'air : +24.
Le résultat de l'expérience : il a fallu 5 heures pour que le liquide s'évapore complètement ;
Solution de peroxyde d'hydrogène. Volume 0,5·10 -6 m 3
Température de l'air : +24.
Résultat de l'expérience : il a fallu 8 heures pour que le liquide s'évapore complètement ;
Huile végétale. Volume 0,5·10 -6 m 3
Température de l'air : +24.
Résultat de l'expérience : il a fallu 40 heures pour que le liquide s'évapore complètement ;
Nous modifions la température de l'air. Placez les verres au réfrigérateur.
Alcool. Volume 0,5·10 -6 m 3
Température de l'air : +6.
Résultat de l'expérience : il a fallu 8 heures pour que le liquide s'évapore complètement ;
Eau. Volume 0,5·10 -6 m 3
Température de l'air : +6.
Résultat de l'expérience : il a fallu 10 heures pour que le liquide s'évapore complètement ;
Solution de peroxyde d'hydrogène. Volume 0,5·10 -6 m 3
Température de l'air : +6.
Résultat de l'expérience : il a fallu 15 heures pour que le liquide s'évapore complètement ;
Huile végétale. Volume 0,5·10 -6 m 3
Température de l'air : +6
Résultat de l'expérience : il a fallu 72 heures pour que le liquide s'évapore complètement ;
Conclusion: Selon les résultats de l'étude, il est clair que lorsque différentes températures le temps nécessaire à l'évaporation des mêmes substances varie. Pour le même liquide, le processus d'évaporation se déroule beaucoup plus rapidement avec plus haute température. Ceci prouve la dépendance du procédé étudié à l'égard de ce paramètre physique. À mesure que la température diminue, la durée du processus d'évaporation augmente et vice versa.
Expérience 2 . Etude de la dépendance du taux d'évaporation sur la surface du liquide.
Cible: Étudier la dépendance du processus d'évaporation sur la surface du liquide.
Matériaux: Eau, alcool, montre, seringue médicale, plaques de verre, règle.
Déroulement de l'expérience :Nous mesurons la surface à l'aide de la formule : S=P · D 2 :4.
À l'aide d'une seringue, nous appliquons différents liquides sur la plaque, la façonnons en cercle et observons le liquide jusqu'à ce qu'il s'évapore complètement. La température de l'air dans la pièce reste inchangée (+24)
Alcool. Volume 0,5·10 -6 m 3
Superficie : 0,00422 m 2
Le résultat de l'expérience : il a fallu 1 heure pour que le liquide s'évapore complètement ;
Eau. Volume 0,5·10 -6 m 3
Le résultat de l'expérience : il a fallu 2 heures pour que le liquide s'évapore complètement ;
Solution de peroxyde d'hydrogène. Volume 0,5·10 -6 m 3
Superficie : 0,00422 m 2
Le résultat de l'expérience : il a fallu 4 heures pour que le liquide s'évapore complètement ;
Huile végétale. Volume 0,5·10 -6 m 3
Superficie : 0,00422 m 2
Résultat de l'expérience : il a fallu 30 heures pour que le liquide s'évapore complètement ;
Nous changeons les conditions. Nous observons l’évaporation des mêmes liquides sur une surface différente.
Alcool. Volume 0,5·10 -6 m 3
Le résultat de l'expérience : il a fallu 3 heures pour que le liquide s'évapore complètement ;
Eau. Volume 0,5·10 -6 m 3
Superficie : 0,00283 m 2
Le résultat de l'expérience : il a fallu 4 heures pour que le liquide s'évapore complètement ;
Solution de peroxyde d'hydrogène. Volume 0,5·10 -6 m 3
Le résultat de l'expérience : il a fallu 6 heures pour que le liquide s'évapore complètement ;
Huile végétale. Volume 0,5·10 -6 m 3
Superficie 0,00283 m 2
Résultat de l'expérience : il a fallu 54 heures pour que le liquide s'évapore complètement ;
Conclusion: Des résultats de l'étude, il résulte que des navires avec différentes régions surfaces, l’évaporation se produit sur différentes périodes de temps. Comme le montrent les mesures prises, à partir d'un navire avec zone plus grande surface, ce liquide s'évapore plus rapidement, ce qui prouve la dépendance du processus étudié à l'égard de ce paramètre physique. À mesure que la surface diminue, la durée du processus d’évaporation augmente et vice versa.
Expérience 3. Etude de la dépendance du processus d'évaporation au type de substance.
Cible: Étudier la dépendance du processus d'évaporation sur le type de liquide.
Appareils et matériels :Eau, alcool, huile végétale, solution de peroxyde d'hydrogène, montre, seringue médicale, assiettes en verre.
Déroulement de l'expérience.À l'aide d'une seringue, nous appliquons différentes sortes liquide sur les plaques et observer le processus jusqu’à évaporation complète. La température de l'air reste inchangée. Les températures des liquides sont les mêmes.
Nous obtenons les résultats d'études sur la différence entre l'évaporation de l'alcool, de l'eau, d'une solution de peroxyde d'hydrogène à 3 % et de l'huile végétale à partir des données d'études antérieures.
Conclusion: Différents liquides nécessitent différents temps pour s’évaporer complètement. D'après les résultats, il est clair que le processus d'évaporation se déroule plus rapidement pour l'alcool et l'eau, et plus lentement pour l'huile végétale, c'est-à-dire qu'il sert de preuve de la dépendance du processus d'évaporation à l'égard du paramètre physique - le type de substance.
Expérience 4. Etude de la dépendance du taux d'évaporation du liquide sur la vitesse des masses d'air.
Cible: étudier la dépendance du taux d'évaporation sur la vitesse du vent.
Appareils et matériels :Eau, alcool, huile végétale, solution de peroxyde d'hydrogène, montre, seringue médicale, assiettes en verre, sèche-cheveux.
Progrès. Nous créons un mouvement artificiel des masses d'air à l'aide d'un sèche-cheveux, observons le processus et attendons que le liquide s'évapore complètement. Le sèche-cheveux dispose de deux modes : mode simple, mode turbo.
En cas de mode simple :
Alcool. Volume : 0,5·10 -6 m 3
Superficie : 0,00283 m 2 Le résultat de l'expérience : il a fallu environ 2 minutes pour que le liquide s'évapore complètement ;
Eau. Volume 0,5·10 -6 m 3
Superficie : 0,00283 m 2
Le résultat de l'expérience : il a fallu environ 4 minutes pour que le liquide s'évapore complètement ;
Solution de peroxyde d'hydrogène. Volume : 0,5·10 -6 m 3
Superficie : 0,00283 m 2
Le résultat de l'expérience : il a fallu environ 7 minutes pour que le liquide s'évapore complètement ;
Huile végétale. Volume : 0,5·10 -6 m 3
Superficie : 0,00283 m 2 Le résultat de l'expérience : il a fallu environ 10 minutes pour que le liquide s'évapore complètement ;
En cas de mode turbo :
Alcool. Volume : 0,5·10 -6 m 3
Superficie : 0,00283 m 2 Le résultat de l'expérience : il a fallu environ 1 minute pour que le liquide s'évapore complètement ;
Eau. Volume : 0,5·10 -6 m 3
Superficie : 0,00283 m 2
Le résultat de l'expérience : il a fallu environ 3 minutes pour que le liquide s'évapore complètement ;
Solution de peroxyde d'hydrogène. Volume : 0,5·10 -6 m 3
Superficie : 0,00283 m 2 Le résultat de l'expérience : il a fallu environ 5 minutes pour que le liquide s'évapore complètement ;
Huile végétale. Volume : 0,5·10 -6 m 3
Superficie : 0,00283 m 2
Le résultat de l'expérience : il a fallu environ 8 minutes pour que le liquide s'évapore complètement ;
Conclusion: Le processus d'évaporation dépend de la vitesse de déplacement des masses d'air au-dessus de la surface du liquide. Plus la vitesse est élevée, plus ce processus se déroule plus rapidement et vice versa.
Ainsi, des études ont montré que l'intensité de l'évaporation du liquide varie selon les liquides et augmente avec l'augmentation de la température du liquide, l'augmentation de sa surface libre et la présence de vent au-dessus de sa surface.
Conclusion.
À la suite de nos travaux, nous avons étudié différentes sources des informations sur le processus d'évaporation et les conditions de son apparition. Les paramètres physiques qui influencent la vitesse du processus d'évaporation sont déterminés. La dépendance du processus d'évaporation à l'égard paramètres physiques, une analyse des résultats obtenus a été réalisée. L'hypothèse énoncée s'est avérée correcte. Les hypothèses théoriques ont été confirmées au cours du processus de recherche - la dépendance du taux de processus d'évaporation sur les paramètres physiques est la suivante :
À mesure que la température du liquide augmente, la vitesse du processus d’évaporation augmente et vice versa ;
Avec une diminution de la surface libre du liquide, la vitesse du processus d'évaporation diminue et vice versa ;
La vitesse du processus d'évaporation dépend du type de liquide.
Ainsi, le processus d'évaporation des liquides dépend de paramètres physiques tels que la température, la surface libre et le type de substance.
Ce travail est d'une importance pratique, car il a étudié la dépendance de l'intensité de l'évaporation - un phénomène que nous rencontrons dans Vie courante, à partir de paramètres physiques. Grâce à ces connaissances, vous pouvez contrôler la progression du processus.
Littérature
Pinsky A. A., Grakovsky G. Yu. Physique : manuel pour les étudiants des institutions
Enseignement professionnel secondaire/Sous général. Éd. Yu.I.Dika, N.S. Puryshevoy.-M.:FORUM:INFRA_M, 2002.-560 p.
Milkovskaya L.B. Répétons la physique. Manuel pour ceux qui entrent à l'université, "École supérieure", 1985.608 p.
Ressources Internet :http://ru.wikipedia.org/wiki/;
http://class-fizika.narod.ru/8_l 3.htm ;
http://e-him.ru/?page=dynamic§ion=33&article=208 ;
Manuel de physique G.Ya. Myakishev "Thermodynamique"