Quel est le nombre de masse d'un atome. Masse atomique
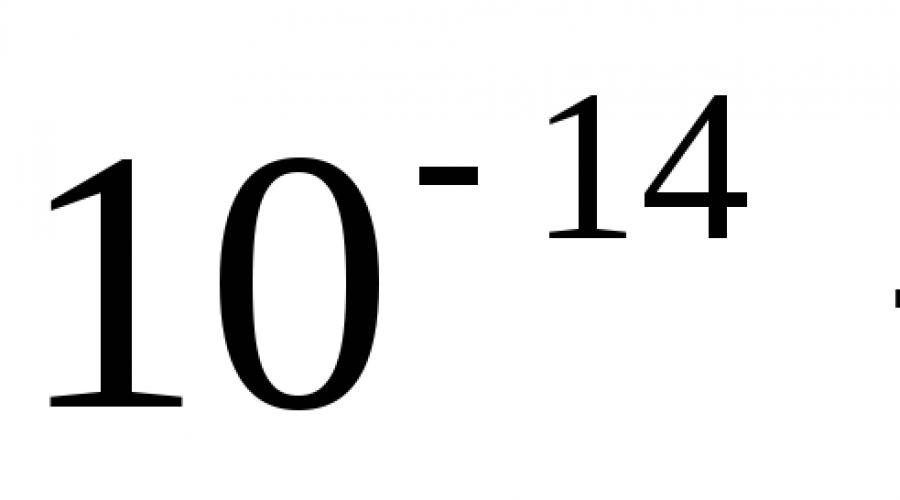
Lire aussi
") dans le noyau. Généralement désigné par la lettre UN. Le nombre de masse est proche de la masse atomique de l'isotope, exprimée en unités de masse atomique, mais ne coïncide avec lui que pour le carbone 12, puisque l'unité de masse atomique (a.m.u.) est désormais définie comme 1 ⁄ 12 de la masse d'un atome de 12 C. Dans tous les autres cas masse atomique n'est pas un nombre entier, contrairement à un nombre de masse. Ainsi, le nombre de masse de l'isotope du chlore 35 Cl est de 35 et sa masse atomique est de 34,96885 uma.
Le nombre de masse dans la désignation d'un nucléide spécifique (type de noyaux atomiques) est écrit avec un index supérieur gauche, par exemple 232 Th. Les nucléides ayant le même numéro de masse sont appelés isobares (par exemple, les nucléides 14 C et 14 N sont des isobares).
Connaître le nombre de masse permet d'estimer la masse du noyau et de l'atome. Si le nombre de masse est connu, alors la masse M. l'atome et son noyau est estimé à partir de la relation suivante M. ≈ Suis N, Où m N ≈ 1,67·10 −27 kg - la masse d'un nucléon, c'est-à-dire d'un proton ou d'un neutron. Par exemple, l'atome d'aluminium 27 et son noyau contiennent 27 nucléons (13 protons et 14 neutrons). Sa masse est d'environ 27·1,67·10−27 kg ≈ 4,5·10−26 kg. S'il est nécessaire d'obtenir la masse du noyau avec une plus grande précision, il faut alors tenir compte du fait que les nucléons du noyau sont liés par les forces d'attraction nucléaire, et donc, conformément à la relation E=mc 2 la masse du noyau diminue. La masse totale des électrons en orbite autour du noyau doit également être ajoutée à la masse de l’atome. Cependant, toutes ces corrections ne dépassent pas 1%.
| 238 92 U | → | 234 90 Ème | + | 4 2 Il |
sur le côté gauche le nombre de masse du noyau initial est 238, sur le côté droit de la réaction il y a deux noyaux avec les numéros de masse 234 et 4, ce qui donne au total 238. Compte tenu du fait que le nombre de masse de l'alpha La particule (noyau d'hélium-4) est de 4, la désintégration alpha réduit le nombre de masse du noyau en décomposition de 4 unités. Tous les types de désintégration bêta (désintégration bêta moins, désintégration des positons, capture d'électrons, tous types de double désintégration bêta) ne modifient pas le nombre de masse, puisque dans ce processus seule la transformation de certains nucléons du noyau d'un type à un autre (protons en neutrons ou retour). La transition isomérique ne modifie pas non plus le nombre de masse du noyau.
Remarques
voir également
Fondation Wikimédia. 2010.
Voyez ce qu'est « Nombre de masse » dans d'autres dictionnaires :
- (nombre de nucléons, symbole A), nombre total NUCLÉONS (NEUTRONS et PROTONS) dans le NOYAU ATOMIQUE. Il est généralement écrit en exposant avant le symbole chimique de l'élément. Ainsi, l'élément le plus léger, l'hydrogène, n'a qu'un seul proton dans son noyau, et... ... Scientifique et technique Dictionnaire encyclopédique
Le nombre total de nucléons (neutrons et protons) en at. cœur. Différent pour les isotopes du même produit chimique. élément. Dictionnaire encyclopédique physique. M. : Encyclopédie soviétique. Rédacteur en chef A.M. Prokhorov. 1983. NOMBRE DE MASSE... Encyclopédie physique
Le nombre de nucléons dans un noyau atomique. Généralement indiqué en haut à gauche du symbole élément chimique(par exemple 10V)… Grand dictionnaire encyclopédique
NOMBRE DE MASSE- le nombre total de nucléons (protons et neutrons) dans le noyau atomique, noté A et indiqué par l'index en haut à gauche du symbole de l'élément correspondant, par exemple. 32S signifie un isotope du soufre avec un nombre de masse de 32 (A = 32). Le numéro de pièce de l'isotope est égal au tout... ... Grande encyclopédie polytechnique
nombre de masse- - [Ya.N.Luginsky, M.S.Fezi Zhilinskaya, Yu.S.Kabirov. Dictionnaire anglais-russe du génie électrique et du génie électrique, Moscou] Thèmes du génie électrique, concepts de base EN nombre de masse ... Guide du traducteur technique
Le nombre de nucléons dans un noyau atomique. Généralement indiqué en haut à gauche du symbole de l'élément chimique (par exemple, 10B). * * * NOMBRE DE MASSE NOMBRE DE MASSE, le nombre de nucléons dans un noyau atomique. Généralement indiqué en haut à gauche du symbole de l'élément chimique... ... Dictionnaire encyclopédique
nombre de masse- masės skaičius statusas T sritis Standartizacija ir metrologija apibrėžtis Atomo branduolio nukleonų skaičius. atitikmenys : engl. nombre de masse; numéro nucléaire; numéro de nucléon vok. Massenzahl, f; Nukleonenzahl, f rus. nombre de masse, n ; nombre… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
nombre de masse- masės skaičius statusas T sritis chemija apibrėžtis Atomo branduolio nukleonų skaičius. atitikmenys : engl. nombre de masse; numéro nucléaire; numéro de nucléon rus. nombre de masse... Chemijos terminų aiškinamasis žodynas
nombre de masse- masės skaičius statusas T sritis fizika atitikmenys: engl. nombre de masse; numéro nucléaire; numéro de nucléon vok. Massenzahl, f; Massezahl, f; Nukleonenzahl, f rus. nombre de masse, n pranc. nombre de masse, m; nombre de nucléons, m … Fizikos terminų žodynas
Le nombre de nucléons (protons et neutrons) dans un noyau atomique ; désigné par la lettre A et est généralement indiqué en haut à gauche à côté du symbole de l'élément, par exemple 32S signifie un isotope du soufre avec A = 32. M.p et la charge du noyau Z, exprimée en unités élémentaires. . Grande Encyclopédie Soviétique
Livres
- Gestionnaire incompétent. L'incompétence comme folie de masse, Farnham Adrian. Un nombre surprenant de personnes travaillent sous la direction de managers manifestement incompétents. Certains experts estiment que dans certains secteurs de l'économie, le nombre d'incompétents...
Le centre de l’atome contient l’essentiel de sa masse et toutes ses charges positives. Cette région de l’atome s’appelle le noyau.
Les dimensions de l'atome sont m et les dimensions du noyau sont  m la masse du noyau est 99,95 % de la masse de l'atome. Dans un atome neutre Z des électrons. La charge nucléaire est positive et multiple de la charge élémentaire
m la masse du noyau est 99,95 % de la masse de l'atome. Dans un atome neutre Z des électrons. La charge nucléaire est positive et multiple de la charge élémentaire  Cl. La charge nucléaire peut être représentée comme
Cl. La charge nucléaire peut être représentée comme  , Où Z- numéro de charge, il coïncide avec le numéro chimique du tableau périodique et est égal au nombre de protons inclus dans le noyau.
, Où Z- numéro de charge, il coïncide avec le numéro chimique du tableau périodique et est égal au nombre de protons inclus dans le noyau.
La deuxième caractéristique la plus importante d’un noyau est sa masse. La masse du noyau s'est avérée supérieure à la somme des masses des protons inclus dans le noyau.
On supposait que le noyau contenait des particules neutres. En 1932, Chadwig découvre les neutrons. Ivanenko et Heisenberg ont proposé la théorie proton-neutron du noyau. Le noyau se divise en protons et neutrons. On les appelle des nucléons. Nombre total de nucléons dans le noyau appelé nombre de masseUN
.
Le nombre total de neutrons est N=A-Z. La masse au repos d'un proton est  kg, la masse des neutrons est
kg, la masse des neutrons est  kg.
kg.
Le noyau d'un élément chimique est désigné par le même symbole qu'un atome neutre  , Où Z- numéro atomique (charge nucléaire), UN- nombre de masse (nombre de nucléons dans le noyau). Les noyaux ayant le même numéro de charge, mais des masses différentes, sont appelés isotopes (les isotopes diffèrent par le nombre de neutrons). Les noyaux ayant le même numéro de masse, mais des numéros de charge différents, sont appelés isobares.
, Où Z- numéro atomique (charge nucléaire), UN- nombre de masse (nombre de nucléons dans le noyau). Les noyaux ayant le même numéro de charge, mais des masses différentes, sont appelés isotopes (les isotopes diffèrent par le nombre de neutrons). Les noyaux ayant le même numéro de masse, mais des numéros de charge différents, sont appelés isobares.
28. Propriétés des forces nucléaires.
Caractéristiques des forces nucléaires :

29. Radioactivité. Désintégration alpha et bêta. Règles de compensation.
La radioactivité est appelée la transformation d'isotopes instables d'un élément chimique en isotopes d'un autre élément, accompagnée de l'émission de certaines particules. La radioactivité naturelle est la radioactivité observée dans les isotopes instables existant dans la nature. La radioactivité artificielle est la radioactivité des isotopes obtenus à la suite de réactions nucléaires.
Le rayonnement radioactif a une composition complexe. Dans un champ magnétique, un faisceau étroit de rayonnement radioactif est divisé en trois composants :

 -particules –
flux de noyaux d'hélium chargés Z=2
e et nombre de masse UN=4
(
-particules –
flux de noyaux d'hélium chargés Z=2
e et nombre de masse UN=4
( ). Vitesse
). Vitesse  -particules est égal à
-particules est égal à  MS. Entrer dans le fond
MS. Entrer dans le fond  -les particules interagissent activement avec les atomes et les molécules, les ionisent et les excitent. Quand l'énergie
-les particules interagissent activement avec les atomes et les molécules, les ionisent et les excitent. Quand l'énergie  -les particules sont réduites à mouvement thermique, il capte deux électrons et se transforme en atome d'hélium ( Il). Avant cela, il emprunte un chemin appelé course. En raison de la forte interaction avec la matière, la portée est courte. Un morceau de papier ou un vêtement retient
-les particules sont réduites à mouvement thermique, il capte deux électrons et se transforme en atome d'hélium ( Il). Avant cela, il emprunte un chemin appelé course. En raison de la forte interaction avec la matière, la portée est courte. Un morceau de papier ou un vêtement retient  -des particules. Une tôle d'aluminium de 0,05 mm d'épaisseur retarde également
-des particules. Une tôle d'aluminium de 0,05 mm d'épaisseur retarde également  -des particules. Pouvoir ionisant
-des particules. Pouvoir ionisant  -les particules sont grosses et égales
-les particules sont grosses et égales  vapeur sur toute la longueur du parcours.
vapeur sur toute la longueur du parcours.
 -particules
est un flux d'électrons s'échappant des noyaux à une vitesse
-particules
est un flux d'électrons s'échappant des noyaux à une vitesse  MS. Le noyau émet un électron lorsqu'un neutron se transforme en proton :
MS. Le noyau émet un électron lorsqu'un neutron se transforme en proton :
![]()
Où  - désignation électronique,
- désignation électronique,  - l'antineutrino électronique.
- l'antineutrino électronique.
Pouvoir ionisant  - les particules sont des centaines de fois plus petites que celles de
- les particules sont des centaines de fois plus petites que celles de  -particules, et le pouvoir pénétrant est plus grand.
-particules, et le pouvoir pénétrant est plus grand.  -le rayonnement est retardé par une couche d'aluminium de 2 mm d'épaisseur.
-le rayonnement est retardé par une couche d'aluminium de 2 mm d'épaisseur.
Qu'est-ce que le nombre de masse noyau atomique? Le nombre de masse est numériquement égal à la somme des neutrons et des protons du noyau. Il est désigné par la lettre A. La notion de « nombre de masse » est apparue du fait que la masse du noyau est déterminée par le nombre de particules nucléaires. Quel est le rapport entre la masse du noyau et le nombre de particules ? Découvrons-le.
Structure atomique
Tout atome est constitué d'un noyau et d'électrons. Sauf l’atome d’hydrogène, puisqu’il ne possède qu’un seul électron. Le noyau est chargé positivement. Les électrons portent une charge négative. La charge de chaque électron est considérée comme étant de -1. L’atome dans son ensemble est électriquement neutre, c’est-à-dire qu’il n’a aucune charge. Cela signifie que le nombre de particules portant une charge négative, c'est-à-dire d'électrons, est égal à la charge positive du noyau. Par exemple, dans un atome d’oxygène, la charge nucléaire est de +8 et il y a 8 électrons ; dans un atome de calcium, la charge nucléaire est de +20 et il y a 20 électrons.
Structure de base
Le noyau est constitué de deux types de particules : les protons et les neutrons. Les protons sont chargés positivement, les neutrons n’ont aucune charge. Ainsi, les protons donnent une charge au noyau. La charge de chaque proton est considérée comme étant de +1. C'est-à-dire combien de protons sont contenus dans le noyau, ce sera la charge de tout le noyau. Par exemple, il y a 6 protons dans le noyau de carbone, la charge du noyau est de +6.
Dans le tableau périodique des éléments de Mendeleev, tous les éléments sont classés par ordre croissant de charge nucléaire. L'hydrogène a une charge nucléaire de +1 et est localisé en premier ; l'hélium a +2, il est deuxième du tableau ; le lithium a +3, il est troisième et ainsi de suite. C'est-à-dire que la charge du noyau correspond au numéro de série (atomique) de l'élément dans le tableau.
En général, tout atome est électriquement neutre. Cela signifie que le nombre d’électrons est égal à la charge du noyau, c’est-à-dire au nombre de protons. Et puisque le nombre de protons détermine le numéro atomique d'un élément, connaissant ce numéro atomique, on connaît ainsi le nombre d'électrons, le nombre de protons et la charge du noyau.
Masse atomique
La masse d'un atome (M) est déterminée par la masse de ses éléments constitutifs, c'est-à-dire les électrons et le noyau. Les électrons sont très légers comparés au noyau et ne contribuent presque pas à la masse de l’atome entier. Autrement dit, la masse d’un atome est déterminée par la masse du noyau. Qu'est-ce que le nombre de masse ? La masse du noyau est déterminée par le nombre de particules qui le composent - protons et neutrons. Ainsi, le nombre de masse est la masse du noyau, exprimée non pas en unités de masse (grammes), mais en nombre de particules. Bien entendu, la masse absolue des noyaux (m), exprimée en grammes, est connue. Mais ce sont de très petits nombres, exprimés en puissances négatives. Par exemple, la masse d'un atome de carbone m (C) = 1,99 ∙ 10 -23 g. Il n'est pas pratique d'utiliser de tels nombres. Et s'il n'y a pas besoin de valeurs absolues masses, mais il suffit de comparer les masses d'éléments ou de particules, puis d'utiliser les masses relatives des atomes (A r), exprimées en amu. La masse relative d'un atome est indiquée dans le tableau périodique, par exemple, l'azote en a 14,007. La masse relative d'un atome, arrondie au nombre entier le plus proche, est le nombre de masse du noyau de l'élément (A). Les nombres de masse sont tels qu'ils sont pratiques à utiliser - ce sont toujours des nombres entiers : 1, 2, 3 et ainsi de suite. Par exemple, l'azote en a 14, le carbone en a 12. Ils sont écrits avec un index en haut à gauche, par exemple 14 N ou 12 C.

Quand faut-il connaître le numéro de masse ?
Connaissant le nombre de masse (A) et le numéro atomique d'un élément du tableau périodique (Z), vous pouvez déterminer le nombre de neutrons. Pour ce faire, vous devez soustraire des protons du nombre de masse.
Connaissant le nombre de masse, vous pouvez calculer la masse du noyau ou de l'atome entier. Puisque la masse du noyau est déterminée par la masse des particules qui le composent, elle est égale au produit du nombre de ces particules et de la masse de ces particules, c'est-à-dire le produit de la masse du neutron. et le nombre de masse. La masse d'un neutron est égale à la masse d'un proton ; en général, on les désigne comme la masse d'un nucléon (particule nucléaire).
Par exemple, calculons la masse d'un atome d'aluminium. Comme le montre le tableau périodique des éléments de Mendeleïev, la masse atomique relative de l'aluminium est de 26,992. En arrondissant, nous obtenons que le nombre de masse du noyau d’aluminium est de 27. Autrement dit, son noyau est constitué de 27 particules. La masse d'une particule est une valeur constante égale à 1,67 ∙ 10 -24 g. Alors, la masse du noyau d'aluminium est égale à : 27 ∙ 1,67 ∙ 10 -24 g = 4,5 ∙ 10 -23 g.

Quel est le nombre de masse de noyaux d’éléments que vous devez connaître pour composer des réactions de désintégration radioactive ou des réactions nucléaires. Par exemple, lorsque l'uranium 235 U capte un neutron 1 n, les noyaux de baryum 141 Ba et de krypton 92 Kr se forment, ainsi que trois neutrons libres 1 n. Lors de la composition de telles réactions, la règle est utilisée : la somme des nombres de masse des côtés droit et gauche de l'équation ne change pas. 235+1 = 92+141+3.
Le nombre de masse est le nombre total de protons et de neutrons dans le noyau d'un atome. Il est désigné par le symbole A.
Lorsqu'on parle d'un noyau atomique spécifique, le terme nucléide est généralement utilisé, et les particules nucléaires, protons et neutrons, sont collectivement appelées nucléons.
Numéro atomique.
Le numéro atomique d’un élément est le nombre de protons présents dans le noyau de son atome. Il est désigné par le symbole Z. Le numéro atomique est lié au nombre de masse par la relation suivante :
où N est le nombre de neutrons dans le noyau d'un atome.
Chaque élément chimique est caractérisé par un numéro atomique spécifique. En d’autres termes, deux éléments ne peuvent pas avoir le même numéro atomique. Le numéro atomique n’est pas seulement égal au nombre de protons dans le noyau d’un atome de cet élément, mais est également égal au nombre d'électrons entourant le noyau d'un atome. Cela s’explique par le fait que l’atome dans son ensemble est une particule électriquement neutre. Ainsi, le nombre de protons dans le noyau d’un atome est égal au nombre d’électrons entourant le noyau. Cette affirmation ne s’applique pas aux ions, qui sont bien entendu des particules chargées.
La première preuve expérimentale du numéro atomique des éléments a été obtenue en 1913 par Henry Moseley, qui travaillait à Oxford. Il bombardait des cibles métalliques solides avec des rayons cathodiques. (En 1909, Barkla et Kayi avaient déjà montré que tout élément solide, lorsqu'il est bombardé par un faisceau rapide de rayons cathodiques, émet des rayons X caractéristiques de cet élément.) Moseley a analysé les rayons X caractéristiques en utilisant une technique d'enregistrement photographique. Il a découvert que la longueur d'onde du rayonnement X caractéristique augmente avec l'augmentation du poids atomique (masse) du métal et a montré que Racine carrée de la fréquence de ce rayonnement X est directement proportionnelle à un nombre entier, qu'il désigne par le symbole
![]()
Moseley a découvert que ce nombre représentait environ la moitié de la valeur de la masse atomique. Il est arrivé à la conclusion que ce nombre - le numéro atomique de l'élément - est propriété fondamentale ses atomes. Il s'est avéré qu'il était égal au nombre de protons dans un atome d'un élément donné. Ainsi, Moseley a associé la fréquence du rayonnement X caractéristique au numéro de série de l'élément émetteur (loi de Moseley). Cette loi avait grande importanceétablir la loi périodique des éléments chimiques et établir la signification physique du numéro atomique des éléments.
Les recherches de Moseley lui ont permis de prédire l'existence de trois disparus à ce moment-là tableau périodiqueéléments de numéros atomiques 43, 61 et 75. Ces éléments ont été découverts plus tard et ont été nommés respectivement technétium, prométhium et rhénium.
Moseley est mort au cours des batailles de la Première Guerre mondiale.
Symboles nucléides.
Le numéro de masse d'un nucléide est généralement indiqué en exposant et le numéro atomique en indice à gauche du symbole de l'élément. Par exemple, la notation signifie que ce nucléide de carbone (comme tous les autres nucléides de carbone) a un numéro atomique 6. Ce nucléide particulier a un nombre de masse de 12. Un autre nucléide de carbone reçoit le symbole Puisque tous les nucléides de carbone ont un numéro atomique 6, le nucléide spécifié le nucléide est souvent écrit simplement ou carbone-14.
Isotopes.
Les isotopes sont des variétés atomiques d’un élément ayant des propriétés différentes. Ils diffèrent par le nombre de neutrons dans leur noyau. Ainsi, les isotopes d’un même élément ont le même numéro atomique mais des nombres de masse différents. Dans le tableau Le tableau 1.1 montre les valeurs du nombre de masse A, du numéro atomique Z et du nombre de neutrons N dans le noyau des atomes de chacun des trois isotopes du carbone.
Tableau 1.1. Isotopes du carbone

Contenu isotopique des éléments.
Dans la plupart des cas, chaque élément est un mélange de différents isotopes. Le contenu de chaque isotope dans un tel mélange est appelé abondance isotopique. Par exemple, le silicium se trouve dans des composés présents dans la nature, avec les abondances isotopiques naturelles suivantes : . Veuillez noter que l'abondance isotopique totale de l'élément doit être exactement de 100 %. La teneur isotopique relative de chacun de ces isotopes est respectivement de 0,9228, 0,0467 et 0,0305. La somme de ces nombres est exactement 1,0000.
Unité de masse atomique (a.m.u.).
La masse d'un nucléide est actuellement acceptée comme norme pour définir l'unité de masse atomique. Ce nucléide se voit attribuer une masse de 12,0000 uma. Ainsi, une unité de masse atomique est égale à un douzième de la masse de ce nucléide. La vraie valeur de l’unité de masse atomique est le kg. Trois particules fondamentales, qui sont Composants l'atome a les masses suivantes :
masse du proton = 1,007277 amu
masse des neutrons = 1,008 665 amu
masse électronique = 0,000 548 6 a. manger.
En utilisant ces valeurs, vous pouvez calculer la masse isotopique de chaque nucléide spécifique. Par exemple, la masse isotopique d'un nucléide est la somme des masses de 17 protons, 18 neutrons et 17 électrons :
Cependant, des données expérimentales précises indiquent que la masse isotopique a une valeur de 34,968 85 a. e.m. L'écart entre les valeurs calculées et trouvées expérimentalement est C'est ce qu'on appelle un défaut de masse, la raison de l'apparition d'un défaut de masse est expliquée dans la section. 1.3.
Sur l’échelle des masses atomiques relatives, les masses des isotopes sont représentées comme le résultat de leur division par un douzième de la masse du nucléide. Ainsi, la masse isotopique relative d’un isotope est

Notez que les masses isotopiques relatives sont exprimées en unités sans dimension.
La masse atomique relative AT d'un élément chimique est la moyenne arithmétique des masses isotopiques relatives, prenant en compte la teneur isotopique. Il est calculé en additionnant les produits de la masse isotopique relative de chaque isotope et de son abondance relative.
Calculons la masse atomique relative du chlore en utilisant les données suivantes :

(appelé terme général"nucléons") dans le noyau. Généralement désigné par la lettre UN. Le nombre de masse est proche de la masse atomique de l'isotope, exprimée en unités de masse atomique, mais n'est le même que pour le carbone 12, puisque l'unité de masse atomique (a.m.u.) est désormais définie comme 1 ⁄ 12 la masse d'un atome est de 12 C. Dans tous les autres cas, la masse atomique n'est pas un nombre entier, contrairement au nombre de masse. Ainsi, le nombre de masse de l'isotope du chlore 35 Cl est de 35 et sa masse atomique est de 34,96885 uma.
Le nombre de masse dans la désignation d'un nucléide spécifique (type de noyaux atomiques) est écrit avec un index supérieur gauche, par exemple 232 Th. Les nucléides ayant le même numéro de masse sont appelés isobares (par exemple, les nucléides 14 C et 14 N sont des isobares).
Connaître le nombre de masse permet d'estimer la masse du noyau et de l'atome. Si le nombre de masse est connu, alors la masse M. l'atome et son noyau est estimé à partir de la relation suivante M. ≈ Suis N, Où m N ≈ 1,67·10 −27 kg - la masse d'un nucléon, c'est-à-dire d'un proton ou d'un neutron. Par exemple, l'atome d'aluminium 27 et son noyau contiennent 27 nucléons (13 protons et 14 neutrons). Sa masse est d'environ 27·1,67·10−27 kg ≈ 4,5·10−26 kg. S'il est nécessaire d'obtenir la masse du noyau avec une plus grande précision, il faut alors tenir compte du fait que les nucléons du noyau sont liés par les forces d'attraction nucléaire, et donc, conformément à la relation E=mc 2 la masse du noyau diminue. La masse totale des électrons en orbite autour du noyau doit également être ajoutée à la masse de l’atome. Cependant, toutes ces corrections ne dépassent pas 1%.
| 238 92 U | → | 234 90 Ème | + | 4 2 Il |
sur le côté gauche le nombre de masse du noyau initial est 238, sur le côté droit de la réaction il y a deux noyaux avec les numéros de masse 234 et 4, ce qui donne au total 238. Compte tenu du fait que le nombre de masse de l'alpha La particule (noyau d'hélium-4) est de 4, la désintégration alpha réduit le nombre de masse du noyau en décomposition de 4 unités. Tous les types de désintégration bêta (désintégration bêta moins, désintégration des positons, capture d'électrons, tous types de double désintégration bêta) ne modifient pas le nombre de masse, puisque dans ce processus seule la transformation de certains nucléons du noyau d'un type à un autre (protons en neutrons ou retour). La transition isomérique ne modifie pas non plus le nombre de masse du noyau.
Donnez votre avis sur l'article "Numéro de masse"
Remarques
voir également
Extrait caractérisant le numéro de masse
– Dites-moi, n'aviez-vous pas connaissance de la mort de la comtesse lorsque vous séjourniez à Moscou ? - dit la princesse Marya et rougit immédiatement, remarquant qu'en posant cette question après ses paroles selon lesquelles il était libre, elle attribuait à ses paroles un sens qu'elles n'avaient peut-être pas."Non", répondit Pierre, ne trouvant visiblement pas gênante l'interprétation que la princesse Marya donnait à sa mention de sa liberté. "J'ai appris cela à Orel, et vous ne pouvez pas imaginer à quel point cela m'a frappé." Nous n'étions pas des conjoints exemplaires », dit-il rapidement en regardant Natasha et en remarquant sur son visage la curiosité quant à la façon dont il réagirait à sa femme. "Mais cette mort m'a terriblement frappé." Lorsque deux personnes se disputent, les deux sont toujours coupables. Et la culpabilité devient soudain terriblement lourde devant une personne qui n’existe plus. Et puis une telle mort... sans amis, sans consolation. "Je suis vraiment, vraiment désolé pour elle", termina-t-il et fut heureux de remarquer la joyeuse approbation sur le visage de Natasha.
"Oui, vous voilà à nouveau célibataire et marié", a déclaré la princesse Marya.
Pierre rougit soudain et essaya longtemps de ne pas regarder Natasha. Lorsqu'il décida de la regarder, son visage était froid, sévère et même méprisant, à son avis.
– Mais avez-vous vraiment vu et parlé avec Napoléon, comme on nous l'a dit ? - dit la princesse Marya.
Pierre rit.
- Jamais jamais. Il semble toujours à tout le monde qu'être prisonnier signifie être l'hôte de Napoléon. Non seulement je ne l’ai pas vu, mais je n’ai pas non plus entendu parler de lui. J'étais en bien pire compagnie.
Le dîner se termine et Pierre, qui refuse d'abord de parler de sa captivité, s'implique peu à peu dans cette histoire.
- Mais est-ce vrai que tu es resté pour tuer Napoléon ? – lui a demandé Natasha en souriant légèrement. « Je l'ai deviné lorsque nous vous avons rencontré à la tour Sukharev ; souviens-toi?
Pierre a admis que c'était vrai, et à partir de cette question, progressivement guidé par les questions de la princesse Marya et surtout de Natasha, il s'est impliqué dans histoire détailléeà propos de vos aventures.
Au début, il parlait avec ce regard moqueur et doux qu'il avait maintenant envers les gens et surtout envers lui-même ; mais ensuite, lorsqu'il en vint au récit des horreurs et des souffrances qu'il avait vues, il se laissa emporter, sans s'en apercevoir, et commença à parler avec l'excitation contenue d'une personne qui éprouve de fortes impressions dans sa mémoire.