El papel de la presión externa en los procesos de evaporación y condensación. Evaporación de líquidos Cómo depende la presión de la evaporación
Utilizando el fenómeno de refrigeración líquida durante su evaporación; dependencia del punto de ebullición del agua con la presión.
Durante la vaporización, una sustancia pasa de un estado líquido a un estado gaseoso (vapor). Hay dos tipos de vaporización: evaporación y ebullición.
Evaporación La vaporización se produce a partir de la superficie libre de un líquido.
¿Cómo se produce la evaporación? Sabemos que las moléculas de cualquier líquido están en movimiento continuo y caótico, algunas más rápidas y otras más lentas. Las fuerzas de atracción entre sí evitan que salgan volando. Sin embargo, si una molécula con una energía cinética lo suficientemente grande aparece cerca de la superficie del líquido, entonces puede vencer las fuerzas de atracción intermolecular y salir volando del líquido. Lo mismo se repetirá con otra molécula rápida, con la segunda, la tercera, etc. Al salir volando, estas moléculas forman vapor sobre el líquido. La formación de este vapor es la evaporación.
Dado que las moléculas escapan más rápido del líquido durante la evaporación, la energía cinética promedio de las moléculas que quedan en el líquido se vuelve cada vez más pequeña. Como resultado la temperatura del líquido que se evapora disminuye: el líquido se enfría. Por eso, en particular, una persona con ropa mojada siente más frío que con ropa seca (especialmente cuando hace viento).
Al mismo tiempo, todos saben que si vierte agua en un vaso y la deja sobre la mesa, a pesar de la evaporación, no se enfriará continuamente, y se enfriará cada vez más hasta que se congele. ¿Qué impide esto? La respuesta es muy sencilla: el intercambio de calor del agua con el aire caliente que rodea el vaso.
El enfriamiento del líquido durante la evaporación es más notorio cuando la evaporación ocurre lo suficientemente rápido (para que el líquido no tenga tiempo de recuperar su temperatura debido al intercambio de calor con el medio ambiente). Los líquidos volátiles se evaporan rápidamente, en los que las fuerzas de atracción intermolecular son pequeñas, por ejemplo, éter, alcohol, gasolina. Si deja caer un líquido de este tipo en su mano, sentiremos frío. Al evaporarse de la superficie de la mano, dicho líquido se enfriará y le quitará algo de calor.
Las sustancias que se evaporan se utilizan ampliamente en ingeniería. Por ejemplo, en tecnología espacial, los vehículos de descenso están recubiertos con dichas sustancias. Al atravesar la atmósfera del planeta, el cuerpo-aparato se calienta por efecto del rozamiento, y la sustancia que lo recubre comienza a evaporarse. Al evaporarse, enfría la nave espacial, evitando así que se sobrecaliente.
El enfriamiento del agua durante su evaporación también se utiliza en instrumentos utilizados para medir la humedad del aire - psicrómetros(del griego "psychros" - frío). El psicrómetro consta de dos termómetros. Uno de ellos (seco) muestra la temperatura del aire, y el otro (cuyo depósito está atado con batista, sumergido en agua), una temperatura más baja debido a la intensidad de la evaporación de la batista húmeda. Cuanto más seco sea el aire cuya humedad se mide, mayor será la evaporación y, por lo tanto, menor será la lectura de bulbo húmedo. Por el contrario, cuanto mayor es la humedad del aire, menos intensa es la evaporación y, por tanto, mayor es la temperatura que muestra este termómetro. Sobre la base de las lecturas de los termómetros secos y húmedos, utilizando una tabla especial (psicrométrica), se determina la humedad del aire, expresada como porcentaje. La humedad más alta es del 100% (a esta humedad, aparece rocío en los objetos). Para una persona, se considera que la humedad más favorable está en el rango de 40 a 60%.
Con la ayuda de sencillos experimentos, es fácil establecer que la velocidad de evaporación aumenta con el aumento de la temperatura del líquido, así como con el aumento de su superficie libre y en presencia de viento.
¿Por qué el líquido se evapora más rápido en presencia de viento? El hecho es que simultáneamente con la evaporación en la superficie del líquido, ocurre el proceso inverso: condensación. La condensación ocurre debido al hecho de que parte de las moléculas de vapor, moviéndose aleatoriamente sobre el líquido, regresa nuevamente a él. El viento se lleva las moléculas que han salido volando del líquido y no les permite regresar.
La condensación también puede ocurrir cuando el vapor no está en contacto con el líquido. Es la condensación, por ejemplo, lo que explica la formación de nubes: las moléculas de vapor de agua que se elevan sobre la tierra en las capas más frías de la atmósfera se agrupan en pequeñas gotas de agua, cuyas acumulaciones son nubes. La condensación de vapor de agua en la atmósfera también provoca lluvia y rocío.
Temperatura de ebullición versus presión
El punto de ebullición del agua es de 100°C; se podría pensar que esta es una propiedad inherente al agua, que el agua, donde sea y en qué condiciones se encuentre, siempre hervirá a 100 °C.
Pero esto no es así, y los habitantes de los pueblos de alta montaña lo saben muy bien.
Cerca de la cima de Elbrus hay una casa para turistas y una estación científica. Los principiantes a veces se preguntan "lo difícil que es hervir un huevo en agua hirviendo" o "por qué el agua hirviendo no se quema". En estas condiciones, se les dice que el agua hierve en la cima del Elbrus ya a 82°C.
¿Cuál es el problema aquí? ¿Qué factor físico interfiere en el fenómeno de la ebullición? ¿Cuál es el significado de la altitud?
Este factor físico es la presión que actúa sobre la superficie del líquido. No es necesario subir a la cima de la montaña para comprobar la validez de lo que se ha dicho.
Al colocar agua calentada debajo de la campana y bombear o bombear aire fuera de ella, uno puede estar convencido de que el punto de ebullición aumenta cuando aumenta la presión y disminuye cuando disminuye.
El agua hierve a 100°C solo a cierta presión: 760 mm Hg. Arte. (o 1 atm).
La curva de punto de ebullición versus presión se muestra en la fig. 4.2. En la cima del Elbrus, la presión es de 0,5 atm, y esta presión corresponde a un punto de ebullición de 82 °C.
Arroz. 4.2
Pero agua hirviendo a 10-15 mm Hg. Art., puedes refrescarte cuando hace calor. A esta presión, el punto de ebullición bajará a 10-15°C.
Incluso puede obtener "agua hirviendo", que tiene la temperatura del agua helada. Para ello, tendrás que reducir la presión a 4,6 mm Hg. Arte.
Se puede observar una imagen interesante si coloca un recipiente abierto con agua debajo de la campana y bombea el aire. El bombeo hará que el agua hierva, pero hervir requiere calor. No hay de dónde sacarlo, y el agua tendrá que ceder su energía. La temperatura del agua hirviendo comenzará a descender, pero a medida que continúe el bombeo, también lo hará la presión. Por lo tanto, la ebullición no se detendrá, el agua continuará enfriándose y eventualmente se congelará.
Tal ebullición de agua fría ocurre no solo cuando se bombea aire. Por ejemplo, cuando la hélice de un barco gira, la presión en una capa de agua que se mueve rápidamente cerca de una superficie metálica cae bruscamente y el agua en esta capa hierve, es decir, aparecen numerosas burbujas llenas de vapor. Este fenómeno se llama cavitación (de la palabra latina cavitas - cavidad).
Al bajar la presión, bajamos el punto de ebullición. ¿Qué hay de aumentarlo? Un gráfico como el nuestro responde a esta pregunta. Una presión de 15 atm puede retrasar la ebullición del agua, solo comenzará a los 200°C, y una presión de 80 atm hará que el agua hierva solo a los 300°C.
Entonces, una cierta presión externa corresponde a un cierto punto de ebullición. Pero esta afirmación también se puede "dar la vuelta", diciendo esto: cada punto de ebullición del agua corresponde a su propia presión específica. Esta presión se llama presión de vapor.
La curva que representa el punto de ebullición en función de la presión es también la curva de la presión de vapor en función de la temperatura.
Las cifras trazadas en un gráfico de punto de ebullición (o gráfico de presión de vapor) muestran que la presión de vapor cambia muy rápidamente con la temperatura. A 0 °C (es decir, 273 K), la presión de vapor es de 4,6 mm Hg. Art., a 100 °C (373 K) es igual a 760 mm Hg. Art., es decir, aumenta en 165 veces. Cuando la temperatura se duplica (de 0 °C, es decir, 273 K, a 273 °C, es decir, 546 K), la presión de vapor aumenta de 4,6 mm Hg. Arte. hasta casi 60 atm, es decir, unas 10.000 veces.
Por lo tanto, por el contrario, el punto de ebullición cambia bastante lentamente con la presión. Cuando la presión se duplica de 0,5 atm a 1 atm, el punto de ebullición aumenta de 82°C (355 K) a 100°C (373 K) y cuando la presión se duplica de 1 a 2 atm, de 100°C (373 K) K) a 120°C (393 K).
La misma curva que ahora estamos considerando también controla la condensación (espesamiento) del vapor en agua.
El vapor se puede convertir en agua ya sea por compresión o enfriamiento.
Tanto durante la ebullición como durante la condensación, el punto no se moverá fuera de la curva hasta que se complete la conversión de vapor a agua o de agua a vapor. Esto también se puede formular de la siguiente manera: bajo las condiciones de nuestra curva, y solo bajo estas condiciones, es posible la coexistencia de líquido y vapor. Si al mismo tiempo no se agrega ni se quita calor, entonces las cantidades de vapor y líquido en un recipiente cerrado permanecerán sin cambios. Se dice que tal vapor y líquido están en equilibrio, y un vapor en equilibrio con su líquido se dice que está saturado.
La curva de ebullición y condensación, como vemos, tiene otro significado: es la curva de equilibrio de líquido y vapor. La curva de equilibrio divide el campo del diagrama en dos partes. A la izquierda y hacia arriba (hacia temperaturas más altas y presiones más bajas) está la región del estado estacionario del vapor. A la derecha y hacia abajo, la región del estado estable del líquido.
La curva de equilibrio vapor-líquido, es decir, la dependencia del punto de ebullición de la presión o, lo que es lo mismo, la presión de vapor de la temperatura, es aproximadamente la misma para todos los líquidos. En algunos casos, el cambio puede ser algo más abrupto, en otros, algo más lento, pero siempre la presión de vapor aumenta rápidamente con el aumento de la temperatura.
Hemos usado las palabras "gas" y "vapor" muchas veces. Estas dos palabras son más o menos lo mismo. Podemos decir: agua gas es el vapor de agua, gas oxígeno es el vapor de un oxígeno líquido. Sin embargo, se ha desarrollado algún hábito en el uso de estas dos palabras. Como estamos acostumbrados a un cierto rango de temperatura relativamente pequeño, generalmente aplicamos la palabra "gas" a aquellas sustancias cuya presión de vapor a temperaturas ordinarias está por encima de la presión atmosférica. Por el contrario, hablamos de vapor cuando, a temperatura ambiente y presión atmosférica, la sustancia es más estable en forma líquida.
El proceso de evaporación intensa de un líquido comienza a una temperatura en la que la presión de vapor del líquido excede la presión externa de la atmósfera gaseosa sobre el líquido. En el punto de ebullición, la formación de vapor se produce en toda la masa del líquido y fluye a una temperatura casi constante hasta la transición completa del líquido (monocomponente) y el vapor. Al bajar artificialmente la presión, es posible hacer que el líquido hierva a temperaturas más bajas, lo cual es muy utilizado en tecnología, ya que es más fácil encontrar material adecuado para equipos para trabajar a bajas temperaturas. La tecnología de vacío moderna tiene a su disposición potentes bombas rotativas capaces de crear un vacío en el que la presión residual no supera los 0,001 mmHg y bombas de difusión por chorro que crean un vacío de hasta 10v-7-10v-8 mmHg. Arte.La destilación al vacío se utiliza para obtener metales de alta pureza; Zn, Cd, Mg, Ca, etc. Suelen trabajar a presiones ligeramente superiores a la presión de vapor del metal destilado en su punto de fusión. Luego, al destilar el metal líquido, se obtiene un condensado sólido, lo que hace posible aplicar un diseño muy simple del aparato de destilación que se muestra en la Fig. 24. El dispositivo es un cilindro, en la parte inferior del cual hay un recipiente con metal líquido destilado. Los vapores se condensan en la parte superior del cilindro en un cilindro de metal compuesto especial (condensador) en forma de una costra cristalina que, una vez finalizado el proceso, se elimina junto con el condensador. Antes de calentar el metal, primero, el aire se bombea fuera del dispositivo con una bomba de vacío, y luego, de vez en cuando, se restablece el vacío, que cambia debido a la fuga de aire del exterior a través de las fugas del equipo. Si el aparato es suficientemente hermético, entonces durante el proceso de destilación, dado que no se liberan gases no condensables, no es necesario el funcionamiento constante de la bomba de vacío.
El dispositivo descrito es extremadamente simple, está hecho de acero o aleaciones de metales resistentes al calor. Lo que es especialmente importante, su cubierta y todas las piezas de sellado - sellado se enfrían con agua, es decir, funcionan a temperatura ambiente, lo que permite el uso de selladores muy avanzados - caucho, masillas de vacío, etc. El uso de vacío permite la limpieza por destilación a temperaturas relativamente bajas (700 -900 °) tales metales químicamente activos y muy agresivos como calcio, magnesio, bario, cuya destilación a presión atmosférica no es factible debido a la imposibilidad de seleccionar material para el equipo.
Consideremos las características del proceso de evaporación en vacío.
El diagrama de estado líquido - vapor con presión decreciente tiene el mismo carácter que los diagramas de presión atmosférica, solo las líneas de líquido y vapor se mueven hacia la región de temperaturas más bajas. De ello se deduce que la eficiencia de separación de los componentes durante la evaporación de su solución al vacío es aproximadamente la misma que a presión atmosférica, pero se lleva a cabo a temperaturas más bajas; la temperatura es más baja cuanto más profundo es el vacío aplicado. Una característica de la operación al vacío es la ausencia de arrastre de pequeñas gotas de líquido junto con vapores, lo que siempre se observa cuando se opera a presión atmosférica. Durante la ebullición rápida del líquido, las burbujas de vapor que revientan y se elevan desde la profundidad del líquido producen salpicaduras, que son arrastradas por los vapores al condensador y contaminan el destilado. En el vacío (suficientemente profundo), no se producen salpicaduras, ya que el proceso de ebullición es fundamentalmente diferente de la ebullición a presión atmosférica. En el vacío, la formación de vapor ocurre solo en la superficie del líquido, no se forman burbujas dentro del líquido, la superficie está tranquila, no hierve, por lo tanto, no pueden ocurrir salpicaduras. Por lo tanto, la destilación al vacío produce un destilado más puro que la destilación atmosférica.
Usemos un ejemplo para mostrar la peculiaridad del proceso de ebullición en el vacío. En un caso, deje hervir agua en un recipiente con una profundidad de capa de 250 mm a presión atmosférica (760 mm Hg). Luego, el vapor liberado de la superficie del agua, para vencer la presión externa, debe tener presión atmosférica (760 mm Hg), que se desarrolla a una temperatura de la superficie del agua de 100 °. La burbuja de vapor que se forma en el fondo del recipiente debe tener una presión mayor, ya que, además de la presión de la atmósfera, necesita vencer la presión hidrostática de una columna de agua de 250 mm de altura, lo que corresponde a una sobrepresión de 18 mm Hg. Arte. Por lo tanto, el vapor que sale del fondo del recipiente debe tener una presión de 760 + 18 = 778 mm Hg. Art., que corresponde a la temperatura del agua en el fondo del recipiente 100,6 °. Un sobrecalentamiento tan pequeño del agua en el fondo (0,6°) es bastante real, y el proceso de ebullición procede de tal manera que se forma vapor en toda la masa de la capa. El agua hierve vigorosamente y salpica cuando las burbujas se rompen en la superficie.
Ahora considere hervir la misma capa de agua en un vacío de 4,58 mm Hg. Arte. Para que hierva, la capa superficial del agua debe tener una temperatura de 0°, a la cual la presión de vapor saturado es de 4,58 mm Hg. Arte. La burbuja que se forma en el fondo debe vencer la presión hidrostática de una columna de agua de 250 mm, lo que corresponde a una presión de 18 mm Hg. Art., y tienen una presión total de 4,58 + 18 = 22,58 mm Hg. Arte. El agua tendrá tal presión de vapor saturada a una temperatura de ~ 23 °, es decir, para que se forme una burbuja de vapor en el fondo del recipiente, es necesario tener una temperatura de 23 ° en el fondo. Es imposible obtener tal diferencia entre las temperaturas cerca del fondo y en la superficie, ya que esto será impedido por las corrientes de convección. En consecuencia, no se formarán burbujas en la profundidad de la capa de líquido y la vaporización se llevará a cabo únicamente desde la superficie del líquido.
Los fundidos metálicos tienen una alta conductividad térmica, lo que evita el sobrecalentamiento local del líquido y, en consecuencia, la ebullición con formación de burbujas.
Hasta que la presión en el dispositivo se vuelve muy pequeña, tiene lugar un intercambio de moléculas entre la superficie del líquido y el vapor y se establece un equilibrio líquido-vapor móvil. Una corriente de vapor de gas convencional fluye hacia el condensador y los resultados del proceso de destilación están determinados por el diagrama de estado líquido-vapor.
Si la presión en el aparato es tan baja que el camino libre medio de las moléculas se hace mayor que las dimensiones del aparato, la naturaleza del proceso de destilación cambia radicalmente.
En estas condiciones, no hay intercambio de moléculas entre los vapores y el líquido, no se establece un equilibrio líquido-vapor móvil y el diagrama de estado líquido-vapor no describe el proceso de evaporación. Escara de gas ordinaria entre el evaporador y el condensador. Se forma, las moléculas de vapor separadas de la superficie del líquido siguen un camino recto, sin chocar con otras moléculas, caen sobre la superficie fría del condensador y permanecen allí, se condensan; el proceso de evaporación es completamente irreversible y tiene el carácter de evaporación molecular. El resultado de la destilación está determinado por la tasa de evaporación, que depende del tipo de sustancia evaporada y de la temperatura y es independiente de la presión externa en el sistema, si esta presión es suficientemente baja. La tasa de evaporación en estas condiciones se puede calcular utilizando la fórmula de Langmuir:
Tomando como tasa de evaporación la masa de una sustancia que se evapora por segundo de una unidad de superficie, expresando la presión de vapor p en milímetros de mercurio y reemplazando los valores de R y π por sus valores numéricos, obtenemos la ecuación (III, 13 ) en una forma diferente, conveniente para cálculos prácticos:
En la evaporación molecular, las sustancias con la misma presión de vapor se pueden separar si sus pesos moleculares son diferentes, como lo demuestran los experimentos de separación de isótopos.
17.10.2019
En el segmento ruso, el negocio de Hoffmann-group está floreciendo. Los socios del grupo de empresas logran aumentar los volúmenes de ventas en la Federación Rusa de año en año....
17.10.2019
El plástico es un material práctico y económico. Esta es la razón de su amplia aplicación en la producción de cosas. Sin embargo, también tiene desventajas...
17.10.2019
El acero inoxidable es ampliamente utilizado en diversos campos de la industria y la construcción. El metal laminado y sus productos son utilizados por empresas de construcción naval y ...
17.10.2019
El alambre de tejer es un material de construcción en forma de un hilo delgado, para cuya fabricación se utiliza acero laminado con bajo contenido de carbono, sujeto a...
17.10.2019
Los paneles de corcho están hechos de material natural. Para ello se utiliza la corteza de roble (el alcornoque crece en el norte de África y en algunas zonas del sur...
17.10.2019
La actividad económica humana a menudo mejora el proceso de erosión natural del suelo. El relieve va cambiando poco a poco, se van creando canales, va cambiando la dirección del río, las acequias…
17.10.2019
Las funciones de las etiquetas pueden variar. Después de ser etiquetados en un producto, se convierten en una fuente de datos sobre el fabricante y los productos, se utilizan como medio de promoción y...
Evaporación
Evaporación sobre una taza de té
Evaporación- el proceso de transición de una sustancia de un estado líquido a un estado gaseoso, que ocurre en la superficie de una sustancia (vapor). El proceso de evaporación es el inverso del proceso de condensación (transición de vapor a líquido). Evaporación (vaporización), la transición de una sustancia de una fase condensada (sólida o líquida) a una fase gaseosa (vapor); transición de fase de primer orden.
Hay un concepto más detallado de la evaporación en la física superior.
Evaporación- este es un proceso en el que las partículas (moléculas, átomos) salen volando (arrancan) de la superficie de un líquido o sólido, mientras que E k > E p.
características generales
La evaporación de un cuerpo sólido se llama sublimación (sublimación), y la vaporización en el volumen de un líquido se llama ebullición. Por lo general, se entiende por evaporación la vaporización en la superficie libre de un líquido como resultado del movimiento térmico de sus moléculas a una temperatura por debajo del punto de ebullición correspondiente a la presión del medio gaseoso situado por encima de la superficie especificada. En este caso, las moléculas con una energía cinética suficientemente grande escapan de la capa superficial del líquido al medio gaseoso; algunos de ellos son reflejados y capturados por el líquido, mientras que el resto se pierde irremediablemente.
La evaporación es un proceso endotérmico en el que se absorbe el calor de transición de fase: el calor de evaporación gastado en vencer las fuerzas de cohesión molecular en la fase líquida y en el trabajo de expansión durante la transformación de líquido en vapor. El calor específico de vaporización se refiere a 1 mol de líquido (calor molar de vaporización, J/mol) o a su unidad de masa (calor de masa de vaporización, J/kg). La tasa de evaporación está determinada por la densidad superficial del flujo de vapor jп, que penetra por unidad de tiempo en la fase gaseosa desde una unidad de superficie líquida [en mol / (s.m 2) o kg / (s.m 2)]. El valor más alto de jp se logra en el vacío. En presencia de un medio gaseoso relativamente denso por encima del líquido, la evaporación se ralentiza debido al hecho de que la velocidad de eliminación de las moléculas de vapor de la superficie del líquido hacia el medio gaseoso se vuelve pequeña en comparación con la velocidad de su emisión por el líquido. . En este caso, cerca de la interfase se forma una capa de una mezcla vapor-gas, prácticamente saturada con vapor. La presión parcial y la concentración de vapor en esta capa es mayor que en la mayor parte de la mezcla de vapor y gas.
El proceso de evaporación depende de la intensidad del movimiento térmico de las moléculas: cuanto más rápido se mueven las moléculas, más rápido ocurre la evaporación. Además, factores importantes que afectan el proceso de evaporación son la tasa de difusión externa (con respecto a la sustancia), así como las propiedades de la sustancia misma. En pocas palabras, con el viento, la evaporación ocurre mucho más rápido. En cuanto a las propiedades de la sustancia, por ejemplo, el alcohol se evapora mucho más rápido que el agua. Un factor importante es también el área superficial del líquido a partir del cual se produce la evaporación: desde un decantador estrecho, se producirá más lentamente que desde un plato ancho.
Nivel molecular
Considere este proceso a nivel molecular: las moléculas que tienen suficiente energía (velocidad) para superar la atracción de las moléculas vecinas salen de los límites de la sustancia (líquido). En este caso, el líquido pierde parte de su energía (se enfría). Por ejemplo, un líquido muy caliente: soplamos sobre su superficie para enfriarlo, mientras aceleramos el proceso de evaporación.
Equilibrio termodinámico
La violación del equilibrio termodinámico entre el líquido y el vapor contenido en la mezcla gas-vapor se explica por el salto de temperatura en el límite de fase. Sin embargo, este salto generalmente se puede despreciar y se puede suponer que la presión parcial y la concentración de vapor en la interfaz corresponden a sus valores para el vapor saturado a la temperatura de la superficie del líquido. Si el líquido y la mezcla gas-vapor están inmóviles y la influencia de la convección libre en ellos es insignificante, la eliminación del vapor formado durante la evaporación desde la superficie del líquido hacia el medio gaseoso se produce principalmente como resultado de la difusión molecular y la apariencia del flujo másico (el llamado Stefan) de una mezcla de vapor y gas dirigida desde la superficie de un líquido hacia un medio gaseoso (ver Difusión). Distribución de temperatura bajo diferentes modos de refrigeración líquida evaporativa. Los flujos de calor se dirigen: a - desde la fase líquida a la superficie de evaporación hacia la fase gaseosa; b - de la fase líquida solamente a la superficie de evaporación; c - a la superficie de evaporación desde el lado de ambas fases; d - a la superficie de evaporación solo desde el lado de la fase gaseosa.
Baro-, difusión térmica
Los efectos de la difusión baro y térmica generalmente no se tienen en cuenta en los cálculos de ingeniería, pero el efecto de la difusión térmica puede ser significativo con una alta falta de homogeneidad de la mezcla de gas y vapor (con una gran diferencia en las masas molares de sus componentes) y gradientes de temperatura significativos. Cuando una o ambas fases se mueven en relación con su interfaz, aumenta el papel de la transferencia convectiva de materia y energía de la mezcla vapor-gas y líquido.
En ausencia de suministro de energía al sistema líquido-gas desde ext. fuentes de calor La evaporación se puede suministrar a la capa superficial del líquido desde una o ambas fases. En contraste con el flujo resultante de una sustancia, que siempre se dirige durante la evaporación de un líquido a un medio gaseoso, los flujos de calor pueden tener diferentes direcciones dependiendo de la relación de temperaturas de la mayor parte del líquido tl, el límite de fase tgr y el medio gaseoso tg. Cuando una determinada cantidad de líquido entra en contacto con un volumen semi-infinito o un flujo de medio gaseoso que lava su superficie y a una temperatura del líquido superior a la temperatura del gas (tl > tgr > tg), se produce un flujo de calor por el lado del líquido a la interfaz: (Qlg = Qzh - Qi, donde Qi es el calor de evaporación, Qzhg es la cantidad de calor transferido del líquido al medio gaseoso. En este caso, el líquido se enfría (el llamado enfriamiento por evaporación ) Si, como resultado de dicho enfriamiento, se alcanza la igualdad tgr \u003d tg, se detiene la transferencia de calor del líquido al gas ( Qzhg = 0) y todo el calor suministrado desde el lado del líquido a la interfaz se gasta en evaporación (Ql = Qi).
En el caso de un medio gaseoso que no esté saturado de vapor, la presión parcial de este último en la interfase y en Ql = Qi permanece mayor que en el grueso del gas, por lo que la evaporación y el enfriamiento evaporativo del el líquido no se detiene y tgr se vuelve más bajo que tl y tg. En este caso, se suministra calor a la interfaz desde ambas fases hasta que, como resultado de una disminución de tl, se alcanza la igualdad tgr = tl y se detiene el flujo de calor del lado líquido, y del lado del gas medio Qgl se vuelve igual a Qi. La evaporación adicional del líquido ocurre a una temperatura constante tm = tl = tgr, que se denomina límite de enfriamiento del líquido durante el enfriamiento por evaporación o la temperatura del termómetro húmedo (ya que se muestra en el termómetro húmedo del psicrómetro). El valor de tm depende de los parámetros del medio gas-vapor y de las condiciones de transferencia de calor y masa entre las fases líquida y gaseosa.
Si un líquido y un medio gaseoso, que tienen diferentes temperaturas, están en un volumen limitado que no recibe energía del exterior y no la cede, se produce la evaporación hasta que se produce el equilibrio termodinámico entre las dos fases, en el que las temperaturas de ambas fases se igualan a una entalpía constante del sistema y la fase gaseosa se satura con vapor a la temperatura del sistema tad. Esta última, llamada temperatura de saturación adiabática del gas, está determinada únicamente por los parámetros iniciales de ambas fases y no depende de las condiciones de transferencia de calor y masa.
Tasa de evaporación
La tasa de evaporación isotérmica [kg / (m 2 s)] con difusión de vapor unidireccional en una capa fija de una mezcla binaria de vapor y gas ubicada sobre la superficie del líquido con un espesor d, [m] se puede encontrar mediante la fórmula de Stefan: , donde D es el coeficiente de difusión mutua, [m 2 /con]; - vapor constante de gas, [J / (kg K)] o [m 2 / (s 2 K)]; T es la temperatura de la mezcla, [K]; p es la presión de la mezcla gas-vapor, [Pa]; - presión de vapor parcial en la interfaz y en el límite exterior de la capa de mezcla, [Pa].
En el caso general (líquido y gas en movimiento, condiciones no isotérmicas), en la capa límite del líquido adyacente a la interfaz, la transferencia de cantidad de movimiento va acompañada de transferencia de calor, y en la capa límite del gas (vapor-gas mezcla), ocurren transferencias interconectadas de calor y masa. En este caso, para calcular la tasa de evaporación, se utilizan coeficientes experimentales de transferencia de calor y masa y, en casos relativamente más simples, métodos aproximados para resolver numéricamente un sistema de ecuaciones diferenciales para capas límite conjugadas de las fases gas y líquida.
La intensidad de la transferencia de masa durante la evaporación depende de la diferencia en los potenciales químicos del vapor en la interfase y en la mayor parte de la mezcla vapor-gas. Sin embargo, si se puede despreciar la difusión baro y térmica, la diferencia de potenciales químicos se reemplaza por la diferencia de presiones parciales o concentraciones de vapor y toma: cp, gr - cp, osn), donde bp, bc - coeficiente de transferencia de masa, p - presión de la mezcla, pp - presión de vapor parcial, yp = pp / p - concentración de vapor molar, cp = rp / r - concentración de vapor en masa, rp, r - densidades locales de vapores y mezclas; los índices significan: "gr" - en el límite de fase, "principal" - en el principal. la masa de la mezcla. La densidad del flujo de calor emitido durante la evaporación por el líquido es [en J/(m2 · s)]: q = azh(tl - tgr) = rjp + ag (tgr - tg), donde azh, ag son la transferencia de calor coeficiente de los lados de líquido y gas , [W / (m 2 K)]; r - Evaporación de calor, [J/kg].
En radios de curvatura muy pequeños de la superficie de evaporación (por ejemplo, durante la evaporación de pequeñas gotas de líquido), se tiene en cuenta la influencia de la tensión superficial del líquido, lo que lleva al hecho de que la presión de vapor de equilibrio por encima de la interfaz es mayor que la presión de vapor saturado del mismo líquido sobre una superficie plana. Si tgr ~ tl, al calcular la evaporación, solo se puede tener en cuenta la transferencia de calor y masa en la fase gaseosa. A una intensidad relativamente baja de transferencia de masa, la analogía entre los procesos de transferencia de calor y masa es aproximadamente válida, de lo cual se sigue: Nu/Nu0 = Sh*/Sh0, donde Nu = ag l/lg es el número de Nusselt, l es el tamaño característico de la superficie de evaporación, lg es la conductividad térmica de la mezcla vapor-gas, Sh* = bpyg, grl/Dp = bccg, grl/D es el número de Sherwood para la componente de difusión del flujo de vapor, Dp = D/ RpT es el coeficiente de difusión relacionado con el gradiente de presión parcial del vapor. Los valores de bp y bc se calculan a partir de las proporciones anteriores, los números Nu0 y Sh0 corresponden a jp: 0 y se pueden determinar a partir de los datos para procesos de transferencia de calor y masa que ocurren por separado. El número Sh0 para el flujo de vapor total (difusión y convección) se encuentra dividiendo Sh* por la concentración de gas molar (yg, gr) o másica (sg, gr) en la interfaz, dependiendo de qué fuerza impulsora de masa transfiere el coeficiente b está asignado a.
ecuaciones
Las ecuaciones de similitud para Nu y Sh* durante la evaporación incluyen, además de los criterios habituales (números de Reynolds Re, Arquímedes Ar, Prandtl Pr o Schmidt Sc y parámetros geom.), parámetros que tienen en cuenta la influencia del flujo de vapor transversal y el grado de falta de homogeneidad de la mezcla de vapor y gas (relaciones de masas molares o constantes de gas de sus componentes) en perfiles, velocidades, temperaturas o concentraciones en la sección transversal de la capa límite.
A jp pequeño, que no viola significativamente el régimen hidrodinámico de movimiento de la mezcla de gas y vapor (por ejemplo, durante la evaporación del agua en el aire atmosférico) y la similitud de las condiciones límite de los campos de temperatura y concentración, la influencia de argumentos adicionales en las ecuaciones de similitud es insignificante y puede despreciarse, asumiendo que Nu = Sh. Cuando las mezclas de varios componentes se evaporan, estas regularidades se vuelven mucho más complicadas. En este caso, los calores de evaporación de los componentes de la mezcla y las composiciones de las fases líquida y vapor-gas, que se encuentran en equilibrio entre sí, son diferentes y dependen de la temperatura. Cuando una mezcla líquida binaria se evapora, la mezcla de vapor resultante es relativamente más rica en un componente más volátil, excluyendo solo las mezclas azeotrópicas que se evaporan en los puntos extremos (máximo o mínimo) de las curvas de estado como un líquido puro.
Diseños de aparatos
La cantidad total de líquido que se evapora aumenta con el aumento de la superficie de contacto de las fases líquida y gaseosa; por lo tanto, el diseño de los dispositivos en los que se produce la evaporación prevé un aumento de la superficie de evaporación creando un gran espejo de líquido, dividiéndolo en chorros y gotas, o formando películas delgadas que fluyen hacia abajo sobre la superficie de las boquillas. También se logra un aumento en la intensidad de la transferencia de calor y masa durante la evaporación aumentando la velocidad del medio gaseoso en relación con la superficie del líquido. Sin embargo, un aumento de esta velocidad no debe conducir a un arrastre excesivo de líquido por el medio gaseoso ya un aumento significativo de la resistencia hidráulica del aparato.
Solicitud
La evaporación se usa ampliamente en la práctica industrial para la limpieza de sustancias, el secado de materiales, la separación de mezclas líquidas y el aire acondicionado. El enfriamiento por evaporación del agua se utiliza en los sistemas de suministro de agua circulante de las empresas.
ver también
Literatura
- // Diccionario Enciclopédico de Brockhaus y Efron: En 86 tomos (82 tomos y 4 adicionales). - San Petersburgo. , 1890-1907.
- Berman L.D., Refrigeración por evaporación del agua en circulación, 2ª ed., M.-L., 1957;
- Fuchs N. A., Evaporación y crecimiento de gotas en un medio gaseoso, M., 1958;
- Byrd R., Stuart W., Lightfoot E., Transfer Phenomena, trad. del inglés, M., 1974;
- Berman L. D., “Fundamentos teóricos de Chem. tecnologías”, 1974, vol.8, no.6, p. 811-22;
- Sherwood T., Pigford R., Wilkie C., Transferencia de masa, trad. del inglés., M., 1982. L. D. Berman.
Enlaces
Fundación Wikimedia. 2010 .
Sinónimos:Vea qué es "Evaporación" en otros diccionarios:
La transición en va de un estado líquido o sólido de agregación a un estado gaseoso (vapor). I. se suele entender como la transición de un líquido a vapor, que se produce en la superficie libre del líquido. I. Los llamados cuerpos sólidos. sublimación o sublimación. Dependencia de la presión ... ... Enciclopedia Física
Vaporización que ocurre en la superficie libre de un líquido. La evaporación desde la superficie de un sólido se llama sublimación... Gran diccionario enciclopédico
COMBUSTIÓN DE LÍQUIDOS
La combustión de líquidos se caracteriza por dos fenómenos interrelacionados: la evaporación y la combustión de la mezcla vapor-aire sobre la superficie del líquido. En consecuencia, la combustión de líquidos va acompañada no solo de una reacción química (oxidación, que se convierte en combustión con llama), sino también de fenómenos físicos (evaporación y formación de una mezcla vapor-aire sobre la superficie del líquido), sin los cuales la combustión es imposible.
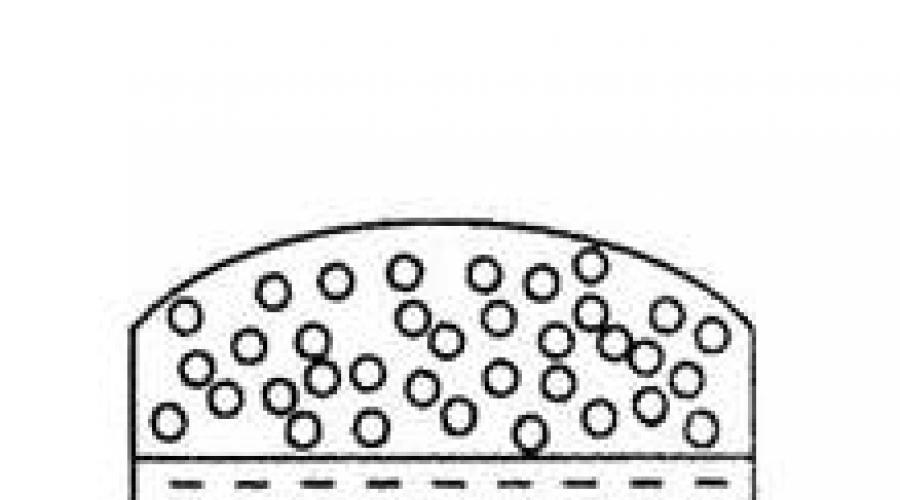
La transición de una sustancia de un estado líquido a un estado de vapor se llama vaporización. Hay dos formas de este proceso: evaporación y ebullición. Evaporación- esta es la transición de líquido a vapor desde la superficie libre a una temperatura por debajo del punto de ebullición del líquido (ver Fig. 4.1). La evaporación ocurre como resultado del movimiento térmico de las moléculas líquidas. La velocidad de movimiento de las moléculas varía ampliamente, desviándose fuertemente en ambas direcciones de su valor promedio. Algunas de las moléculas con una energía cinética suficientemente grande escapan de la capa superficial del líquido al medio gaseoso (aire). El exceso de energía de las moléculas perdidas por el líquido se gasta en vencer las fuerzas de interacción entre las moléculas y el trabajo de expansión (aumento de volumen) durante la transición del líquido a vapor. Hirviendo- esto es evaporación no solo de la superficie, sino también del volumen del líquido por la formación de burbujas de vapor en todo el volumen y su liberación. La evaporación se observa a cualquier temperatura del líquido. La ebullición ocurre solo a una temperatura a la cual la presión de vapor saturado alcanza el valor de la presión externa (atmosférica).
Debido al movimiento browniano en la zona de gas, también tiene lugar el proceso inverso: condensación. Si el volumen sobre el líquido está cerrado, entonces, a cualquier temperatura del líquido, se establece un equilibrio dinámico entre los procesos de evaporación y condensación.
El vapor en equilibrio con el líquido se llama vapor saturado. El estado de equilibrio corresponde a la concentración de vapor determinada para una temperatura dada. La presión de un vapor en equilibrio con un líquido se llama Presión de vapor saturado.

Arroz. 4.1. Esquema de evaporación de líquido en: a) un recipiente abierto, b) un recipiente cerrado
La presión de vapor saturado (p n.p.) de un líquido dado a una temperatura constante es una constante y no cambia para él. El valor de la presión de vapor de saturación está determinado por la temperatura del líquido: al aumentar la temperatura, aumenta la presión de vapor de saturación. Esto se debe al aumento de la energía cinética de las moléculas líquidas al aumentar la temperatura. En este caso, una fracción cada vez mayor de moléculas resulta tener energía suficiente para convertirse en vapor.
Así, por encima de la superficie (espejo) del líquido existe siempre una mezcla vapor-aire, que en estado de equilibrio se caracteriza por la presión de los vapores saturados del líquido o su concentración. Con el aumento de la temperatura, la presión de vapor saturado aumenta de acuerdo con la ecuación de Claiperon-Clasius:
 , (4.1)
, (4.1)
o en forma integral:
 , (4.2)
, (4.2)
donde p np – presión de vapor saturado, Pa;
DH isp es el calor de vaporización, la cantidad de calor que es necesaria para convertir una unidad de masa de líquido en un estado de vapor, kJ / mol;
T es la temperatura del líquido, K.
La concentración de vapor saturado C sobre la superficie del líquido está relacionada con su presión por la relación:
 . (4.3)
. (4.3)
De (4.1 y 4.2) se deduce que a medida que aumenta la temperatura del líquido, la presión de los vapores saturados (o su concentración) aumenta exponencialmente. En este sentido, a cierta temperatura, se crea una concentración de vapor sobre la superficie del líquido, igual al límite inferior de concentración de propagación de la llama. Esta temperatura se denomina límite inferior de temperatura de propagación de la llama (LTLP).
Por lo tanto, para cualquier líquido siempre existe un intervalo de temperatura en el que la concentración de vapores saturados sobre el espejo estará en la región de ignición, es decir, HKPRP £ j n £ VKPRP.
Para regular la presión de evaporación, utilice el regulador KVP, que está instalado en la línea de succión aguas abajo del evaporador (Fig. 6.13).
Además de su función principal, el regulador de presión de evaporación proporciona protección en caso de una fuerte caída de la presión de evaporación para evitar la congelación del agua enfriada en la ruta de intercambio de calor de los evaporadores de enfriadores de agua.
El regulador funciona de la siguiente manera: cuando la presión sube por encima de la presión establecida, el regulador se abre, y cuando la presión cae por debajo del valor establecido, se cierra. La señal de control es solo la presión en la entrada al regulador.
En instalaciones con varios evaporadores y que funcionan a diferentes presiones de evaporación, el regulador se instala después del evaporador, en el que la presión es mayor. Para evitar la condensación del refrigerante durante las paradas, se monta una válvula de retención en la línea de succión inmediatamente después del evaporador con presión mínima. En instalaciones con evaporadores en paralelo y compresor común, se instala un regulador en la línea de aspiración para mantener la misma presión en los evaporadores.
Además de este tipo de regulador, la presión de evaporación se estabiliza mediante sistemas de control electrónico para una o más cámaras frigoríficas, armarios, etc., proporcionando una alta precisión en el mantenimiento de la temperatura de consigna (± 0,5 K) en un amplio rango de potencia frigorífica - del 10 al 100% del valor nominal.
8. Reguladores de rendimiento.
Los controladores de capacidad (Fig. 6.14) ayudan a que la capacidad frigorífica del compresor se adapte al cambio de la carga térmica del evaporador en instalaciones con muy baja carga de refrigerante. Evitan bajas presiones de aspiración y arranques inútiles.

A medida que disminuye la carga térmica del evaporador, la presión de aspiración desciende, provocando un vacío en el circuito, lo que conlleva el peligro de entrada de humedad en la instalación. Cuando la presión de aspiración desciende por debajo del valor ajustado, el regulador se abre, provocando el paso de un determinado volumen de gases calientes desde la descarga a la aspiración. Como resultado, la presión de succión aumenta y la capacidad de enfriamiento disminuye. El regulador reacciona solo a la presión en la línea de succión, es decir. a la salida de la misma.
9. Reguladores de arranque.
Los reguladores de arranque evitan que el compresor funcione y arranque a valores de presión de succión demasiado altos, lo que ocurre después de una parada prolongada de la máquina o después de descongelar el evaporador.
El regulador de arranque KVL pertenece al tipo de reguladores de presión de estrangulamiento "después de sí mismo". Mantiene una presión constante en la línea de succión entre el regulador y el compresor y descarga el compresor en el arranque.
La presión de entrada del regulador actúa sobre el fuelle desde abajo y sobre la placa de la válvula desde arriba. Dado que el área efectiva del fuelle es equivalente al área del orificio, la presión de entrada se neutraliza. La presión de salida (en el cárter) actúa sobre el plato de la válvula desde abajo, contrarrestando la fuerza de tensión del resorte ajustable. Estas dos fuerzas son las fuerzas actuantes del regulador. Cuando la presión regulada en la salida (en el cárter) disminuye, la válvula se abre y pasa vapor de refrigerante al compresor. Para sistemas de refrigeración de gran capacidad, es posible el montaje paralelo de arrancadores KVL. En este caso, los reguladores se seleccionan a partir de la condición de la misma caída de presión en cada tubería y desempeño equivalente. 
El regulador se ajusta a los valores máximos, sin exceder, sin embargo, los valores recomendados por el fabricante para el compresor o la unidad condensadora. El ajuste se realiza de acuerdo con las lecturas del manómetro en la línea de succión del compresor.
El regulador de arranque está instalado en la línea de succión entre el evaporador y el compresor (Fig. 6.15).
En este regulador, es posible conectar una línea de extracción de vapor a través de una salida manométrica en la tubería de entrada que tiene un diámetro de orificio de 1/4". Con este método de regulación, la extracción de vapor se realiza "después de sí mismo".
La elección de un regulador de arranque está determinada por cinco indicadores principales:
El tipo de refrigerante
rendimiento de sistema,
presión de diseño de succión,
Presión máxima de diseño,
caída de presión en el regulador.
La diferencia entre la presión de succión de diseño y la máxima de diseño determina cuánto tiempo se abrirá la válvula. La caída de presión en el regulador es un factor importante ya que las pérdidas de presión en la línea de succión afectan el rendimiento de la máquina. Por lo tanto, la caída de presión en el regulador debe mantenerse al mínimo. Normalmente, en los sistemas de refrigeración de baja temperatura, la caída de presión es de 3...7 kPa. La caída de presión máxima para la mayoría de los sistemas de refrigeración es de 14 kPa.
En la apertura máxima de la válvula, el regulador, por un lado, proporciona el máximo rendimiento y, por otro lado, provoca grandes pérdidas de presión, lo que reduce el rendimiento del sistema. Por lo tanto, la caída de presión en el regulador debe mantenerse lo más baja posible.