Velocidad normal de propagación de la llama. Influencia de varios factores en la velocidad de la llama Velocidad máxima de la llama de la quema de propano
Sobre la superficie de un líquido o sólido a cualquier temperatura hay una mezcla de vapor y aire, cuya presión en el estado de equilibrio está determinada por la presión de los vapores saturados o su concentración. Con un aumento de la temperatura, la presión de los vapores saturados aumentará pero exponencialmente (Ecuación de Clapeyron - Clausis):
donde P n „ - presión de vapor saturado, Pa; Q„ C11 - calor de vaporización, kJ/mol; T- temperatura del líquido, K.
Para cualquier líquido, existe un rango de temperatura en el que la concentración de vapores saturados sobre el espejo (superficie del líquido) estará en la región de ignición, es decir NKPV
Para crear LCVV de vapores, es suficiente calentar no todo el líquido, sino solo su capa superficial, a una temperatura igual a LTPV.
En presencia de una fuente de ignición, tal mezcla será capaz de ignición. En la práctica, los conceptos de "punto de inflamación" y "temperatura de ignición" se utilizan con mayor frecuencia.
Punto de inflamación: la temperatura mínima de un líquido a la que se forma una concentración de vapor por encima de su superficie, capaz de encenderse por una fuente de ignición, pero la tasa de formación de vapor es insuficiente para sostener la combustión.
Por lo tanto, tanto en el punto de inflamación como en el límite inferior de temperatura de ignición por encima de la superficie del líquido, se forma un límite inferior de concentración de ignición; sin embargo, en el último caso, los vapores saturados crean LEL. Por lo tanto, el punto de inflamación siempre es algo más alto que el LTLW. Aunque en el punto de inflamación se produce una ignición a corto plazo del vapor, que no es capaz de convertirse en una combustión estable del líquido, sin embargo, en determinadas condiciones, la inflamación puede provocar un incendio.
El punto de inflamación se toma como base para la clasificación de líquidos en inflamables (líquidos inflamables) y líquidos combustibles (FL). Los líquidos inflamables incluyen líquidos con un punto de inflamación en un recipiente cerrado de 61 °C e inferior, líquidos combustibles con un punto de inflamación de más de 61 °C.
Experimentalmente, el punto de inflamación se determina en dispositivos abiertos y cerrados. En recipientes cerrados, los puntos de inflamación son siempre más bajos que en recipientes abiertos, porque en este caso los vapores líquidos tienen la oportunidad de difundirse en la atmósfera y se requiere una temperatura más alta para crear una concentración de combustible sobre la superficie.
En mesa. 2.4 muestra el punto de inflamación de algunos líquidos, determinado por dispositivos de tipo abierto y cerrado.
Tabla 2.4
Punto de inflamación de diferentes tipos de líquidos con diferentes métodos de determinación
Temperatura de ignición: la temperatura mínima de un líquido a la cual, después de la ignición de los vapores de una fuente de ignición, se establece una combustión estacionaria.
En líquidos inflamables, la temperatura de ignición es más alta que el punto de inflamación entre 1 y 5 °, mientras que cuanto más bajo es el punto de inflamación, menor es la diferencia entre los puntos de ignición y de inflamación.
Para líquidos combustibles con un alto punto de inflamación, la diferencia entre estas temperaturas alcanza los 25-35 °. Existe una correlación entre el punto de inflamación en un crisol cerrado y el límite inferior de temperatura de ignición, descrito por la fórmula
Esta relación es válida para Г В(.
La dependencia significativa de las temperaturas de flash e ignición de las condiciones experimentales provoca ciertas dificultades en la creación de un método de cálculo para estimar sus valores. Uno de los más comunes es el método semiempírico propuesto por V. I. Blinov:
donde G sol - punto de inflamación (encendido), K; Rnp - presión parcial de vapor saturado de líquido en el punto de inflamación (ignición), Pa; D()- coeficiente de difusión de vapores líquidos, s/m 2 ; b- el número de moléculas de oxígeno necesarias para la oxidación completa de una molécula de combustible; EN - método de definición constante.
Al calcular el punto de inflamación en un recipiente cerrado, se recomienda tomar EN= 28, en un recipiente abierto EN= 45; Para calcular la temperatura de ignición, tome EN = 53.
Los límites de temperatura inflamable se pueden calcular:
Según los valores conocidos del punto de ebullición
donde ^n(v)' 7/ip - límite inferior (superior) de temperatura de ignición y punto de ebullición, respectivamente, °C; k, yo- parámetros, cuyos valores dependen del tipo de líquido combustible;
Según valores conocidos de los límites de concentración. Para hacer esto, primero determine la concentración de vapores saturados sobre la superficie del líquido.
donde (p„ n es la concentración de vapores saturados, %; R norte p - presión de vapor saturado, Pa; R 0 - presión externa (atmosférica), Pa.
De la fórmula (2.41) se sigue
Habiendo determinado la presión del vapor saturado por el valor del límite de ignición inferior (superior), encontramos la temperatura a la que se alcanza esta presión. Es el límite inferior (superior) de temperatura de ignición.
Según la fórmula (2.41), también es posible resolver el problema inverso: calcular los límites de concentración de ignición a partir de los valores conocidos de los límites de temperatura.
La propiedad de una llama a la propagación espontánea se observa no solo durante la combustión de mezclas de gases combustibles con un agente oxidante, sino también al quemar líquidos y sólidos. Bajo la exposición local a una fuente de calor, por ejemplo, una llama abierta, el líquido se calentará, la tasa de evaporación aumentará y cuando la superficie del líquido alcance la temperatura de ignición, la mezcla de vapor y aire se encenderá en el sitio de exposición a la fuente de calor, se establecerá una llama estable, que luego se extenderá a cierta velocidad sobre la superficie y la parte fría.
¿Cuál es la fuerza impulsora detrás de la propagación del proceso de combustión, cuál es su mecanismo?
La propagación de la llama sobre la superficie del líquido se produce como resultado de la transferencia de calor debido a la radiación, la convección y la conducción de calor molecular desde la zona de la llama hasta la superficie del espejo líquido.
De acuerdo con los conceptos modernos, la principal fuerza impulsora para la propagación del proceso de combustión es la radiación de calor de la llama. Se sabe que la llama, al tener una temperatura elevada (más de 1000 °C), es capaz de irradiar energía térmica. De acuerdo con la ley de Stefan-Boltzmann, la intensidad del flujo de calor radiante emitido por un cuerpo calentado está determinada por la relación
donde c yo- intensidad del flujo de calor radiante, kW/m 2 ; 8 0 - grado de negrura del cuerpo (llama) (e 0 \u003d 0.75-H.0); un = = 5.7 10 11 kJ / (m 2 s K 4) - Constante de Stefan-Boltzmann; Г g - temperatura del cuerpo (llama), K; Г 0 - temperatura media, K.
El calor, que se irradia en todas las direcciones, ingresa parcialmente a las áreas de la superficie del líquido que aún no se han incendiado, calentándolas. Con un aumento en la temperatura de la capa superficial sobre el área calentada, el proceso de evaporación del líquido se intensifica y se forma una mezcla de vapor y aire. Tan pronto como la concentración de vapor líquido exceda el NKVP, se encenderá de la llama. Luego, esta sección de la superficie del líquido comienza a calentar intensamente la sección adyacente de la superficie del líquido, y así sucesivamente. La velocidad de propagación de la llama a través del líquido depende de la velocidad de calentamiento de la superficie del líquido por el flujo de calor radiante de la llama, es decir de la velocidad de formación de una mezcla combustible de vapor y aire sobre la superficie del líquido, que, a su vez, depende de la naturaleza del líquido y de la temperatura inicial.
Cada tipo de líquido tiene su propio calor de vaporización y punto de inflamación. Cuanto mayores sean sus valores, mayor será el tiempo requerido para que su calentamiento forme una mezcla combustible de vapor y aire, menor será la velocidad de propagación de la llama. Con un aumento en el peso molecular de una sustancia dentro de la misma serie homóloga, la presión de vapor de elasticidad disminuye, el calor de evaporación y el punto de inflamación aumentan, y la velocidad de propagación de la llama disminuye en consecuencia.
El aumento de la temperatura del líquido aumenta la velocidad de propagación de la llama, ya que se reduce el tiempo necesario para que el líquido se caliente hasta el punto de inflamación frente a la zona de combustión.
Durante un destello, la velocidad de propagación de la llama a lo largo del espejo líquido será (en términos físicos) igual a la velocidad de propagación de la llama a través de la mezcla vapor-aire de una composición cercana al LCV, es decir 4-5 cm/seg. Con un aumento en la temperatura inicial del líquido por encima del punto de inflamación, la velocidad de propagación de la llama dependerá (de manera similar a la velocidad de propagación de la llama) de la composición de la mezcla combustible. De hecho, a medida que la temperatura del líquido sube por encima de su punto de inflamación, la concentración de la mezcla de vapor y aire sobre la superficie del espejo aumentará de NKVP al 100% (punto de ebullición).
Por tanto, inicialmente, a medida que la temperatura del líquido sube desde el punto de inflamación hasta la temperatura a la que se forman vapores saturados sobre la superficie, con una concentración igual a la estequiométrica (más precisamente, algo superior a la estequiométrica), la velocidad de propagación de la llama incrementará. En recipientes cerrados, a medida que aumenta la temperatura del líquido, la velocidad de propagación de la llama comienza a disminuir, hasta la velocidad correspondiente al límite superior de temperatura de ignición, en el que la propagación de la llama y la mezcla de vapor y aire ya no se producirán. ser posible debido a la falta de oxígeno en la mezcla vapor-aire sobre la superficie del líquido. Sobre la superficie de un yacimiento abierto, la concentración de vapores a diferentes niveles será diferente: en la superficie será máxima y corresponderá a la concentración de vapor saturado a una temperatura dada, a medida que aumenta la distancia desde la superficie, la concentración será disminuye gradualmente debido a la convección y la difusión molecular.
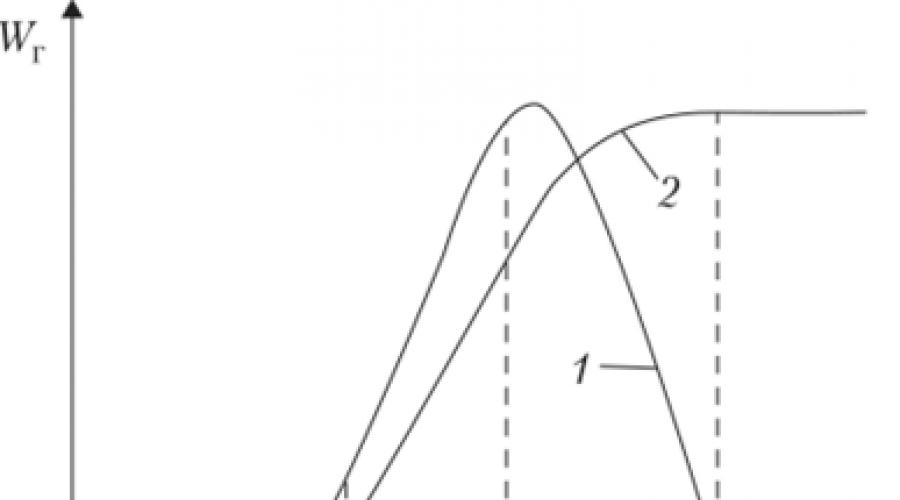
A una temperatura del líquido cercana al punto de inflamación, la velocidad de propagación de la llama sobre la superficie del líquido será igual a la velocidad de su propagación a través de la mezcla de vapores en el aire en el LIP, es decir 3-4 cm/seg. En este caso, el frente de la llama estará ubicado cerca de la superficie del líquido. Con un aumento adicional en la temperatura inicial del líquido, la velocidad de propagación de la llama aumentará de manera similar al crecimiento de la velocidad normal de propagación de la llama en la mezcla vapor-aire con un aumento en su concentración. A máxima velocidad, la llama se propagará a través de la mezcla con una concentración cercana a la estequiométrica. En consecuencia, con un aumento de la temperatura inicial del líquido por encima de G stx, la velocidad de propagación de la llama permanecerá constante, igual al valor máximo de la velocidad de propagación de la combustión en la mezcla estequiométrica o algo mayor que él (Fig. 2.5). Por lo tanto,

Arroz. 25
1 - líquido ardiente en un recipiente cerrado; 2 - combustión de un líquido en un recipiente abierto con un cambio en la temperatura inicial del líquido en un recipiente abierto en un amplio rango de temperatura (hasta el punto de ebullición), la velocidad de propagación de la llama variará desde unos pocos milímetros hasta 3-4 m / s.
A máxima velocidad, la llama se propagará a través de la mezcla con una concentración cercana a la estequiométrica. Con un aumento en la temperatura del líquido por encima de Гstx, la distancia sobre el líquido aumentará, en la que se formará la concentración estequiométrica y la velocidad de propagación de la llama seguirá siendo la misma (ver Fig. 2.5). Esta circunstancia debe recordarse siempre, tanto al organizar el trabajo preventivo como al extinguir incendios, cuando, por ejemplo, puede existir el peligro de que el aire sea aspirado en un contenedor cerrado: su despresurización.
Después de la ignición del líquido y la propagación de la llama, pero su superficie se establece modo de difusión de su agotamiento, que se caracteriza por la masa específica WRM y lineal WV Jl velocidades
Velocidad de masa específica: la masa de una sustancia que se quema de una unidad de área de un espejo líquido por unidad de tiempo (kg / (m 2 * s)).
Velocidad lineal: la distancia sobre la cual se mueve el nivel del espejo líquido por unidad de tiempo debido a su agotamiento (m / s).
Las tasas de quemado de masa y lineal están interconectadas a través de la densidad del líquido p:
Después de la ignición del líquido, la temperatura de su superficie aumenta desde la temperatura de ignición hasta la de ebullición y se forma una capa calentada. Durante este período, la velocidad de combustión del líquido aumenta gradualmente, la altura de la llama crece según el diámetro del tanque y el tipo de líquido combustible. Después de 1 a 10 minutos de combustión, el proceso se estabiliza: la tasa de quemado y las dimensiones de la llama permanecen sin cambios en el futuro.
La altura y la forma de la llama durante la combustión por difusión de líquido y gas obedecen a las mismas leyes, ya que en ambos casos el proceso de combustión está determinado por la difusión mutua del combustible y el comburente. Sin embargo, si durante la combustión por difusión de gases, la velocidad del chorro de gas no depende de los procesos que ocurren en la llama, entonces durante la combustión de un líquido, se establece una cierta tasa de agotamiento, que depende tanto de los parámetros termodinámicos del líquido y de las condiciones de difusión del oxígeno del aire y del vapor líquido.
Se establece una cierta transferencia de calor y masa entre la zona de combustión y la superficie del líquido (Fig. 2.6). Parte del flujo de calor que llega a la superficie del líquido. q 0y se gasta en calentarlo hasta el punto de ebullición q ucn. Además, cálido q TC para calentar el liquido sale del soplete de la llama a traves de las paredes del deposito debido a la conduccion de calor. Con un diámetro suficientemente grande q TC puede despreciarse, entonces q() = K „ norte +
Es obvio que
donde c es la capacidad calorífica del líquido, kJDkg-K); p es la densidad del líquido, kg / m 3; WNC- tasa de crecimiento de la capa calentada, m/s; W Jl- tasa de agotamiento lineal, m/s; 0i SP - calor de vaporización, kJ/kg; G kip - el punto de ebullición del líquido, K.

Arroz. 2.6.
Г () - temperatura inicial; G kip - punto de ebullición;
Tg- temperatura de combustión; q KUW q Jl - flujos de calor convectivo y radiante, respectivamente; q 0 - flujo de calor que entra en la superficie del líquido
De la fórmula (2.45) se deduce que la intensidad del flujo de calor de la zona de la llama determina una cierta tasa de suministro de combustible a esta zona, cuya interacción química con el oxidante, a su vez, afecta el valor # 0 . En esto consiste la relacion de masa y intercambio de calor entre la zona de llama y la fase condensada durante la combustión de líquidos y sólidos.
Estimación de la proporción de calor de la liberación total de calor durante la combustión del líquido, que se gasta en su preparación para la combustión. q 0 , se puede realizar en la siguiente secuencia.
Tomando por simplicidad retorciéndose= W nx , obtenemos
La tasa de liberación de calor por unidad de superficie del espejo líquido (calor específico del fuego qll7K) se puede determinar por la formula
donde Q H es el poder calorífico más bajo de la sustancia, kJ/kg; P p - coeficiente de integridad de la combustión.
Entonces, teniendo en cuenta el estado (2.44) y dividiendo la expresión (2.45) por la fórmula (2.46), obtenemos
Los cálculos muestran que alrededor del 2 % del calor total liberado durante la combustión líquida se gasta en la formación y suministro de vapor líquido a la zona de combustión. Cuando se establece el proceso de quemado, la temperatura de la superficie del líquido aumenta hasta el punto de ebullición, que posteriormente permanece sin cambios. Esta declaración se refiere a un líquido individual. Sin embargo, si consideramos mezclas de líquidos que tienen diferentes puntos de ebullición, primero se produce la liberación de fracciones de punto de ebullición ligero, luego, cada vez más, de puntos de ebullición más altos.
La tasa de quemado se ve significativamente afectada por el calentamiento del líquido en profundidad como resultado de la transferencia de calor del líquido calentado por el flujo radiante q0 la superficie del líquido hasta su profundidad. Esta transferencia de calor se lleva a cabo por conductividad térmica y convenciones
El calentamiento de un líquido debido a la conductividad térmica se puede representar mediante una dependencia exponencial de la forma
donde T x - temperatura de la capa líquida en profundidad X, PARA; G kip - temperatura de la superficie (punto de ebullición), K; k- coeficiente de proporcionalidad, m -1 .
Este tipo de campo de temperatura se llama distribución de temperatura del primer tipo(Figura 2.7).
La convención laminar surge como resultado de las diferentes temperaturas del líquido en las paredes del tanque y en su centro, así como por la destilación fraccionada en la capa superior durante la combustión de la mezcla.
La transferencia de calor adicional desde las paredes calentadas del depósito al líquido conduce al calentamiento de sus capas cerca de las paredes a una temperatura más alta que en el centro. El líquido calentado cerca de las paredes (o incluso burbujas de vapor si se calienta cerca de las paredes por encima del punto de ebullición) sube, lo que contribuye a una mezcla intensiva y un calentamiento rápido del líquido a gran profundidad. La llamada capa homotermal, aquellas. una capa de temperatura prácticamente constante, cuyo espesor aumenta durante la combustión. Tal campo de temperatura se llama distribución de temperatura del segundo tipo.

Arroz. 2.7.
1 - distribución de temperatura del primer tipo; 2 - distribución de temperatura del segundo tipo
La formación de una capa homotérmica también es posible como resultado de la destilación fraccionada de capas cercanas a la superficie de una mezcla de líquidos que tienen diferentes puntos de ebullición. A medida que estos líquidos se queman, la capa cercana a la superficie se enriquece en fracciones más densas y de alto punto de ebullición, que se hunden y contribuyen al calentamiento más convectivo del líquido.
Se ha establecido que cuanto más bajo es el punto de ebullición de un líquido (combustible diesel, aceite de transformador), más difícil es formar una capa homotérmica. Cuando se queman, la temperatura de las paredes del tanque rara vez supera el punto de ebullición. Sin embargo, cuando se queman productos de petróleo húmedos de alto punto de ebullición, la probabilidad de formación de una capa homotérmica es bastante alta. Cuando las paredes del tanque se calientan a 100 °C o más, se forman burbujas de vapor de agua que, al ascender, provocan un movimiento intenso de todo el líquido y un calentamiento rápido en profundidad. La dependencia del espesor de la capa homotérmica con el tiempo de combustión se describe mediante la relación
donde X - espesor de la capa homotérmica en un momento determinado del tiempo de combustión, m; x pr - espesor límite de la capa homotérmica, m; t es el tiempo contado desde el inicio de la formación de la capa, s; p - coeficiente, s -1.
La posibilidad de que se forme una capa homotérmica suficientemente gruesa durante la combustión de productos de petróleo húmedo está plagada de ebullición y expulsión de líquido.
La tasa de quemado depende significativamente del tipo de líquido, la temperatura inicial, la humedad y la concentración de oxígeno en la atmósfera.
A partir de la ecuación (2.45), teniendo en cuenta la expresión (2.44), es posible determinar la tasa de quemado masivo:

Es obvio a partir de la fórmula (2.50) que la tasa de quemado se ve afectada por la intensidad del flujo de calor proveniente de la llama hacia el espejo líquido y los parámetros termofísicos del combustible: punto de ebullición, capacidad calorífica y calor de evaporación.
De la Mesa. 2.5 es obvio que existe una cierta correspondencia entre la tasa de quemado y los costos de calor para calentar y evaporar el líquido. Por lo tanto, en la serie de bencenoxilengliceroles, con un aumento en el consumo de calor para calefacción y evaporación, la tasa de agotamiento disminuye. Sin embargo, al pasar de benceno a éter dietílico, los costos de calor disminuyen. Esta aparente discrepancia se debe a la diferencia en la intensidad de los flujos de calor provenientes de la llama hacia la superficie del líquido. El flujo radiante es suficientemente grande para una llama de benceno humeante y pequeño para una llama de éter dietílico relativamente transparente. Como regla general, la proporción de las tasas de quemado de los líquidos de combustión más rápida y los líquidos de combustión más lenta es bastante pequeña y asciende a 3,0-4,5.
Tabla 25
Dependencia de la tasa de quemado del consumo de calor para calefacción y evaporación
De la expresión (2.50) se deduce que con un aumento en Г 0 aumenta la tasa de quemado, ya que disminuyen los costos de calor para calentar el líquido hasta el punto de ebullición.
El contenido de humedad en la mezcla reduce la velocidad de combustión del líquido, en primer lugar, debido al consumo de calor adicional para su evaporación y, en segundo lugar, como resultado del efecto flemador del vapor de agua en la zona de gas. Esto último conduce a una disminución de la temperatura de la llama, y por tanto, según la fórmula (2.43), también disminuye su poder radiante. Estrictamente hablando, la velocidad de combustión de un líquido húmedo (líquido que contiene agua) no es constante, aumenta o disminuye durante el proceso de combustión dependiendo del punto de ebullición del líquido.
El combustible húmedo se puede representar como una mezcla de dos líquidos: combustible + agua, durante cuya combustión sus dispersión fraccionada. Si el punto de ebullición de un líquido combustible es inferior al punto de ebullición del agua (100°C), entonces el combustible se quema preferentemente, la mezcla se enriquece con agua, la tasa de quemado disminuye y, finalmente, se detiene la combustión. Si el punto de ebullición del líquido es superior a 100 ° C, entonces, por el contrario, la humedad se evapora principalmente primero y su concentración disminuye. Como resultado, la tasa de combustión del líquido aumenta hasta la tasa de combustión del producto puro.
Como regla general, con un aumento en la velocidad del viento, aumenta la tasa de agotamiento del líquido. El viento intensifica el proceso de mezcla del combustible con el comburente, elevando así la temperatura de la llama (Tabla 2.6) y acercando la llama a la superficie de combustión.
Cuadro 2.6
Efecto de la velocidad del viento sobre la temperatura de la llama
Todo esto aumenta la intensidad del flujo de calor suministrado al calentamiento y evaporación del líquido, por lo tanto, conduce a un aumento en la tasa de quemado. A velocidades de viento más altas, la llama puede romperse, lo que provocará el cese de la combustión. Entonces, por ejemplo, cuando el queroseno de un tractor se quemaba en un tanque con un diámetro de 3 m, el apagado se producía a una velocidad del viento de 22 m/s.
La mayoría de los líquidos no pueden arder en una atmósfera con menos del 15 % de oxígeno. Con un aumento en la concentración de oxígeno por encima de este límite, aumenta la tasa de quemado. En una atmósfera significativamente enriquecida con oxígeno, la combustión del líquido procede con la liberación de una gran cantidad de hollín en la llama y se observa una intensa ebullición de la fase líquida. Para líquidos multicomponentes (gasolina, queroseno, etc.), la temperatura de la superficie aumenta con el aumento del contenido de oxígeno en el ambiente.
Un aumento en la tasa de quemado y la temperatura de la superficie del líquido con un aumento en la concentración de oxígeno en la atmósfera se debe a un aumento en la emisividad de la llama como resultado de un aumento en la temperatura de combustión y un alto contenido de hollín en ella .
La tasa de quemado también cambia significativamente con una disminución en el nivel de líquido inflamable en el tanque: la tasa de quemado disminuye, hasta el cese de la combustión. Dado que el suministro de oxígeno del aire desde el ambiente dentro del tanque es difícil, cuando el nivel del líquido disminuye, la distancia h np entre la zona de la llama y la superficie de combustión (Fig. 2.8). El flujo radiante al espejo líquido disminuye y, en consecuencia, la tasa de quemado también disminuye, hasta la atenuación. Cuando se queman líquidos en tanques de gran diámetro, la profundidad límite /g pr a la que se atenúa la combustión es muy grande. Entonces, para un tanque con un diámetro de 5 m, son 11 m, y con un diámetro de Im, aproximadamente 35 m.

La velocidad normal de propagación de la llama es la velocidad de movimiento del frente de la llama en relación con el gas sin quemar en una dirección perpendicular a su superficie.
El valor de la velocidad normal de propagación de la llama debe utilizarse para calcular la tasa de aumento de la presión de una explosión de mezclas de gas y vapor en instalaciones y equipos cerrados y con fugas, el diámetro crítico (de extinción) en el desarrollo y creación de llama pararrayos, el área de estructuras de caída fácil, membranas de seguridad y otros dispositivos de despresurización; al desarrollar medidas para garantizar la seguridad contra incendios y explosiones de los procesos tecnológicos de acuerdo con los requisitos de GOST 12.1.004 y GOST 12.1.010.
La esencia del método para determinar la velocidad normal de propagación de la llama es preparar una mezcla combustible de composición conocida dentro del recipiente de reacción, encender la mezcla en el centro con una fuente puntual, registrar el cambio de presión en el recipiente con el tiempo y procesar la dependencia presión-tiempo experimental utilizando un modelo matemático del proceso de combustión de gases en recipiente cerrado y procedimientos de optimización. El modelo matemático permite obtener una dependencia calculada “presión-tiempo”, cuya optimización según una dependencia experimental similar da como resultado un cambio en la velocidad normal durante el desarrollo de una explosión para un ensayo particular.
La velocidad de combustión normal es la velocidad a la que se propaga el frente de llama en relación con los reactivos no quemados. La velocidad de combustión depende de una serie de propiedades fisicoquímicas de los reactivos, en particular, la conductividad térmica y la velocidad de una reacción química, y tiene un valor bien definido para cada combustible (en condiciones de combustión constantes). En mesa. 1 muestra las velocidades de combustión (y los límites de ignición) de algunas mezclas gaseosas. Las concentraciones de combustible en las mezclas se determinaron a 25°C y presión atmosférica normal. Los límites de inflamabilidad, con las excepciones señaladas, se obtuvieron con la propagación de la llama en un tubo de 0,05 m de diámetro cerrado por ambos lados. Los coeficientes de exceso de combustible se definen como la relación entre el contenido volumétrico de combustible en la mezcla real, la mezcla estequiométrica (j1) y la mezcla en la tasa de combustión máxima (j2).
tabla 1
Velocidades de combustión de mezclas condensadas (oxidante inorgánico + magnesio)
| Sábana |
| Documento núm.: |
| Firma |
| la fecha |
| Sábana |
| TGIV 20.05.01.070000.000 PZ |
Como puede verse, durante la combustión de mezclas de aire y gas a presión atmosférica tu max se encuentra dentro de 0,40-0,55 m/s, y - dentro de 0,3-0,6 kg/(m2-s). Solo para algunos compuestos insaturados de bajo peso molecular e hidrógeno. tu max se encuentra dentro de 0.8-3.0 m/s, y alcanza 1-2 kg/(m2s). por ampliación y max los combustibles estudiados en mezclas con aire pueden ser
ordenar en la siguiente fila: gasolina y combustibles líquidos para cohetes - parafinas y aromáticos - monóxido de carbono - ciclohexano y ciclopropano - etileno - óxido de propileno - óxido de etileno - acetileno - hidrógeno.
| Cambio |
| Sábana |
| Documento núm.: |
| Firma |
| la fecha |
| Sábana |
| TGIV 20.05.01.070000.000 PZ |
La tasa de combustión lineal de las mezclas de oxígeno es mucho más alta que las mezclas de aire (para hidrógeno y monóxido de carbono, 2-3 veces, y para metano, más de un orden de magnitud). La velocidad de combustión másica de las mezclas de oxígeno estudiadas (excepto la mezcla de CO + O2) se encuentra en el rango de 3,7 a 11,6 kg/(m2·s).
En mesa. La Tabla 1 muestra (según los datos de N. A. Silin y D. I. Postovsky) las tasas de combustión de mezclas compactadas de nitratos y percloratos con magnesio. Se usaron componentes en polvo con tamaños de partículas de nitratos de 150 a 250 μm, percloratos de 200 a 250 μm y magnesio de 75 a 105 μm para preparar mezclas. La mezcla se llenó en carcasas de cartón con un diámetro de 24-46 mm hasta un factor de compactación de 0,86. Las muestras se quemaron al aire a presión y temperatura inicial normales.
A partir de una comparación de los datos en la Tabla. 1 y 1.25 se deduce que las mezclas condensadas son superiores a las mezclas de gases en términos de masa y son inferiores a ellas en términos de velocidad de combustión lineal. La velocidad de combustión de las mezclas con percloratos es menor que la velocidad de combustión de las mezclas con nitratos, y las mezclas con nitratos de metales alcalinos se queman a una velocidad mayor que las mezclas con nitratos de metales alcalinotérreos.
Tabla 2
Límites de inflamabilidad y velocidades de combustión de mezclas con aire (I) y oxígeno (II) a presión normal y temperatura ambiente
| Sábana |
| Documento núm.: |
| Firma |
| la fecha |
| Sábana |
| TGIV 20.05.01.070000.000 PZ |
| Cambio |
Métodos para calcular la tasa de quemado de líquidos.
| Cambio |
| Sábana |
| Documento núm.: |
| Firma |
| la fecha |
| Sábana |
| TGIV 20.05.01.070000.000 PZ |
![]() ; (16)
; (16)
donde METRO es la tasa de agotamiento adimensional;
 ; (17)
; (17)
M F- peso molecular del líquido, kg mol -1 ;
d- tamaño característico del espejo de líquido en llamas, m Se determina como la raíz cuadrada de la superficie de combustión; si el área de combustión tiene la forma de un círculo, entonces el tamaño característico es igual a su diámetro. Al calcular la tasa de combustión turbulenta, se puede tomar d= 10 metros;
t a es el punto de ebullición del líquido, K.
El procedimiento de cálculo es el siguiente.
El modo de combustión está determinado por el valor del criterio de Galileo Georgia, calculado por la fórmula
donde gramo- aceleración de caída libre, m·s -2 .
Dependiendo del modo de combustión, la tasa de quemado adimensional se calcula METRO. Para el modo de combustión laminar:
Para el modo de combustión transitoria:
si, entonces ![]() , (20)
, (20)
si , entonces , (21)
Para régimen de combustión turbulenta:
; ![]() , (22)
, (22)
M0- peso molecular del oxígeno, kg mol -1 ;
norte 0- coeficiente estequiométrico de oxígeno en la reacción de combustión;
nF- coeficiente estequiométrico del líquido en la reacción de combustión.
B- parámetro adimensional que caracteriza la intensidad de la transferencia de masa, calculado por la fórmula
![]() , (23)
, (23)
donde q- poder calorífico inferior del líquido, kJ·kg -1 ;
| Cambio |
| Sábana |
| Documento núm.: |
| Firma |
| la fecha |
| Sábana |
| TGIV 20.05.01.070000.000 PZ |
C- capacidad calorífica isobárica de los productos de la combustión (supuestamente igual a la capacidad calorífica del aire c = 1), kJ·kg -1 ·K -1 ;
T0- temperatura ambiente, tomada igual a 293 K;
H- calor de vaporización del líquido en el punto de ebullición, kJ·kg -1 ;
ce es la capacidad calorífica isobárica promedio del líquido en el rango de T0 antes de T a.
Si se conocen la viscosidad cinemática del vapor o el peso molecular y el punto de ebullición del líquido en estudio, entonces la tasa de combustión turbulenta se calcula utilizando datos experimentales mediante la fórmula
donde yo- valor experimental de la tasa de quemado en el modo de combustión transitoria, kg · m -2 · s -1 ;
yo- el diámetro del quemador en el que se obtiene el valor yo, M. Se recomienda utilizar una antorcha con un diámetro de 30 mm. Si se observa un régimen de combustión laminar en un quemador con un diámetro de 30 mm, se debe utilizar un quemador con un diámetro mayor.
3. PROPAGACIÓN DE LLAMAS EN MEZCLAS DE GASES
La velocidad de propagación de la llama durante la combustión de sustancias sólidas, líquidas y gaseosas tiene un interés práctico en términos de prevención de incendios y explosiones. Considere la velocidad de propagación de la llama en mezclas de gases y vapores combustibles con aire. Conociendo esta velocidad, es posible determinar la velocidad segura del flujo de gas-aire en una tubería, mina, instalación de ventilación y otros sistemas explosivos.
3.1. VELOCIDAD DE LA LLAMA
Como ejemplo, en la fig. 3.1 muestra un diagrama de ventilación de escape en una mina de carbón. Desde las galerías de la mina 1 hasta la tubería 2, se extrae una mezcla polvorienta de aire y polvo de carbón y, en algunos casos, se libera metano en las vetas de carbón. Cuando ocurre un incendio, el frente de llama 3 se extenderá hacia las galerías 1. Si la velocidad de la mezcla combustiblew será menor que la velocidad de propagación del frente de llamay en relación con las paredes del tubo, la llama se extenderá hacia la mina y provocará una explosión. Por lo tanto, para el funcionamiento normal del sistema de ventilación, es necesario cumplir con la condición
w>u.
La velocidad de remoción de la mezcla explosiva debe ser mayor que la velocidad de propagación del frente de llama. Esto evitará que las llamas entren en los conductos del eje.
Arroz. 3.1. Esquema de propagación de llamas en la mina:
1 - mio; 2 - tubería; 3 - frente de llama
La teoría de la propagación de la llama desarrollada en los trabajos de Ya.B. Zeldovich y D. A. Frank-Kamenetsky, se basa en las ecuaciones de conducción, difusión y cinética química del calor. La ignición de una mezcla combustible siempre comienza en un punto y se extiende por todo el volumen ocupado por la mezcla combustible. Considere un caso unidimensional: un tubo lleno de una mezcla combustible (Fig. 3.2).
Si la mezcla se enciende desde un extremo del tubo, un frente de llama angosto se propagará a lo largo del tubo, separando los productos de combustión (detrás del frente de llama) de la mezcla combustible nueva. El frente de la llama tiene forma de casquete o de cono con su parte convexa vuelta hacia el movimiento de la llama. El frente de llama es una fina capa gaseosa (10 -4 ÷ 10 -6) m de ancho, en esta capa, que se denomina zona de combustión, tienen lugar reacciones químicas de combustión. La temperatura del frente de llama, dependiendo de la composición de la mezcla, es T= (1500 ÷ 3000) K. El calor de combustión liberado se gasta en calentar los productos de combustión de la mezcla combustible fresca y las paredes del tubo debido a los procesos de conducción y radiación de calor.

Arroz. 3.2. Esquema de propagación del frente de llama en un tubo.
Cuando el frente de la llama se mueve en el tubo, surgen ondas de compresión en la mezcla combustible, que crean movimientos de vórtice. Los remolinos de gas doblan el frente de la llama sin cambiar su grosor y la naturaleza de los procesos que ocurren en él. En una superficie unitaria del frente de la llama, siempre arde la misma cantidad de sustancia por unidad de tiempo. ![]() . El valor es constante para cada mezcla combustible y se denomina velocidad de combustión másica. .
Conociendo el área del frente de llamaS, se puede calcular la masa de una sustancia METRO, combustible en todo el frente de combustión por unidad de tiempo:
. El valor es constante para cada mezcla combustible y se denomina velocidad de combustión másica. .
Conociendo el área del frente de llamaS, se puede calcular la masa de una sustancia METRO, combustible en todo el frente de combustión por unidad de tiempo:
Cada elemento del frente de llama dSse mueve con respecto a la mezcla fresca siempre en la dirección de la normal al frente de llama en un punto dado (Fig. 3.2), y la velocidad de este movimiento:
donde es la densidad de la mezcla combustible fresca.
Valor se denomina velocidad normal de propagación de la llama y tiene la dimensión m/s. Es un valor constante del proceso de combustión de una mezcla dada y no depende de las condiciones hidrodinámicas que acompañan al proceso de combustión. La velocidad normal de propagación de la llama es siempre menor que la velocidad observada y, es decir, la velocidad del frente de combustión con respecto a las paredes del tubo:
tú n< u .
Si el frente de la llama es plano y está dirigido perpendicularmente al eje del tubo, en este caso la velocidad normal y observada de propagación de la llama será la misma.
tu norte = tu .
El área del frente de llama convexo.Problema Ssiempre mayor que el área del frente planoS pl, Es por eso
> 1.
Velocidad de llama normaltú npara cada mezcla combustible depende de la mezcla de gases inertes, la temperatura de la mezcla, la humedad y otros factores. En particular, el precalentamiento del gas combustible aumenta la velocidad de propagación de la llama. Se puede demostrar que la velocidad de propagación de la llamatú nes proporcional al cuadrado de la temperatura absoluta de la mezcla:
u n .= constante T 2.
En la fig. 3.3 muestra la dependencia de la velocidad de propagación de la llama en la mezcla combustible "aire - monóxido de carbono", en función de la concentración de CO. Como se desprende de los gráficos anteriores, la velocidad de propagación de la llama aumenta al aumentar la temperatura de la mezcla. Para cada valor de temperatura, la velocidad de propagación de la llama tiene un máximo en la región de concentración de monóxido de carbono CO igual a ~ 40%.
La capacidad calorífica del gas inerte afecta la velocidad de propagación de la llama. Cuanto mayor es la capacidad calorífica de un gas inerte, más reduce la temperatura de combustión y más reduce la velocidad de propagación de la llama. Entonces, si una mezcla de metano con aire se diluye con dióxido de carbono, la velocidad de propagación de la llama puede disminuir de 2 a 3 veces. La velocidad de propagación de la llama en mezclas de monóxido de carbono con aire está muy influenciada por la humedad contenida en la mezcla, la presencia de partículas de hollín e impurezas de gases inertes.

Arroz. 3.3. Dependencia de la velocidad de propagación de la llama
sobre la concentración de monóxido de carbono en la mezcla
Distribución de la zona de transformaciones químicas en un sistema combustible abierto
La combustión comienza con la ignición de la mezcla combustible en el volumen local del sistema combustible, luego se propaga en la dirección de la mezcla en movimiento. La zona de combustión en la que se llevan a cabo las reacciones químicas redox visibles para el observador se denomina llama. La superficie que separa la llama y la mezcla que aún no se quema sirve como frente de la llama. La naturaleza de la propagación de la llama depende de muchos procesos, pero el proceso de calentamiento de la mezcla combustible es el factor determinante. Dependiendo del método de calentamiento de la mezcla combustible a la temperatura de ignición, hay propagación de llama normal, turbulenta y de detonación.
Se observa una propagación normal de la llama durante la combustión en un sistema combustible con una mezcla en movimiento laminar. Durante la propagación normal de la llama, la energía térmica se transfiere de la capa ardiente a la fría principalmente por conductividad térmica, así como por difusión molecular. La conductividad térmica en los gases se caracteriza por su baja intensidad, por lo que la velocidad de propagación normal de la llama es baja.
Durante el movimiento turbulento de una mezcla combustible, la transferencia de energía térmica de la capa ardiente a la fría ocurre principalmente por difusión molar, así como por conductividad térmica. La transferencia molar es proporcional a la escala de turbulencia, que está determinada por la velocidad de la mezcla. La velocidad de propagación de la llama turbulenta depende de las propiedades de la mezcla y de la dinámica del gas del flujo.
La propagación de la llama en una mezcla combustible desde la zona de combustión hasta las capas frías a través de procesos moleculares y molares se denomina deflagración.
Los procesos de combustión física y química van acompañados de un aumento de temperatura y presión en la llama. En sistemas combustibles, bajo ciertas condiciones, pueden surgir zonas de alta presión que pueden comprimir capas adyacentes, calentándolas hasta un estado de ignición. La propagación de la llama al comprimir rápidamente una mezcla fría a la temperatura de ignición se denomina detonación y siempre es explosiva.
En los sistemas combustibles, puede ocurrir una combustión vibratoria, en la que el frente de la llama se mueve a una velocidad que varía tanto en magnitud como en dirección.
La velocidad de propagación del frente de combustión en una mezcla estacionaria o en movimiento laminar se denomina velocidad normal o fundamental de propagación de la llama. El valor numérico de la velocidad normal viene determinado por la velocidad de la mezcla que aún no se ha encendido, normalmente dirigida hacia el frente de combustión.
El valor de u n para un frente de combustión plano se puede determinar a partir de la condición de equilibrio dinámico entre la velocidad de calentamiento de la mezcla por conductividad térmica a la temperatura de ignición y la velocidad de la reacción química. El resultado es la siguiente formula
donde l es el coeficiente de conductividad térmica de la mezcla de gases, ср es el coeficiente de capacidad calorífica de la mezcla a presión constante, Тin es la temperatura inicial de la mezcla, Та es la temperatura de combustión adiabática, Arr es el criterio de Arrhenius, k 0 es el coeficiente de la ley de Arrhenius.
La velocidad normal se puede determinar experimentalmente a partir de la velocidad del frente en un tubo con una mezcla estacionaria o de la altura del cono de combustión en un mechero Bunsen. El mechero Bunsen es un mechero de laboratorio con premezclado parcial de gas y aire. A la salida del quemador se forma una llama con un frente de combustión en forma de cono de forma regular (Fig.).
Figura 7. Frente de combustión en un mechero Bunsen
Con una posición estable del frente de combustión, la velocidad de propagación de la llama u n se equilibra con la componente W n normal a la superficie del cono de combustión y la velocidad de la mezcla aire-gas W, es decir
donde j es el ángulo entre el vector velocidad de la mezcla gas-aire y el vector de su componente normal a la superficie del cono de combustión.
El valor de la velocidad de movimiento de la mezcla de aire y gas a la salida de la boquilla con un cono de combustión de forma regular está determinado por la fórmula
donde d 0 es el diámetro de la boquilla del quemador, V es el caudal de la mezcla de gas y aire a través del quemador.
El valor de cos j se puede expresar en función de la altura del cono de combustión
Teniendo en cuenta que la superficie de combustión es la superficie lateral de un cono regular
el valor de la velocidad normal se determina
El valor de la velocidad normal de propagación de la llama se ve afectado por:
1. Temperatura inicial de la mezcla. A bajas temperaturas, u n es directamente proporcional al cuadrado de la temperatura absoluta de la mezcla que entra en la combustión. A una temperatura por encima de la temperatura de ignición, el concepto de velocidad normal pierde su significado, ya que la mezcla se vuelve capaz de autoencenderse.
2. La temperatura de las paredes del canal, siempre que la llama se propague por el interior de este canal. Las paredes frías interrumpen las reacciones en cadena y ralentizan la propagación de la llama.
3. Diámetro del canal. Para cada mezcla combustible, existe un valor crítico del diámetro d cr, a partir del cual es imposible la propagación de la llama en el interior del canal. El valor del diámetro crítico se puede determinar mediante la fórmula
donde a cm es la difusividad térmica de la mezcla.
4. Presión. Al aumentar la presión, u n disminuye.
5. La composición de la mezcla. Para una mezcla con una composición cercana a la estequiométrica, la velocidad normal tiene un valor máximo. Además, existen límites inferiores y superiores en términos de concentración de combustible, más allá de los cuales la llama no puede propagarse.
Lubricantes
El objetivo principal en el desarrollo de lubricantes ecológicos es crear un producto con alta biodegradabilidad y baja ecotoxicidad. En los países desarrollados de Occidente,
Actualmente, empresas públicas y privadas están comenzando a crear un mercado para los lubricantes amigables con el medio ambiente. La mayoría de los estudios se centran en la composición química del producto y la evaluación de su biodegradabilidad. A la hora de crear lubricantes ecológicos se tienen en cuenta dos áreas principales: la producción de aceites base, cuya naturaleza química determina la naturaleza del impacto sobre el medio ambiente, y la síntesis de nuevos aditivos que sean ecológicos, biodegradables y eficaces.
En la actualidad, y probablemente en el futuro, tres grupos de aceites base derivados de diversas fuentes de materias primas son de particular importancia: aceites de petróleo hidrocraqueados (HA), polialfaolefinas (PAO) y ésteres, que son rápidamente biodegradables en el medio ambiente. De gran importancia por un período indefinidamente largo, los aceites base de los esquemas de flujo tradicionales permanecerán sin duda, especialmente teniendo en cuenta el factor que los lubricantes obtenidos en base a PAO. los ésteres de polialcoholes, polialquilenglicoles y diésteres tienen un costo de 2 a 10 veces mayor que los derivados del petróleo. La mayor biodegradabilidad no es un incentivo para superar las diferencias de precios.
Las características de alto rendimiento y el respeto al medio ambiente de los aceites minerales son proporcionadas por un conjunto de ciertas cualidades. En primer lugar, esta es su composición química de grupo fraccional y favorable estrecha con una cantidad mínima de compuestos de azufre y nitrógeno en los aceites base. La elección de las materias primas, la clasificación de los aceites utilizados en la producción de aceites de alto índice y su procesamiento por separado son de suma importancia. En la obtención de aceites minerales base que cumplan con los requisitos ambientales, la purificación selectiva juega un papel importante,
carcinogenicidad significativa del producto. Actualmente, en EE. UU. y Canadá, más del 70% de los aceites base se obtienen mediante refinación selectiva. El uso de procesos modernos como el hidrocraqueo, el hidrodesparafinado y la hidroisomerización abre amplias posibilidades. Estas tecnologías se describen en detalle en el trabajo. El uso de procesos hidrocatalíticos en combinación con métodos tradicionales de refinación de materias primas petroleras con solventes selectivos mejora el desempeño y las propiedades ambientales de los aceites base.
En mesa. La Tabla 1.4 muestra datos comparativos sobre la composición química de los aceites base obtenidos mediante refinado selectivo e hidrotratamiento. Este último reduce significativamente el contenido de arenos, azufre y nitrógeno en los aceites.
Tabla 14
Efecto del hidrotratamiento sobre la composición química
aceites base
La introducción de los procesos de hidrocraqueo e hidroisomerización en la producción de aceites minerales base permite obtener productos de mayor biodegradabilidad y libres de arenos. Los aceites de hidrocraqueo, según los resultados obtenidos con los métodos de prueba modernos, no son tóxicos, la ausencia práctica de arenos en ellos indica una carcinogenicidad muy baja y una probabilidad insignificante de su crecimiento a través de la formación y acumulación de arenos policíclicos durante la operación; la ausencia de arenes y el predominio
Dando isoparafinas proporciona una biodegradabilidad bastante alta.
Los aceites base hidrocraqueados se producen en los EE. UU. desde finales de 1996. . Se ha preparado una instalación en Finlandia para su puesta en marcha.
En Rusia, VNIINP, junto con el centro científico y de ingeniería de OAO LUKOIL y AO LUKOIL - Volgogradneftepererabotka, están realizando investigaciones sobre la organización de la producción de varios aceites y bases escasos utilizando tecnologías de hidrogenación, en particular, aceite de aviación MS-8 y AMG. fluido hidráulico de aviación -diez.
En comparación con los aceites minerales, los aceites sintéticos en algunos casos tienen mejores características ambientales. Las clases más importantes de aceites sintéticos en términos de seguridad ambiental incluyen aceites elaborados a base de ésteres sintéticos, polialfaolefinas y polibutenos. Son no tóxicos, no cancerígenos, caracterizados por una baja emisión de sustancias nocivas.
Los aceites sintéticos a base de ésteres con aditivos han sido ampliamente utilizados en motores de turbinas de gas de aeronaves civiles y militares desde la década de 1960. En CIAM, junto con VNIINP y el 25.º Instituto Estatal de Investigación del Ministerio de Defensa de la Federación Rusa, se está trabajando para crear un aceite de éster altamente estable térmicamente (hasta 240 ° C) utilizando composiciones de aditivos eficaces que no sean inferiores en calidad. a los mejores aceites extranjeros. Un análisis de la información científica, técnica y de patentes sobre aceites para motores de turbinas de gas de aviación muestra que los ésteres de poliol siguen siendo la principal clase de compuestos para su uso como existencias de base [PO]. Sin embargo, la situación está cambiando con la próxima generación de motores aeronáuticos, ya que las mejoras en el diseño y la necesidad de reducir el consumo de combustible conducen a un aumento de la presión, la temperatura y la tensión en el aceite.
Este último contribuye al peligro de las formaciones locales de carbono. Por lo tanto, para la aviación militar en el futuro, es necesario abandonar el uso de aceites a base de ésteres. Para este propósito, los aceites de un nuevo tipo son los más prometedores, basados en perfluoroalquilpoliéteres simples. Según datos modernos, estos compuestos no son tóxicos e incluso se utilizan en el extranjero en perfumería y para la conservación de monumentos de arte y arquitectura de mármol.
Los aditivos tienen una gran influencia en las propiedades ambientales de los lubricantes. En los aceites de aviación, los antioxidantes tradicionales y los inhibidores de la corrosión como la dioctildifenilamina, la fenil-p-naftilamina, el benzotriazol, el aditivo de succinimida tipo K-51 y otros que han demostrado su eficacia se utilizan ampliamente como aditivos.
En todo el mundo se ha estado trabajando durante mucho tiempo para crear nuevos productos no tóxicos y biodegradables. En particular, desde los años 90, se han desarrollado sustitutos de los aditivos que contienen cloro. Una cuestión importante es la sustitución de los compuestos de plomo. Los sustitutos del plomo son compuestos de bismuto. Ha comenzado el desarrollo de un aditivo de ditiocarbamato de bismuto.
Aditivos como Mif-1 (aditivo tipo benceno de composición compleja), Irganox L-57 (aditivo antioxidante de Siba, difenilamina octilada y butilada), aditivo X (compuesto que contiene flúor con funciones oxisulfito e hidroxicarbamato) y otros han sido desarrollado.
Se mejoran las propiedades de los aditivos conocidos. Así, en el fosfato de tricresilo se reduce el contenido del ortoisómero neutrotóxico al 3% (Rusia), y en EE.UU. se produce fosfato de tricresilo que no contiene el ortoisómero.
Peligro de incendio y explosión de combustibles y lubricantes avna
Los combustibles y lubricantes de aviación utilizados actualmente son productos inflamables. En cuanto al fuego, los combustibles gaseosos son especialmente peligrosos. Los combustibles de hidrocarburos (combustibles para aviones, gasolinas, etc.) son líquidos inflamables (líquidos inflamables). Se caracterizan por una alta producción de calor (-2000 °C) y volatilidad, crean fácilmente mezclas combustibles con el aire, que al quemarse forman una gran cantidad de productos de combustión (coeficiente estequiométrico grande), que son buenos dieléctricos y, por lo tanto, puede acumular cargas de electricidad estática.
Según el riesgo de incendio, los líquidos inflamables se dividen en tres categorías. El punto de inflamación se utiliza como indicador determinante (se determina de acuerdo con GOST 12.1.044-89):
Dependiendo de la temperatura de autoignición (determinada según GOST 12.1.044-89), los combustibles de hidrocarburos pertenecen a uno u otro grupo de una mezcla explosiva de vapores con aire:
Nos atrevemos a que los vapores de combustibles de hidrocarburos con aire pertenecen a la categoría de explosivos TTA: se determina de acuerdo con GOST 12.1.011-78. Este indicador se utiliza al elegir el tipo de equipo eléctrico a prueba de explosiones y al diseñar extintores de incendios.
Las propiedades inflamables del combustible también están determinadas por los límites de concentración de ignición (CIL): el contenido mínimo y máximo de vapores de combustible en una mezcla con aire (oxidante), en el que es posible la propagación de la llama a través de la mezcla a cualquier distancia de la ignición. fuente (GOST 12.1.044-89). Una característica importante del combustible son los límites de temperatura de ignición: las temperaturas a las que los vapores de combustible saturados en el aire se encuentran en concentraciones iguales al CPV inferior o superior, respectivamente. De gran importancia es la energía mínima de la descarga eléctrica requerida para encender la mezcla vapor-aire.
Al evaluar el riesgo de incendio al manipular combustibles, también se determina la tasa de quemado: la cantidad de combustible que se quema por unidad de tiempo desde una unidad de superficie; mínima energía de ignición - para garantizar la seguridad contra chispas electrostáticas. Se evalúa la interacción del combustible en llamas con agentes extintores de espuma de agua (según GOST 12.1.044-89).
Un incendio suele ir precedido de una explosión de una mezcla de gas y aire. Cuando las mezclas de aire explotan en tuberías de gran diámetro y longitud, puede producirse una combustión por detonación, propagándose a una velocidad de 1100-1400 m/s. En este caso, la presión puede aumentar hasta 0,8 MPa o más. Una onda de choque de alta velocidad provoca un fuerte aumento de la presión, la temperatura y la densidad de la mezcla combustible que, a su vez, acelera las reacciones químicas de la combustión y aumenta el efecto destructivo.
Se pueden formar concentraciones explosivas de vapores de combustible con el aire en un amplio rango de temperaturas y especialmente en espacios y contenedores cerrados. La naturaleza y contenido de las medidas cautelares se regulan por instrucciones departamentales especiales. La esencia de las precauciones es evitar la aparición de una fuente de calor en lugares donde se forman mezclas explosivas, especialmente una fuente de fuego abierto. Una de las fuentes más peligrosas de fuego abierto es la descarga de potenciales electrostáticos a través de un medio vapor-aire y la formación de una chispa al impactar cuerpos sólidos. La aparición de altos potenciales eléctricos en el combustible se explica por sus propiedades electrofísicas. Se pueden caracterizar por la capacidad de acumular cargas en el volumen (electrolizabilidad) y carga propiedades de relajación (cable eléctrico para ellos).
En mesa. 1.5. se dan indicadores que caracterizan las propiedades de riesgo de incendio de los combustibles de aviación.
Tabla 1.5
Propiedades inflamables de los combustibles de aviación.
1 Calculado por aditividad.
^ Calculado según las ecuaciones (47) y (48) GOST 12.1.044-89 basado en el punto de ebullición inicial de -10/-4 °C.
° En el numerador - en un crisol cerrado, en el denominador - en uno abierto. a ‘Límites de propagación de llama según GOST 10277-89.
Velocidad de llama normal
La velocidad de propagación de la llama en una mezcla combustible depende de las condiciones para su determinación y conteo. Para una evaluación comparativa de los combustibles de acuerdo con esta característica, se adopta la velocidad normal de propagación de la llama, es decir, la velocidad lineal de movimiento de la zona de combustión con respecto a una mezcla combustible fresca y homogénea en la dirección normal al frente de la llama. La velocidad de propagación de la llama en tales condiciones para una composición dada de la mezcla combustible puede considerarse como una característica fisicoquímica que depende únicamente de la presión y la temperatura.
Experimentalmente, la velocidad normal de propagación de la llama se determina de acuerdo con GOST 12.1.044-89.
A una temperatura de 20 ° C y una presión de 0.101 MPa en mezclas de hidrocarburo-hidrógeno-aire, la velocidad máxima u se logra a una concentración de combustible en la mezcla de C ^ ~ 1.15 C st x (Fig. 1.24), es decir
con a - 0.87 y con el número de átomos de carbono en el hidrocarburo n\u003e 7, es -39-40 cm / s (Fig. 1.25). La velocidad normal mínima de propagación de la llama y la velocidad de combustión másica alcanzadas en los límites de concentración de propagación de la llama en condiciones normales son 4–6 cm/s y (5–7) 10° g/(cm 2 s) respectivamente.
En ausencia de datos experimentales, la velocidad normal de propagación de la llama debe elegirse por interpolación de los valores de u para mezclas con propiedades fisicoquímicas similares, o deben usarse ecuaciones empíricas. Ecuaciones simples y convenientes fueron propuestas por A.S. Pre-conducción:
- (1.3)
t \u003d t p + B (St-C ^ (C en -C t),
donde u es la velocidad de propagación en cm/s; m es la tasa de combustión másica de la mezcla, g/(cm 2 s); y 11P, tn - valores límite (mínimos) de la velocidad de propagación de la llama; С„ y С n son la concentración de combustible en la mezcla en los límites de concentración inferior y superior de propagación de la llama; A y B son coeficientes determinados a partir de un punto experimental.

Arroz. 1.24.
Propagación de la llama en función del coeficiente estequiométrico molar del exceso de aire bm:
- - parafina; * - olefínico; ° - acetileno; D - aceite; © - dipolar; ° hidrocarburos con C p 11 2 „ ciclos
- 1 2 3 4 5 segundo 7 pag

Arroz. 1.25. La velocidad normal máxima de propagación de la llama en la mezcla aire-combustible en función del número de átomos de carbono en la molécula de hidrocarburo (P=0,101 MPa, 1=20°C, tubo de vidrio abierto: longitud 57 cm, diámetro 2,5 cm): - parafina; * - olefínico;
° - acetileno; D - nafténico; en - dnolsfipovye; o cíclico (C P P2 ");
1 - gasolina [ 116]; 2 - benceno
La relación funcional entre la velocidad de propagación de la llama y la concentración de combustible C t en C t C * t (pero dada por EMIN) se puede representar mediante la ecuación:
- - = 11 pags
/sr-s; yo
"s t -s "t"
donde m y y N- velocidad normal de propagación de la llama
a concentraciones de combustible en la mezcla C t y Connecticut, cm/s; y pp- también,
en el límite inferior de concentración de propagación de la llama, cm/s.
Curso aproximado de la curva y N - /(Ct) en una mezcla de complejo
La composición se puede construir sobre tres puntos de referencia correspondientes a los límites de concentración inferior y superior y la velocidad máxima de propagación de la llama. Para estos puntos, se deben conocer las concentraciones de combustible y las velocidades de propagación de la llama.
Valores C t y y y para los puntos especificados se calculan
por el siguiente método. Cada mezcla compleja de gases combustibles se representa como compuesta por un número correspondiente de mezclas simples. El cálculo de la composición en los límites de concentración y en el punto de máximas velocidades se realiza según la regla de mezcla, en base a los límites de concentración y la composición de "mezclas máximas". La ecuación de cálculo correspondiente tiene la forma:
C] + C* 2 + do oh...
- -Yo G...
- (1.5)
donde b- la concentración de combustible en el CPRP o en una mezcla con una velocidad máxima de propagación de la llama, % (vol.); C, C 2, C 3, ... - la concentración de gases simples en una mezcla compleja,
(s, + C2 + C3 +... = 100%); b|, b 2 , b 3> ... - la concentración de gases en mezclas simples en el KPRP o en mezclas con y y, % (vol.).
El valor de la velocidad máxima normal de propagación de la llama en la mezcla se calcula mediante la ecuación;
C, r/, + C2u2 + C3u3 +
do, + do 2 + do 3 4-...
- (1.6)
donde C*, C 2 , C 3 - el contenido de mezclas simples en una mezcla compleja con una velocidad máxima de propagación de llama,% (vol.); y*, y 2 , y 3 son las velocidades máximas de propagación de la llama en mezclas simples, cm/s.
Para calcular otros puntos de la curva y y= /(C; .) se deben establecer varios valores arbitrarios de la velocidad de la llama, encontrar la concentración b en una mezcla compleja de acuerdo con la ecuación (1.5), en la que C, C 2 , C 3 están dados por la composición de la mezcla.
Este método de cálculo es aplicable a mezclas de gases de naturaleza afín (por ejemplo, metano-propano). Esta técnica no es aplicable a una mezcla de S P N W con H3 y CO.
La tasa de combustión másica es directamente proporcional a la temperatura absoluta de precalentamiento de la mezcla y se puede calcular a partir de la ecuación:

donde w, entonces y t „ R eo- tasa de combustión másica de la mezcla a la temperatura T, To y T P r e d, respectivamente, g/(cm -s).
Si T»T pr e D, entonces

La dependencia de la velocidad normal máxima de propagación de la llama con la temperatura y la presión se describe aproximadamente mediante la ecuación:
y' =u1(T/273) 2 ?(/’/10 5)", (19)
donde u'o es la máxima velocidad normal de propagación de la llama a una temperatura de 293 K y una presión de 0,101 MPa, cm/s; T es la temperatura l de la llama, en K; P - presión, en Pa; p - exponente, ns dependiendo de la presión en el rango MO 4 + 5-10 5 Pa; para mezcla aire-combustible n = -0.3 -*? -0,4; para mezclas de hidrocarburo-oxígeno P = -0.1 -5-0.
Velocidad normal máxima de propagación de la llama en función de la concentración de oxígeno en el comburente P R P wu p
giil = \%ig" 0 + B-
donde G „I! Pero - en y, p y^ 0 , cm2/s; B - coeficiente determinado a partir de datos experimentales (para propano B ~ 0,22); tú/t- concentración extremadamente baja de oxígeno en el comburente.
El valor de u*n a diferentes concentraciones de oxígeno en el oxidante 1 //"PAG cuando la temperatura de precalentamiento de la mezcla cambia de 310 a 422 K, se puede determinar mediante la ecuación:
":=en; (u,-s), (MO
donde u*n - en cm/s; T - en K; А, С ip - se encuentran de acuerdo con datos experimentales, sus valores para propano, isooctano y etileno se dan a continuación:
Límites de concentración y temperatura de propagación de la llama
Los límites de concentración de propagación de llama (KPRP) en una mezcla combustible son las concentraciones límite mínima y máxima de combustible en la mezcla en la que todavía es posible la propagación de llama (límites inferior y superior, respectivamente). Dependen de la actividad química del combustible, la concentración de oxidante e impurezas inertes, la conductividad térmica y la capacidad calorífica de la mezcla, la temperatura y la presión. Los KPPR para combustibles para suspensión, en función de sus propiedades físicas y químicas, están determinados por el medio de dispersión. La determinación de KPRP para mezclas combustibles homogéneas se lleva a cabo de acuerdo con GOST 12.1.044-89: de acuerdo con la cláusula 4.11 experimentalmente y de acuerdo con la cláusula 4.12, por cálculo.
Según GOST 12.1.044-84, los límites de concentración de propagación de llama se definen como

donde Cn (i) - CPRP inferior (superior),% (vol.); R- coeficiente estequiométrico (número de moles de oxígeno por mol de combustible); un y b- constantes universales, sus valores se dan a continuación:
Para combustibles C P N W
P \u003d n + t / 4.
Error de cálculo: para el límite inferior 0,12; para el superior 0.40 en (3 p > 7,5. Datos sobre KIRP en función de R(% vol.) se dan en la tabla. 1.6 (GOST 12.1.044-84).
Tabla 1.6
Límites de concentración de propagación de llama (inferior y superior) de vapores y gases en el aire
Existen otras ecuaciones para calcular el CPRP, a saber:
- 4.76-(N-1) + ! '
- (1.14)
- 4.76/Y +4'
- (1.15)
donde С„ y de a - en aproximadamente.); N es el número de átomos de oxígeno necesarios para la oxidación completa del combustible.
Para combustible С„Н t
- (1.17)
- 3,74 10 5
donde Cn - en% (vol.); () norte es el valor calorífico molar más bajo, kJ/kmol.
Para combustibles de hidrocarburos SpN t a 3 p 10, el error de cálculo es de ±15%.
Si se conoce el KRI de los componentes individuales del combustible, se recomienda calcular su KRI inferior mediante la ecuación:
donde C y Cn son las concentraciones del 1er componente en la mezcla y en el límite inferior, % (vol.).
Para combustibles C p N t en primera aproximación a k ~ a p - 1.42. Recálculo, y de en a un y un producido:

donde Cn (d) es la concentración de combustible en la parte inferior (superior)
KPRP, % (vol.); Mt y Mo son el peso molecular del combustible y el comburente; Bo - en kg de comburente/kg de combustible; bm es el coeficiente estequiométrico molar, mol de combustible/mol de combustible.
El recálculo del KPPR inferior para diferentes temperaturas se puede realizar de acuerdo con la ecuación:
L II l
T - 293
donde Tn es la temperatura (en K) de los productos de combustión de la mezcla, en la que la concentración de combustible a 293 K corresponde al KPP inferior (en primera aproximación, Tn para una mezcla hidrocarburo-aire es 1600-1650K); C „ y C „ - concentraciones de combustible correspondientes al límite inferior de concentración a temperaturas T y 293 K, % (acerca de.).
La ecuación (1.20) es válida en un amplio rango de temperaturas, pero no se puede utilizar a temperaturas cercanas a la temperatura de autoignición.
La temperatura de los productos de combustión en el KPRP más bajo también se puede calcular usando la ecuación
- (A. + 1) -s_s
- (1.21)
este
donde Tn en K; T con la temperatura de la mezcla antes de la combustión, K; Сstsh - concentración de combustible en una mezcla de composición estequiométrica, % (vol.);
Срш es la capacidad calorífica isobárica promedio de los productos de combustión a una temperatura T, „ kJ / (kg ° С).
El KRPP es prácticamente independiente de las dimensiones de un recipiente de reacción cilíndrico si su diámetro es superior a 50 mm, y de uno esférico, si el volumen supera los 2000 cm 3 .
Para determinar el KPPR y la composición óptima de la mezcla hidrocarburo-aire, los gráficos que se muestran en la fig. 1.26.
С„,s,%(ov.)

Arroz. 1.26. Los límites de concentración de propagación de llama en mezclas de hidrocarburo-aire (Cb y C") y la concentración de hidrocarburo en mezclas de composición estequiométrica (Cc, ") en función del coeficiente estequiométrico molar 1^ m a H20 ° C P = 0,101 MPa:
- - parafina; a - olefínico;
- ? - nafténicos; ? - aromático
Las mezclas combustibles de vapores de combustible con aire en el espacio sobre el combustible pueden formarse solo en un cierto rango de temperatura. La temperatura mínima a la cual una mezcla combustible capaz de combustión estacionaria cuando se enciende desde una fuente externa todavía puede formarse en un volumen cerrado del espacio de sobrecombustible se denomina límite de temperatura inferior; corresponde al KPP inferior. La temperatura más alta a la que la mezcla de vapores con aire en el espacio por encima del combustible aún conserva la capacidad de combustión estacionaria se denomina límite de temperatura superior; corresponde al KPRP superior La determinación experimental de los límites de temperatura para la formación de mezclas explosivas se lleva a cabo de acuerdo con GOST 12.1.044-89 (p. 4.12), calculado - de acuerdo con la aplicación del mismo estándar.
La temperatura a la que se alcanza el límite inferior de temperatura para la formación de una mezcla explosiva a presión atmosférica suele identificarse con el punto de inflamación. En el punto de inflamación, solo se quema la mezcla resultante de vapor y aire, pero el proceso de combustión no se estabiliza.
El cálculo de los límites de temperatura para la formación de mezclas combustibles se reduce a las siguientes operaciones. Inicialmente, a una presión total dada P y valores conocidos del coeficiente de exceso de oxidante (aire) correspondiente al KPRP inferior y superior (un n y una c), de acuerdo con la ecuación (1.22) determinar
presiones parciales de los vapores de combustible Р t :
X | 0.232 sobre? 0 Mt " ?« -
donde P es la presión total, Pa; C - coeficiente estequiométrico, kg de comburente/kg de combustible; un - factor de exceso de oxidante; Mt es la masa de un mol de combustible, kg/kmol; Mo es la masa de un mol de un agente oxidante, para el aire Mo = 28,966 kg/kmol; en/ 0 - concentración de oxígeno en el oxidante en masa.

Arroz. 1.27.
Luego, de acuerdo con las tablas o gráficos, Pc.p. = ^ (0 (donde P, la presión de los vapores de combustible saturados) encuentre las temperaturas correspondientes a los valores calculados de Pt-
Si se desconocen los límites de concentración para la formación de mezclas combustibles, entonces los límites de temperatura se pueden calcular aproximadamente utilizando la ecuación:
1,15 1*(7,5 R d) - 0,239 3,31
donde yo - a 0 C; 15% - punto de ebullición de una fracción del 5%, 0 C; Рт - presión de los vapores de combustible en el KPP (Р„ o Р„), kPa; 8 „ con „ - la entropía de evaporación a una temperatura del 15% y presión atmosférica (tomada de acuerdo con el gráfico de la Fig. 1.28).

Arroz. 1.28.
60 80 100 120 140 160 180 1°C
Límites de energía inflamable y concentración inflamable
La inflamabilidad de una mezcla combustible homogénea por una fuente de calor externa se caracteriza por los límites de concentración y la energía requerida para encenderla.
Los límites de ignición por concentración (CIL) son concentraciones limitantes de combustible en una mezcla en las que una fuente de ignición local (descarga eléctrica, cuerpo calentado, llama) puede garantizar la propagación del proceso de combustión a todo el volumen de la mezcla. Por analogía con KG1RP, se distinguen el CPV superior e inferior. Dependen de las propiedades fisicoquímicas del combustible y comburente, energía y tipo de fuente de ignición, su ubicación, etc.
Según Ya.B. Zeldovich, la energía requerida para encender una mezcla combustible homogénea está determinada por:
R1-T con r (T 2 -Tc)
donde pc y Tc son la densidad y temperatura de la mezcla; Tg es la temperatura de los productos de combustión en la cámara de combustión inicial; L 7 - coeficiente de conductividad térmica de los productos de combustión a Tg; u - velocidad normal de propagación de la llama; C rt - medio
capacidad calorífica isobárica másica del gas en una capa esférica 8 T que rodea la cámara de combustión inicial esférica; 5, - anchura térmica del frente de llama.
La ecuación (1.24) también es aplicable al caso de ignición de una mezcla en movimiento, si el coeficiente de conductividad térmica L 7 ser reemplazado por el coeficiente de intercambio turbulento IV/"(/ - escala
turbulencia, V/*- velocidad pulsante), y el valor de n - la velocidad de propagación de la llama en un flujo turbulento.
La composición de la mezcla correspondiente al mínimo de la curva O = KANSAS,), se llama óptimo. Para hidrocarburos parafínicos normales, la concentración de combustible en una mezcla de composición óptima a 25 °C se puede determinar a partir de la relación:
- 1 - metano; 2 - etano; 3 - propano;
- 4 - n-butano; 5 - n-hexano; 6 - n-heptano;
- 7 - ciclopropano: 8 - éter dietílico;
- 9 - benceno
Con un aumento en la concentración de oxígeno en el comburente, la composición óptima de la mezcla combustible cambia a la región de menor concentración de combustible.
La dependencia de la energía de ignición óptima (mínima) de la presión y la temperatura de la mezcla combustible se describe mediante la ecuación [114]:
O-optar


donde Oopt es la energía de ignición en P y T, J; Cb - energía de ignición en T = 273 K y P = 10 5 Pa.
La ecuación (1.26) tiene una buena correlación con los datos experimentales.
La relación entre la energía de ignición óptima y la concentración de oxígeno en el comburente se describe mediante la ecuación

donde (С? 0 „„,) y / = / - el valor óptimo de la energía de ignición de la mezcla de combustible y oxígeno; ~ concentración de volumen
oxígeno en el oxidante; n es el exponente, está cerca de la unidad (n ~ 0.8).
Datos experimentales para metano, etano y propano al cambiar c/x, de 0,1 a 0,21 y presiones de 0,98 a 19,6 kPa confirman la ecuación (1.27). Aparentemente, sigue siendo válido para mezclas de hidrocarburos.
Las concentraciones de combustible en los límites de ignición se pueden calcular si se conocen el KPRP y los valores de () ref y C opt de acuerdo con las ecuaciones

o.5 (s; + s;) \u003d C_ + 0.15 (C. (1.29)
Las ecuaciones (1.28) y (1.29) son válidas para --
Denotando las partes correctas de estas ecuaciones, respectivamente, B y 0.5A, obtenemos
CON" - CON" = B y C"+ C" = PERO . (1.30)
C" = 0.5 (I-B) y C; =0.5 (A + B). (1.31)
En las ecuaciones anteriores: C in y C n - concentraciones de combustible en la mezcla en el KPRP superior e inferior; C in y C " - la concentración de combustible en la mezcla en el CPV superior e inferior con la energía de ignición de la carga eléctrica capacitiva; C opt - la concentración de combustible en la mezcla correspondiente a O ref.
Las ecuaciones (1.28) y (1.29) se basan en los resultados de los estudios experimentales que se muestran en la fig. 1.30.
- (s;-s>;)-2s optar

Arroz. 1.30. Área de ignición de mezclas C p N P1 + 02 + ^ dependiendo de la energía de ignición
Los límites de concentración de ignición dependen del caudal, acercándose entre sí con su aumento (Fig. 1.31 y 1.32).
La influencia de la velocidad del flujo en la energía de ignición se describe correctamente mediante la ecuación:
(2 = (?o + Au "a (1.32)
donde (Zo - energía de ignición de una mezcla estacionaria, 10 "3 J; XV - velocidad de flujo, m / s; A - coeficiente establecido experimentalmente.

Arroz. 1.31.

Arroz. 1.32. ¿Coeficiente de aire en exceso a en el CPV de la mezcla gasolina-aire en función del caudal? y presión Р [ 114]:
Punto de inflamación y temperatura de autoignición
El punto de inflamación es la temperatura mínima a la cual la mezcla vapor-aire resultante puede encenderse por una fuente de calor externa, pero el proceso de combustión no se estabiliza. Experimentalmente, el punto de inflamación se determina en un crisol abierto o cerrado de acuerdo con GOST 12.1.044-84 (elementos 4.3 y 4.4). La determinación calculada del punto de inflamación se realiza de acuerdo con GOST 12.1.044.84 (cláusula 4.5).
El punto de inflamación está 10-15°C por debajo del límite de temperatura para la formación de una mezcla combustible capaz de propagar llamas.
Para una determinación aproximada del punto de inflamación, se puede utilizar la dependencia que se muestra en la Fig. 1. 1.33.

Arroz. 1.33. Punto de inflamación 1 V cp de turbosina y gasolina B-70 dependiendo de la presión de vapor saturado Pn p a 1=40°C en un crisol cerrado (62]: o - combustibles de diferente composición; - curva generalizadora
La autoignición es el proceso de encender una mezcla combustible sin contacto con una llama o cuerpo caliente. La temperatura inicial mínima suficiente para la autoignición de una mezcla combustible se denomina temperatura de autoignición. Depende de la naturaleza química del combustible, la composición de la mezcla aire-combustible, la presión, la naturaleza adiabática del proceso de autoignición, la presencia de catalizadores e inhibidores de oxidación, y otros factores.
El intervalo de tiempo entre el momento en que la mezcla combustible alcanza la temperatura de autoignición y la aparición de una llama se denomina período de retardo de autoignición. Al suministrar combustible líquido, cubre el proceso de atomización, calentamiento y evaporación de gotas de combustible, difusión de vapores de combustible y oxígeno y, finalmente, reacciones químicas.
La temperatura y el período de retardo del autoencendido están interconectados por la relación:

donde mi- energía de activación efectiva, kJ/kmol; mi\u003d 8.31419 kJ / (kmol K) - constante de gas universal; t- tiempo de retardo del autoencendido a la temperatura T.
La tendencia de los hidrocarburos y sus mezclas a la autoignición se caracteriza por la temperatura mínima de autoignición obtenida en condiciones adiabáticas, cuando el tiempo de exposición de la mezcla combustible en unas condiciones iniciales dadas no limita el proceso de autoignición.
La temperatura mínima de autoignición está determinada únicamente por la estructura de la molécula. Entonces, por ejemplo, para los hidrocarburos parafínicos, 1 st está directamente relacionado con la longitud efectiva de la cadena de carbono Lc, que se calcula mediante la ecuación:
- 21>GLG,
- (1.34)
donde r es el número de grupos CH 3 en la molécula; k es el número de cadenas de carbono que comienzan y terminan con el grupo CH 3, m* es el número de cadenas posibles que contienen átomos de carbono b^. La dependencia 1 sv =A(bc) se muestra en la fig. 1.34.

Arroz. 1.34.
- 1 - CH 4; 2 - C2H6; 3 - C 3 H "; 10 - n - C4H10; 11 - n - C5H12;
- 14 - n - S L N M; 15 - n - C7H16; 16 - n - SkNsch; 17 - n - SdN2o;
- 18 - n - C| 0 H 22; 19 - n - C, 2H 2I; 21 - n - C14H30; 22 - n - C|^H 3 4
La temperatura de autoignición de las mezclas de hidrocarburos no obedece a la regla de aditividad, suele ser inferior a la calculada en base a la regla especificada.
Los datos sobre la temperatura de autoignición de las mezclas de aire y combustible de la composición óptima según el número de átomos de carbono en la molécula de hidrocarburo (para combustibles para aviones en la fórmula anterior) se muestran en la Fig. 2. 1.35. El efecto de la presión y la concentración de oxígeno en el oxidante se ilustra con los datos que se muestran en las Figs. 1.36.

Arroz. 1.35. Dependencia de la temperatura de autoignición de mezclas aire-combustible de composición óptima del número de átomos de hidrocarburo n en la molécula a Р=0.101 MPa [124]; t es el período de retardo del autoencendido; t L - "sobre; RT - combustibles para aviones (p-en la fórmula anterior) - parafina; a-olefínico; ? - hidrocarburos nafténicos

Arroz. 1.36. La dependencia de la temperatura de autoignición del combustible T-6 con la presión P y la concentración de oxígeno en el oxidante f 0 2 (según V.V. Malyshev):
2 = 0 2/(°2+L, d)
La temperatura de autoignición está determinada por la capacidad del combustible para formar mezclas combustibles en la fase de vapor. De esto se deduce que la temperatura de autoignición de la suspensión
combustibles está determinado por el medio de dispersión y el espesante. La fase dispersa participa en el proceso de autoignición solo en términos de absorción de calor cuando la suspensión se calienta a la temperatura de autoignición de la fase líquida.
Presión de explosión en un volumen cerrado
Presión de explosión: la presión más alta que se produce durante una explosión de deflagración de una mezcla de vapor y aire en un volumen cerrado a una presión inicial de 0,101 MPa. La tasa de aumento de presión durante una explosión es la derivada de la presión de explosión con respecto al tiempo. (s1R/(1t) en la sección ascendente de la dependencia P=Y t).
Experimentalmente, la presión de explosión máxima y la tasa de aumento de presión durante la explosión de mezclas de vapor y aire se determinan de acuerdo con GOST 12.1.044-89 (Apéndice 8). La determinación calculada de la tasa de aumento de la presión durante una explosión se lleva a cabo de acuerdo con GOST 12.1.044-89 (Apéndice 12).
La presión de explosión está determinada por:

donde Pvzr - presión de explosión, Pa; Pn - presión inicial, Pa; T„, y T p.s. - temperatura inicial y temperatura de los productos de combustión. PARA; pico - el número de moles de productos de combustión y la mezcla inicial.
La tasa máxima de aumento de presión (en Pa/s) se calcula a partir de la ecuación

donde Ro es la presión inicial. Pensilvania; u - velocidad normal de propagación de la llama en Po y To m / s; To es la temperatura inicial de la mezcla, K; r es el radio de la bomba, m; PAG - R m /R 0 - presión de explosión máxima reducida; k es el índice adiabático de la mezcla bajo prueba; mi- indicador termocinético, en función de yn, presión y temperatura; si valor mi desconocido, se toma igual a 0,4.
La tasa promedio de aumento de presión (en Pa/s) se calcula a partir de la ecuación:
"s1R_ZR 0 y ‘(i-)-i k * e ^m) con g/(l, k, e)
donde ^m,k 7 mi)-función, su valor se encuentra según el nomograma de la fig. 1.37.

Arroz. 1.37. Dependencia de la función /(n, c.s) de presión reducida n=P/PK,„ exponente adiabático para e índice termocinético con mezcla de prueba (apéndice de GOST 12.1.044-84)
Valores tg y k se encuentra por cálculo termodinámico o. en caso de imposibilidad de cálculo, aceptar para= 9,0 yk=1,4.
Urgencias y emergencias
Un accidente es un incidente peligroso provocado por el hombre que crea una amenaza para la vida y la salud de las personas en un objeto, un determinado territorio o área de agua y conduce a la destrucción de edificios, estructuras, equipos y vehículos, la interrupción del proceso de producción o transporte. , así como daños al medio ambiente natural (GOST R 22.0 .05-94).
Un accidente es una liberación destructiva e incontrolada de energía o componentes químicamente (biológicamente, radiación) activos. Dependiendo de la fuente de ocurrencia, se distinguen las situaciones de emergencia (ES) de naturaleza natural, artificial y natural artificial. En la fig. 1.38 muestra el crecimiento relativo en el número de accidentes y desastres naturales, provocados por el hombre y provocados por el hombre natural en Rusia. En la fig. 1.39 muestra la dinámica del número de todos los accidentes provocados por el hombre en Rusia para el período 1990-94. Puede verse en la figura que el aumento en el número de emergencias no ocurre de manera suave, sino abrupta, con estallidos que ocurren en períodos inmediatamente posteriores a los trastornos sociales (agosto de 1991, octubre de 1993).
El número de emergencias provocadas por el hombre ha aumentado de manera especialmente pronunciada en los últimos años, incluso en la aviación.
Objetos potenciales de accidentes son aeronaves, así como instalaciones de almacenamiento y almacenes para productos petrolíferos explosivos e inflamables ubicados en el territorio del aeropuerto, puntos de reabastecimiento de combustible y mantenimiento, y puntos de reparación. La causa de las emergencias pueden ser fugas de aceite.
productos a través de las unidades de sellado de válvulas de cierre, bombas de transferencia, tuberías y dispositivos de llenado; a través de la ventilación del espacio de gas de los tanques; desbordamiento de depósitos, cisternas y tanques; limpieza de tanques; corrosión destrucción de tanques y comunicaciones.
Varios contenedores se utilizan para el almacenamiento y transporte de productos derivados del petróleo. La operación segura de los contenedores está determinada por su fuerza. Sin embargo, pueden ocurrir accidentes en dichas instalaciones debido a deficiencias en el sistema existente para monitorear y monitorear el estado de las estructuras, así como la falta de documentación reglamentaria y técnica.
La seguridad de la operación de las instalaciones de almacenamiento de productos derivados del petróleo debe garantizarse durante el diseño, la construcción y la operación. Este enfoque está dictado por el análisis de la aceptación y la documentación operativa, así como las causas de las situaciones de emergencia. Una tarea importante, cuya solución mejorará la confiabilidad de las instalaciones de almacenamiento operadas, es realizar sus exámenes técnicos completos con base científica y equiparlos con un sistema para diagnosticar y monitorear operativamente la condición del metal, los cimientos, las estructuras de aislamiento térmico y equipos de proceso.
Para la gestión segura de los flujos de productos petrolíferos, la capacidad de servicio de los accesorios tecnológicos de las tuberías es de gran importancia: dispositivos de cierre, estrangulación, seguridad; válvulas de control; válvulas de acción inversa (para evitar la posibilidad de movimiento del producto, la inversa del trabajador); accesorios de emergencia y corte (para el corte automático del flujo a la sección de emergencia o su cierre), drenajes de condensados, etc.
Número de accidentes

Arroz. 1.38.
- 1 - pg "familiares;
- 2 - natural-tecnogénico;
- 3 - tecnogénico

Arroz. 1.39.
Cuando el equipo está despresurizado, el producto sale y se evapora rápidamente con la formación de una concentración
de mezclas gas-vapor-aire explosivas e inflamables. Las emisiones o fugas accidentales de mezclas de vapor y gas dan lugar a la formación de nubes que pueden detonar. En el trabajo se considera la detonación de sistemas vapor-gas y aerodispersos. La ocurrencia de detonación en nubes grandes se explica por los siguientes mecanismos. El primero de ellos tiene en cuenta el posible efecto de la intensa radiación térmica de una llama larga en las nubes mezcladas preliminarmente por flujos turbulentos de gas.
El segundo mecanismo para que ocurra la detonación involucra la aceleración de las llamas en nubes grandes debido a la diferencia en las aceleraciones de los volúmenes elementales del gas quemado y la mezcla fresca en una llama turbulenta. Esta diferencia surge bajo la acción de los gradientes de presión promedio en la llama debido a la diferente flotabilidad de los volúmenes de gas elemental de diferentes densidades, lo que conduce a una turbulencia y retroalimentación de flujo adicional. Este mecanismo de retroalimentación positiva, determinado por la diferencia de densidades en diferentes áreas de la nube, puede intensificar significativamente la aceleración de la llama.
El encendido va acompañado de un destello brillante de alta temperatura. La figura geométrica más aceptable de la mezcla de vapor y gas evaporada es la figura de una bola irregular o elipse (bola de fuego). Se entiende por bola de fuego (OS) el producto de la evaporación o fuga repentina de combustible (o gas) gasificado, acompañada de su fogonazo y posterior combustión normal o de deflagración. Para numerosas descargas lineales y cíclicas de hidrocarburos combustibles en el rango de densidad de 700 a 1000 kg / m 3, las relaciones para el diámetro de la bola de fuego se dan:
donde M es la masa de combustible en el OH, kg;
Тf - temperatura real en el OR (en la nube), 0 С;
Trep - temperatura de referencia (referencia), °С.
El rango del coeficiente 4.2n-5.3 depende del tipo de combustible y de las condiciones de formación de nubes.
Para el tiempo de vida de una nube durante su combustión natural, la expresión tiene la forma:
m = 0M-*1m-1±.
Estas dependencias se muestran en la fig. 1.40 y 1.41.

Arroz. 1.40.

Arroz. 1.41.
Existe un gran peligro de explosión de mezclas vapor-gas-aire en un volumen cerrado. En mesa. 1.7 muestra los límites de detonación de hidrocarburos en el aire en un volumen cerrado y espacio abierto, que indican un mayor peligro de explosión de gas o mezclas gas-vapor en un volumen cerrado. Esto se explica tanto por los procesos de aceleración de la reacción debido al aumento de la autocatálisis, como por la amplificación de las ondas reflejadas durante el inicio del proceso ario y por una serie de razones cinéticas siempre presentes. La mayor facilidad de excitación de la detonación en los recipientes se debe a la capacidad de las paredes para generar turbulencia en el flujo frente a la llama, lo que acelera la transición de la combustión a la detonación.
Límites de detonación de hidrocarburos en el aire
La explosión de la mezcla gaseosa acumulada puede ocurrir bajo la acción de una chispa accidental. Con una carga abierta de un producto petrolífero, también es posible una explosión debido a una descarga estática, en particular, en ausencia de un dispositivo de puesta a tierra. La causa más común de una explosión es una chispa, incluso como resultado de la acumulación de electricidad estática. Una chispa eléctrica puede ocurrir sin conductores ni redes. Es peligroso porque se presenta en los lugares más insospechados: en las paredes de los tanques, en los neumáticos de los automóviles, en la ropa, en los impactos, en los roces, etc. Otra de las causas de la explosión es la negligencia e indisciplina de los trabajadores.
Donde sea posible la formación de mezclas de vapor, gas y aire, es necesario proporcionar una protección confiable contra rayos, protección contra la electricidad estática y prever medidas contra las chispas de los aparatos eléctricos y otros equipos.
En caso de accidentes asociados con explosiones, se produce la destrucción de los objetos circundantes y las personas resultan heridas. La destrucción es consecuencia de la acción fantasma de los productos de la explosión y la onda de choque del aire. En este caso, los principales factores dañinos son la onda de choque, la radiación térmica ligera y las cargas tóxicas (monóxido de carbono). Las personas que se encuentran a una distancia de 5 m reciben quemaduras de primer grado y otras lesiones.
Los accidentes con explosivos suelen ir acompañados de incendios, que pueden tener consecuencias catastróficas y posteriores explosiones más grandes y una mayor destrucción. Las causas de los incendios suelen ser las mismas que las de las explosiones. En este caso, una explosión puede ser causa o efecto de un incendio y viceversa, un incendio puede ser la causa o efecto de una explosión.
Un incendio es una ciudad de renio que se desarrolla espontáneamente, no prevista por procesos tecnológicos. La combustión de productos derivados del petróleo puede ocurrir en tanques, equipos de producción y derrames en áreas abiertas. En caso de incendio de productos derivados del petróleo en tanques, pueden ocurrir explosiones, ebullición y su liberación, y como resultado, derrames de líquido caliente. Las emisiones y la ebullición de los productos derivados del petróleo son de gran peligro, lo que está asociado con la presencia de agua en ellos, y se caracteriza por la rápida combustión de la masa espumosa de los productos. Al hervir, la temperatura aumenta bruscamente (hasta 1500 ° C) y la altura de la llama.
Para evaluar el grado de daño de un objeto, se suele utilizar la llamada curva de umbral, que relaciona el flujo de energía calorífica y luminosa q (flujo de calor) y la energía total O, que cae por unidad de superficie (Fig. 1.42).

Arroz. 1.42.
Para tiempos prolongados de exposición térmica, que excedan el tiempo de la posible existencia intacta del objeto, el umbral de daño estará determinado exclusivamente por el flujo térmico (luz térmica) n. Bajo pulsos de exposición corta, el umbral estará determinado principalmente por la energía O. Los valores de R y O que excedan el umbral causarán un daño incondicional al objeto.
Si I u O es menor que sus valores umbral, entonces no hay una lesión típica y solo es posible una molestia leve. Por ejemplo, con un aumento en la duración de la radiación de 0,5 a 2 s, i disminuye de 120 a 30 unidades, es decir con un ligero aumento de O incluso con un aumento del tiempo de exposición de 4 veces, afectando a las lesiones
están ausentes, y una persona puede sentir solo una ligera molestia.
Sin embargo, el valor de la energía total O que cae sobre el objeto de destrucción en el mismo período de tiempo crece de aproximadamente 10 a 25 unidades. (^.
Así, la línea K, respondiendo a cambios interrelacionados en I y O, forma una zona (área) de la lesión, indicada en la figura a la derecha de la línea K.
Una de las consecuencias más desagradables del daño por energía radiante es la quemadura de los "bastones" y "conos" del ojo.
En la fig. 1.43 muestra la dependencia de i en m, así como T en m, que determina las áreas de dolor tolerable e intolerable durante la formación de quemaduras térmicas por luz de diversos grados. El criterio implementado en la figura se basa en el hecho de que con la radiación térmica, se produce un dolor insoportable cuando la temperatura de una capa de piel de aproximadamente 0,14-0,15 mm de espesor (debajo de la superficie de la capa epitelial superior) alcanza o supera una temperatura de 45 ° C.
Después de la eliminación de la radiación (pero no más de 20-30 s), el dolor agudo cede y luego, por regla general, desaparece por completo. Un aumento en la temperatura de esta capa de 4 a 10 grados o más provoca un shock de dolor y quemaduras evidentes en la piel.
El área de dolor tolerable que se muestra en el gráfico está determinada por el hecho de que en el momento de la exposición a la radiación se produce un reflejo protector biológico que provoca un aumento del flujo sanguíneo desde las partes periféricas del cuerpo, lo que impide un aumento local. en la temperatura a un nivel de umbral. Cuando se expone a una alta dosis de presión térmica, este mecanismo fisiológico ya no puede proporcionar la eliminación de calor necesaria y el cuerpo sufre cargas térmicas patológicas y, a veces, prohibitivas. De la naturaleza de las líneas en la Fig. 1.42 muestra que hay una cierta cantidad
dosis de radiación q y temperatura T, lo que provoca daño térmico y la aparición de un dolor insoportable cuando se aporta esta dosis con el tiempo de exposición necesario.
Duración de la exposición, s Fig 1.43. Límites de lesiones térmicas y lumínicas
Los accidentes con aeronaves (LA) ocurren principalmente debido al mal funcionamiento de las unidades, en primer lugar: falla del motor, ataques terroristas, incendios y van acompañados de explosiones. Puede producirse una explosión en el aire o al impactar contra el suelo. Cuando una aeronave cae sobre zonas residenciales, se pueden dañar personas, estructuras, etc.. En los trabajos se dan ejemplos de emergencias aeronáuticas, su análisis.
Uno de los principales peligros en la aviación es la posibilidad de un incendio durante un aterrizaje de emergencia. El combustible que se escapa de los tanques dañados puede encenderse por chispas de fricción de
superficies o llamas abiertas. En este caso, el centro de combustión resultante se esparce rápidamente por todas las zonas en las que la relación aire-vapor/combustible está dentro de la región de inflamabilidad. Un método para reducir el riesgo de incendio es utilizar combustibles gelificados, que se esparcen más lentamente y son menos volátiles que los combustibles líquidos convencionales. Cuando se daña un tanque con combustible espesado, tanto la tasa de dispersión del combustible como la tasa de formación de aerosoles inflamables se reducen drásticamente. Esto le permite aumentar el período de tiempo durante el cual los pasajeros pueden ser evacuados.
Las emergencias y emergencias provocan grandes daños materiales y exacerban los problemas ambientales. En caso de accidentes acompañados de explosiones e incendios, se produce un fuerte impacto mecánico, térmico y químico en el medio ambiente. Al mismo tiempo, las emisiones de contaminantes aumentan considerablemente; la superficie de la tierra está llena de fragmentos de LL, residuos de combustible, productos de combustión; se causan daños significativos al paisaje natural, flora, fauna; los pastos y los suelos fértiles están muriendo.
El efecto mecánico se caracteriza por la violación de la capa superior (fértil) del suelo debido a su destrucción superficial y profunda, el impacto de la energía de la explosión (onda de choque); violación de la cubierta de pasto, daño o muerte de arbustos, árboles y otra vegetación. La estructura de la capa fértil superior, el intercambio de gas y agua y la estructura capilar están cambiando.
Las medidas destinadas a mejorar la seguridad en situaciones de emergencia suelen dividirse en dos categorías. El primero incluye actividades realizadas después del surgimiento de
situación de emergencia. Las actividades de El1 suelen denominarse operativas y se reducen esencialmente a proteger a la población y eliminar las consecuencias de las emergencias. El segundo grupo de medidas incluye actividades realizadas con anticipación. Estos incluyen aumentar la confiabilidad de los equipos de proceso, reducir las existencias de sustancias peligrosas en las instalaciones, eliminar una instalación peligrosa y tomar medidas tempranas para proteger a las personas.
De gran importancia es el sistema de seguridad de vuelo activo (ASOSPS), que es un elemento del sistema de apoyo al piloto "inteligente" a bordo, conocido en la práctica aeronáutica como el "asistente del piloto", diseñado para trabajar tanto en situaciones de vuelo normales como anormales. . ASOBP emite señales de advertencia sobre una amenaza para la seguridad del vuelo, así como información oportuna en forma de "consejos" para controlar la aeronave y su complejo a bordo para evitar que la aeronave entre en modos críticos de vuelo. Para evitar colisiones con la superficie terrestre y entre aeronaves, el ASOBP genera trayectorias espaciales de "separación".
Una de las áreas efectivas de trabajo en la prevención de accidentes de aviación es la investigación completa, profunda y objetiva de los eventos que ya han ocurrido y el desarrollo de recomendaciones sobre esta base para evitar que se repitan.
La eficacia de dicho trabajo depende no solo de un nivel suficiente de recursos, sino también de los poderes exhaustivos del organismo que realiza una investigación independiente, lo que le permite influir en cualquier área del sistema de transporte aéreo (fabricación, diseño, prueba, certificación , operación, reparación, marco regulatorio, etc.).
Estándar 5.4. El Anexo 13 del Convenio sobre Aviación Civil Internacional establece: "Se otorgará a la autoridad de investigación de accidentes independencia en la realización de la investigación y facultades ilimitadas para llevarla a cabo". Este requisito también se implementa en las Reglas de investigación rusas aprobadas por el Gobierno de la Federación Rusa. El Comité Interestatal de Aviación (IAC) formado por el Acuerdo recibió de los jefes de estado y de gobierno de la CEI el derecho a investigar de forma independiente los accidentes de aviación. Desde 1992, los especialistas de IAC han investigado más de 270 accidentes de aviación, incluidos más de 50 internacionales, incluidas investigaciones de eventos con aeronaves de fabricación occidental.
Actualmente existen siete centros especializados de investigación de accidentes de este tipo en el mundo (EE.UU., Francia, Gran Bretaña, Canadá, Alemania, Australia e IAC).
No es de poca importancia el suministro de información a los estados con datos sobre fallas y mal funcionamiento del equipo de aviación y acciones erróneas de las tripulaciones. Con estos datos, las autoridades aeronáuticas de cada Estado pueden tomar medidas preventivas.