Disposiciones informativas y metodológicas para la mejora de la gestión de las actividades innovadoras. Mejorar la gestión de las actividades innovadoras de la organización. organizativo y económico - contiene temas relacionados con la planificación de personal y
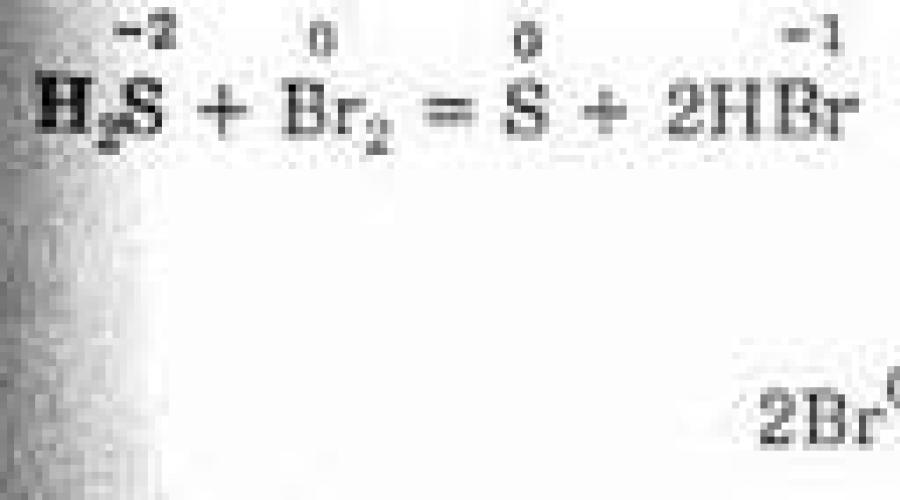
El flúor solo puede ser un agente oxidante, lo que se explica fácilmente por su posición en el sistema periódico de elementos químicos de D. I. Mendeleev. Es el agente oxidante más fuerte, oxidando incluso algunos gases nobles:
2F 2 +Xe=XeF 4
La alta actividad química del flúor debe explicarse
Pero la destrucción de una molécula de flúor requiere mucha menos energía que la que se libera durante la formación de nuevos enlaces.
Entonces, debido al pequeño radio del átomo de flúor, los pares de electrones no compartidos en la molécula de flúor chocan y se debilitan.
Los halógenos interactúan con casi todas las sustancias simples.
1. La reacción con los metales procede más vigorosamente. Cuando se calienta, el flúor interactúa con todos los metales (incluidos el oro y el platino); en frío reacciona con metales alcalinos, plomo, hierro. Con cobre, níquel, la reacción no se produce en frío, ya que se forma una capa protectora de fluoruro en la superficie del metal, que protege al metal de una mayor oxidación.
El cloro reacciona vigorosamente con los metales alcalinos, y con el cobre, el hierro y el estaño, la reacción continúa cuando se calienta. El bromo y el yodo se comportan de manera similar.
La interacción de los halógenos con los metales es un proceso exotérmico y puede expresarse mediante la ecuación:
2M + nHaI 2 \u003d 2MHaI DH<0
Los haluros metálicos son sales típicas.
Los halógenos en esta reacción exhiben fuertes propiedades oxidantes. En este caso, los átomos de metal donan electrones y los átomos de halógeno reciben, por ejemplo:
2. En condiciones normales, el flúor reacciona con el hidrógeno en la oscuridad con una explosión. La interacción del cloro con el hidrógeno se produce a la luz del sol.
El bromo y el hidrógeno interactúan solo cuando se calientan, y el yodo y el hidrógeno reaccionan cuando se calientan fuertemente (hasta 350°C), pero este proceso es reversible.
H 2 + Cl 2 \u003d 2HCl H 2 + Br 2 \u003d 2HBr
H 2 + I 2 "350 ° 2HI
El halógeno en esta reacción es el agente oxidante.
Los estudios han demostrado que la reacción de la interacción del hidrógeno con el cloro en la luz tiene el siguiente mecanismo.
La molécula de Cl 2 absorbe un cuanto de luz hv y se descompone en radicales inorgánicos Cl . . Esto sirve como el comienzo de la reacción (la excitación inicial de la reacción). Luego continúa por su cuenta. El radical cloro Cl. reacciona con una molécula de hidrógeno. En este caso, se forma un radical de hidrógeno H. y HCl. A su vez, el radical de hidrógeno H. reacciona con la molécula de Cl 2, formando Hcl y Cl. etc.
Cl2+hv=Cl. +Cl.
cl. + H 2 \u003d Hcl + H.
N. + Cl 2 \u003d Hcl + C1.
La excitación inicial provocó una cadena de reacciones sucesivas. Este tipo de reacciones se denominan reacciones en cadena. El resultado es cloruro de hidrógeno.
3. Los halógenos no interactúan directamente con el oxígeno y el nitrógeno.
4. Los halógenos reaccionan bien con otros no metales, por ejemplo:
2P + 3Cl 2 \u003d 2PCl 3 2P + 5Cl 2 \u003d 2PCl 5 Si + 2F 2 \u003d SiF 4
Los halógenos (excepto el flúor) no reaccionan con gases inertes. La actividad química del bromo y el yodo con respecto a los no metales es menos pronunciada que la del flúor y el cloro.
En todas las reacciones anteriores, los halógenos exhiben propiedades oxidantes.
Interacción de halógenos con sustancias complejas. 5. Con agua.
El flúor reacciona explosivamente con el agua para formar oxígeno atómico:
H 2 O + F 2 \u003d 2HF + O
Los halógenos restantes reaccionan con el agua según el siguiente esquema:
Gal 0 2 + H 2 O "NGal -1 + NGal +1 O
Esta reacción es una reacción de desproporción cuando el halógeno es tanto un agente reductor como un agente oxidante, por ejemplo:
Cl 2 + H 2 O "HCl + HClO
Cl 2 + H 2 O "H + + Cl - + HClO
Сl°+1e - ®Сl - Cl°-1e - ®Сl +
donde HCl es un ácido clorhídrico fuerte; HClO - ácido hipocloroso débil
6. Los halógenos pueden tomar hidrógeno de otras sustancias, trementina + C1 2 = HC1 + carbono

El cloro reemplaza al hidrógeno en hidrocarburos saturados: CH 4 + Cl 2 \u003d CH 3 Cl + HCl
y une compuestos insaturados:
C 2 H 4 + Cl 2 \u003d C 2 H 4 Cl 2
7. La reactividad de los halógenos decrece en la serie F-Cl - Br - I. Por tanto, el elemento anterior desplaza al siguiente de los ácidos del tipo NG (G - halógeno) y sus sales. En este caso, la actividad disminuye: F 2 > Cl 2 > Br 2 > I 2

Solicitud
El cloro se utiliza para desinfectar el agua potable, blanquear tejidos y pulpa de papel. Se consumen grandes cantidades para producir ácido clorhídrico, lejía, etc. El flúor ha encontrado una amplia aplicación en la síntesis de materiales poliméricos: fluoroplásticos, que tienen una alta resistencia química, y también como oxidante para combustible para cohetes. Algunos compuestos de flúor se utilizan en medicina. El bromo y el yodo son agentes oxidantes fuertes y se utilizan en diversas síntesis y análisis de sustancias.
Grandes cantidades de bromo y yodo se utilizan en la fabricación de medicamentos.
haluros de hidrógeno
Los compuestos de halógenos con hidrógeno HX, donde X es cualquier halógeno, se denominan haluros de hidrógeno. Debido a la alta electronegatividad de los halógenos, el par de electrones de enlace se desplaza hacia ellos, por lo que las moléculas de estos compuestos son polares.
Los haluros de hidrógeno son gases incoloros con un olor acre y son fácilmente solubles en agua. A 0°C, disuelva 500 volúmenes de HCl, 600 volúmenes de HBr y 450 volúmenes de HI en 1 volumen de agua. El fluoruro de hidrógeno es miscible con agua en cualquier proporción. La alta solubilidad de estos compuestos en agua permite obtener concentrados
Tabla 16. Grados de disociación de ácidos hidrohálicos
soluciones de baño. Cuando se disuelven en agua, los haluros de hidrógeno se disocian como ácidos. HF pertenece a compuestos débilmente disociados, lo que se explica por la fuerza especial del enlace en el frío. Las soluciones restantes de haluros de hidrógeno se encuentran entre los ácidos fuertes.
HF - ácido fluorhídrico (hidrofluórico) HC1 - ácido clorhídrico (clorhídrico) HBr - ácido bromhídrico HI - ácido yodhídrico
La fuerza de los ácidos en la serie HF - HCl - HBr - HI aumenta, lo que se explica por una disminución en la misma dirección de la energía de enlace y un aumento en la distancia internuclear. HI es el ácido más fuerte entre los ácidos hidrohálicos (ver Tabla 16).
![]()
La polarizabilidad aumenta debido al hecho de que el agua se polariza
más es la conexión, cuya longitud es mayor. I Las sales de ácidos hidrohálicos tienen los siguientes nombres, respectivamente: fluoruros, cloruros, bromuros, yoduros.
Propiedades químicas de los ácidos hidrohálicos
En forma seca, los haluros de hidrógeno no actúan sobre la mayoría de los metales.
1. Las soluciones acuosas de haluros de hidrógeno tienen las propiedades de los ácidos libres de oxígeno. Interactuar vigorosamente con muchos metales, sus óxidos e hidróxidos; los metales que están en la serie electroquímica de voltajes de los metales después del hidrógeno no se ven afectados. Interactúa con algunas sales y gases.

El ácido fluorhídrico destruye el vidrio y los silicatos:
SiO 2 + 4HF \u003d SiF 4 + 2H 2 O
Por lo tanto, no se puede almacenar en cristalería.
2. En las reacciones redox, los ácidos hidrohálicos se comportan como agentes reductores y la actividad reductora en la serie Cl - , Br - , I - aumenta.

Recibo
El fluoruro de hidrógeno se produce por la acción del ácido sulfúrico concentrado sobre el espato flúor:
CaF 2 + H 2 SO 4 \u003d CaSO 4 + 2HF
El cloruro de hidrógeno se obtiene por interacción directa del hidrógeno con el cloro:
H 2 + Cl 2 \u003d 2HCl
Esta es una forma sintética de obtener.
El método del sulfato se basa en la reacción de concentrado
ácido sulfúrico con NaCl.
Con un ligero calentamiento, la reacción prosigue con la formación de HCl y NaHSO 4 .
NaCl + H 2 SO 4 \u003d NaHSO 4 + HCl
A una temperatura más alta, procede la segunda etapa de la reacción:
NaCl + NaHSO 4 \u003d Na 2 SO 4 + HCl
Pero HBr y HI no se pueden obtener de manera similar, porque sus compuestos con metales cuando interactúan con concentrados
oxidado con ácido sulfúrico, porque. I - y Br - son fuertes agentes reductores.
2NaBr -1 + 2H 2 S +6 O 4 (k) \u003dBr 0 2 + S +4 O 2 + Na 2 SO 4 + 2H 2 O
![]()
El bromuro de hidrógeno y el yoduro de hidrógeno se obtienen por hidrólisis de PBr 3 y PI 3: PBr 3 + 3H 2 O \u003d 3HBr + H 3 PO 3 PI 3 + 3H 2 O \u003d 3HI + H 3 PO 3
haluros
Los haluros metálicos son sales típicas. Se caracterizan por un tipo de enlace iónico, donde los iones metálicos tienen una carga positiva y los iones halógenos tienen una carga negativa. Tienen una red cristalina.
La capacidad reductora de los haluros aumenta en la serie Cl - , Br - , I - (ver § 2.2).
La solubilidad de las sales poco solubles disminuye en la serie AgCl - AgBr - AgI; por el contrario, la sal de AgF es muy soluble en agua. La mayoría de las sales de ácidos hidrohálicos son altamente solubles en agua.
DEFINICIÓN
halógenos- elementos del grupo VIIA - flúor (F), cloro (Cl), bromo (Br) y yodo (I).
Configuración electrónica del nivel de energía externa de los halógenos ns 2 np 5 . Dado que, antes de completar el nivel de energía, los halógenos carecen de un solo electrón, en OVR exhiben con mayor frecuencia las propiedades de los agentes oxidantes. Estados de oxidación de los halógenos: de "-1" a "+7". El único elemento del grupo de los halógenos, el flúor, presenta un solo estado de oxidación "-1" y es el elemento más electronegativo.
Las moléculas de halógeno son diatómicas: F 2 , Cl 2 , Br 2 , I 2 . Con un aumento en la carga del núcleo de un átomo de un elemento químico, es decir. al pasar del flúor al yodo, la capacidad oxidante de los halógenos disminuye, lo que se confirma por la capacidad de desplazar los halógenos inferiores por los superiores de los ácidos hidrohálicos y sus sales:
Br 2 + 2HI \u003d Yo 2 + 2HBr
Cl2 + 2KBr = Br2 + 2KCl
Propiedades físicas de los halógenos.
en n.o. El flúor es un gas de color amarillo claro con un olor acre. Venenoso. El cloro es un gas de color verde claro, como el flúor, tiene un olor acre. Fuertemente venenoso. A presión elevada y temperatura ambiente, se convierte fácilmente en estado líquido. El bromo es un líquido pesado de color marrón rojizo con un olor acre desagradable característico. El bromo líquido, así como sus vapores, son altamente tóxicos. El bromo es poco soluble en agua y bueno en disolventes no polares. El yodo es un sólido gris oscuro con un brillo metálico. Los vapores de yodo son de color púrpura. El yodo se sublima fácilmente, es decir, transforma a un estado gaseoso de un sólido, sin pasar por el estado líquido.
Obtención de halógenos
Los halógenos se pueden obtener por electrólisis de soluciones o fundidos de haluros:
MgCl 2 \u003d Mg + Cl 2 (derretido)
La mayoría de las veces, los halógenos se obtienen mediante la reacción de oxidación de los ácidos hidrohálicos:
MnO 2 + 4HCl \u003d MnCl 2 + Cl 2 + 2H 2 O
K 2 Cr 2 O 7 + 14HCl \u003d 3Cl 2 + 2KCl + 2CrCl 3 + 7H 2 O
2KMnO4 + 16HCl \u003d 2MnCl2 + 5Cl2 + 8H2O + 2KCl
Propiedades químicas de los halógenos.
El flúor tiene la mayor actividad química. La mayoría de los elementos químicos, incluso a temperatura ambiente, interactúan con el flúor y liberan una gran cantidad de calor. Hasta el agua arde en flúor:
2H 2 O + 2F 2 \u003d 4HF + O 2
El cloro libre es menos reactivo que el flúor. No reacciona directamente con oxígeno, nitrógeno y gases nobles. Interactúa con todas las demás sustancias como el flúor:
2Fe + Cl2 = 2FeCl3
2P + 5Cl2 = 2PCl5
Cuando el cloro interactúa con el agua en frío, se produce una reacción reversible:
Cl 2 + H 2 O↔HCl + HClO
La mezcla, que son los productos de reacción, se llama agua clorada.
Cuando el cloro interactúa con los álcalis en frío, se forman mezclas de cloruros e hipocloritos:
Cl 2 + Ca (OH) 2 \u003d Ca (Cl) OCl + H 2 O
Cuando el cloro se disuelve en una solución alcalina caliente, ocurre la siguiente reacción:
3Cl 2 + 6KOH \u003d 5KCl + KClO 3 + 3H 2 O
El bromo, como el cloro, se disuelve en agua y, reaccionando parcialmente con ella, forma la llamada "agua de bromo", mientras que el yodo es prácticamente insoluble en agua.
El yodo difiere significativamente en la actividad química de otros halógenos. No reacciona con la mayoría de los no metales y reacciona lentamente con los metales solo cuando se calienta. La interacción del yodo con el hidrógeno ocurre solo con un fuerte calentamiento, la reacción es endotérmica y altamente reversible:
H 2 + I 2 \u003d 2HI - 53 kJ.
Ejemplos de resolución de problemas
EJEMPLO 1
| Ejercicio | Calcular el volumen de cloro (n.a.) que reaccionó con yoduro de potasio si se formó yodo con una masa de 508 g | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Decisión | Escribamos la ecuación de reacción: Cl 2 + 2KI \u003d Yo 2 + 2KCl Encuentre la cantidad de sustancia formada yodo: v(yo 2)=m(yo 2)/M(yo 2) v (yo 2) \u003d 508/254 \u003d 2 mol De acuerdo con la ecuación de reacción, la cantidad de sustancia de cloro. El átomo de hidrógeno tiene la fórmula electrónica del (y único) nivel electrónico externo 1 s uno . Por un lado, por la presencia de un electrón en el nivel electrónico exterior, el átomo de hidrógeno es similar a los átomos de metales alcalinos. Sin embargo, al igual que los halógenos, solo le falta un electrón para llenar el nivel electrónico externo, ya que no se pueden ubicar más de 2 electrones en el primer nivel electrónico. Resulta que el hidrógeno se puede colocar simultáneamente tanto en el primer como en el penúltimo (séptimo) grupo de la tabla periódica, lo que a veces se hace en varias versiones del sistema periódico: Sin embargo, desde el punto de vista de las propiedades del hidrógeno como sustancia simple, tiene más en común con los halógenos. El hidrógeno, al igual que los halógenos, es un no metal y forma moléculas diatómicas (H 2 ) de manera similar a ellos. En condiciones normales, el hidrógeno es una sustancia gaseosa e inactiva. La baja actividad del hidrógeno se explica por la alta fuerza del enlace entre los átomos de hidrógeno en la molécula, que requiere un fuerte calentamiento o el uso de catalizadores, o ambos al mismo tiempo, para romperlo. Interacción del hidrógeno con sustancias simples.con metales¡De los metales, el hidrógeno reacciona solo con álcalis y alcalinotérreos! Los metales alcalinos incluyen los metales del subgrupo principal del grupo I (Li, Na, K, Rb, Cs, Fr), y los metales alcalinotérreos son los metales del subgrupo principal del grupo II, excepto el berilio y el magnesio (Ca, Sr, Ba , Ra) Cuando interactúa con metales activos, el hidrógeno exhibe propiedades oxidantes, es decir, disminuye su estado de oxidación. En este caso, se forman hidruros de metales alcalinos y alcalinotérreos, que tienen una estructura iónica. La reacción procede cuando se calienta: Cabe señalar que la interacción con metales activos es el único caso cuando el hidrógeno molecular H2 es un agente oxidante. con no metales¡De los no metales, el hidrógeno reacciona solo con carbono, nitrógeno, oxígeno, azufre, selenio y halógenos! El carbono debe entenderse como grafito o carbono amorfo, ya que el diamante es una modificación alotrópica extremadamente inerte del carbono. Al interactuar con los no metales, el hidrógeno solo puede realizar la función de un agente reductor, es decir, solo puede aumentar su estado de oxidación: Interacción del hidrógeno con sustancias complejascon óxidos metálicosEl hidrógeno no reacciona con los óxidos metálicos que están en la serie de actividad de los metales hasta el aluminio (inclusive), sin embargo, es capaz de reducir muchos óxidos metálicos a la derecha del aluminio cuando se calienta: con óxidos no metálicosDe los óxidos no metálicos, el hidrógeno reacciona cuando se calienta con óxidos de nitrógeno, halógenos y carbono. De todas las interacciones del hidrógeno con los óxidos no metálicos, cabe destacar especialmente su reacción con el monóxido de carbono CO. La mezcla de CO y H 2 incluso tiene su propio nombre: "gas de síntesis", ya que, según las condiciones, se pueden obtener productos industriales tan demandados como metanol, formaldehído e incluso hidrocarburos sintéticos: con ácidos¡El hidrógeno no reacciona con los ácidos inorgánicos! De los ácidos orgánicos, el hidrógeno reacciona únicamente con ácidos insaturados, así como con ácidos que contienen grupos funcionales que pueden ser reducidos por hidrógeno, en particular grupos aldehído, ceto o nitro. con salesEn el caso de soluciones acuosas de sales, no se produce su interacción con el hidrógeno. Sin embargo, cuando se hace pasar hidrógeno sobre sales sólidas de algunos metales de media y baja actividad, es posible su reducción parcial o total, por ejemplo: Propiedades químicas de los halógenos.Los halógenos son los elementos químicos del grupo VIIA (F, Cl, Br, I, At), así como las sustancias simples que forman. En lo sucesivo, salvo que se indique lo contrario, se entenderá por halógenos sustancias simples. Todos los halógenos tienen una estructura molecular, lo que conduce a puntos de fusión y ebullición bajos de estas sustancias. Las moléculas de halógeno son diatómicas, es decir, su fórmula se puede escribir en forma general como Hal 2 . Cabe señalar una propiedad física tan específica del yodo como su capacidad para sublimación o, en otras palabras, sublimación. sublimación, llaman al fenómeno en el que una sustancia en estado sólido no se derrite cuando se calienta, sino que, sin pasar por la fase líquida, pasa inmediatamente al estado gaseoso. La estructura electrónica del nivel de energía externa de un átomo de cualquier halógeno tiene la forma ns 2 np 5, donde n es el número del período de la tabla periódica en el que se encuentra el halógeno. Como puede ver, solo falta un electrón en la capa exterior de ocho electrones de los átomos de halógeno. De esto es lógico suponer las propiedades predominantemente oxidantes de los halógenos libres, lo que también se confirma en la práctica. Como saben, la electronegatividad de los no metales disminuye al descender en el subgrupo y, por lo tanto, la actividad de los halógenos disminuye en la serie: F 2 > Cl 2 > Br 2 > I 2 Interacción de halógenos con sustancias simples.Todos los halógenos son altamente reactivos y reaccionan con la mayoría de las sustancias simples. Sin embargo, cabe señalar que el flúor, debido a su altísima reactividad, puede reaccionar incluso con aquellas sustancias simples con las que otros halógenos no pueden reaccionar. Tales sustancias simples incluyen oxígeno, carbono (diamante), nitrógeno, platino, oro y algunos gases nobles (xenón y criptón). Aquellas. actualmente, el flúor no reacciona sólo con algunos gases nobles. Los halógenos restantes, es decir, el cloro, el bromo y el yodo también son sustancias activas, pero menos activas que el flúor. Reaccionan con casi todas las sustancias simples excepto con oxígeno, nitrógeno, carbono en forma de diamante, platino, oro y gases nobles. Interacción de halógenos con no metales.hidrógenoTodos los halógenos reaccionan con hidrógeno para formar haluros de hidrogeno con la fórmula general HHal. Al mismo tiempo, la reacción del flúor con el hidrógeno comienza espontáneamente incluso en la oscuridad y continúa con una explosión de acuerdo con la ecuación: La reacción del cloro con el hidrógeno puede iniciarse mediante intensa irradiación ultravioleta o calentamiento. También fugas con una explosión: El bromo y el yodo reaccionan con el hidrógeno solo cuando se calientan y, al mismo tiempo, la reacción con el yodo es reversible: fósforoLa interacción del flúor con el fósforo conduce a la oxidación del fósforo al estado de oxidación más alto (+5). En este caso, se produce la formación de pentafluoruro de fósforo: Cuando el cloro y el bromo interactúan con el fósforo, es posible obtener haluros de fósforo tanto en el estado de oxidación + 3 como en el estado de oxidación + 5, lo que depende de las proporciones de los reactivos: En el caso del fósforo blanco en atmósfera de flúor, cloro o bromo líquido, la reacción se inicia espontáneamente. La interacción del fósforo con el yodo puede conducir a la formación de solo triyoduro de fósforo debido a la capacidad oxidante significativamente menor que otros halógenos: grisEl flúor oxida el azufre al estado de oxidación más alto +6, formando hexafluoruro de azufre: El cloro y el bromo reaccionan con el azufre, formando compuestos que contienen azufre en estados de oxidación que son extremadamente inusuales para él +1 y +2. Estas interacciones son muy específicas, y para aprobar el examen de química, no es necesaria la capacidad de escribir las ecuaciones de estas interacciones. Por lo tanto, las siguientes tres ecuaciones se dan más bien como guía: Interacción de halógenos con metales.Como se mencionó anteriormente, el flúor puede reaccionar con todos los metales, incluso con los inactivos como el platino y el oro: Los halógenos restantes reaccionan con todos los metales excepto el platino y el oro: Reacciones de halógenos con sustancias complejas.Reacciones de sustitución con halógenosHalógenos más activos, es decir, cuyos elementos químicos se encuentran más arriba en la tabla periódica, pueden desplazar a los halógenos menos activos de los ácidos hidrohálicos y los haluros metálicos que forman: De manera similar, el bromo y el yodo desplazan el azufre de las soluciones de sulfuros o sulfuro de hidrógeno: El cloro es un agente oxidante más fuerte y oxida el sulfuro de hidrógeno en su solución acuosa no a azufre, sino a ácido sulfúrico: Interacción de los halógenos con el agua.El agua arde en flúor con una llama azul de acuerdo con la ecuación de reacción: El bromo y el cloro reaccionan de manera diferente con el agua que el flúor. Si el flúor actuaba como agente oxidante, entonces el cloro y el bromo se desproporcionaban en el agua, formando una mezcla de ácidos. En este caso, las reacciones son reversibles: La interacción del yodo con el agua ocurre en un grado tan insignificante que puede despreciarse y considerarse que la reacción no ocurre en absoluto. Interacción de halógenos con soluciones alcalinas.El flúor, al interactuar con una solución acuosa de álcali, nuevamente actúa como un agente oxidante: No se requiere la capacidad de escribir esta ecuación para aprobar el examen. Basta con conocer el hecho de la posibilidad de tal interacción y el papel oxidante del flúor en esta reacción. A diferencia del flúor, los halógenos restantes se desproporcionan en soluciones alcalinas, es decir, aumentan y disminuyen simultáneamente su estado de oxidación. Al mismo tiempo, en el caso del cloro y el bromo, dependiendo de la temperatura, es posible el flujo en dos direcciones diferentes. En particular, en frío, las reacciones se desarrollan de la siguiente manera: y cuando se calienta: El yodo reacciona con los álcalis exclusivamente según la segunda opción, es decir con la formación de yodato, porque el hipoyodito es inestable no solo cuando se calienta, sino también a temperaturas normales e incluso en frío. Química de los Elementos No metales del subgrupo VIIA Los elementos del subgrupo VIIA son no metales típicos con un alto electronegatividad, tienen un nombre de grupo: "halógenos". Cuestiones clave abordadas en la conferencia Características generales de los no metales del subgrupo VIIA. Estructura electrónica, las características más importantes de los átomos. lo mas caracteristico espuma de oxidación. Características de la química de los halógenos. sustancias simples. compuestos naturales Compuestos halógenos Ácidos hidrohalicos y sus sales. Sal y ácido fluorhídrico tragamonedas, recepción y aplicación. complejos de haluros. Compuestos binarios de oxígeno de halógenos. Inestabilidad ok- Las propiedades redox de sustancias simples y co- unidades Reacciones de desproporción. Diagramas de Latimer.
Química de elementos del subgrupo VIIA características generales
El grupo VIIA está formado por elementos p: flúor F, cloro Cl, bromo Br, yodo I y astato At. La fórmula general para los electrones de valencia es ns 2 np 5. Todos los elementos del grupo VIIA son no metales típicos.
para formar un ocho electrones estable lochki, por lo que tienen una fuerte tendencia hacia la adición de un electrón. Todos los elementos forman fácilmente simples cargados individualmente nye aniones à – . En forma de aniones simples, los elementos del grupo VIIA se encuentran en agua natural y en cristales de sales naturales, por ejemplo, halita NaCl, silvin KCl, fluorita CaF2. Nombre común del grupo de elementos VIIA- grupo "halógenos", es decir, "que dan a luz a las sales", debido al hecho de que la mayoría de sus compuestos con metales pre- es una sal típica (CaF2, NaCl, MgBr2, KI), que que se puede obtener por mutuo directo interacción de un metal con un halógeno. Los halógenos libres se obtienen a partir de sales naturales, por lo que el nombre "halógenos" también se traduce como "nacidos de sales".
El estado de oxidación mínimo (–1) es el más estable todos los halógenos. Algunas características de los átomos de los elementos del grupo VIIA se dan en Las características más importantes de los átomos de los elementos del grupo VIIA.
Los halógenos tienen una alta afinidad electrónica (máxima para Cl) y una energía de ionización muy alta (máxima para F) y máxima posible electronegatividad en cada uno de los periodos. El flúor es el más electronegativo de todos los elementos químicos. La presencia de un electrón desapareado en los átomos de halógeno provoca conduce a la unión de átomos en sustancias simples en moléculas diatómicas Г2. Para las sustancias halógenas simples, los agentes oxidantes son los más característicos. propiedades que son más fuertes para F2 y se debilitan al pasar a I2. Los halógenos se caracterizan por la mayor reactividad de todos los elementos no metálicos. El flúor, incluso entre los halógenos, se aísla es extremadamente activo. El elemento del segundo período, el flúor, es el que más difiere de los demás. algunos elementos del subgrupo. Este es un patrón general para todos los no metales.
El flúor, como elemento más electronegativo, no muestra el genero estados de oxidación vivos. En cualquier conexión, incluso con Ki- oxígeno, el flúor está en estado de oxidación (-1). Todos los demás halógenos exhiben estados de oxidación positivos. hasta un máximo de +7. Los estados de oxidación más característicos de los halógenos: F: -1, 0; Cl, Br, I: -1, 0, +1, +3, +5, +7. Los óxidos son conocidos por Cl, en el que se encuentra en los estados de oxidación: +4 y +6. Los compuestos halogenados más importantes, en positivo las espumas de oxidación son ácidos que contienen oxígeno y sus sales. Todos los compuestos halógenos en estados de oxidación positivos son son agentes oxidantes fuertes. terrible estado de oxidación. La desproporción es promovida por un ambiente alcalino. Aplicación práctica de sustancias simples y compuestos de oxígeno. halógenos se debe principalmente a su efecto oxidante. Las sustancias simples Cl2 encuentran la aplicación práctica más amplia. y F2. La mayor cantidad de cloro y flúor se consume en or- Síntesis orgánica: en la producción de plásticos, refrigerantes, disolventes, pesticidas, medicamentos. Una cantidad importante de cloro y yodo se utiliza para obtener metales y para su refinación. También se usa cloro. para el blanqueo de celulosa, para la desinfección de agua potable y en la producción de agua de lejía y ácido clorhídrico. Las sales de oxoácidos se utilizan en la fabricación de explosivos.
Los ácidos son ampliamente utilizados en la práctica - clorhídrico y de fusión El flúor y el cloro se encuentran entre los veinte elementos más comunes allí, mucho menos bromo y yodo en la naturaleza. Todos los halógenos se encuentran en la naturaleza en estado de oxidación.(-uno). Solo el yodo se encuentra en forma de sal KIO3, que, como impureza, se incluye en el salitre chileno (KNO3). El astato es un elemento radiactivo obtenido artificialmente (no existe en la naturaleza). La inestabilidad de At se refleja en el nombre, que proviene del griego. "astatos" - "inestable". Astatine es un emisor conveniente para la radioterapia de tumores cancerosos. sustancias simples Las sustancias simples de los halógenos están formadas por moléculas diatómicas G2. En sustancias simples, durante la transición de F2 a I2 con un aumento en el número de electrones. capas de electrones y un aumento en la polarizabilidad de los átomos, hay un aumento interacción intermolecular, lo que lleva a un cambio en el agregado de pie en condiciones estándar. El flúor (en condiciones normales) es un gas amarillo, a -181 °C se convierte en estado liquido. El cloro es un gas de color amarillo verdoso, se convierte en líquido a -34 °C. Con un color ha- se le asocia el nombre Cl, que proviene del griego "chloros" - "amarillo- verde". Un fuerte aumento en el punto de ebullición de Cl2 en comparación con F2, indica un aumento en la interacción intermolecular. El bromo es un líquido rojo oscuro, muy volátil, hierve a 58,8 °C. On- el título del elemento está asociado con un fuerte olor desagradable a gas y se forma a partir de "bromos" - "apestoso". Yodo - cristales de color púrpura oscuro, con un ligero brillo "metálico" skom, que al calentarse se sublima fácilmente formando vapores violetas;
el punto de ebullición del yodo es de 183o C. Su nombre proviene del color del vapor de yodo - "yodos" - "violeta". Todas las sustancias simples tienen un olor acre y son venenosas. La inhalación de sus vapores causa irritación de las membranas mucosas y los órganos respiratorios y, en altas concentraciones, asfixia. Durante la Primera Guerra Mundial, el cloro se usó como veneno. El flúor gaseoso y el bromo líquido provocan quemaduras en la piel. Trabajando con ha- logens, se deben tomar precauciones. Dado que las sustancias simples de los halógenos están formadas por moléculas no polares se enfría, se disuelven bien en disolventes orgánicos no polares: alcohol, benceno, tetracloruro de carbono, etc. En agua, el cloro, el bromo y el yodo son poco solubles, sus soluciones acuosas se denominan agua con cloro, bromo y yodo. Br2 se disuelve mejor que otros, la concentración de bromo en sat- solución de salmuera alcanza 0,2 mol/l, y cloro - 0,1 mol/l. El flúor descompone el agua: 2F2 + 2H2O = O2 + 4HF Los halógenos exhiben alta actividad oxidativa y transición dyat en aniones de haluro. Ã2 + 2e– 2Ö El flúor tiene una actividad oxidante particularmente alta. El flúor oxida los metales nobles (Au, Pt). Punto + 3F2 = PuntoF6 Incluso interactúa con algunos gases inertes (criptón, xenón y radón), por ejemplo, Xe + 2F2 = XeF4 Muchos compuestos muy estables se queman en una atmósfera F2, por ejemplo, agua, cuarzo (SiO2). SiO2 + 2F2 = SiF4 + O2
En reacciones con flúor, incluso agentes oxidantes tan fuertes como el nítrico y el azufre ácido, actúan como agentes reductores, mientras que el flúor oxida incluidos en su composición O(–2). 2HNO3 + 4F2 = 2NF3 + 2HF + 3O2 H2 SO4 + 4F2 = SF6 + 2HF + 2O2 La alta reactividad de F2 crea dificultades con la elección de con- materiales estructurales para trabajar con él. Por lo general, para estos fines, Contienen níquel y cobre que, cuando se oxidan, forman densas películas protectoras de fluoruros en su superficie. El nombre F está asociado a su acción agresiva. Quiero decir, viene del griego. "Ftoros" - "destruir". En la serie F2, Cl2, Br2, I2, la capacidad oxidante se debilita debido a un aumento en cambiar el tamaño de los átomos y reducir la electronegatividad. En soluciones acuosas, las propiedades oxidantes y reductoras de Las sustancias se suelen caracterizar utilizando potenciales de electrodo. La tabla muestra los potenciales de electrodo estándar (Eo, V) para las semirreacciones del formación de halógenos. A modo de comparación, el valor de Eo para ki- El oxígeno es el agente oxidante más común. Potenciales de electrodo estándar para sustancias simples halógenas
Disminución de la actividad oxidativa Como se puede ver en la tabla, F2 - el agente oxidante es mucho más fuerte, que O2, por lo tanto F2 no existe en soluciones acuosas , oxida el agua, recuperando a F–. A juzgar por el valor de Eo, la capacidad oxidante de Cl2
también superior a la del O2. De hecho, durante el almacenamiento a largo plazo de agua clorada, se descompone con la liberación de oxígeno y con la formación de HCl. Pero la reacción es lenta (la molécula de Cl2 es notablemente más fuerte que la molécula de F2 y energía de activación para reacciones con cloro es mayor), despro- porcionado: Cl2 + H2O HCl + HOCl En el agua no llega al final (K = 3.9.10–4), por lo que el Cl2 existe en soluciones acuosas. Br2 e I2 son aún más estables en agua. La desproporción es un oxidativo muy característico. reacción de reducción de halógenos. La desproporción de la vertido en un ambiente alcalino. La desproporción de Cl2 en álcali conduce a la formación de aniones. Cl– y ClO– . La constante de desproporción es 7,5. 1015 . Cl2 + 2NaOH = NaCl + NaClO + H2O Cuando el yodo está desproporcionado en álcali, se forman I– y IO3–. Ana- Br2 desproporciona yodo lógicamente. El cambio en el producto es desproporcionado La ionización se debe al hecho de que los aniones GO– y GO2– en Br e I son inestables. La reacción de desproporción del cloro se utiliza en la industria sti para obtener un agente oxidante de hipoclorito fuerte y de acción rápida, cal blanqueadora, sal de bartolita. 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Interacción de halógenos con metales. Los halógenos interactúan vigorosamente con muchos metales, por ejemplo: Mg + Cl2 = MgCl2 Ti + 2I2 TiI4 Haluros de Na +, en los que el metal tiene un estado de oxidación bajo (+1, +2), Son compuestos similares a sales con un enlace predominantemente iónico. Cómo- he aquí, los haluros iónicos son sólidos con un alto punto de fusión Haluros metálicos, en los que el metal tiene un alto estado de oxidación. niya, son compuestos con un enlace predominantemente covalente. Muchos de ellos en condiciones normales son gases, líquidos o sólidos fusibles. Por ejemplo, WF6 es un gas, MoF6 es un líquido, TiCl4 es un líquido. Interacción de halógenos con no metales. Los halógenos interactúan directamente con muchos no metales: hidrógeno, fósforo, azufre, etc. Por ejemplo: H2 + Cl2 = 2HCl 2P + 3Br2 = 2PBr3 S + 3F2 = SF6 El enlace en los haluros no metálicos es predominantemente covalente. Estos compuestos suelen tener puntos de fusión y ebullición bajos. En la transición de flúor a yodo, se potencia el carácter covalente de los haluros. Los haluros covalentes de los no metales típicos son compuestos ácidos; al interactuar con el agua, se hidrolizan para formar ácidos. Por ejemplo: PBr3 + 3H2O = 3HBr + H3PO3 PI3 + 3H2O = 3HI + H3PO3 PCl5 + 4H2O = 5HCl + H3PO4
Las dos primeras reacciones se utilizan para obtener bromo y yoduro de hidrógeno. ácido noico. interhaluros. Los halógenos, combinándose entre sí, forman un inter- Guías. En estos compuestos, el halógeno más ligero y electronegativo se encuentra en estado de oxidación (–1) y el más pesado en estado positivo. espuma de oxidación. Debido a la interacción directa de los halógenos cuando se calientan, se obtienen: ClF, BrF, BrCl, ICl. También hay interhaluros más complejos: ClF3, BrF3, BrF5, IF5, IF7, ICl3. Todos los interhaluros en condiciones normales son sustancias líquidas con puntos de ebullición bajos. Los interhaluros tienen un alto poder oxidante. actividad. Por ejemplo, sustancias químicamente estables como SiO2, Al2O3, MgO, etc. se queman en vapores de ClF3. 2Al2O3 + 4ClF3 = 4AlF3 + 3O2 + 2Cl2 El fluoruro ClF 3 es un reactivo de fluoración agresivo que actúa rápidamente patio F2. Se utiliza en síntesis orgánicas y para obtener películas protectoras en la superficie de los equipos de níquel para trabajar con flúor. En el agua, los interhaluros se hidrolizan para formar ácidos. Por ejemplo, ClF5 + 3H2O = HClO3 + 5HF Halógenos en la naturaleza. Obtención de sustancias simples En la industria, los halógenos se obtienen a partir de sus compuestos naturales. Todos Los procesos de obtención de halógenos libres se basan en la oxidación de halo- iones nidos. 2D – Ã2 + 2e– Una cantidad importante de halógenos se encuentra en las aguas naturales en forma de aniones: Cl–, F–, Br–, I–. El agua de mar puede contener hasta un 2,5% de NaCl. El bromo y el yodo se obtienen del agua de pozos petrolíferos y del agua de mar.
DEFINICIÓN halógenos- elementos del grupo VII A - flúor (F), cloro (Cl), bromo (Br) y yodo (I). Configuración electrónica del nivel de energía externa de los halógenos ns 2 np 5 . Dado que, antes de completar el nivel de energía, los halógenos carecen de un solo electrón, en OVR exhiben con mayor frecuencia las propiedades de los agentes oxidantes. Estados de oxidación de los halógenos: de "-1" a "+7". El único elemento del grupo de los halógenos, el flúor, presenta un solo estado de oxidación "-1" y es el elemento más electronegativo. Las moléculas de halógeno son diatómicas: F 2 , Cl 2 , Br 2 , I 2 . Propiedades químicas de los halógenos.Con un aumento en la carga del núcleo de un átomo de un elemento químico, es decir. al pasar del flúor al yodo, la capacidad oxidante de los halógenos disminuye, lo que se confirma por la capacidad de desplazar los halógenos inferiores por los superiores de los ácidos hidrohálicos y sus sales: Br2 + 2HI = I2 + 2HBr; Cl2 + 2KBr = Br2 + 2KCl. El flúor tiene la mayor actividad química. La mayoría de los elementos químicos, incluso a temperatura ambiente, interactúan con el flúor y liberan una gran cantidad de calor. Hasta el agua arde en flúor: 2H 2 O + 2F 2 \u003d 4HF + O 2. El cloro libre es menos reactivo que el flúor. No reacciona directamente con oxígeno, nitrógeno y gases nobles. Interactúa con todas las demás sustancias como el flúor: 2Fe + Cl2 = 2FeCl3; 2P + 5Cl2 = 2PCl5. Cuando el cloro interactúa con el agua en frío, se produce una reacción reversible: Cl2 + H2O↔HCl + HClO. La mezcla, que son los productos de reacción, se llama agua clorada. Cuando el cloro interactúa con los álcalis en frío, se forman mezclas de cloruros e hipocloritos: Cl 2 + Ca (OH) 2 \u003d Ca (Cl) OCl + H 2 O. Cuando el cloro se disuelve en una solución alcalina caliente, ocurre la siguiente reacción: 3Cl 2 + 6KOH \u003d 5KCl + KClO 3 + 3H 2 O. El bromo, como el cloro, se disuelve en agua y, reaccionando parcialmente con ella, forma la llamada "agua de bromo", mientras que el yodo es prácticamente insoluble en agua. El yodo difiere significativamente en la actividad química de otros halógenos. No reacciona con la mayoría de los no metales y reacciona lentamente con los metales solo cuando se calienta. La interacción del yodo con el hidrógeno ocurre solo con un fuerte calentamiento, la reacción es endotérmica y altamente reversible: H 2 + I 2 \u003d 2HI - 53 kJ. Propiedades físicas de los halógenos.en n.o. El flúor es un gas de color amarillo claro con un olor acre. Venenoso. El cloro es un gas de color verde claro, como el flúor, tiene un olor acre. Fuertemente venenoso. A presión elevada y temperatura ambiente, se convierte fácilmente en estado líquido. El bromo es un líquido pesado de color marrón rojizo con un olor acre desagradable característico. El bromo líquido, así como sus vapores, son altamente tóxicos. El bromo es poco soluble en agua y fácilmente soluble en solventes no polares. El yodo es un sólido gris oscuro con un brillo metálico. Los vapores de yodo son de color púrpura. El yodo se sublima fácilmente, es decir, transforma a un estado gaseoso de un sólido, sin pasar por el estado líquido. Obtención de halógenosLos halógenos se pueden obtener por electrólisis de soluciones o fundidos de haluros: MgCl 2 = Mg + Cl 2 (fundido). La mayoría de las veces, los halógenos se obtienen mediante la reacción de oxidación de los ácidos hidrohálicos: MnO 2 + 4HCl \u003d MnCl 2 + Cl 2 + 2H 2 O; K2Cr2O7 + 14HCl = 3Cl2 + 2KCl + 2CrCl3 + 7H2O; 2KMnO 4 + 16HCl \u003d 2MnCl 2 + 5Cl 2 + 8H 2 O + 2KCl. Aplicación de halógenosLos halógenos se utilizan como materia prima para varios productos. Así, el flúor y el cloro se utilizan para la síntesis de diversos materiales poliméricos, el cloro también es materia prima en la producción de ácido clorhídrico. El bromo y el yodo se usan ampliamente en medicina, el bromo también se usa en la industria de la pintura. Ejemplos de resolución de problemasEJEMPLO 1
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




