Ecocardiografía en el drenaje venoso pulmonar anómalo. Drenaje venoso pulmonar anómalo parcial Drenaje venoso pulmonar anormal Diagnóstico
Leer también
10 U d/m 2 inicialmente y > 7 U d/m 2 después del uso de vasodilatadores); - la presencia de contraindicaciones absolutas para la patología somática concomitante. Tácticas quirúrgicas En ausencia de síntomas, la corrección debe realizarse antes de los 3-4 años. La corrección oportuna ayuda a evitar complicaciones a largo plazo de PALV: hipertensión pulmonar e insuficiencia ventricular derecha, aleteo y fibrilación auricular. Los pacientes con síndrome de Scimitar desarrollan síntomas de insuficiencia cardíaca durante la infancia. El tratamiento quirúrgico se realiza por etapas; en primer lugar, se realiza un cateterismo cardíaco para detectar y embolizar colaterales aortopulmonares al pulmón derecho. Además, dependiendo de los síntomas de insuficiencia cardíaca, se realiza la corrección quirúrgica de PALV. Técnica quirúrgica Si la CIA es pequeña o está ausente, se expande o se le da forma. El desplazamiento de la boca PV hacia la cavidad RA se realiza mediante un parche, se cose para no estrechar la boca PV. En caso de estenosis de la vena cava, se realiza una plastia adicional de su boca con un parche autoxenopericárdico. Técnicas para corregir PALV: - aislamiento y trasplante de VP de flujo anormal en la aurícula izquierda o en VP de flujo normal; - división del tronco común de la vena cava superior o inferior en dos canales (colector de la vena pulmonar y colector de la vena cava) con la dirección posterior de sus flujos hacia las aurículas; - anastomosis del extremo distal de la SVC (PV se drena a través del segmento proximal de la SVC); - la conmutación intracardíaca a través de ASD de las corrientes venosas de los círculos grandes y pequeños de la circulación de la sangre; Como material para plásticos utilizo tautopericardio tratado con glutaraldehído, o xenopericardio. Complicaciones específicas del tratamiento quirúrgico: - shunt residual entre las aurículas; - estenosis de las bocas de las venas huecas o venas pulmonares; - síndrome de debilidad del nódulo sinusal en el plástico de la boca del VIV; NRS, taquiarritmias. Observación postoperatoria 1. La duración de la observación de pacientes con PADL corregido en ausencia de trastornos hemodinámicos no es más de 2 años. Antes de la cancelación del registro, se realizan un ECG y un examen de ultrasonido del corazón. 2. En caso de registro en el período postoperatorio de NRS (bradiarritmias, taquicardias auriculares), además del examen, se recomienda SMEKG cada 6 meses o más a menudo. Si está indicado, se realiza terapia antiarrítmica, RFA o implantación de marcapasos. 3. La prevención de la endocarditis bacteriana se realiza según indicaciones en los primeros 6 meses tras la corrección quirúrgica del defecto. 4. La admisibilidad de la educación física y los deportes después de la corrección del defecto (max-width: 448px) 100vw, 448px"> La PALV se caracteriza por el drenaje de una o más venas pulmonares, pero no todas, hacia la aurícula derecha y sus afluentes. Las venas pulmonares pueden drenar en la vena innominada, seno coronario, SVC (vena de la vena cava superior), PP (aurícula derecha), IVC (vena cava inferior), venas porta, venas hepáticas.
A diferencia de TADPV (drenaje venoso pulmonar anómalo total), este defecto puede ocurrir sin combinación con ASD (defecto del tabique interauricular) (5,7%).
Las variantes clínicamente más significativas de PALV son:
- las venas de los lóbulos superior y / o medio del pulmón derecho fluyen hacia la SVC debajo de la desembocadura de la vena braquiocefálico (combinado con ASD "sinus venosus");
- las venas del lóbulo inferior del pulmón derecho desembocan en la VCI por encima o por debajo del nivel del diafragma (forma parte del "síndrome de la cimitarra"
- riego sanguíneo arterial anormal e hipoplasia del lóbulo inferior del pulmón derecho, dextroposición del corazón);
- la confluencia de la VP izquierda (vena(s) pulmonar(es)) en la vena innominada a través de la vena vertical izquierda.
La hemodinámica de PALV es similar en muchos aspectos a ASD, con la única diferencia de que la hipervolemia de la ICC (circulación pulmonar) no está asociada con el cortocircuito izquierda-derecha, sino con su recirculación parcial a través de los pulmones. El volumen de recirculación depende del número de venas pulmonares de drenaje, la presencia de DMMP y la magnitud de la TRL (resistencia pulmonar total). La tasa de desarrollo de HP (hipertensión pulmonar) depende del volumen de sangre que recircula a través de los pulmones. La HP alcanza un grado significativo en la 3ª-4ª década de la vida.
CLÍNICA
una. Manifestaciones clínicas de la enfermedad:
- los niños con PADL suelen ser asintomáticos;
- en presencia de drenaje de la VP derecha en la VCI, los niños pueden tener frecuentes infecciones broncopulmonares.
b. Examen físico: desdoblamiento permanente del II tono en el II m.r. a la izquierda del esternón, independientemente de las fases de la respiración (con una combinación de CHADLV y ASD);
Soplo sistólico de intensidad débil o moderada (no más de 3/6) de estenosis relativa de la válvula AI en II m. a la izquierda del esternón;
Suave soplo mesodiastólico de estenosis relativa de la TC (válvula tricúspide);
A lo largo del borde izquierdo del esternón en el tercio inferior.
DIAGNÓSTICO
- Electrocardiografía
- hipertrofia del páncreas (ventrículo derecho);
- bloqueo completo o incompleto de la pierna derecha del haz de His;
- no se excluye la variante normal del ECG.
- ecocardiografía
El diagnóstico de PALV generalmente se logra detectando la ausencia de la confluencia típica de una o más venas pulmonares en la AI en ubicaciones típicas.
Los ASD altos del tipo "sinus venosus", por regla general, se combinan con PALV.
Criterios de diagnóstico:
- la dilatación de los departamentos derechos;
- expansión de la arteria pulmonar;
- disminución relativa de LA y LV;
- Vena cava superior dilatada.
TRATAMIENTO Y OBSERVACIÓN
- Observación y tratamiento de pacientes con PADL no corregido
una. No está indicada la prevención de la endocarditis bacteriana.
b. Corrección de los síntomas de insuficiencia cardíaca (en casos raros).
en. La admisibilidad de la educación física en el deporte antes de la corrección del defecto.
- Cirugía
Indicaciones de tratamiento quirúrgico
Un diagnóstico confirmado de PADLV es una indicación absoluta para el tratamiento quirúrgico.
Contraindicaciones para el tratamiento quirúrgico:
- hipertensión pulmonar alta (ARS > 10 U d/m 2 inicialmente y > 7 U d/m 2 después del uso de vasodilatadores);
- la presencia de contraindicaciones absolutas para la patología somática concomitante.
tácticas quirúrgicas
En ausencia de síntomas, la corrección debe realizarse antes de los 3-4 años. La corrección oportuna ayuda a evitar complicaciones a largo plazo de PALV: hipertensión pulmonar e insuficiencia ventricular derecha, aleteo y fibrilación auricular.
En pacientes con síndrome de la cimitarra Los síntomas de insuficiencia cardíaca se desarrollan en la infancia. El tratamiento quirúrgico se realiza por etapas; en primer lugar, se realiza un cateterismo cardíaco para detectar y embolizar colaterales aortopulmonares al pulmón derecho. Además, dependiendo de los síntomas de insuficiencia cardíaca, se realiza la corrección quirúrgica de PALV.
técnica quirúrgica
En el caso de un tamaño pequeño o ausencia de ASD, se expande o se forma. El desplazamiento de la boca PV hacia la cavidad RA se realiza mediante un parche, se cose para no estrechar la boca PV. En caso de estenosis de la vena cava, se realiza una plastia adicional de su boca con un parche autoxenopericárdico.
Técnicas para corregir PHADLV:
- aislamiento y trasplante de VP de flujo anormal en la aurícula izquierda o en VP de flujo normal;
- división del tronco común de la vena cava superior o inferior en dos canales (colector de la vena pulmonar y colector de la vena cava) con la dirección posterior de sus flujos hacia las aurículas;
- anastomosis del extremo distal de la SVC (PV se drena a través del segmento proximal de la SVC);
- la conmutación intracardíaca a través de ASD de las corrientes venosas de los círculos grandes y pequeños de la circulación de la sangre;
Como material para plásticos utilizo tautopericardio tratado con glutaraldehído, o xenopericardio.
Complicaciones específicas del tratamiento quirúrgico:
- derivación residual entre las aurículas;
- estenosis de las bocas de las venas huecas o venas pulmonares;
- síndrome de debilidad del nódulo sinusal con cirugía plástica del orificio del VIV; NRS, taquiarritmias.
Seguimiento postoperatorio
- La duración de la observación de pacientes con PADL corregido en ausencia de trastornos hemodinámicos no es más de 2 años. Antes de la cancelación del registro, se realiza un examen de ultrasonido del corazón.
- En caso de registro en el período postoperatorio de NRS (bradiarritmias, taquicardias auriculares), además del examen, se recomienda SMEKG cada 6 meses o más a menudo. Si está indicado, se realiza terapia antiarrítmica, RFA o implantación de marcapasos.
- La prevención de la endocarditis bacteriana se lleva a cabo según las indicaciones en los primeros 6 meses después de la corrección quirúrgica del defecto.
- La admisibilidad de la educación física y el deporte después de la corrección del defecto.
La vena pulmonar (foto de abajo) es un vaso que lleva sangre arterial, enriquecida con oxígeno en los pulmones, a la aurícula izquierda.
A partir de los capilares pulmonares, estos vasos se fusionan en venas más grandes, que van a los bronquios, luego a los segmentos, lóbulos y en las puertas del pulmón forman grandes troncos (dos de cada raíz), que en posición horizontal van a la parte superior. parte de la aurícula izquierda. En este caso, cada uno de los troncos penetra en un orificio separado: los izquierdos, desde el lado izquierdo de la aurícula izquierda, y los derechos desde el derecho. Las venas pulmonares derechas, siguiendo a la aurícula (izquierda), cruzan transversalmente la aurícula derecha (su pared posterior).
Vena pulmonar superior (derecha)
Está formado por venas segmentarias de segmentos de los lóbulos medio y superior del pulmón.

Vena pulmonar inferior (derecha)
Este vaso recibe sangre del lóbulo inferior (sus 5 segmentos) y tiene dos entradas principales: la vena común basal y la rama superior.
rama superior
Se encuentra entre los segmentos basal y superior. Se forma a partir de las venas accesoria y principal, sigue hacia adelante y hacia abajo, pasando por detrás del bronquio apical segmentario. Esta rama es la más alta de todas las que desembocan en la vena pulmonar inferior derecha.
En correspondencia con el bronquio, la vena principal contiene tres afluentes: lateral, superior, medial, ubicados en su mayoría de manera intersegmentaria, pero también pueden estar intrasegmentarios.

Gracias a la vena accesoria, la sangre se drena desde el segmento superior (su parte superior) hacia la región sublobar de la vena posterior segmentaria del lóbulo superior (su segmento posterior).
Vena común basal
Es un tronco venoso corto formado por la confluencia de las venas basales inferior y superior, cuyas ramas principales se encuentran mucho más profundas que la superficie lobular anterior.
Vena basosuperior. Se forma debido a la confluencia de la mayor de las venas segmentarias basales, así como las venas que transportan sangre de los segmentos medial, anterior y lateral.
Vena basal inferior. Adyacente a la vena común basal desde el lado de su superficie posterior. El principal afluente de este vaso es la rama posterior basal, que recoge sangre del segmento posterior basal. En algunos casos, la vena basal inferior puede acercarse a la vena basal superior.
ADLV
Es una patología congénita del corazón, en la que se detecta una entrada no anatómica de las venas pulmonares en la aurícula (derecha) o en las últimas venas huecas.

Esta patología se acompaña de neumonía frecuente, fatiga, dificultad para respirar, retraso en el desarrollo físico, dolor cardíaco. Como diagnóstico, utilizan: ECG, resonancia magnética, radiografía, ultrasonido, ventriculo y atriografía, angiopulmonografía.
El tratamiento quirúrgico del defecto depende de su tipo.
Información general
ADLV es un defecto congénito y representa alrededor del 1,5-3,0% de los defectos cardíacos. Se observa principalmente en pacientes masculinos.
Muy a menudo, este defecto se combina con una ventana ovalada (abierta) y defectos del tabique entre los ventrículos. Con un poco menos de frecuencia (20%): con un tronco arterial común, hipoplasia del lado izquierdo del corazón, VSD, dextrocardia, tétrada de Fallot y transposiciones de los vasos principales, un ventrículo común del corazón.
Además de los defectos anteriores, la ADLV suele acompañarse de patología extracardíaca: hernias umbilicales, malformaciones del sistema endocrino y óseo, divertículos intestinales, riñón en herradura, hidronefrosis y poliquistosis renal.
Clasificación del drenaje venoso pulmonar anómalo (APLV)
Si todas las venas fluyen hacia la circulación sistémica o hacia la aurícula derecha, este defecto se denomina drenaje anómalo completo, pero si una o más venas fluyen hacia las estructuras anteriores, dicho defecto se denomina parcial.
De acuerdo con el nivel de confluencia, se distinguen varias variantes del defecto:
- Opción uno: supracardial (supracardial). Las venas pulmonares (como un tronco común o por separado) desembocan en cualquiera de sus ramas.
- Opción dos: cardíaca (intracardíaca). Las venas pulmonares se drenan en la aurícula derecha.
- Opción tres: subcardíaca (infra o subcardiaca). Las venas pulmonares entran en la vena cava portal o inferior (con mucha menos frecuencia en el conducto linfático).
- Cuarta opción: mixta. Las venas pulmonares entran en varias estructuras y en diferentes niveles.
Características de la hemodinámica.
En el período intrauterino, este defecto, por regla general, no se manifiesta debido a las peculiaridades de la circulación sanguínea del feto. Después del nacimiento de un bebé, las manifestaciones de los trastornos hemodinámicos están determinadas por la variante del defecto y su combinación con otras anomalías congénitas.
En el caso de drenaje anómalo total, las alteraciones hemodinámicas se expresan por hipoxemia, sobrecarga hipercinética del corazón derecho e hipertensión pulmonar.
En el caso de drenaje parcial, la hemodinámica es similar a la de ASD. El papel principal en las violaciones pertenece a la descarga anormal de sangre venosa-arterial, lo que conduce a un aumento en el volumen de sangre en el círculo pequeño.
Síntomas de drenaje venoso pulmonar anormal
Los niños con este defecto a menudo sufren de SRAS de repetición y neumonía, tienen tos, poco aumento de peso, taquicardia, dificultad para respirar, dolor de corazón, cianosis leve y fatiga.

En el caso de hipertensión pulmonar evidente a una edad temprana, insuficiencia cardíaca, cianosis grave y
Diagnóstico
El cuadro de auscultación en ADLV es similar al ASD, es decir, se escucha un soplo áspero sistólico en el área de proyecciones de las arterias de las venas (venas pulmonares) y desdoblamiento del 2do tono.
- El ECG muestra signos de sobrecarga del corazón derecho, desviación del EOS a la derecha, bloqueo (incompleto) de la pierna derecha del haz de Hiss.
- La fonografía muestra signos de TEA.
- En la radiografía, el patrón de los pulmones se realza, la arteria pulmonar (su arco) sobresale, la expansión de los bordes cardíacos hacia la derecha, el síntoma del "sable turco".
- EcoCG.
- Sondaje de las cavidades cardíacas.
- Flebografía.
- Atriografía (derecha).
- Angiopulmonografía.
- ventriculografía.

El diagnóstico diferencial de este defecto debe realizarse con:
- Linfangiectasia.
- atresia
- Transposición vascular.
- Estenosis mitral.
- Estenosis de las venas pulmonares derecha/izquierda.
- Triple corazón.
- TEA aislado.
Tratamiento
Los tipos de tratamiento quirúrgico del drenaje parcial están determinados por la variante del defecto, el tamaño y la ubicación de la CIA.

La comunicación interauricular se elimina con ayuda de plásticos o sutura de la CIA. Los bebés de hasta tres meses de edad, que se encuentran en estado crítico, son sometidos a una operación paliativa (atrioseptotomía cerrada), cuyo objetivo es ampliar la comunicación interauricular.
La corrección radical general del defecto (forma total) incluye varias manipulaciones.
- Ligadura de la comunicación patológica de vasos con venas.
- Aislamiento de las venas pulmonares.
- Cierre de la DMP.
- Formación de una anastomosis entre la aurícula izquierda y las venas pulmonares.
La consecuencia de tales operaciones puede ser: un aumento de la hipertensión pulmonar y el síndrome de insuficiencia del nodo sinusal.
Pronósticos
El pronóstico para el curso natural de este defecto es desfavorable, ya que el 80% de los pacientes mueren durante el primer año de vida.
Los pacientes con drenaje parcial pueden vivir hasta los treinta años. La muerte de tales pacientes se asocia con mayor frecuencia a infecciones pulmonares o insuficiencia cardíaca grave.
Los resultados de las correcciones quirúrgicas del defecto suelen ser satisfactorios, pero entre los recién nacidos, la mortalidad durante o después de la cirugía sigue siendo alta.
Las venas pulmonares fluyen hacia la aurícula izquierda, y es a través de ellas que la sangre oxigenada ingresa al ventrículo izquierdo y luego a la aorta. Además, es transportado por las arterias a lo largo de la circulación sistémica.
Bajo la influencia de una serie de factores negativos externos en el período prenatal, se pueden crear condiciones para la formación de un defecto cardíaco congénito como el drenaje venoso pulmonar anormal (ADPV), en el que estos vasos no fluyen hacia la izquierda, sino hacia la aurícula derecha, vena cava o seno coronario. Tal localización anormal de los vasos puede ser parcial o total, es decir, parte de las venas pulmonares individuales o todas las bocas de estos vasos pueden comunicarse con la aurícula derecha. La condición del paciente depende en gran medida de estos factores.
Según las estadísticas, ADLV se detecta en 1.5-3% de los pacientes con. Más a menudo esta patología se encuentra entre los hombres.
A menudo, ADLV se combina con tales anomalías en el desarrollo del corazón como un defecto del tabique auricular. Y en el 20% de los pacientes se acompaña de otros defectos: tétrada de Fallot, comunicación interventricular, subdesarrollo de las cavidades izquierdas del corazón, etc. Además, en pacientes con este diagnóstico suelen detectarse anomalías del desarrollo no cardíacas: herradura riñón con forma de riñón, poliquistosis renal, hidronefrosis, hernia umbilical, divertículos intestinales y malformaciones del sistema musculoesquelético o del sistema endocrino.
En este artículo, le presentaremos las posibles causas, tipos, manifestaciones, métodos para detectar y tratar el drenaje venoso pulmonar anormal. La información obtenida le ayudará a comprender la esencia de esta cardiopatía congénita, y podrá plantear a su médico las cuestiones que le interesen.
Esta rara malformación congénita fue descrita por primera vez por Wilson en 1798, pero sus variantes se consideraron con más detalle solo después de la acumulación de suficiente experiencia quirúrgica cardíaca en los años cincuenta y sesenta. La primera operación exitosa para corregir esta patología fue realizada por Miller en 1951. Posteriormente se mejoraron las técnicas quirúrgicas cardiacas y en 1956 se realizó una corrección radical de la ADLV mediante hipotermia superficial. En el mismo año se realizó una intervención similar mediante circulación extracorpórea.
En el territorio de la URSS, por primera vez, Nikolai Mikhailovich Amosov realizó una operación exitosa para eliminar dicho defecto cardíaco en 1978, y uno de los principales cirujanos cardíacos rusos, Georgy Eduardovich Falkovsky, informó sobre una serie de correcciones exitosas. en niños pequeños en 1984.
Las razones
Probablemente, la herencia juega un cierto papel en el desarrollo de ADLV.Las causas probables del desarrollo de ADLV pueden ser los mismos factores externos que provocan otras anomalías congénitas en la estructura del corazón y los vasos sanguíneos:
- herencia (mutaciones de cromosomas);
- tomar ciertos medicamentos teratogénicos;
- exposición a sustancias tóxicas en el cuerpo durante el embarazo;
- malos hábitos de la futura madre;
- enfermedades infecciosas transferidas a una mujer embarazada;
- desordenes endocrinos;
- toxicosis;
- entorno desfavorable.
La disociación de las venas pulmonares con la aurícula izquierda puede ser causada por los siguientes factores:
- la ausencia de su conexión con la aurícula izquierda - se forma debido al hecho de que, bajo la influencia de las causas externas descritas anteriormente, el crecimiento de la aurícula izquierda no puede contactar con los plexos venosos del futuro pulmón;
- atresia temprana de la vena pulmonar: ocurre con la conexión inicial del lecho vascular pulmonar y la vena pulmonar común, cuya luz se oblitera posteriormente y la sangre de los pulmones comienza a fluir a través de otras vías colaterales.
Variedades
ADLV es de dos tipos:
- Total (o completo). Con tal defecto, la circulación sanguínea entre los círculos grandes y pequeños se detiene por completo, ya que no hay comunicación entre las venas pulmonares y la aurícula izquierda. Esta forma de defecto es incompatible con la vida, sin embargo, el niño puede tener tales anomalías concomitantes en el desarrollo del corazón como defectos en el tabique interauricular o interventricular, compensando ligeramente una violación hemodinámica tan significativa. En tales casos, el bebé puede vivir por algún tiempo. Sin embargo, en la mayoría de los casos, sin la corrección quirúrgica cardíaca oportuna de la ADLV total, los niños mueren antes del primer año de vida.
- Parcial. Con tal anomalía, una de las ramas de las venas pulmonares se comunica con la aurícula izquierda, y el estado hemodinámico del paciente depende del volumen de descarga de sangre.
Según el nivel de entrada de las venas pulmonares en la aurícula izquierda, se distinguen cuatro variantes anatómicas de ADLV:
- supracardial (o supracardial): se observa en casi el 55% de los recién nacidos y se acompaña del flujo de las venas pulmonares hacia el sistema de la vena cava superior;
- cardíaco (o intracardíaco): se detecta en el 30% de los pacientes y se acompaña del flujo de las venas pulmonares hacia la aurícula derecha o el seno coronario;
- subcardíaco (o subcardial, infracardial): se observa en el 12% de los niños y se acompaña del flujo de las venas pulmonares hacia la vena cava inferior o la vena porta (a veces hacia el conducto linfático);
- mixto: detectado en el 3% de los recién nacidos y puede ir acompañado de diversas variaciones de la confluencia de las venas pulmonares descritas anteriormente.
¿Cómo se altera la hemodinámica?
Durante el desarrollo intrauterino, esta cardiopatía no se manifiesta de ninguna manera, ya que la circulación intracardíaca en el feto se acompaña de la comunicación de las aurículas izquierda y derecha a través de la ventana oval abierta. ADLV comienza a hacerse sentir después del nacimiento de un niño, y la gravedad de los trastornos hemodinámicos estará determinada por el tipo y la variante de esta anomalía. Además, la presencia de defectos concomitantes en el desarrollo del corazón y los vasos sanguíneos puede afectar la gravedad de los síntomas del defecto.
Con ADLV total, la sangre enriquecida con oxígeno que ingresa a la aurícula derecha se mezcla con la sangre venosa. Además, una parte ingresa al ventrículo derecho y la otra ingresa a la aurícula izquierda a través de un defecto del tabique auricular existente o un foramen oval abierto. En tales casos, la ADLV total es compatible con la vida, ya que no se pierde la comunicación entre la circulación sistémica y la pulmonar. Dichos trastornos hemodinámicos conducen a una sobrecarga de las cavidades derechas del corazón, un aumento de la presión en los vasos pulmonares y una disminución del contenido de oxígeno en la sangre, lo que conduce a la falta de oxígeno en los órganos y tejidos.
Con ADLV parcial, las alteraciones hemodinámicas ocurren de la misma manera que con los defectos interauriculares. La gravedad de la condición del paciente con este tipo de anomalía está determinada por la cantidad de descarga arteriovenosa patológica.
Síntomas
Los signos de ADLV se hacen sentir inmediatamente después del nacimiento de un niño. Con un defecto total, que no se acompaña de la presencia de defectos en las comunicaciones interauriculares, la circulación sanguínea entre el círculo pequeño y grande se vuelve completamente imposible y el recién nacido muere rápidamente. En tales casos, la vida del niño solo puede salvarse mediante una cirugía cardíaca de emergencia utilizando el método de Rashkind como una septostomía auricular endovascular con balón.
En otros casos, la gravedad de las manifestaciones clínicas de la ADLV está determinada por su variante anatómica, el tamaño de las comunicaciones interauriculares y la naturaleza de los trastornos hemodinámicos. Por lo general, los padres de niños con un defecto congénito de este tipo notan las siguientes manifestaciones de esta patología:
- rápida fatigabilidad;
- la aparición de dificultad para respirar después de la actividad física (alimentación, llanto, etc.);
- dolor en la región del corazón (el niño no duerme bien, está inquieto, llora fuerte y estira las piernas);
- piel pálida;
- luz ;
- tos;
- náuseas y vómitos;
- aumento de peso lento
- SARS frecuente y neumonía.
Al sondear el pulso, el médico puede detectar su rapidez y arritmia. En el examen, se determina la deformidad del tórax y el aumento de los latidos del corazón.
La cianosis leve que ocurre en las primeras semanas de vida puede desaparecer o volverse menos pronunciada con el tiempo. Como regla general, la cianosis es más pronunciada durante el esfuerzo físico.
Al escuchar los sonidos del corazón, no se detectan signos específicos de este defecto. Puede ser escuchado:
- fuerte tono sobre el corazón;
- división del tono II con un aumento en el componente pulmonar;
- tono III auscultado sobre el vértice del corazón (en muchos pacientes);
- soplo sistólico suave sobre la arteria pulmonar con duración e intensidad variables.
En el ECG, se determina una sobrecarga del corazón derecho: un alto voltaje de la onda P en las derivaciones derechas y desviaciones del eje eléctrico hacia la derecha en las derivaciones estándar. Una sobrecarga de la aurícula derecha se indica por una onda P alta en el tórax derecho y derivaciones estándar. A menudo hay signos de incompleto.
Si hay un gran defecto en el tabique interauricular, el niño puede desarrollarse normalmente y luego, a una edad mayor, hay quejas de una disminución significativa en la tolerancia al ejercicio, dificultad para respirar, palidez y mala salud general. Posteriormente, estos niños desarrollan síntomas.
Diagnóstico
 Uno de los métodos para ayudar a detectar y verificar ADLV es la ecografía cardíaca.
Uno de los métodos para ayudar a detectar y verificar ADLV es la ecografía cardíaca. Por primera vez, se puede detectar ADLV en el feto durante un examen de ultrasonido en el tercer trimestre del embarazo.
Para aclarar todos los datos sobre dicha cardiopatía congénita, se prescriben los siguientes métodos de investigación instrumental:
- radiografía;
- (se prescriben adultos y niños mayores);
- sondeo de las cámaras del corazón y.
Tratamiento
La única forma de eliminar la ADLV es su corrección cardioquirúrgica. Antes de la cirugía, se recomienda que el niño limite la actividad física y se prescriben medicamentos para prevenir la insuficiencia cardíaca aguda (,). Los padres de un niño deben ser conscientes de que incluso el llanto o la incomodidad de la temperatura pueden empeorar significativamente el bienestar con una enfermedad cardíaca de este tipo. Si el niño ya es un adulto, debe controlar constantemente su tiempo libre: no debe correr, levantar pesas ni trabajar demasiado.
Métodos de corrección quirúrgica.
El método para realizar la corrección quirúrgica cardíaca en ADLV está determinado por el tipo y la variante del defecto.
Con el drenaje total, un niño críticamente enfermo menor de 3 meses puede ser sometido a una operación paliativa, que consiste en aumentar la comunicación interauricular mediante la realización de una atrioseptomía con balón según el método de Rashkind. Tal corrección contribuye al flujo de sangre hacia la aurícula izquierda y al restablecimiento de la circulación sanguínea en el círculo grande.
Para la eliminación radical de la ADLV se realizan intervenciones encaminadas a crear una anastomosis amplia entre la aurícula izquierda y las venas pulmonares, detener el drenaje patológico de las venas pulmonares con otros vasos venosos y eliminar la comunicación interauricular. Tales intervenciones se realizan preferentemente a una edad temprana. El método de corrección radical se selecciona según la variante anatómica de ADLV.
Las intervenciones correctivas son bastante efectivas, sin embargo, a pesar del desarrollo de la cirugía cardíaca moderna, el porcentaje de muertes que ocurren durante la cirugía o en el postoperatorio sigue siendo alto. El resultado de la corrección radical depende en gran medida de la habilidad del cirujano cardíaco, el equipo técnico, el tipo y la variante del defecto. Además, el mayor riesgo de muerte se presenta entre los recién nacidos y los niños pequeños que padecen hipertensión pulmonar grave. Muy a menudo, tal manifestación del defecto se observa entre pacientes con una variante subcardial de la anomalía.
Los resultados a largo plazo entre los niños que sobrevivieron a la corrección radical de la ADLV son bastante satisfactorios. Solo algunos pacientes pueden desarrollar debilidad del nódulo sinusal e hipertensión pulmonar, que son difíciles de responder a la terapia con medicamentos.
Pronóstico
La corrección cardioquirúrgica radical de ADLV realizada con éxito mejora significativamente el pronóstico del resultado de esta enfermedad cardíaca. Sin embargo, el riesgo de muerte durante o después de la cirugía sigue siendo alto.
Con una forma total de ADLV y la ausencia de corrección quirúrgica cardíaca de emergencia, alrededor del 80% de los niños mueren antes de cumplir un año. Si el drenaje venoso pulmonar anormal es parcial, los pacientes pueden vivir hasta 20-30 años. En ausencia de tratamiento quirúrgico, estos pacientes mueren por insuficiencia cardíaca o infecciones pulmonares.
El drenaje venoso pulmonar anómalo es una cardiopatía congénita rara y siempre requiere cirugía cardiaca. En algunos casos, la condición de un recién nacido se vuelve crítica debido a trastornos hemodinámicos significativos, y tales operaciones se realizan con carácter de emergencia. Después de una corrección cardioquirúrgica radical exitosa, la condición del paciente mejora significativamente y el pronóstico del resultado de la enfermedad se vuelve favorable.
El drenaje venoso pulmonar anómalo (ADPV) es un defecto en el que todas las venas pulmonares (totales) o individuales (parciales) fluyen hacia la aurícula derecha o la vena cava que conduce a ella. La primera descripción del vicio es de J. B. Winslow (1739) y J. G. Wilson (1798). La frecuencia de ADLV es 0.5-2% de todos los CHD en combinación con ASD en 10-15%. Es probable que un número significativo de casos de ADLV parcial permanezcan sin diagnosticar debido a la ausencia de manifestaciones clínicas.
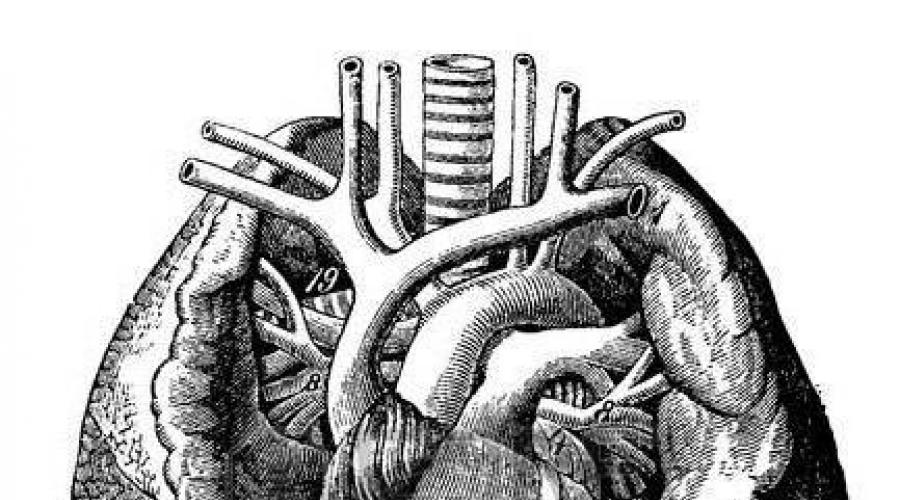
Anatomía, clasificación. El drenaje anormal de las venas del pulmón derecho es más común. Se pueden distinguir las siguientes variantes de ADLV (Fig. 12): 1) nivel supracardíaco - pulmonar
a - nivel supracardíaco: drenaje anómalo de JIB en la VCS; b - nivel cardíaco: drenaje anormal de la VP en la AD; c - nivel infracárdico: drenaje anormal del VI en la VCI; 1 - comunicación interauricular.
las venas nye desembocan en la vena cava superior innominada izquierda o en una de sus ramas; 2) nivel cardíaco: drenaje de todas o parte de las venas pulmonares en la cavidad de la aurícula derecha o seno coronario; 3) infracardial: parte de las venas pulmonares desemboca en un vaso venoso ubicado debajo del corazón; 4) mixto.
La mayoría de los pacientes tienen una CIA secundaria concomitante (a menudo un defecto en el seno venoso), un foramen oval abierto. La autopsia muestra cavidades agrandadas de la aurícula y el ventrículo derechos, arterias pulmonares dilatadas y vena cava; las cavidades izquierdas del corazón y la aorta no se modifican. Por lo general, en la confluencia hay varias bocas de las venas pulmonares, a veces se juntan en un tronco y se abren con una boca común. En el 20% de los casos, ocurren otras CC (CIV, transposición de la aorta y la arteria pulmonar, tetralogía de Fallot, ventrículo único, estenosis pulmonar, dextrocardia).
Hemodinámica. Con ADLV parcial, las alteraciones hemodinámicas son similares a las de ASD y están determinadas por la cantidad de venas con drenaje anormal, el tamaño de la derivación izquierda-derecha y el tamaño de ASD asociado con CHD. Si una vena pulmonar drena y no hay ASD, el defecto permanece asintomático. La presión en la arteria pulmonar con ADLV parcial se mantiene normal durante mucho tiempo, ya que la sangre se desvía a nivel de las aurículas y no hay un factor de "presión de transferencia" (del ventrículo izquierdo y la aorta al ventrículo derecho y la arteria pulmonar, como en VSD y PDA).
Clínica, diagnóstico. Con ADLV parcial, las manifestaciones clínicas pueden estar ausentes durante mucho tiempo o parecerse a las del TEA secundario. Los principales síntomas del defecto no son
Síntomas: son posibles la fatiga, el dolor en el corazón, la dificultad para respirar durante el ejercicio, la neumonía repetida, el retraso en el desarrollo físico. Con la edad, aparece una joroba cardíaca, los límites del embotamiento cardíaco se expanden más hacia la derecha. El cuadro auscultatorio es similar al de la CIA secundaria: un soplo sistólico no áspero en el sitio de la proyección de la arteria pulmonar, que se divide
- tonos La insuficiencia cardíaca en los niños rara vez se desarrolla, generalmente en los casos en que más del 50% de las venas pulmonares están drenadas de manera anormal; en adultos, el deterioro del estado general aparece antes que en los casos de TEA aislado.
En el examen de rayos X de los órganos del tórax, el estado del patrón pulmonar está determinado por el valor de la descarga arteriovenosa. Con ADLV parcial, aumenta más a lo largo del lecho arterial si la descarga es más del 50% del volumen minuto de la circulación pulmonar. En los mismos casos, es posible que se abulte el tronco de la arteria pulmonar y aumente la pulsación de las raíces de los pulmones. La sombra del corazón se agranda debido a las secciones correctas; la aurícula derecha está más dilatada que en la CIA aislada. Con ADLV, su expansión es visible en la vena cava superior. Una sombra ovalada desde las venas pulmonares derechas que se extiende hasta la vena cava inferior a lo largo del borde derecho del corazón (patrón de "sable turco" o "síndrome de sable") es un signo confiable de malformación en casos de confluencia anormal de las venas pulmonares derechas en la vena cava inferior.
Hasta la fecha, no existen criterios ecocardiográficos convincentes para diagnosticar el drenaje venoso pulmonar anómalo parcial. Las manifestaciones indirectas (hemodinámicas) de la misma son: dilatación del ventrículo derecho, movimiento paradójico del tabique interventricular, tamaño pequeño de la aurícula y el ventrículo izquierdos, aumento de la excursión de la válvula tricúspide. En la ecocardiografía 2D, debe sospecharse una ADLV parcial cuando un defecto septal anatómico es inconsistente con una manifestación hemodinámica de derivación arteriovenosa.
Durante el cateterismo de las cavidades del corazón, la sonda de la aurícula derecha ingresa a una de las venas cavas y desde allí al campo pulmonar libre. Es necesario realizar un estudio escalonado de la vena cava y la aurícula derecha, que permita establecer el nivel de confluencia de las venas pulmonares y su número. Cuando la sonda de la aurícula derecha ingresa al tronco de la vena pulmonar, tiene un recorrido suave en el intervalo entre los orificios de la vena cava y las venas pulmonares, desviándose hacia la derecha desde la línea media, o no pasa
mediocre en el borde de la sombra de la aurícula derecha. En algunos casos, la sonda puede pasar al tronco de la vena pulmonar a través de la CIA y la cavidad auricular izquierda. La conexión de las venas pulmonares con la vena cava se evidencia por un aumento de la saturación de oxígeno en sangre a los niveles de la vena innominada izquierda, cava superior o inferior.
Con drenaje anormal hacia la aurícula derecha, se observa arterialización de sangre en esta cavidad, que también es característica de un ASD aislado. La presión en las cavidades del corazón puede ser normal.
La técnica diagnóstica más valiosa debe considerarse la angiocardiografía selectiva con la introducción de un medio de contraste en el tronco de la arteria pulmonar o de forma selectiva en sus ramas derecha o izquierda. Después de un llenado apretado y rápido de la arteria pulmonar con un agente de contraste, la fase capilar es visible, luego se revela el curso y el lugar de confluencia de todas las venas pulmonares, las venas completas, la aurícula y el ventrículo derechos y las partes izquierdas del corazón. .
Tratamiento. Al corregir la ADLV parcial, se utilizan una variedad de operaciones según el tipo de defecto (nivel de drenaje, tamaño y ubicación de ASD). En caso de drenaje anormal de una parte de las venas pulmonares hacia la vena cava superior o su boca, se utilizan las siguientes tácticas: a) crear un túnel con un parche que conecte las bocas de las venas pulmonares con drenaje anormal con la aurícula izquierda a través de un tabique defecto; b) la creación de dos túneles desde el tronco de la vena cava superior para la formación de flujos sanguíneos separados, sistémicos y pulmonares, y la extracción de sangre de las venas pulmonares. directamente a la aurícula izquierda a través de un ASD; c) suturar el borde inferior del defecto a la pared posterior de la vena cava por encima de los orificios de las venas pulmonares con drenaje anormal. Con drenaje anormal de las venas pulmonares en la cavidad de la aurícula derecha, la cirugía se realiza con un parche. Con una CIA pequeña, se expande para crear un túnel adecuado que no interfiera con el flujo de sangre desde las venas pulmonares hacia la aurícula izquierda. En caso de drenaje anómalo aislado de las venas pulmonares hacia la vena cava superior o la aurícula derecha, se recomienda crear una comunicación interauricular artificial con la subsiguiente corrección del defecto. En caso de drenaje anormal de las venas pulmonares hacia la vena cava inferior, se utiliza uno de los métodos anteriores, o se corta el colector de la vena pulmonar y se implanta en la aurícula izquierda. En caso de drenaje anormal de las venas pulmonares izquierdas hacia la vena vertical izquierda, se liga esta vena, se cortan las venas pulmonares izquierdas y se implantan en el apéndice auricular izquierdo.
Los resultados de la operación son buenos. La mortalidad quirúrgica no supera el 2-3%. De las complicaciones, son posibles un estrechamiento parcial de la vena cava superior, drenaje deficiente de las venas pulmonares, daño al seno o nódulos auriculoventriculares.
La vida del paciente es posible solo en presencia de TEA concomitante. Si no hay CIA, sino sólo un conducto arterioso abierto, los pacientes mueren a edad temprana, ya que las partes izquierdas del corazón no participan en la circulación sanguínea; la muerte también ocurre en casos de cierre prematuro (antes o poco después del nacimiento) del foramen oval. Existen muchas variedades de esta CC compleja, por lo que se han propuesto varias clasificaciones. La clasificación más sencilla es la de R. Darling et al. (1957), distinguen cuatro tipos de defecto: tipo I - supracardial - la confluencia de todas las venas pulmonares por un tronco común (colector) a través de la vena anómala hacia la vena cava superior, a través de la vena vertical - hacia el innominado izquierdo, a través de la vena anómala - en impar (47 %); Tipo II - cardíaco - la confluencia de todas las venas pulmonares en la aurícula derecha o el seno coronario (30%);
- tipo - infracárdico - la confluencia de todas las venas pulmonares en el portal o vena cava inferior (18%); Tipo IV - mixto'- varias combinaciones de estos tres tipos (5%) (Fig. 13). Antes de fluir hacia el corazón o el vaso que va hacia él, las venas pulmonares se reúnen en una sola cámara: un colector, que luego se conecta a la circulación sistémica en diferentes niveles. Con este tipo de ADLV, hay dilataciones de las cavidades derechas, el tronco de la arteria pulmonar, mientras que el corazón izquierdo suele ser normal.
Con la ADLV total, puede haber causas anatómicas de obstrucción en el drenaje venoso pulmonar: más a menudo esto se debe al estrechamiento de los orificios de las venas pulmonares que drenan anormalmente o la apertura del colector, con menos frecuencia hay presión externa sobre la vena anormal (en el punto de paso a través del diafragma, entre la arteria pulmonar izquierda y el bronquio principal izquierdo). En el 80% de los casos, la obstrucción de las venas pulmonares acompaña a la variante infradiafragmática de ADLV.
Las CC concomitantes más comunes en la ADLV total son la aurícula común, el ventrículo único, la hipoplasia de las secciones izquierdas, la transposición de los grandes vasos (esta combinación crea una corrección funcional del defecto). En el 25-30% de los casos, hay malformaciones extracardiacas del tracto gastrointestinal (malrotación del intestino, divertículos, hernia umbilical), bazo (agenesia, múltiples bazos adicionales), urogenital
1-nivel supracardiaco; 2-nivel cardíaco (confluencia de todas las venas pulmonares en el seno coronario); 3 - nivel infracardiaco.
(quistes renales congénitos, hidronefrosis) y sistemas musculoesqueléticos.
Hemodinámica. Con ADLV total, la sangre de ambos círculos de circulación sanguínea ingresa a la aurícula derecha, la magnitud y la dirección de la descarga están determinadas por la relación de las resistencias de los círculos grandes y pequeños de circulación sanguínea y la relajación diastólica de los ventrículos. Una gran cantidad de sangre arterial ingresa a la aurícula derecha desde el colector, hacia el cual fluyen las venas pulmonares. En la aurícula, la sangre arterial se mezcla con la sangre venosa, de aquí, a través de la CIA, parte de la sangre (más pequeña) ingresa a la aurícula izquierda y luego a la circulación sistémica; se envía más sangre al círculo pequeño, lo que contribuye a una disminución del corazón izquierdo y al desarrollo de hipertensión pulmonar. Si una CIA alcanza un tamaño significativo y la descarga de sangre a la circulación sistémica es suficiente, entonces el ventrículo izquierdo no es hipoplásico, la hipertensión pulmonar no supera la etapa I-II. y los pacientes pueden vivir hasta la edad adulta. En casos de obstrucción de las venas pulmonares, se desarrolla hipertensión pulmonar venosa; en ausencia de involución fisiológica en la estructura de los vasos pulmonares, también es posible la hipertensión pulmonar congénita. Así, la ADLV total se caracteriza por una circulación sanguínea mixta con una ligera disminución del contenido de oxígeno en la circulación sistémica, sobrecarga del corazón derecho, hipertensión pulmonar (arterial, venosa, congénita).
Clínica, diagnóstico. El curso clínico de la ADLV total está determinado por las características anatómicas y hemodinámicas del defecto, en particular, el nivel de resistencia pulmonar general, el grado de obstrucción venosa pulmonar, el tamaño de la comunicación interauricular y el estado del miocardio del ventrículo derecho. . Los primeros signos de este tipo de defecto suelen aparecer desde los primeros días y meses de vida, hay manifestaciones de corazón
insuficiencia, neumonía repetida e infecciones virales respiratorias agudas, tos, retraso en el desarrollo físico. La cianosis puede aparecer a cualquier edad, a menudo al final del primer año de vida. Como regla general, es insignificante y se nota solo cuando grita; La cianosis pronunciada desde los primeros días de vida es característica de la obstrucción venosa pulmonar. La joroba cardíaca (principalmente del lado derecho) aparece antes que con DMG1G1 aislado. El temblor sistólico suele estar ausente. Durante la auscultación, el tono I en el área de la válvula tricúspide aumenta (un signo de aumento del flujo sanguíneo a través de ella). El tono II sobre la arteria pulmonar se acentúa, se divide, a menudo hay un tono III; en el segundo espacio intercostal a la izquierda, se escucha un soplo sistólico de intensidad media (como en ASD), en el borde inferior del esternón a la izquierda, es posible un soplo mesodiastólico. Si el colector desemboca en la vena cava superior y hay obstrucción venosa pulmonar, se puede escuchar un soplo sistólico prolongado por encima de la clavícula a la derecha o a la izquierda.
En pacientes adultos con ADLV total e hipertensión pulmonar, se escucha un tono de eyección sistólico en el segundo espacio intercostal de la izquierda (ver Capítulo 2). La insuficiencia ventricular derecha en combinación con síntomas clínicos de CIA y cianosis moderada ayuda a sospechar ADLV total en niños. En pacientes adultos con este defecto, el cuadro clínico es indistinguible del TEA.
En el ECG (Fig. 14), una desviación significativa del eje eléctrico del corazón hacia la derecha (Z.aAQRS de +90 a +210 °), un aumento en la aurícula derecha (punta alta Pn.v), ventrículo derecho (en V4R y V| forma qR ', rR', rSR', las ondas R son bajas en las derivaciones torácicas izquierdas, las ondas S son profundas; estos signos son especialmente pronunciados en la hipertensión pulmonar alta para
ma R a Vi). Se puede observar el síndrome de WPW tipo B. Con un aumento de la carga en el ventrículo derecho, aparece un cambio en el intervalo ST debajo de la isolínea con ondas T negativas profundas en las derivaciones II, III, aVF, Vt-Ve.
La fonocardiografía confirma los datos de la auscultación y tiene todos los signos de un TEA.
En la radiografía con ADLV total, el patrón pulmonar está significativamente realzado tanto en los canales arteriales como venosos, hay cardiomegalia moderada o significativa causada por un aumento de las cámaras derechas, las secciones izquierdas son de tamaño normal, a veces una sombra agrandada de la Se ve la vena cava superior. Para la forma supracardiaca del defecto, es típica una sombra cardíaca típica en forma de ocho o muñeco de nieve, donde la parte inferior es el corazón mismo, y la formación adicional en la parte superior derecha es un colector que recolecta sangre de todos los pulmones. venas y se abre en la vena cava izquierda o derecha o en las venas innominadas (Fig. 15). Estos últimos están dilatados, ya que contienen un gran volumen de flujo sanguíneo pulmonar. A veces, la forma del corazón imita una glándula timo agrandada. Cuando las venas pulmonares desembocan en el seno coronario o en la vena cava inferior, no hay manifestaciones radiológicas características del defecto.
La ecocardiografía no revela un defecto; los signos indirectos son el tamaño relativamente pequeño de la aurícula izquierda y el ventrículo izquierdo, la dilatación de la aurícula y el ventrículo derechos, el movimiento paradójico del tabique interventricular. Cuando las venas pulmonares desembocan en el seno coronario, la ecocardiografía bidimensional permite determinar el espacio formado por el colector venoso detrás de la sombra del corazón, lo que se confirma mediante la administración intravenosa de contraste ecográfico.
El sondaje de las cavidades del corazón con ADLV total revela una alta saturación de oxígeno en la sangre en todas las partes del corazón (90-96%); en la arteria pulmonar, la saturación es a veces la misma que en la aorta. La mayor saturación se observa en la aurícula derecha o en la vena donde drena el colector venoso pulmonar. La presión en la arteria pulmonar puede aumentar debido a cambios (fetales, escleróticos) en las arteriolas pulmonares, aumento del flujo sanguíneo pulmonar, obstrucción de las venas pulmonares (al mismo tiempo, también aumenta la presión capilar pulmonar). La presión en las aurículas es igual o mayor en la derecha que en la izquierda. En tales casos, desde los primeros días se observan pequeñas CIA y un curso leve de la enfermedad. A menudo se muestra una atrioseptostomía urgente (procedimiento de Rush Kinda) durante el cateterismo.
La introducción de un agente de contraste en la arteria pulmonar le permite realizar de inmediato el diagnóstico correcto (Fig. 16). El medio de contraste se encuentra en el colector de la vena pulmonar (CLV), a través de la vena vertical (VV) ingresa a la vena innominada izquierda (LV), luego a la vena cava superior y la aurícula derecha.
diagnóstico diferencial. En recién nacidos y niños en los primeros meses de vida, este defecto se diferencia de la atresia mitral o aórtica, estenosis mitral, corazón triatrial, estenosis de venas pulmonares, transposición de grandes vasos, linfangiectasia; a una edad más avanzada - con VSD.
Curso, tratamiento. Alrededor del 80% de los niños con ADLV total mueren en los primeros años de vida, especialmente en el caso de malformaciones infracardiacas (infradiafragmáticas) y de otro tipo con obstrucción venosa pulmonar. Las principales causas de muerte en pacientes: insuficiencia cardíaca, neumonía, cierre prematuro del foramen oval. Cuanto más tarde aparezcan los primeros síntomas de la enfermedad, mejor será el pronóstico. Las observaciones se describen cuando los pacientes vivieron hasta 30 años; en tales casos, hay una buena mezcla de sangre a nivel de las aurículas debido al tamaño suficiente de la CIA, no hay obstrucción venosa, el nivel de presión y resistencia pulmonar general es bajo y el estado del miocardio del ventrículo derecho es satisfactorio En presencia de insuficiencia cardíaca, está indicado el nombramiento de glucósidos cardíacos y diuréticos (ver Capítulo 22). La terapia farmacológica eficaz permite posponer el tratamiento quirúrgico hasta una edad más avanzada, ya que la corrección de un defecto a una edad temprana se acompaña de una tasa de mortalidad del 35 al 50% [Falkovsky GE et al., 1986; Clarke D. et al., 1977].
Con ADLV total a la aurícula derecha (forma cardiaca), la operación se realiza mediante circulación extracorpórea e hipotermia y consiste en aumentar el defecto interauricular y aplicar un parche de tal manera que dirija el flujo sanguíneo desde los orificios de las venas pulmonares a través del defecto. a la aurícula izquierda. En los casos en que el colector drene a través del seno coronario, para crear un drenaje adecuado, se extirpa una parte del tabique ubicado entre el seno coronario y la ventana oval, se incide la pared posterior superior del seno coronario, el parche desplaza la pared y el seno coronario hacia la aurícula izquierda. En los tipos de defecto supracardiaco e infracardico, se aplica una anastomosis entre el colector de la vena pulmonar y la aurícula izquierda [Burakovsky V.I. et al., 1989].
En caso de hipoplasia severa del ventrículo izquierdo, se utiliza la corrección de una CIA con un parche perforado o un tratamiento quirúrgico en dos etapas, que incluye: etapa 1 - anastomosis entre el colector y la aurícula izquierda (permite el desarrollo de las secciones izquierdas de la corazón), etapa II - ligadura de la vertical
vena, a través de la cual las venas pulmonares desembocan en la vena cava superior derecha.
Mortalidad posquirúrgica en niños menores de 6 años, según
- Galloway y otros (1985) fue del 10%. Es mayor en la forma infracárdica, drenaje de las venas pulmonares a la vena cava superior, especialmente a la derecha (que cuando desembocan en el seno coronario o directamente en la aurícula derecha), con hipertensión pulmonar, ventrículo izquierdo y aurícula izquierda hipoplásicos .
Cuando se realiza una operación en la infancia, los resultados a largo plazo suelen ser buenos, ya que los cambios escleróticos en los vasos de la circulación pulmonar y en el miocardio de los ventrículos del corazón no tienen tiempo de desarrollarse. Si la anastomosis muestra signos de obstrucción funcional, está indicada una segunda operación.
En este caso, un tipo de defecto bastante raro, las venas pulmonares no desembocan en la aurícula izquierda, sino a través de conexiones anormales en el sistema venoso. Las cuatro venas pulmonares pueden drenar a través de un colector común a la vena cava superior, al seno coronario o al sistema de la vena porta. Muy raramente se conectan directamente a la aurícula derecha.
Dado que con este defecto, la sangre de ambos círculos de la circulación sanguínea eventualmente ingresa a la aurícula derecha, la circulación sistémica se mantiene al pasar la sangre a través del foramen oval, a menos, por supuesto, que el conducto arterioso esté funcionando o la presión en los vasos de la circulación pulmonar. no excede la de los vasos de gran círculo. Las características de la hemodinámica en este tipo de defecto, similares a las de la HVI sin atresia de la válvula mitral o arterial, no afectan negativamente el desarrollo del feto. Las partes izquierdas del corazón fetal reciben una menor cantidad de sangre en relación con el flujo sanguíneo pulmonar (dependiendo del tamaño del foramen oval), que no proviene de las venas pulmonares, sino de la aurícula derecha. Un punto importante que determina el curso natural de la enfermedad y la sintomatología es la obstrucción concomitante de las venas pulmonares, que invariablemente ocurre cuando las venas pulmonares desembocan en la circulación sistémica por debajo del diafragma. La obstrucción de la vena en este tipo de defecto subdiafragmático se debe al volumen y la longitud del colector, a la disminución del calibre del conducto venoso después del nacimiento de un niño o a la estenosis del colector en el sitio de su unión a la vena sistémica. . Así, después del nacimiento de un niño, la sangre oxigenada de los pulmones pasa por la vena porta y el hígado antes de entrar en la aurícula derecha. Por el contrario, en el tipo de defecto supradiafragmático, la sangre oxigenada de los pulmones ingresa directamente al seno coronario, o a la vena cava superior a través de la vena vertical común izquierda, o a la aurícula derecha, mezclándose con la sangre venosa sistémica. . Se ha establecido que con este tipo de defecto puede ocurrir una obstrucción venosa de diversos grados.
En general, en niños con obstrucción venosa pulmonar severa, los síntomas aparecen antes en el tipo de defecto subdiafragmático. En este caso, el niño puede experimentar edema pulmonar y atelectasia, se desarrolla enfisema intersticial y aumentan los conductos linfáticos. Además, la hipertrofia de la capa media de las venas pulmonares y los cambios en las arteriolas pulmonares no se modifican. Además, con una obstrucción severa de las venas pulmonares, las venas bronquiales, que desempeñan el papel de colaterales, se expanden. Las paredes de las arterias pulmonares pequeñas se engrosan y aumenta la masa muscular de las arteriolas periféricas. El corazón derecho y la arteria pulmonar tienden a estar dilatados, mientras que el corazón izquierdo es relativamente pequeño.
Los síntomas de la enfermedad en recién nacidos en los que las venas pulmonares no están obturadas, aparecen más tarde que con las venas obstruidas. Al mismo tiempo, el flujo sanguíneo pulmonar del niño aumenta notablemente. Por lo general, en los niños que desarrollan síntomas en el período posnatal temprano, la comunicación entre las aurículas es pequeña, es decir, se transmite más a través del foramen oval que a través de un verdadero defecto del tabique interauricular. El pronóstico depende de su tamaño.
La frecuencia del drenaje venoso pulmonar anómalo total es del 2-4% de todas las cardiopatías congénitas que se manifiestan en el período neonatal, siendo el defecto igualmente frecuente tanto en niños como en niñas.
En los niños con este defecto, la sangre de los vasos de los círculos grandes y pequeños ingresa a la aurícula derecha y, desde allí, a los vasos de los pulmones y la circulación sistémica a través del orificio en el tabique auricular y el ventrículo izquierdo. En este sentido, el nivel de pO 2 en los vasos de un círculo grande y la oxigenación de la sangre es inferior a lo normal. Su valor absoluto depende del flujo sanguíneo pulmonar. Con la obstrucción de las venas pulmonares, el flujo de sangre a los pulmones se reduce y puede desarrollarse congestión y edema pulmonar, lo que exacerba la hipoxemia y la cianosis. Sin una operación radical, el niño muere rápidamente. En este caso, siempre se observa hipertensión pulmonar y los signos de insuficiencia cardíaca aparecen temprano. El tipo de defecto subdiafragmático es fácil de asumir si el nivel de pO 2 en la sangre de la vena umbilical es más alto que en la aórtica.
Drenaje venoso pulmonar anómalo total
La palabra "anómalo" significa "incorrecto". Con este defecto, las venas pulmonares (y hay cuatro de ellas), que deberían desembocar en Aurícula izquierda, no caigas en él, es decir. no te conectes con él. Hay muchas opciones para su confluencia incorrecta.
Hay un drenaje anómalo "parcial": esto es cuando una o dos de las cuatro venas fluyen hacia la aurícula derecha (la opción más común), y en la gran mayoría de los casos se combina con comunicación interauricular, y hablamos de esto en el capítulo sobre TEA.
El drenaje venoso pulmonar anómalo total o total (TADPV) es un asunto completamente diferente. Con este defecto, las cuatro venas pulmonares de ambos pulmones están conectadas en un colector de vasos ancho. Este colector de sangre arterial oxidada en los pulmones no se fusiona con la aurícula izquierda, como debería, sino que se conecta al sistema venoso del cuerpo, generalmente a través de una vena grande. La sangre arterial, por lo tanto, sin pasar por el corazón, ingresa a las venas grandes y llega a la aurícula derecha. Solo aquí, después de haber atravesado el defecto del tabique interauricular, estará donde debería estar inicialmente, en la aurícula izquierda, y luego seguirá el camino habitual a través de la circulación sistémica. Es difícil imaginar cómo podría ser en absoluto. Pero los niños con este defecto nacen a término y el corazón hace frente a esa situación durante algún tiempo. Sin embargo, este tiempo puede ser muy corto.
En primer lugar, la vida de un niño depende del tamaño del mensaje interauricular: cuanto más pequeño es, más difícil es que la sangre arterial llegue a su destino en la mitad izquierda del corazón.
En segundo lugar, en esta mitad izquierda del corazón, una parte importante de la sangre es simplemente venosa, es decir, sin oxidar, y nuevamente será forzado a formar un gran círculo. En un niño, por lo tanto, la sangre parcialmente venosa comienza a circular en las arterias y se vuelve "azul", es decir, color de la piel, y especialmente - yemas de los dedos y membranas mucosas (labios, boca) - cianótico. Esto es cianosis, y de sus causas, manifestaciones y consecuencias hablaremos más adelante.
Con drenaje anómalo completo, la cianosis puede no ser muy pronunciada, pero está presente y suele notarse poco después del nacimiento.
En la mayoría de los casos, la condición de los niños con drenaje venoso pulmonar anómalo completo es "crítica" desde el comienzo de la vida. Si no se hace nada, morirán en unos pocos días o meses.
El tratamiento quirúrgico existe, y los resultados hoy en día son bastante alentadores. La operación es bastante complicada, se realiza a corazón abierto y consiste en que se sutura el colector de la vena pulmonar común a la aurícula izquierda y se cierra con un parche el orificio del tabique interauricular. Así, después de la operación, se restablece la circulación sanguínea normal en dos círculos separados.
A veces, también es aceptable una opción de emergencia: la expansión del defecto durante el sondeo como la primera etapa para salvar vidas, lo que le permite retrasar un poco la intervención principal.
No tocaremos aquí muchos detalles relacionados con varios tipos de vicios y métodos para corregirlos. Pero solo queremos recalcar que los niños con este defecto necesitan especializado inmediato ayuda, que hoy es absolutamente real.
Los resultados a largo plazo de la operación son bastante buenos; después de todo, se eliminó el defecto principal. Sin embargo, los niños deben estar bajo la supervisión de cardiólogos porque las complicaciones son posibles en forma de alteraciones del ritmo o estrechamiento de las venas pulmonares en los sitios de sutura (esto se debe al hecho de que el corazón que ha sufrido una operación tan importante continúa crecer). Y nuevamente queremos enfatizar: este niño no está discapacitado. Debe llevar una vida absolutamente normal, y cuanto antes se haga la operación, antes se olvidará de todo.
Pacientes
Retroalimentación
© Copyright 1998 - 2018, Institución Presupuestaria del Estado Federal “N.M. UN. Bakulev" del Ministerio de Salud de Rusia. Reservados todos los derechos.
Enfermedades → Drenaje venoso pulmonar anómalo total
Los materiales publicados en el sitio son información verificada de especialistas en varios campos de la medicina y están destinados únicamente con fines educativos e informativos. El sitio no proporciona consejos y servicios médicos para el diagnóstico y tratamiento de enfermedades. Las recomendaciones y opiniones de especialistas publicadas en las páginas del portal no reemplazan la atención médica calificada. Posibles contraindicaciones. SIEMPRE consulte con su médico.
¿NOTASTE UN ERROR EN EL TEXTO? ¡Selecciónelo con el mouse y presione Ctrl + Enter! ¡GRACIAS!
Drenaje venoso pulmonar anómalo total en recién nacidos
Todas las venas pulmonares desembocan en el corazón derecho.
Suyaracardial (las venas pulmonares drenan en la vena vertical ascendente, vena innominada);
Cardíaco (las venas pulmonares drenan en la aurícula derecha, seno coronario);
Infracardial (las venas pulmonares drenan en las venas intraabdominales).
FISIOPATOLOGIA
A pesar de la diferente anatomía de la malformación, en cuanto a la fisiopatología circulatoria, se puede clasificar en dos tipos según la presencia o no de obstrucción de las venas pulmonares. Importante para la continuación de la vida en el período posnatal es la presencia de comunicaciones entre RA (aurícula derecha) y LP (aurícula izquierda) (AMPP, LLC).
La hemodinámica de la variante no obstructiva de TALV es similar a la de un ASD mayor. La sangre de las venas pulmonares ingresa a la RA, luego al RV (ventrículo derecho) y, en presencia de una CIA, a la LA. En este caso, la cantidad de sangre que regresa por la CIA a la AI está determinada por el tamaño del defecto y el grado de extensibilidad de la próstata. Sin embargo, bajo cualquier condición, una parte mucho mayor de la sangre ingresa al páncreas y circula en la ICC (circulación pulmonar), provocando una sobrecarga de volumen del páncreas y una marcada hipervolemia de la ICC. La presión en la LA (arteria pulmonar) permanece baja. Debido a que la mezcla de sangre venosa y arterial procedente de las venas pulmonares se produce a nivel de la PP, la saturación en la AI y la aorta es idéntica.
En la variante obstructiva de TALV, la salida de sangre enriquecida con oxígeno de las venas pulmonares es difícil. Esto conduce al desarrollo de hipertensión venosa pulmonar y luego a un aumento de la presión en la LA y el páncreas. Se crea una situación parecida a la hemodinámica en la estenosis de la válvula mitral. En este caso, el riesgo de desarrollar edema pulmonar es alto, porque. La presión hidrostática en los capilares se vuelve mucho más alta que la presión osmótica de la sangre. Siempre que la ASD existente proporcione un volumen suficiente de derivación de sangre de derecha a izquierda, la cavidad pancreática seguirá siendo pequeña. El lado izquierdo del corazón, como en el caso de la variante no obstructiva de TALV, permanece "bajo carga" y tiene un tamaño relativamente pequeño. El nivel de saturación de oxígeno en la aorta y la AI es igual, pero sus valores son significativamente más bajos que en la variante no obstructiva del defecto. El grado de desaturación arterial será inversamente proporcional al volumen de flujo sanguíneo en el ICC.
El pronóstico para los pacientes con TALV es extremadamente desfavorable. Sin corrección quirúrgica, dos tercios de los pacientes con una forma no obstructiva de la enfermedad mueren al final del primer año de vida.
La causa de la muerte suele ser la neumonía. Con una variante obstructiva, la esperanza de vida es de un mes.
CLÍNICA
una. Manifestaciones clínicas de la enfermedad:
Variante obstructiva de TADLV:
Caracterizado por cianosis rápidamente progresiva desde el nacimiento, que aumenta con la alimentación, que se asocia con la compresión de las venas pulmonares por el esófago;
Dificultad para respirar y signos de edema pulmonar en el período neonatal.
Cianosis moderada desde el nacimiento;
Rezago en el desarrollo físico, frecuentes infecciones broncopulmonares;
Signos de insuficiencia cardíaca (taquicardia, dificultad para respirar, hepatomegalia).
b. Examen físico:
Variante obstructiva de TADLV:
Tono fuerte II en la base del corazón;
Variante no obstructiva de TADLV:
El tono II se desdobla en la base del corazón (se acentúa el componente pulmonar del tono II);
Soplo sistólico de estenosis relativa de la válvula pulmonar de intensidad débil o moderada (no más de 3/6) en II m. a la izquierda del esternón;
Soplo mesodiastólico de estenosis relativa de la TC (válvula tricúspide) a lo largo del borde izquierdo del esternón en el tercio inferior (con importante flujo desde la AD).
DIAGNÓSTICO
- Electrocardiografía
Variante obstructiva de TADLV:
hipertrofia del páncreas (tipo R);
Raramente hipertrofia de PP.
Variante no obstructiva de TADLV:
Hipertrofia del páncreas según el tipo de bloqueo de la rama derecha del haz de His en la derivación Vj (consecuencia de la sobrecarga de volumen del páncreas);
Raramente hipertrofia de PP.
El diagnóstico de TALVV se basa en la ausencia de todas las venas pulmonares que desembocan en la aurícula izquierda en lugares típicos.
Dilatación aguda de las partes derechas del corazón;
Expansión de la arteria pulmonar;
Reducción significativa de las cámaras izquierdas;
Vena vertical expandida y vena cava superior;
La presencia de TEA con descarga derecha-izquierda.
TRATAMIENTO Y OBSERVACIÓN
- 1. Seguimiento y tratamiento de pacientes con TALV no corregido
La variante obstructiva de TALV es una indicación de emergencia para cirugía. Antes de que el paciente ingrese a la clínica de cirugía cardíaca, se deben tomar las siguientes acciones:
una. Infusión IV de preparaciones de prostaglandina E 1, que mantendrán el conducto abierto y asegurarán la descarga de sangre desde la AI hacia la aorta. Esto reducirá el riesgo de desarrollar edema pulmonar y aumentará el volumen de flujo sanguíneo en el BCC.
en. Corrección de la acidosis metabólica.
Variante no obstructiva de TADLV:
una. Cuidados intensivos para la insuficiencia cardiaca (diuréticos, digoxina).
b. Si se presenta acidosis metabólica, se corrige.
Al establecer el diagnóstico de TALV con la presencia de un ASD pequeño/restrictivo, se realiza el procedimiento de Rashkind para aumentar el volumen de flujo sanguíneo en el BCC. La indicación para el procedimiento es la presencia de comunicación restrictiva entre las aurículas, un gradiente de presión de más de 6 mm Hg.
Indicaciones para el tratamiento quirúrgico:
Establecer el diagnóstico de TADLV es una indicación absoluta de cirugía.
Contraindicaciones para el tratamiento quirúrgico:
La presencia de contraindicaciones absolutas para la administración concomitante
Alta resistencia venosa de los vasos de los pulmones.
tácticas quirúrgicas
El momento de la cirugía está determinado por la presencia o ausencia de obstrucción venosa pulmonar.
En TALV obstructiva, la intervención se realiza inmediatamente dentro de las primeras horas después del diagnóstico. Por lo general, estas son las primeras horas de la vida de un niño.
En la TALV no obstructiva, el tratamiento quirúrgico puede retrasarse y realizarse durante los primeros meses de vida.
técnica quirúrgica
en condiciones de IR. Asigne un colector común LV en el lugar de su confluencia. Por lo general, el colector es lo suficientemente largo (incluso en el caso de un drenaje infracardiaco) para moverlo hacia la aurícula izquierda. El colector se abre ampliamente, eliminando zonas de estrechamiento. Abra ampliamente la aurícula izquierda. Se forma una amplia anastomosis entre el colector PV y la AI. Se atan elementos adicionales del sistema venoso (vena vertical, etc.).
Complicaciones específicas del tratamiento quirúrgico
hipertensión pulmonar residual;
Violación del ritmo cardíaco (síndrome de debilidad del nódulo sinusal), taquicardia auricular;
Disminución del gasto cardíaco debido a la obstrucción residual del tracto de salida de la VP.
Seguimiento postoperatorio
- La observación se realiza todos los meses. La duración de la observación se determina individualmente. Se realiza un seguimiento de las complicaciones tardías de la corrección quirúrgica del defecto: estenosis de la vena pulmonar, alteraciones del ritmo cardíaco.
- En caso de registro en el período postoperatorio de NRS, además del examen, se recomienda SMEKG cada 6 meses o más a menudo. Si está indicado, se realiza terapia antiarrítmica, RFA o implantación de marcapasos.
- La prevención de la endocarditis bacteriana se lleva a cabo según las indicaciones si hay estenosis de las venas pulmonares.
- La admisibilidad de la educación física después de la corrección del defecto. La actividad física está limitada en pacientes con estenosis de la vena pulmonar.
Si encuentra un error, seleccione un fragmento de texto y presione Ctrl+Enter.
Drenaje venoso pulmonar anómalo total (TADLV)
El drenaje venoso pulmonar anómalo total es un defecto en el que no existe una conexión directa entre las venas pulmonares y la aurícula izquierda. Las venas pulmonares drenan anormalmente hacia la aurícula derecha o sus tributarias. Casi todos los pacientes tienen un foramen oval permeable o ASD.
TADLV fue descrito por primera vez por Wilson en 1798. En 1951, Muller realizó la primera operación exitosa. Ella fue un paliativo. Sin el uso de tecnología de corazón abierto, se realizó una anastomosis entre el colector de la vena pulmonar y el oído izquierdo. En 1956, Lewis, Varco et al informaron sobre la corrección exitosa de un defecto en condiciones de hipotermia moderada creada por el enfriamiento de la superficie y la oclusión temporal del flujo venoso al corazón. En el mismo año, Burroughs y Kirklin realizaron la corrección de defectos bajo IR. La experiencia de los años siguientes mostró que la mortalidad de los lactantes era significativamente mayor que la de los niños mayores. Con el tiempo, comenzaron a aparecer informes en la literatura sobre el éxito de las operaciones en pacientes graves con un tipo obstructivo de TALV. La mejora en los resultados se asoció con la introducción de perfusión hipotérmica con volumen de flujo sanguíneo reducido y paro circulatorio.
La frecuencia de aparición de TALV, según diversos estudios, varía de 0,83 a 2,8%.
Morfogénesis
La asociación de la formación de TADLV con agentes teratogénicos externos conocidos no se ha establecido claramente, aunque la exposición a plomo, pinturas, solventes y pesticidas puede ser una causa probable. No se ha identificado la naturaleza genética de TALV, pero no se excluye un patrón monogénico de herencia debido a los numerosos informes de casos familiares entre hermanos y hermanas consanguíneos. El gen de esta forma familiar de TADLV está vinculado al cromosoma 4q13-q12. En la misma región se encontró el gen del receptor del factor de crecimiento endotelial vascular, que se asocia con una forma familiar y probablemente esporádica de TADLW.
TADLV se combina con una serie de síndromes congénitos: asplenia, poliesplenia, síndrome del ojo de gato. Con el síndrome del ojo de gato, el 50% de los pacientes tienen CHD como TADLV, tetralogía de Fallot, VSD, ATK.
Anatomía
Según la clasificación clínica de Darling et al., según el nivel de drenaje, el defecto se presenta en cuatro opciones:
supracardial. Constituye el 50% de todos los TADLV. El colector venoso pulmonar común, ubicado posterior a la aurícula izquierda, drena en la PVVC a través de las venas innominada izquierda y vertical izquierda.
Intracardíaca. Se observa en el 20% de los pacientes con TALV. El colector común de las venas pulmonares drena en el seno coronario, o desembocan por separado en la aurícula derecha con cuatro bocas.
infracárdico. Ocurre en el 20% de los casos. El colector venoso pulmonar común drena en la vena porta, el conducto venoso, la vena hepática y la VCI. La vena pulmonar común, a través de una vena vertical que perfora el diafragma en el esófago, se conecta a las venas porta y la IVC a través del conducto venoso o sinusoides hepáticos.
Mezclado. Ocurre en el 10% de los pacientes. Este tipo es una combinación de las opciones anteriores.
La vida del paciente es posible solo en presencia de ASD concomitante o una ventana oval abierta, que son una parte integral del defecto. Por la misma razón, la persistencia del conducto arterioso persistente en niños pequeños no es una anomalía complicada.
Independientemente de la ubicación de la conexión anormal de las venas pulmonares, el corazón en pacientes con TADLV tiene características anatómicas comunes: dilatación e hipertrofia del ventrículo derecho y la aurícula derecha, dilatación de la arteria pulmonar. La mitad izquierda del corazón está relativamente subdesarrollada, especialmente la aurícula izquierda. Su volumen se reduce al 50% de la norma.
Conexión a la aurícula derecha
La unión generalmente se encuentra en la parte posterior inferior de la aurícula derecha. La vena pulmonar común o dos, tres o cuatro venas pulmonares desembocan en la aurícula derecha. El estrechamiento de las conexiones anormales de las venas pulmonares es raro. Los defectos cardíacos asociados son comunes.
Conexión con el sistema cardinal común derecho
Las venas pulmonares de ambos lados forman un colector común ubicado detrás de la aurícula izquierda. Del lado derecho de este colector parte un único tronco venoso, que asciende, pasa por delante de la raíz del pulmón derecho y desemboca por detrás en la SVC. En raras ocasiones, conecta con v.azygos. Los cirujanos domésticos se encontraron con esta variante de TADLV en un paciente. No se realizó un diagnóstico preciso antes de la cirugía. Un examen externo e intracardíaco no reveló la unión del colector con el corazón derecho, a pesar de que la VCS estaba significativamente expandida. Después de la creación de una anastomosis entre el colector de la vena pulmonar y la aurícula izquierda y el destete de la CE, se redujo el gasto cardíaco, lo que se manifestó por hipotensión arterial. Con un pinzamiento de prueba a corto plazo de la SVC en el lugar de su confluencia con la aurícula derecha, la presión arterial aumentó adecuadamente. Quedó claro que había una fuga de sangre a lo largo de un trayecto corto desde la aurícula izquierda hasta la VCS. Se expuso la pared posterior de la VCS en toda su longitud y se encontró una vena ácigos agrandada. Después de su vendaje, se restableció la hemodinámica normal.
Conexión con el sistema cardinal común izquierdo
Vena innominada izquierda.
En esta, la variante más común de TALV, las venas pulmonares de ambos lados forman un colector común detrás de la aurícula izquierda. La vena vertical que se origina en el lado izquierdo del colector generalmente pasa por delante de la arteria pulmonar izquierda y el bronquio principal, asciende al mediastino superior, pasa por delante del cayado aórtico y se une a la vena braquiocefálico izquierda proximal a la confluencia de la yugular izquierda. y venas subclavias. La vena innominada izquierda normalmente se fusiona con la SVC. Con menos frecuencia, la vena vertical discurre entre la arteria pulmonar izquierda y el bronquio principal izquierdo. Estas estructuras lo aprietan desde el exterior, provocando la obstrucción del flujo venoso pulmonar. El tronco venoso que conecta el colector con la vena innominada izquierda se denomina vena cava superior izquierda persistente o vena vertical anómala.
El vaso que conecta el colector de la vena pulmonar directamente con la SVC, sin pasar por la vena braquiocefálico, pasa entre la arteria pulmonar derecha y la tráquea y es comprimido por ellas. Una de las variantes de la obstrucción venosa vertical es su estrechamiento discreto o difuso.
La vía venosa anormal corre dentro del pericardio. Las venas pulmonares se fusionan con un tronco común, que se une al seno coronario en el surco auriculoventricular. El seno coronario luego sigue un camino normal hacia la aurícula derecha y el orificio se encuentra, como de costumbre, entre la VCI y la válvula tricúspide. Las venas del corazón drenan normalmente en el seno coronario. Este último está cubierto con fibras de la aurícula izquierda. El seno coronario tiene una pared común con la aurícula izquierda en casi toda su longitud. Puede haber constricciones en o dentro de la unión de la vena pulmonar común con el seno coronario.
Conexión con el sistema umbilical-vitelino
La unión distal se encuentra debajo del diafragma. Las venas pulmonares de ambos lados forman un colector común detrás de la aurícula izquierda. El tronco venoso común parte de la parte media del colector, desciende anteriormente al esófago y penetra en el diafragma a través de la abertura esofágica. Muy a menudo, la vena anómala se une a la vena porta en la confluencia de las venas esplénica y mesentérica superior. Con menos frecuencia, el tronco anómalo se conecta al conducto venoso, a una de las venas hepáticas o directamente a la vena cava inferior. En este tipo de TALV suele ocurrir obstrucción del retorno venoso pulmonar.
Sitios de obstrucción anatómica del drenaje venoso pulmonar
Muchos pacientes con tipos supra e intracardíacos de TALV y la mayoría de los pacientes con tipo infracárdico tienen hipertensión pulmonar debido a la obstrucción del retorno venoso pulmonar en forma de estrechamiento del orificio de la vena pulmonar, orificio colector o presión externa sobre la vena anormal. La presencia de obstrucción en el canal venoso pulmonar anormal tiene una influencia decisiva en el estado hemodinámico y las manifestaciones clínicas.
Obstrucción a nivel del tabique interauricular.
Una pequeña comunicación interauricular puede interferir con el flujo de sangre hacia la aurícula izquierda y, por lo tanto, interrumpir la salida de sangre de las venas pulmonares. La esperanza de vida de los pacientes con TALV está obviamente relacionada con el tamaño de la CIA. Los pacientes con grandes defectos viven más que aquellos con comunicación auricular restrictiva.
El estrechamiento de las venas pulmonares y sus bocas es especialmente frecuente en la isomería auricular. El examen histológico revela engrosamiento de la media y la adventicia, así como proliferación de la íntima.
Obstrucción de vías venosas anormales.
Una de las causas de la obstrucción es la presión externa. Por lo tanto, en la TALV supracardiaca, la vena vertical puede pasar por detrás de la arteria pulmonar izquierda y comprimirse en el estrecho espacio entre el bronquio, la arteria pulmonar y el conducto arterioso permeable o el ligamento. Puede estar comprimido entre la arteria pulmonar derecha y la tráquea. También hay un estrechamiento interno en el paso típico de la vena vertical por delante de la arteria pulmonar izquierda. Con TALV infracardial, la compresión de la vena vertical ocurre en el esófago. En los casos en que la vena vertical está conectada al conducto venoso, su estrechamiento natural interrumpe la salida de sangre de las venas pulmonares. Finalmente, cuando la vena anómala se une a la vena porta oa una de sus tributarias, los sinusoides hepáticos comprimen el canal venoso pulmonar, obstruyendo el retorno venoso pulmonar.
Atresia de la vena pulmonar común
En raras ocasiones, la atresia de la vena pulmonar común es la confluencia de todas las venas pulmonares sin conexión con el corazón o las venas sistémicas. La corta vida útil es posible debido a las pequeñas conexiones entre las venas bronquiales y pulmonares. Con esta patología, se pronuncia la dilatación de los vasos linfáticos pulmonares. La atresia de vena pulmonar común es la forma más grave de TALV obstructiva y se presenta con edema pulmonar grave y cianosis grave inmediatamente después del nacimiento. El diagnóstico se establece mediante ecocardiografía y angiografía. La intervención quirúrgica tiene éxito sólo en casos excepcionales. ECMO se usa antes y después de la cirugía hasta que mejore la condición de los pulmones.
Defectos cardíacos asociados
TADLV se combina con muchos CHD, especialmente a menudo en pacientes con heterotaxia atrio-abdominal:
una tétrada a la que le falta una válvula pulmonar;
interrupción del arco aórtico;
transposición corregida y completa de los grandes vasos;
ventrículo con dos salidas;
síndrome de hipoplasia de las partes izquierdas del corazón;
Síndrome del sable turco.
Microestructura de los pulmones
El cuadro histológico depende de la presencia o ausencia de obstrucción venosa pulmonar. En ausencia de obstrucción en las arterias y arteriolas musculares, existe una marcada hipertrofia de la capa media. Rara vez se observa agrandamiento de la íntima en bebés, pero se observa con frecuencia en niños mayores y adultos.
La TALV con obstrucción se caracteriza por hipertrofia medial en las paredes de los canales venosos anormales, venas extrapulmonares y venas pulmonares pequeñas. Se ha demostrado que las paredes de las arterias y venas pulmonares con drenaje anormal son mucho más gruesas de lo normal y con CIV e hipertensión pulmonar. El engrosamiento de la capa media de las arterias y venas es más pronunciado en presencia de obstrucción venosa pulmonar. El engrosamiento de la capa muscular en las pequeñas arterias pulmonares en TALV se correlaciona con la presión en la arteria pulmonar. A la misma presión en la arteria pulmonar, el engrosamiento medial siempre es más pronunciado en TALV que en VSD. El grosor de la capa media de las venas pulmonares también está estrechamente relacionado con el nivel de hipertensión arterial pulmonar en pacientes con TAHD. Las arteriolas suelen mostrar proliferación de la íntima y es común la arteritis necrosante.
Los espacios interalveolares se caracterizan por edema y extravasación de eritrocitos. Los vasos linfáticos subpleurales e interlobulillares están dilatados. La linfangiectasia ocurre en el 62% de los pacientes con TALV. Se acompaña de enfisema intersticial, que es una de las causas de mortalidad postoperatoria.
hemodinámica
La aurícula derecha recibe sangre de ambas circulaciones. La sangre arterial ingresa a la aurícula derecha desde el colector al que fluyen las venas pulmonares. En la aurícula se mezcla con la venosa, de aquí, a través de la CIV o de una ventana oval abierta, parte de la sangre ingresa a la aurícula izquierda y luego a la circulación sistémica; la otra parte va al círculo pequeño. La naturaleza de la circulación sanguínea depende de la distribución de la sangre venosa mixta entre los círculos pulmonar y sistémico. La circulación sanguínea se debe principalmente a la magnitud de la comunicación interauricular. Si es restrictivo, la cantidad de sangre que ingresa a la aurícula izquierda es pequeña y se reduce el flujo sanguíneo sistémico. La disminución del flujo sanguíneo sistémico se compensa parcialmente con un aumento de la presión en la aurícula derecha. Dado que todas las venas sistémicas y pulmonares drenan en la aurícula derecha, aumenta la presión en ambos depósitos venosos.
Con un foramen oval muy abierto o ASD, hay movimiento libre de sangre entre las dos aurículas. En estas condiciones, la distribución de la sangre venosa mixta está determinada por la relación de las resistencias de los círculos grandes y pequeños de circulación sanguínea y la extensibilidad de los ventrículos. Los pacientes con obstrucción de las venas pulmonares desarrollan hipertensión pulmonar venosa y, en relación con esto, arterial. En ausencia de involución de la estructura fetal de las arterias pulmonares, a veces se produce hipertensión pulmonar primaria.
TALV se caracteriza por sobrecarga del corazón derecho e hipertensión pulmonar.
TALV sin obstrucción venosa
Al nacer, la distribución del flujo sanguíneo entre los círculos grande y pequeño es aproximadamente la misma, ya que la resistencia vascular es casi igual. Durante las primeras semanas de vida, se produce la maduración del lecho vascular pulmonar, una disminución de la resistencia arterial pulmonar y un aumento gradual del volumen de sangre venosa mixta que entra en la circulación pulmonar. El flujo sanguíneo pulmonar es 3-5 veces mayor que el sistémico. El flujo sanguíneo sistémico es normal. Debido a que el conjunto de sangre venosa mixta recibe de 3 a 5 partes de sangre completamente arterializada por una parte de sangre venosa sistémica desaturada, la saturación de oxígeno de la aurícula derecha puede exceder el 90%. Como regla general, la sangre en la aurícula derecha se mezcla bien, por lo que la saturación de sangre en el ventrículo derecho, la arteria pulmonar, la aurícula izquierda, el ventrículo izquierdo y la aorta es igual a la de la aurícula derecha.
En TALV, se observan dilatación e hipertrofia del ventrículo derecho y dilatación de la arteria pulmonar.
La presión de la arteria pulmonar en los bebés varía de levemente elevada a sistémica. En los pocos niños que sobreviven hasta la adolescencia y más allá, la presión de la arteria pulmonar está ligeramente elevada. Con el tiempo, se desarrollan hipertrofia medial y proliferación de la íntima en las arteriolas pulmonares; por lo tanto, se observa una hipertensión más pronunciada en la tercera y cuarta décadas de la vida.
TALV con obstrucción venosa pulmonar
El aumento de la presión en los canales venosos pulmonares se transmite al lecho capilar pulmonar. Cuando la presión hidrostática en los capilares excede la presión osmótica de la sangre, se desarrolla edema pulmonar. Los mecanismos destinados a prevenir el edema pulmonar incluyen aumento del movimiento linfático, canales alternativos de derivación venosa pulmonar, reducción de la permeabilidad de la pared capilar pulmonar y espasmo reflejo de las arteriolas. Este último conduce a una disminución del flujo sanguíneo pulmonar, hipertensión pulmonar, aumento de la presión ventricular derecha, hipertrofia e insuficiencia ventricular derecha. Una disminución en el volumen del flujo sanguíneo pulmonar conduce a una disminución en la proporción de sangre oxigenada en sangre venosa mixta y una disminución en la saturación de las arterias de la circulación sistémica.
Clínica, diagnóstico
El curso clínico de TALVV está determinado por las características anatómicas y hemodinámicas del defecto, en particular:
el nivel de resistencia pulmonar general;
grado de obstrucción venosa pulmonar;
el tamaño del mensaje interauricular;
el estado del miocardio del ventrículo derecho;
la presencia de un conducto arterioso funcionante.
TALV sin obstrucción venosa pulmonar
Estos bebés son asintomáticos al nacer. Pronto, la mitad de los niños desarrollan dificultad para respirar, tos, dificultades para alimentarse, infecciones respiratorias recurrentes e insuficiencia cardíaca. El resto de los síntomas aparecen hacia el primer año de vida.
La cianosis puede aparecer a cualquier edad. Inicialmente, la cianosis no es pronunciada y aumenta en presencia de insuficiencia cardíaca, así como también como resultado del desarrollo gradual de cambios secundarios en los vasos pulmonares. Para el primer año de vida, el 75-85% de los niños mueren, la mayoría en los primeros 3 meses. Los bebés se están quedando atrás en el desarrollo físico, irritables, con llanto y esfuerzo, la cara se oscurece. Casi siempre se presenta dificultad para respirar, respiración rápida y taquicardia. La joroba cardíaca, predominantemente del lado derecho, aparece antes que con un ASD aislado.
El cuadro auscultatorio se caracteriza por la presencia de muchos tonos cardíacos. El primer tono es fuerte y distinto, seguido por el tono de exilio. El segundo tono está ampliamente dividido y no cambia con los actos de respiración. Se acentúa el componente pulmonar del tono II. Casi siempre se escucha un tercer tono, máximo en la parte superior. En pacientes mayores, casi siempre se escucha un ruido cardíaco intravenoso.
En ocasiones, los soplos cardíacos pueden estar ausentes. No se siente el temblor. Por lo general, se escucha un soplo sistólico suave en la arteria pulmonar. A menudo, el ruido se escucha bien en el proceso xifoides ya lo largo del borde inferior del esternón a la izquierda. Los soplos son el resultado del flujo turbulento en el tracto de salida pulmonar y la insuficiencia de la válvula tricúspide. En la mitad de los casos, debajo del borde izquierdo del esternón se escucha un soplo diastólico de aumento del flujo sanguíneo a través de la válvula tricúspide. Al drenar el colector en la vena innominada izquierda, a la derecha oa la izquierda en la base del corazón, se puede escuchar un soplo sistólico prolongado. A diferencia de los soplos venosos funcionales, los soplos patológicos no aumentan en la diástole y no cambian con los cambios de posición o la presión sobre las venas yugulares.
Con insuficiencia cardíaca, el hígado está agrandado, hay edema periférico. En algunos niños que sobrevivieron a la infancia, las falanges terminales de los dedos están engrosadas.
Un hallazgo típico es una onda P alta y puntiaguda en las derivaciones II o derecha, que refleja agrandamiento de la aurícula derecha. El eje eléctrico se desvía hacia la derecha. Siempre hay signos de hipertrofia del ventrículo derecho, manifestados por alto voltaje de los dientes en las derivaciones derechas y bloqueo incompleto de la rama derecha.
El propósito de la ecografía TALV es confirmar el diagnóstico clínico y localizar el sitio de drenaje anormal. Los estudios Doppler pueden detectar la presencia de obstrucción en venas pulmonares individuales ya lo largo de la vena vertical. Un síntoma común a todas las formas de TALV es la sobrecarga de volumen del ventrículo derecho. El ventrículo derecho está dilatado. La aurícula derecha y las arterias pulmonares también están dilatadas, el tabique auricular sobresale hacia la izquierda. Se observa movimiento paradójico del tabique interventricular.
Además de los signos de sobrecarga de volumen del ventrículo derecho, la sospecha de TALV se debe a la incapacidad de rastrear el flujo de las venas pulmonares hacia la aurícula izquierda a lo largo del eje corto paraesternal alto o supraesternal. Desde aquí, así como desde la posición subcostal, se puede detectar un espacio sin eco, que es el canal venoso pulmonar común detrás de la aurícula izquierda con las venas pulmonares que desembocan en él. Una vez que se ha identificado un colector venoso común, se debe ubicar el sitio de su drenaje. En la TALVV supracardial, la vena vertical ascendente drena en una estructura venosa sistémica dilatada, más comúnmente en la vena braquiocefálico izquierda o LVVC. El examen Doppler de la vena vertical revela la dirección del flujo sanguíneo hacia arriba y la dirección opuesta de la sangre en la vena cava superior.
Con el drenaje TALV en el seno coronario, este último está dilatado y puede detectarse a lo largo del eje paraesternal largo o desde la posición apical de cuatro cámaras.
El examen Doppler de la vena vertical revela la dirección del flujo sanguíneo hacia arriba, en contraste con el movimiento opuesto en la vena cava superior.
Si el colector venoso pulmonar común drena en el seno coronario, este último está dilatado y puede verse desde la posición apical de cuatro cámaras. El seno coronario dilatado sobresale anteriormente y hacia arriba en la aurícula izquierda porque está ubicado en el surco auriculoventricular. Si el colector desemboca directamente en la aurícula derecha, se sitúa más alto que cuando drena en el seno coronario.
En la TALV infradiafragmática, el colector venoso pulmonar común drena en el sistema venoso porta, pero puede conectarse a las venas hepáticas. Las venas pulmonares convergen en un canal común, que a menudo es pequeño y está ubicado debajo de la aurícula izquierda y justo encima del diafragma. Es visible desde la posición subcostal. La vena descendente común se encuentra entre la aorta y la VCI. Estos vasos se pueden diferenciar según la dirección y la naturaleza del flujo sanguíneo con ecocardiografía Doppler: en la aorta - laminar pulsante en la dirección del corazón, a lo largo de la vena cava inferior - casi constante hacia el corazón. El flujo a través de la vena vertical descendente se parece al de la VCI, pero se aleja del corazón.
Para diagnosticar TADLV mixto, es necesario utilizar diferentes posiciones del sensor. El tipo más común de drenaje mixto es una combinación de drenaje hacia el seno coronario y la vena innominada izquierda.
El estudio Doppler es el mejor método para evaluar la presencia de obstrucción de las venas pulmonares. El flujo venoso pulmonar sin obstrucciones se caracteriza por un flujo bifásico o trifásico casi constante, con un breve período de reversión al inicio de la diástole. La obstrucción dentro de uno de los componentes de la vía venosa pulmonar se manifiesta por corriente monofásica directa de alta velocidad. La obstrucción del retorno venoso pulmonar puede enmascararse si se reduce el flujo sanguíneo pulmonar. Puede ser desenmascarado por la introducción de prostaglandina E1. Puede verse directamente un estrechamiento o compresión discreta a lo largo de la vía venosa pulmonar entre estructuras como la rama de la arteria pulmonar y el bronquio.
Un estudio Doppler color proporciona información sobre la dirección y la velocidad promedio del flujo a través de la conexión anómala de la vena pulmonar. Esto le permite identificar rápidamente la unión del canal venoso pulmonar con la vena sistémica. La obstrucción crea turbulencia en el flujo y aparece como un chorro de color mosaico. Una vez que se localiza el sitio de la turbulencia, evalúe el grado de constricción por la magnitud de la velocidad de flujo espectral máxima en la ecocardiografía Doppler.
En cada tipo de TALV, se examina cuidadosamente la posibilidad de malformaciones concomitantes, como defectos en las almohadillas endocárdicas, atresia pulmonar, ventrículo único, TMA. Los errores en el diagnóstico de TALV son más probables con anomalías del situs auricular, drenaje venoso pulmonar mixto y malformaciones asociadas.
La ecocardiografía prenatal se usa cada vez más para diagnosticar defectos cardíacos en casos de alto riesgo. La conexión normal de las venas pulmonares con la aurícula izquierda se puede determinar a partir de la posición apical de cuatro cámaras del corazón fetal. Debido a que el flujo sanguíneo pulmonar fetal está reducido, es difícil identificar el drenaje venoso pulmonar anormal. Un signo indirecto de TALV es la expansión del ventrículo derecho y la arteria pulmonar, que no es proporcional al tamaño del ventrículo izquierdo y la aorta, especialmente cuando se excluyen otros defectos que crean el mismo cuadro. A pesar de las dificultades del diagnóstico prenatal, existen reportes aislados en la literatura de casos de diagnóstico inequívoco de TALV confirmados después del nacimiento. Por el contrario, hay casos de TALV que se detectaron por primera vez en el período neonatal, a pesar del ecodiagnóstico prenatal.
TALV se puede diagnosticar mediante resonancia magnética no invasiva. Este método detecta las venas pulmonares que fluyen hacia la cámara detrás de la aurícula izquierda. Se puede ver que la vena pulmonar común se conecta con la vena braquiocefálico izquierda, el seno coronario o la aurícula derecha.
Comunes a todos los tipos de TADLV son signos de aumento del flujo sanguíneo pulmonar. La aurícula derecha y el ventrículo derecho están dilatados e hipertrofiados, el arco de la arteria pulmonar sobresale. Las cámaras de las partes izquierdas del corazón no están dilatadas. La unión del colector venoso pulmonar puede reflejarse en la configuración de la sombra cardíaca. Con un drenaje anormal en la vena braquiocefálica, la sombra del corazón se asemeja a un ocho o un muñeco de nieve. La parte superior del "ocho" está formada por la vena vertical a la izquierda, la vena innominada izquierda arriba y la vena cava superior a la derecha. Los hallazgos radiográficos característicos generalmente están ausentes en los primeros meses de vida y, a menudo, se observan en niños mayores y adultos. Con drenaje anormal de las venas pulmonares en la vena cava superior, su dilatación se manifiesta por el abultamiento del borde superior derecho de la sombra del corazón.
Actualmente, las indicaciones para el cateterismo cardíaco están limitadas debido a la alta sensibilidad y al 99% de especificidad del diagnóstico ecocardiográfico de TALV. El cateterismo se realiza para aclarar detalles importantes que no se aclararon durante el estudio ecocardiográfico:
identificación de defectos concomitantes;
detección de lugares de conexiones anómalas;
localización de la obstrucción venosa.
El sitio de una conexión anormal entre las venas pulmonar y sistémica puede detectarse mediante un “salto” de oxígeno al nivel de la vena innominada izquierda, la vena cava superior derecha o el seno coronario. El drenaje anormal hacia la aurícula derecha se identifica por un aumento de la oxigenación al nivel de la aurícula derecha, como ocurre con otros cortocircuitos de izquierda a derecha hacia la aurícula derecha. En TALV, la saturación de oxígeno en la aurícula derecha oscila entre el 80 y el 95%. Aproximadamente el mismo nivel de saturación en el ventrículo derecho, arteria pulmonar, aurícula izquierda, ventrículo izquierdo y arterias sistémicas. Con el drenaje anormal del retorno venoso pulmonar hacia la vena braquiocefálico izquierda o SVC, la sangre mixta fluye predominantemente hacia el ventrículo derecho y la sangre de la vena cava inferior deriva principalmente hacia la aurícula izquierda, por lo que la saturación de sangre en la arteria pulmonar puede ser mayor. que en las arterias sistémicas.
La presión en el ventrículo derecho y la arteria pulmonar varía desde niveles ligeramente elevados hasta niveles sistémicos. La presión en la aurícula derecha no refleja completamente la idoneidad de la comunicación interauricular. La presencia de presiones iguales en ambas aurículas no es un signo fiable de un defecto auricular no obstructivo. Este fenómeno se explica por la distensibilidad casi idéntica de los dos ventrículos, por lo que las presiones de llenado son casi iguales incluso con comunicación interauricular restrictiva. Gradiente de presión positiva tan bajo como 2 mmHg. Arte. o más pueden indicar un ASD pequeño, pero también pueden ocurrir con un informe más grande. La única forma fiable de estimar el tamaño del mensaje interauricular es medirlo con un catéter con balón.
La arteriografía pulmonar selectiva refina significativamente los resultados de la ecocardiografía. El paso del medio de contraste por las arterias pulmonares y su aparición en los canales venosos pulmonares da una idea clara de la anatomía del defecto. Con TALVV, se puede ver una vena vertical en la vena innominada izquierda, que se extiende desde el colector de la vena pulmonar y se conecta con la vena innominada izquierda. A continuación, puede rastrear el flujo del agente de contraste en el SVC.
Con drenaje anormal en el seno coronario, el agente de contraste se acumula en la vena pulmonar común y entra al seno coronario en la parte posterior del corazón. En la proyección anteroposterior, el seno coronario aparece como una formación ovoide en la parte media e inferior de la aurícula derecha. Los detalles anatómicos del seno coronario se definen mejor en la vista lateral.
Cuando las venas pulmonares drenan directamente en la aurícula derecha, las estructuras extracardíacas no se visualizan y el medio de contraste ingresa rápidamente a la aurícula derecha.
Si el catéter ingresa en una vena anormal, la saturación de sangre alcanza el 100%. Es útil realizar una angiografía selectiva, sin embargo, debe recordarse que el catéter puede obstruir sitios de obstrucción venosa pulmonar.
TALV con obstrucción de la vena pulmonar
La obstrucción venosa pulmonar siempre ocurre con TALV infracardial; en el 50% de los casos, con drenaje supracardíaco, con menos frecuencia, con drenaje en el seno coronario o en la aurícula derecha. Independientemente del sitio de la obstrucción, el cuadro clínico es similar. Los síntomas no suelen aparecer durante las primeras 12 horas de vida, lo que permite diferenciar este defecto del síndrome de dificultad respiratoria. Los síntomas de la TALV obstructiva incluyen disnea progresiva, dificultades para alimentarse e insuficiencia cardíaca.
Los niños mueren dentro de 2 días - 4 meses. vida. El drenaje infracardial se caracteriza por cianosis y disnea, que se agravan con el esfuerzo y la deglución debido al aumento de la presión intraabdominal o la compresión de la vena pulmonar común por el esófago, como se observa en la hernia esofágica.
A pesar de los síntomas graves, los signos cardiovasculares pueden ser mínimos. El corazón no está dilatado, el ventrículo derecho no está elevado. El segundo tono suele desdoblarse y se acentúa el componente pulmonar. No hay soplo cardíaco, o es suave, soplando sobre la arteria pulmonar. Los estertores húmedos generalmente se escuchan en las partes inferiores de los pulmones. Casi siempre se observa hepatomegalia, acompañada de edema periférico.
El ECG muestra signos de hipertrofia ventricular derecha. A diferencia de TALV sin obstrucción venosa, generalmente no hay signos de agrandamiento de la aurícula derecha.
Con signos clínicos de TALVV obstructivo, las venas pulmonares individuales, el colector de la vena pulmonar y su confluencia con las estructuras del lado derecho del corazón deben examinarse cuidadosamente para localizar el sitio de la constricción. Se caracteriza por una naturaleza monofásica, constante y de alta velocidad del flujo sanguíneo venoso.
El tamaño de la sombra del corazón es casi normal. El patrón pulmonar se realza y se caracteriza por sellos difusos en forma de abanico que irradian desde las raíces. Los bordes de la sombra del corazón son indistintos. Los signos radiológicos específicos de TALV con obstrucción están ausentes.
La detección de sangre altamente oxigenada en la vena cava superior o inferior es de gran importancia para el diagnóstico. Sin embargo, este hecho debe interpretarse con cautela, ya que, por un lado, debido a una disminución del flujo sanguíneo pulmonar, la saturación de sangre venosa pulmonar y sistémica mixta puede ser baja, por otro lado, en recién nacidos con TALV en el sistema venoso portal, la sangre de la vena umbilical está completamente oxigenada, lo que confirma el diagnóstico. La presión del ventrículo derecho suele ser igual o mayor que la presión sistémica. La presión auricular es normal, en contraste con la presión alta en la vasculatura arterial pulmonar.
El angiograma pulmonar es un método confiable para diagnosticar TALV en el sistema venoso portal con obstrucción venosa. Los sitios de obstrucción también se pueden encontrar en otros lugares de drenaje venoso pulmonar anormal. Dado el importante retraso en el paso del medio de contraste a través del lecho vascular pulmonar, este aparece en el sistema venoso pulmonar con un retraso de hasta 12 s tras su administración.
Si el catéter ingresa a un canal venoso anormal, puede pasar por el área del estrechamiento con la amenaza de una obstrucción importante o completa del flujo venoso, por lo que la inyección de agente de contraste debe realizarse de forma rápida y manual.
Diagnóstico diferencial
La TALV sin obstrucción debe diferenciarse de VSD grande, conducto arterioso, AOS, AVSD y ventrículo único sin estenosis pulmonar. A diferencia de TALVV, todas estas anomalías tienen signos radiográficos y electrocardiográficos de hipertrofia auricular y ventricular izquierda. Para TALVV, varios soplos cardíacos característicos de los defectos de comparación no son típicos.
En niños mayores y adultos se debe diferenciar con ASD, aurícula común y PALV. En el TALV suele haber al menos cianosis moderada, lo que no ocurre en individuos en la primera o segunda décadas de la vida con diversas malformaciones con un shunt arteriovenoso a nivel auricular.
El TALV con obstrucción debe diferenciarse de otras causas de obstrucción venosa pulmonar y del síndrome del corazón izquierdo hipoplásico, atresia de la válvula tricúspide, atresia pulmonar, coartación, TMA, síndrome de dificultad respiratoria y circulación fetal persistente. La cardiomegalia severa generalmente acompaña a la atresia valvular y la coartación aórtica y es un sello claro que no está presente en la TALV obstructiva. Un patrón vascular arterial intensificado es característico de la MAT y del síndrome del corazón izquierdo hipoplásico. La vascularización pulmonar debilitada es típica de la atresia pulmonar y tricuspídea. La obstrucción del retorno venoso pulmonar puede deberse a insuficiencia mitral o insuficiencia ventricular izquierda. Estas causas se diagnostican fácilmente sobre la base de signos clínicos característicos, en particular, hipertrofia y dilatación del ventrículo izquierdo. La ausencia de hipertrofia del ventrículo izquierdo es característica de la estenosis mitral, que también es la causa del deterioro del flujo de sangre desde los pulmones. La presencia de hipertrofia auricular izquierda indica que la constricción está cerca de la válvula mitral. Esto puede ser una estenosis mitral o un anillo estenosante supravalvular de la aurícula izquierda, en el que aumenta la presión en la aurícula izquierda.
En pacientes con hipertrofia del ventrículo derecho, la TALVV debe diferenciarse de la estenosis de las venas pulmonares individuales, del corazón triatrial y de la atresia de la vena pulmonar común. En todos estos casos, la presión en el lecho arterial de los pulmones aumenta y la presión en la aurícula izquierda es normal.
La identificación de defectos obstructivos se lleva a cabo mediante angiografía selectiva. Los criterios de diagnóstico importantes son la detección de una derivación derecha-izquierda, la duración del llenado de la aurícula izquierda.
EchoCG es especialmente informativo para diferenciar TALV de circulación fetal persistente, síndrome de dificultad respiratoria.
flujo natural
El pronóstico de TALV depende del tamaño de la comunicación interauricular, la presencia de obstrucción venosa pulmonar y la resistencia de la arteria pulmonar en niños que tienen la suerte de vivir varios años.
En una revisión de Keith et al, que incluyó TADP de todos los tipos, el 50 % de los niños con este diagnóstico morían a los 3 meses de edad y el 80 % al primer año. Los datos de Burroughs y Edwards son similares. Los pacientes con comunicación interauricular inadecuada tienen un pronóstico aún peor. El pronóstico es catastrófico en pacientes con obstrucción del canal venoso anormal. Suelen morir dentro de las primeras semanas de vida, el hijo mayor vivió 4,5 meses. Algunos pacientes sobreviven a la infancia debido al aumento de la resistencia arterial pulmonar. Este mecanismo adaptativo puede provocar al médico una intervención quirúrgica arriesgada. Los cambios pronunciados en la íntima de las arteriolas pulmonares se detectan desde los 8 meses de edad.