Opis tečne supstance. Tečno stanje. Strukture tekućina i amorfnih tijela su slične
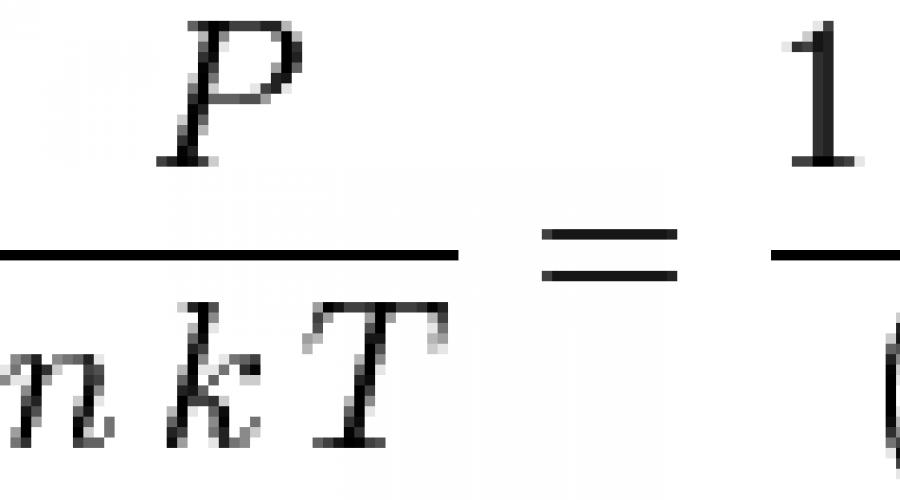
· Eulerova jednačina · Navier - Stokesova jednačina · Difuzijska jednačina · Hookeov zakon
Po pravilu, supstanca u tečnom stanju ima samo jednu modifikaciju. (Najvažniji izuzeci su kvantne tečnosti i tečni kristali.) Stoga, u većini slučajeva, tečnost nije samo agregatno stanje, već i termodinamička faza (tečna faza).
Sve tečnosti se obično dele na čiste tečnosti i smeše. Neke mješavine tekućina su od velikog značaja za život: krv, morska voda, itd. Tečnosti mogu funkcionirati kao rastvarači.
Fizička svojstva tečnosti
- Fluidnost
Glavno svojstvo tečnosti je tečnost. Ako se vanjska sila primjenjuje na dio tekućine koji je u ravnoteži, tada nastaje tok čestica tekućine u smjeru u kojem se primjenjuje ova sila: tečnost teče. Dakle, pod utjecajem neuravnoteženih vanjskih sila, tekućina ne zadržava svoj oblik i relativni raspored dijelova, te stoga poprima oblik posude u kojoj se nalazi.
Za razliku od plastičnih čvrstih materija, tečnost nema tačku tečenja: dovoljno je primeniti proizvoljno malu spoljnu silu da bi tečnost mogla da teče.
- Očuvanje zapremine
Jedno od karakterističnih svojstava tečnosti je da ima određenu zapreminu (pod stalnim spoljnim uslovima). Tečnost je izuzetno teško mehanički komprimirati jer, za razliku od plina, između molekula ima vrlo malo slobodnog prostora. Pritisak koji se vrši na tečnost zatvorenu u posudi prenosi se bez promene na svaku tačku zapremine te tečnosti (Paskalov zakon važi i za gasove). Ova karakteristika, zajedno sa vrlo niskom kompresibilnošću, koristi se u hidrauličnim mašinama.
Tečnosti generalno povećavaju zapreminu (šire se) kada se zagreju i smanjuju zapreminu (skupljaju) kada se ohlade. Međutim, postoje izuzeci, na primjer, voda se skuplja kada se zagrije, pri normalnom pritisku i temperaturi od 0°C do približno 4°C.
- Viskoznost
Pored toga, tečnosti (poput gasova) karakteriše viskoznost. Definiše se kao sposobnost odupiranja kretanju jednog dijela u odnosu na drugi – odnosno unutrašnjem trenju.
Kada se susjedni slojevi tekućine pomiču jedan u odnosu na drugi, neizbježno dolazi do sudara molekula pored onih uzrokovanih toplinskim kretanjem. Pojavljuju se sile koje koče pravilno kretanje. U ovom slučaju kinetička energija uređenog kretanja pretvara se u toplinsku energiju - energiju kaotičnog kretanja molekula.
Tečnost u posudi, pokrenuta i prepuštena sama sebi, postepeno će prestati, ali će se njena temperatura povećati.
- Slobodno formiranje površine i površinski napon
Zbog očuvanja zapremine, tečnost može da formira slobodnu površinu. Takva površina je međufaza između faza date supstance: s jedne strane je tečna faza, s druge je plinovita faza (para) i, eventualno, drugi plinovi, na primjer, zrak.
Ako tekuća i gasovita faza iste supstance dođu u kontakt, nastaju sile koje teže smanjenju površine interfejsa – sile površinskog napona. Interfejs se ponaša kao elastična membrana koja ima tendenciju kontrakcije.
Površinska napetost se može objasniti privlačenjem između tekućih molekula. Svaki molekul privlači druge molekule i teži da se “okruži” njima, što znači da napusti površinu. Shodno tome, površina ima tendenciju smanjenja.
Stoga, mjehurići sapuna i mjehurići imaju tendenciju da poprime sferni oblik prilikom ključanja: za datu zapreminu, sfera ima minimalnu površinu. Ako na tekućinu djeluju samo sile površinskog napona, ona će nužno poprimiti sferni oblik - na primjer, voda pada u nultu gravitaciju.
Mali objekti gustoće veće od gustoće tečnosti mogu da „lebde” na površini tečnosti, jer je sila gravitacije manja od sile koja sprečava povećanje površine. (Pogledajte Površinski napon.)
- Isparavanje i kondenzacija
- Difuzija
Kada se u posudi nalaze dvije pomiješane tekućine, molekuli, kao rezultat termičkog kretanja, počinju postupno prolaziti kroz međupovršinu, te se tako tečnosti postepeno miješaju. Ova pojava se naziva difuzija (javlja se iu supstancama u drugim agregacijskim stanjima).
- Pregrijavanje i hipotermija
Tečnost se može zagrejati iznad tačke ključanja tako da ne dođe do ključanja. To zahtijeva ravnomjerno zagrijavanje, bez značajnih promjena temperature unutar zapremine i bez mehaničkih utjecaja kao što su vibracije. Ako nešto bacite u pregrijanu tečnost, odmah će proključati. Pregrijana voda se lako dobija u mikrotalasnoj pećnici.
Superhlađenje je hlađenje tečnosti ispod tačke smrzavanja bez prelaska u čvrsto agregatno stanje. Kao i kod pregrijavanja, superhlađenje zahtijeva odsustvo vibracija i značajne promjene temperature.
- Talasi gustine
Iako je tečnost izuzetno teško sabiti, njen volumen i gustina se i dalje mijenjaju kada se pritisak promijeni. Ovo se ne dešava odmah; Dakle, ako je jedno područje komprimirano, onda se takva kompresija prenosi na druga područja sa zakašnjenjem. To znači da su elastični talasi, tačnije talasi gustine, sposobni da se šire unutar tečnosti. Zajedno sa gustinom, mijenjaju se i druge fizičke veličine, poput temperature.
Ako se gustoća lagano mijenja kako se val širi, takav val se naziva zvučni val ili zvuk.
Ako se gustoća promijeni dovoljno snažno, tada se takav val naziva udarni val. Udarni val je opisan drugim jednadžbama.
Valovi gustoće u tekućini su uzdužni, odnosno gustoća se mijenja duž smjera prostiranja vala. U tečnosti nema poprečnih elastičnih talasa zbog neočuvanja oblika.
Elastični valovi u tekućini s vremenom blijede, njihova energija se postepeno pretvara u toplinsku energiju. Razlozi slabljenja su viskoznost, „klasična apsorpcija“, molekularna relaksacija i drugi. U ovom slučaju radi takozvani drugi, odnosno volumetrijski viskozitet - unutrašnje trenje kada se gustoća mijenja. Udarni val, kao rezultat slabljenja, nakon nekog vremena prelazi u zvučni val.
Elastični talasi u tečnosti takođe su podložni rasejanju nehomogenostima koje su rezultat haotičnog toplotnog kretanja molekula.
- Talasi na površini
Ako pomjerite dio površine tekućine iz ravnotežnog položaja, tada se pod djelovanjem sila vraćanja površina počinje vraćati u ravnotežni položaj. Ovo kretanje, međutim, ne prestaje, već prelazi u oscilatorno kretanje blizu ravnotežnog položaja i širi se na druga područja. Ovako se pojavljuju valovi na površini tekućine.
Ako je obnavljajuća sila prvenstveno gravitacija, onda se takvi valovi nazivaju gravitacijskim valovima (ne brkati ih sa gravitacijskim valovima). Gravitacioni talasi na vodi mogu se videti svuda.
Ako je povratna sila pretežno sila površinske napetosti, tada se takvi valovi nazivaju kapilarni.
Ako su ove sile uporedive, takvi valovi se nazivaju kapilarno-gravitacijskim valovima.
Talasi na površini tečnosti opadaju pod uticajem viskoznosti i drugih faktora.
- Suživot sa drugim fazama
Formalno gledano, za ravnotežnu koegzistenciju tečne faze sa drugim fazama iste supstance - gasovitim ili kristalnim - potrebni su strogo definisani uslovi. Dakle, pri datom pritisku potrebna je strogo određena temperatura. Međutim, u prirodi i tehnologiji svuda, tečnost koegzistira sa parom, ili i sa čvrstim agregatnim stanjem - na primer, voda sa parom i često sa ledom (ako paru posmatramo kao zasebnu fazu koja je prisutna zajedno sa vazduhom). To je zbog sljedećih razloga.
Neravnotežno stanje. Potrebno je vrijeme da tekućina ispari; dok tekućina potpuno ne ispari, ona koegzistira s parom. U prirodi voda neprestano isparava, kao i obrnuti proces - kondenzacija.
Zatvoreni volumen. Tečnost u zatvorenoj posudi počinje da isparava, ali pošto je zapremina ograničena, pritisak pare raste, postaje zasićen i pre nego što je tečnost potpuno isparila, ako je njena količina bila dovoljno velika. Kada se dostigne stanje zasićenja, količina isparene tečnosti jednaka je količini kondenzovane tečnosti, sistem dolazi u ravnotežu. Tako se u ograničenoj zapremini mogu uspostaviti uslovi neophodni za ravnotežnu koegzistenciju tečnosti i pare.
Prisustvo atmosfere u uslovima Zemljine gravitacije. Na tečnost utiče atmosferski pritisak (vazduh i para), dok se kod pare mora uzeti u obzir skoro samo njen parcijalni pritisak. Dakle, tečnost i para iznad njene površine odgovaraju različitim tačkama na faznom dijagramu, u oblasti postojanja tečne faze, odnosno u oblasti postojanja gasovite faze. Ovo ne poništava isparavanje, ali isparavanje zahtijeva vrijeme tokom kojeg obje faze koegzistiraju. Bez ovog uslova, tečnosti bi ključale i isparile vrlo brzo.
Teorija
Mehanika
Odjeljak mehanike posvećen je proučavanju kretanja i mehaničke ravnoteže tekućina i plinova i njihove međusobne interakcije i čvrstih tijela - hidroaeromehanika (koja se često naziva i hidrodinamika). Aeromehanika fluida je dio općenitije grane mehanike, mehanike kontinuuma.
Mehanika fluida je grana hidroaeromehanike koja se bavi nestišljivim fluidima. Budući da je kompresibilnost tekućina vrlo mala, u mnogim slučajevima se može zanemariti. Dinamika plina je posvećena proučavanju kompresibilnih tekućina i plinova.
Mehanika fluida se deli na hidrostatiku, koja proučava ravnotežu nestišljivih fluida, i hidrodinamiku (u užem smislu), koja proučava njihovo kretanje.
U magnetohidrodinamici se proučava kretanje elektroprovodljivih i magnetnih fluida. Hidraulika se koristi za rješavanje primijenjenih problema.
Osnovni zakon hidrostatike je Pascalov zakon.
2. Tečnosti iz dvoatomskih molekula koje se sastoje od identičnih atoma (tečni vodonik, tečni azot). Takvi molekuli imaju kvadrupolni moment.
4. Tečnosti koje se sastoje od polarnih molekula povezanih dipol-dipol interakcijom (tečni vodonik bromid).
5. Povezane tečnosti, ili tečnosti sa vodoničnim vezom (voda, glicerin).
6. Tečnosti koje se sastoje od velikih molekula za koje su važni unutrašnji stepeni slobode.
Tečnosti prve dve grupe (ponekad tri) obično se nazivaju jednostavnim. Jednostavne tečnosti su proučavane bolje od drugih; voda je najbolje proučavana od složenih tečnosti. Ova klasifikacija ne uključuje kvantne tečnosti i tečne kristale, koji su posebni slučajevi i moraju se razmatrati odvojeno.
Statistička teorija
Struktura i termodinamička svojstva tekućina najuspješnije se proučavaju pomoću Percus-Yevikove jednačine.
Ako koristimo model tvrde kugle, odnosno smatramo da su tečni molekuli kuglice prečnika d, onda se Percus-Yevick jednačina može analitički riješiti i dobiti jednačina stanja tekućine:
![]() Gdje n- broj čestica po jedinici zapremine,
Gdje n- broj čestica po jedinici zapremine, ![]() - bezdimenzionalna gustina. Pri malim gustoćama, ova jednačina se pretvara u jednadžbu stanja idealnog plina:
- bezdimenzionalna gustina. Pri malim gustoćama, ova jednačina se pretvara u jednadžbu stanja idealnog plina: ![]() . Za ekstremno velike gustine, , dobija se jednadžba stanja nestišljivog fluida: .
. Za ekstremno velike gustine, , dobija se jednadžba stanja nestišljivog fluida: .
Model čvrste kugle ne uzima u obzir privlačnost između molekula, tako da nema oštrog prijelaza između tekućine i plina kada se vanjski uvjeti promijene.
Ako su potrebni precizniji rezultati, onda se najbolji opis strukture i svojstava tečnosti postiže upotrebom teorije perturbacije. U ovom slučaju, model tvrde lopte se smatra nultom aproksimacijom, a privlačne sile između molekula smatraju se poremećajem i daju korekcije.
Teorija klastera
Jedna od modernih teorija je "teorija klastera". Zasniva se na ideji da se tečnost predstavlja kao kombinacija čvrste supstance i gasa. U ovom slučaju, čestice čvrste faze (kristali koji se kreću na kratkim udaljenostima) nalaze se u oblaku gasa, formirajući klaster struktura. Energija čestice odgovara Boltzmannovoj raspodjeli, dok prosječna energija sistema ostaje konstantna (pod uvjetom da je izoliran). Spore čestice sudaraju se s klasterima i postaju dio njih. Dakle, konfiguracija klastera se kontinuirano mijenja, sistem je u stanju dinamičke ravnoteže. Kada se stvori vanjski utjecaj, sistem će se ponašati prema Le Chatelierovom principu. Dakle, lako je objasniti faznu transformaciju:
- Kada se zagreje, sistem će se postepeno pretvarati u gas (ključanje)
- Kada se ohladi, sistem će se postepeno pretvoriti u čvrst (zamrznuti).
Eksperimentalne metode istraživanja
Struktura tekućina proučava se metodama rendgenske strukturne analize, difrakcije elektrona i neutronske difrakcije.
vidi takođe
- Karakteristike površinskog sloja tečnosti
Linkovi
| Termodinamička stanja materije | |
|---|---|
| Fizika: solidna Tečnost Gas Plasma | |
- Čvrsto stanje
- Tečno stanje
- Gasovito stanje
- Promjena stanja materije
Studije hemije su važne. Šta je "supstanca"? Materija je sve što ima masu i zapreminu. Supstanca može biti u jednom od tri agregatna stanja: čvrsta, tečna, gasovita.
1. Čvrsto stanje
Čestice (molekule) u čvrstom stanju se kombinuju u krutu strukturu koja se ponavlja - kristalna rešetka. Čestice u kristalnoj rešetki prolaze kroz male vibracije oko centara ravnoteže. Čvrsto ima formu I volumen.
2. Tečno stanje
Za razliku od čvrstih materija, tečnosti nemaju specifičan oblik, ali imaju zapreminu. To se objašnjava činjenicom da su u tekućinama čestice na većoj udaljenosti jedna od druge nego u čvrstim tvarima i aktivnije se kreću.
Budući da su čestice u tečnostima locirane manje gusto nego u čvrstim materijama, ne mogu formirati kristalnu rešetku, stoga tečnosti nemaju specifičan oblik.
3. Gasovito stanje
U plinovima se čestice nalaze na čak većim udaljenostima nego u tekućinama. Štaviše, čestice su stalno u haotičnom (neurednom) kretanju. Prema tome, gasovi imaju tendenciju da jednoliko popune zapreminu koja im je data (otuda i činjenica da gasovi nemaju specifičan oblik).
4. Promjena stanja materije
Uzmimo trivijalni primjer i pratimo proces promjene stanja vode.
U svom čvrstom stanju, voda je led. Temperatura leda je manja od 0 o C. Kada se zagrije, led počinje da se topi i pretvara u vodu. To se objašnjava činjenicom da se čestice leda koje se nalaze u kristalnoj rešetki počinju kretati kada se zagrijavaju, zbog čega se rešetka uništava. Temperatura na kojoj se supstanca topi naziva se "tačka topljenja" supstance. Tačka topljenja vode je 0 o C.
Treba napomenuti da dok se led potpuno ne otopi, temperatura leda će biti 0 o C.
| Tokom faznih promjena tvari, temperatura ostaje konstantna |
Nakon što se led potpuno pretvori u vodu, nastavljamo sa grijanjem. Temperatura vode će rasti, a kretanje čestica pod utjecajem topline će se sve više ubrzavati. To se dešava sve dok voda ne dostigne svoju sljedeću tačku promjene stanja - ključanje.
Ovaj trenutak nastaje kada se veze čestica vode potpuno pokidaju i njihovo kretanje postaje slobodno: voda se pretvara u paru.
| Proces prelaska supstance iz tečnog u gasovito stanje naziva se ključanje |
Temperatura na kojoj tečnost ključa se naziva "tačka ključanja".
Imajte na umu da tačka ključanja zavisi od pritiska. Pri normalnom pritisku (760 mm Hg), tačka ključanja vode je 100 o C.
Po analogiji s topljenjem: dok se voda potpuno ne pretvori u paru, temperatura će ostati konstantna.
Sažmite. Kao rezultat zagrijavanja dobili smo različita fazna stanja vode:
Led → voda → para ili N 2 0 (t) → N 2 0 (g) → N 2 0 (g)
Šta će se dogoditi ako počnemo hladiti vodenu paru? Ne morate biti „najbolji učenik“ da biste pogodili da će se dogoditi obrnuti proces faznih promjena u vodi:
Para → voda → led
Postoje neke supstance koje prelaze iz čvrstog stanja direktno u gasovito stanje, zaobilazeći tečnu fazu. Ovaj proces se zove sublimacija ili sublimacija. Ovako se ponaša, na primjer, “suhi led” (dušik dioksid CO 2). Kada se zagrije, nećete vidjeti ni kap vode - "suhi led" će izgledati kao da ispari pred vašim očima.
Obrnuti proces sublimacije (prelazak tvari iz plinovitog u čvrsto stanje) naziva se desublimacija.
Tečnosti zauzimaju srednju poziciju između gasovitih i čvrstih materija. Na temperaturama blizu tačkama ključanja, svojstva tečnosti se približavaju svojstvima gasova; na temperaturama blizu tačke topljenja, svojstva tečnosti se približavaju svojstvima čvrstih materija. Ako čvrste tvari karakterizira strogi poredak čestica, koji se proteže na udaljenosti do stotina tisuća interatomskih ili intermolekularnih radijusa, tada u tekućoj tvari obično nema više od nekoliko desetina uređenih čestica - to se objašnjava činjenicom brzo nastaje i taj red između čestica na različitim mestima tečne supstance, koja se ponovo „erodira“ termičkom vibracijom čestica. Istovremeno, ukupna gustoća pakiranja čestica tekuće tvari se malo razlikuje od čvrste tvari - stoga je njihova gustoća bliska gustoći čvrstih tvari, a njihova kompresibilnost je vrlo niska. Na primjer, za smanjenje zapremine vode u tekućem stanju za 1%, potreban je pritisak od ~200 atm, dok je za isto smanjenje zapremine gasova potreban pritisak od oko 0,01 atm. Posljedično, kompresibilnost tekućina je približno 200:0,01 = 20.000 puta manja od kompresibilnosti plinova.
Gore je navedeno da tečnosti imaju određenu zapreminu i poprimaju oblik posude u kojoj se nalaze; ova svojstva su mnogo bliža svojstvima čvrste nego gasovite supstance. Neposrednu blizinu tekućeg i čvrstog stanja potvrđuju i podaci o standardnim entalpijama isparavanja ∆H° eva i standardnim entalpijama topljenja ∆H° pl. Standardna entalpija isparavanja je količina topline potrebna da se 1 mol tekućine pretvori u paru na 1 atm (101,3 kPa). Ista količina toplote se oslobađa kada se 1 mol pare kondenzuje u tečnost na 1 atm. Količina topline koja se troši da se 1 mol čvrste tvari pretvori u tekućinu pri 1 atm naziva se standardna entalpija fuzije(ista količina toplote se oslobađa kada se 1 mol tečnosti „zamrzne“ („stvrdne“) na 1 atm). Poznato je da je ∆N° pl mnogo manji od odgovarajućih vrijednosti ∆N° isp, što je lako razumjeti, budući da je prijelaz iz čvrstog u tekuće stanje praćen manjim poremećajem međumolekularne privlačnosti nego prijelaz iz tečnog u gasovito stanje.
Brojna druga važna svojstva tekućina sličnija su svojstvima plinova. Dakle, kao i gasovi, tečnosti mogu teći - ovo svojstvo se naziva fluidnost. Otpor protoku određuje viskozitet. Na fluidnost i viskoznost utiču sile privlačenja između molekula tečnosti, njihova relativna molekulska težina i niz drugih faktora. Viskoznost tečnosti je ~100 puta veća od viskoznosti gasova. Baš kao i gasovi, tečnosti mogu da difunduju, iako mnogo sporije, jer su čestice tečnosti upakovane mnogo gušće od čestica gasa.
Jedno od najvažnijih svojstava tečnosti je njena površinski napon(ovo svojstvo nije svojstveno ni gasovima ni čvrstim materijama). Na molekul u tekućini jednoliko djeluju intermolekularne sile sa svih strana. Međutim, na površini tečnosti ravnoteža ovih sila je poremećena, pa se kao rezultat toga „površinski“ molekuli nađu pod uticajem određene rezultantne sile usmerene u tečnost. Iz tog razloga, površina tečnosti je u stanju napetosti. Površinski napon- ovo je minimalna sila koja sputava kretanje čestica tečnosti u dubinu tečnosti i na taj način sprečava da se površina tečnosti skuplja. Površinska napetost objašnjava „kapljasti” oblik čestica tečnosti koje slobodno padaju.
U tekućem stanju razmak između čestica je mnogo manji nego u plinovitom stanju. Čestice zauzimaju najveći dio volumena, neprestano se međusobno dodiruju i privlače. Uočeno je određeno sređivanje čestica (poredak kratkog dometa). Čestice su pokretljive jedna u odnosu na drugu.
U tekućinama, van der Waalsove interakcije nastaju između čestica: disperzija, orijentacija i indukcija. Male grupe čestica koje su ujedinjene određenim silama nazivaju se klasteri. U slučaju identičnih čestica nazivaju se klasteri u tečnosti saradnici
U tečnostima, formiranje vodoničnih veza povećava redosled čestica. Međutim, vodonične veze i van der Waalsove sile su krhke - molekule u tekućem stanju su u kontinuiranom haotičnom kretanju, što se naziva Brownovo kretanje.
Za tečno stanje vrijedi Maxwell-Boltzmannova raspodjela molekula po brzini i energiji.
Teorija tečnosti je mnogo manje razvijena od teorije gasova, jer svojstva tečnosti zavise od geometrije i polariteta međusobno blisko lociranih molekula. Osim toga, nedostatak specifične strukture tečnosti otežava njihov formalni opis – u većini udžbenika tečnostima je posvećeno mnogo manje prostora nego gasovima i kristalnim čvrstim materijama.
Ne postoji oštra granica između tekućina i plinova - potpuno nestaje kritične tačke. Za svaki gas postoji poznata temperatura iznad koje ne može biti tečnost ni pri jednom pritisku; s ovim kritičan temperature, granica (meniskus) između tečnosti i njene zasićene pare nestaje. Postojanje kritične temperature („apsolutne tačke ključanja“) utvrdio je D. I. Mendeljejev 1860.
Tabela 7.2 - Kritični parametri (t k, p k, V k) nekih supstanci
| Supstanca | t k, o C | p k, atm | Vc, cm 3 /mol | t rastopiti o C | t kip o C |
| On | -267,9 | 2,26 | 57,8 | -271,4 | -268,94 |
| H 2 | -239,9 | 12,8 | 65,0 | -259,2 | -252,77 |
| N 2 2 | -147,0 | 33,54 | 90,1 | -210,01 | -195,82 |
| O 2 2 | -118,4 | 50,1 | -218,76 | -182,97 | |
| CH 4 | -82,1 | 45,8 | 99,0 | -182,49 | -161,58 |
| CO2 | +31,0 | 72,9 | 94,0 | -56,16 | -78.48(sub) |
| NH 3 | 132,3 | 111,3 | 72,5 | -77,76 | -33,43 |
| Cl2 | 144,0 | 76,1 | -101,0 | -34,06 | |
| SO 2 | 157,5 | 77,8 | -75,48 | -10,02 | |
| H2O | 374,2 | 218,1 | 0,0 | 100,0 |
Pritisak zasićene pare– parcijalni pritisak pri kojem su brzine isparavanja i kondenzacije pare jednake:
gdje su A i B konstante.
Temperatura ključanja– temperatura na kojoj je pritisak zasićene pare tečnosti jednak atmosferskom pritisku.
Tečnosti imaju fluidnost– sposobnost kretanja pod uticajem malih sila smicanja; tečnost zauzima zapreminu u koju je smeštena.
Otpor fluida na fluidnost naziva se viskozitet,[Pa. With].
Površinski napon[J/m 2 ] – rad potreban za stvaranje jedinice površine.
Stanje tečnog kristala– supstance u tečnom stanju, koje imaju visok stepen uređenosti, zauzimaju međupoložaj između kristala i tečnosti. Imaju fluidnost, ali u isto vrijeme imaju dalekosežni poredak. Na primjer, derivati smeđe kiseline, azolitini i steroidi.
Temperatura čišćenja– temperatura na kojoj tečni kristali (LC) prelaze u normalno tečno stanje.
7.5 Čvrste materije
U čvrstom stanju, čestice se toliko približavaju jedna drugoj da između njih nastaju jake veze, nema translacionog kretanja i ostaju vibracije oko njihovog položaja. Čvrste tvari mogu biti u amorfnom ili kristalnom stanju.
7.5.1 Supstance u amorfnom stanju
U amorfnom stanju, supstance nemaju uređenu strukturu.
staklast stanje - čvrsto amorfno stanje supstance koje se dobija kao rezultat dubokog prehlađenja tečnosti. Ovo stanje nije u ravnoteži, ali naočare mogu postojati dugo vremena. Omekšavanje stakla događa se u određenom temperaturnom rasponu - rasponu staklastog prijelaza, čije granice zavise od brzine hlađenja. Sa povećanjem brzine hlađenja tečnosti ili pare, povećava se vjerovatnoća dobivanja ove tvari u staklastom stanju.
Krajem 60-ih godina 20. stoljeća dobijeni su amorfni metali (metalna stakla) - za to je bilo potrebno rastopljeni metal ohladiti brzinom od 10 6 - 10 8 stepeni/s. Većina amorfnih metala i legura kristalizira kada se zagrije iznad 300 o C. Jedna od najvažnijih primjena je mikroelektronika (difuzijske barijere na sučelju metal-poluvodič) i uređaji za magnetno skladištenje (LCD glave). Ovo posljednje je zbog svoje jedinstvene magnetske mekoće (magnetna anizotropija je dva reda veličine manja nego kod konvencionalnih legura).
Amorfne supstance izotropna, tj. imaju ista svojstva u svim smjerovima.
7.5.2 Supstance u kristalnom stanju
Čvrsta kristalna supstance imaju uređenu strukturu sa elementima koji se ponavljaju, što im omogućava da se proučavaju difrakcijom rendgenskih zraka (metoda difrakcije rendgenskih zraka, koja se koristi od 1912. godine).
Monokristale (pojedinačna jedinjenja) karakterizira anizotropija - ovisnost svojstava o smjeru u prostoru.
Pravilan raspored čestica u čvrstom stanju je prikazan kao kristalna rešetka. Kristalne tvari se tope na određenoj temperaturi, tzv tačka topljenja.
Kristale karakterizira energija, konstanta rešetke i koordinacijski broj.
Permanentna mreža karakterizira udaljenost između centara čestica koje zauzimaju čvorove u kristalu u smjeru karakterističnih osa.
Koordinacioni broj obično se naziva brojem čestica koje su direktno uz datu česticu u kristalu (vidi sliku 7.2 - koordinacijski broj osam za cezijum i klor)
Energija kristalne rešetke je energija potrebna za uništavanje jednog mola kristala i uklanjanje čestica izvan granica njihove interakcije.

Slika 7.2 - Struktura kristala cezijum hlorida CsCl (a) i kubične jedinične ćelije u centru tela ovog kristala (b)
7.5.3 Kristalne strukture
Najmanja strukturna jedinica kristala, koja izražava sva svojstva njegove simetrije, je elementarna ćelija. Kada se ćelije ponavljaju mnogo puta u tri dimenzije, dobija se kristalna rešetka.
Postoji sedam osnovnih ćelija: kubne, tetraedarske, heksagonalne, romboedarske, orto-romboedarske, monokliničke i trikliničke. Postoji sedam derivata osnovnih jediničnih ćelija, na primjer, centar u tijelu, kubični centar sa licem.

a - jedinična ćelija kristala NaCl; b - gusto lice-centrirano kubno pakovanje NaCl; c - kubično pakovanje CsCl kristala u centru tijela Slika Slika 7.3 - Jedinična ćelija
Izomorfne supstance– supstance slične hemijske prirode koje formiraju identične kristalne strukture: CaSiO 4 i MgSiO 4
Polimorfizam– spojevi koji postoje u dvije ili više kristalnih struktura, na primjer SiO 2 (u obliku heksagonalnog kvarca, ortorombičnog tridimita i kubnog kristobalita).
Alotropske modifikacije– polimorfne modifikacije jednostavnih supstanci, na primjer, ugljika: dijamant, grafit, karbin, fuleren.
Na osnovu prirode čestica u čvorovima kristalne rešetke i hemijskih veza između njih, kristali se dijele na:
1) molekularni– čvorovi sadrže molekule između kojih djeluju niskoenergetske van der Waalsove sile: kristale leda;
2) atomski– kovalentni kristali– u čvorovima kristala nalaze se atomi koji formiraju jake kovalentne veze jedni s drugima i imaju visoku energiju rešetke, na primjer, dijamant (ugljik);
3) jonski kristali– strukturne jedinice kristala ovog tipa su pozitivno i negativno nabijeni ioni, između kojih dolazi do električne interakcije, karakterizirane prilično visokom energijom, na primjer NaCL, KCL;
4) metalni kristali– supstance koje imaju visoku električnu provodljivost, toplotnu provodljivost, savitljivost, duktilnost, metalni odsjaj i visoku refleksivnost u odnosu na svetlost; veza u kristalima je metalna, energija metalne veze je srednja između energija kovalentnih i molekularnih kristala;
5) kristali mješovite veze– postoje složene interakcije između čestica koje se mogu opisati superpozicijom dvije ili više vrsta veza jedna na drugu, na primjer klatrati (uključeni spojevi) – formirani uključivanjem molekula (gostiju) u šupljine kristalnog okvira koji se sastoji čestica drugog tipa (domaćini): gasni klatrati CH 4 . 6H 2 O, urea klatrati.
U prirodi se voda nalazi u tri stanja:
- čvrsto stanje (snijeg, grad, led);
- tečno stanje (voda, magla, rosa i kiša);
- gasovitom stanju (para).
Od ranog djetinjstva, pa i u školi, proučavaju različita fizička stanja vode: magla, kiša, grad, snijeg, led itd. Postoji jedan koji se detaljno proučava u školi. Oni nas susreću svaki dan u životu i utiču na naš život. – ovo je stanje vode na određenoj temperaturi i pritisku, koje se karakteriše u određenom intervalu.
Treba razjasniti osnovne pojmove o stanju vode da se stanje magle i oblačno stanje ne odnose na stvaranje gasa. Pojavljuju se tokom kondenzacije. Ovo je jedinstveno svojstvo vode koje može biti u tri različita agregatna stanja. Tri stanja vode su od vitalnog značaja za planetu, formiraju hidrološki ciklus i osiguravaju proces kruženja vode u prirodi. U školi pokazuju razne eksperimente isparavanja i. U svakom kutku prirode voda se smatra izvorom života. Postoji i četvrto stanje, ne manje važno - voda Deryagin (ruska verzija), ili kako se u ovom trenutku obično naziva - voda Nanotube (američka verzija).
Čvrsto stanje vode
Oblik i volumen su očuvani. Na niskim temperaturama tvar se smrzava i pretvara u čvrstu supstancu. Ako je pritisak visok, tada je potrebna viša temperatura očvršćavanja. Čvrsta materija može biti kristalna ili amorfna. U kristalu je položaj atoma strogo uređen. Oblici kristala su prirodni i podsjećaju na poliedar. U amorfnom tijelu tačke su locirane haotično i osciliraju; u njima se održava samo kratkoročni red.
Tečno stanje vode
U tečnom stanju voda zadržava svoj volumen, ali se ne zadržava oblik. Pod ovim podrazumijevamo da tekućina zauzima samo dio volumena i može teći po cijeloj površini. Kada u školi proučavate tečno stanje, treba da shvatite da je ovo srednje stanje između čvrstog i gasovitog medija. Tečnosti se dele na čista i mešana stanja. Neke mješavine su vrlo važne za život, poput krvi ili morske vode. Tečnosti mogu da deluju kao rastvarači.
Stanje plina
Oblik i volumen nisu sačuvani. Na drugi način, gasovito stanje, koje se proučava u školi, naziva se vodena para. Eksperimenti jasno pokazuju da je para nevidljiva, rastvorljiva je u vazduhu i pokazuje relativnu vlažnost. Rastvorljivost zavisi od temperature i pritiska. Zasićena para i tačka rose indikatori su maksimalne koncentracije. Para i magla su različita agregatna stanja.
Četvrto stanje agregacije je plazma
Proučavanje plazme i moderni eksperimenti počeli su se razmatrati nešto kasnije. Plazma je potpuno ili djelomično jonizirani plin; javlja se u stanju ravnoteže na visokoj temperaturi. U prizemnim uslovima nastaje gasno pražnjenje. Svojstva plazme određuju njeno plinovito stanje, osim što u svemu tome veliku ulogu igra elektrodinamika. Među agregatnim stanjima, plazma je najčešća u Univerzumu. Proučavanje zvijezda i međuplanetarnog prostora pokazalo je da su tvari u stanju plazme.
Kako se mijenjaju stanja agregacije?
Promjena procesa tranzicije iz jednog stanja u drugo:
- tečnost - para (isparavanje i ključanje);
- para - tečnost (kondenzacija);
- tečnost - led (kristalizacija);
- led - tečnost (topi se);
- led - para (sublimacija);
- para - led, formiranje mraza (desublimacija).
 Voda se naziva zanimljivim prirodnim mineralom zemlje. Ova pitanja su složena i zahtijevaju stalno proučavanje. Fizičko stanje u školi potvrđeno je provedenim eksperimentima, a ako se pojave pitanja, eksperimenti jasno omogućavaju razumijevanje gradiva koji se uči na lekciji. Prilikom isparavanja, tečnost se pretvara u, proces može početi od nula stepeni. Kako temperatura raste, ona se povećava. Intenzitet ovoga potvrđuju eksperimenti ključanja na 100 stepeni. Na pitanja isparavanja se odgovara isparavanjem sa površina jezera, rijeka, pa čak i sa kopna. Kada se ohladi, dolazi do procesa obrnute transformacije kada se tečnost formira iz gasa. Ovaj proces se naziva kondenzacija, kada se male kapljice oblaka formiraju iz vodene pare u zraku.
Voda se naziva zanimljivim prirodnim mineralom zemlje. Ova pitanja su složena i zahtijevaju stalno proučavanje. Fizičko stanje u školi potvrđeno je provedenim eksperimentima, a ako se pojave pitanja, eksperimenti jasno omogućavaju razumijevanje gradiva koji se uči na lekciji. Prilikom isparavanja, tečnost se pretvara u, proces može početi od nula stepeni. Kako temperatura raste, ona se povećava. Intenzitet ovoga potvrđuju eksperimenti ključanja na 100 stepeni. Na pitanja isparavanja se odgovara isparavanjem sa površina jezera, rijeka, pa čak i sa kopna. Kada se ohladi, dolazi do procesa obrnute transformacije kada se tečnost formira iz gasa. Ovaj proces se naziva kondenzacija, kada se male kapljice oblaka formiraju iz vodene pare u zraku.
Upečatljiv primjer je živin termometar, u kojem je živa predstavljena u tekućem stanju; na temperaturi od -39 stepeni, živa postaje čvrsta. Moguće je promijeniti stanje čvrstog tijela, ali to će zahtijevati dodatni napor, na primjer pri savijanju nokta. Školarci često postavljaju pitanja o tome kako se daje oblik čvrstom tijelu. To se radi u fabrikama i specijalizovanim radionicama uz upotrebu posebne opreme. Apsolutno svaka supstanca može postojati u tri stanja, uključujući vodu, zavisi od fizičkih uslova. Kada voda prelazi iz jednog stanja u drugo, molekularni raspored i kretanje se mijenjaju, ali se sastav molekula ne mijenja. Eksperimentalni zadaci će vam pomoći da uočite takva zanimljiva stanja.