Ko je predložio planetarni model atoma. Ko je predložio nuklearni model strukture atoma? Nuklearni model strukture atoma i njegov dijagram
Predložen je jedan od prvih modela strukture atoma J. Thomson 1904. godine, Atom je zamišljen kao "more pozitivnog elektriciteta" sa elektronima koji osciliraju u njemu. Ukupni negativni naboj elektrona električno neutralnog atoma bio je jednak njegovom ukupnom pozitivnom naboju.
Rutherfordovo iskustvo
Za testiranje Thomsonove hipoteze i više precizna definicija atomska struktura E. Rutherford organizovao seriju eksperimenata o rasejanju α -čestice sa tankim metalnim pločama - folija. 1910. studenti Rutherforda Hans Geiger I Ernest Marsden sprovodili eksperimente bombardovanja α - fine čestice metalne ploče. Najviše su to otkrili α -čestice prolaze kroz foliju bez promjene putanje. I to nije bilo iznenađujuće ako prihvatimo ispravnost Thomsonovog modela atoma.
Izvor α - zračenje je stavljeno u olovnu kocku sa kanalom izbušenim u njoj, tako da je bilo moguće dobiti fluks α -čestice koje lete u određenom pravcu. Alfa čestice su dvostruko ionizirani atomi helijuma ( Ne 2+). Imaju +2 pozitivno naelektrisanje i masu skoro 7350 puta veću od mase elektrona. Dolazak na ekran obložen cink sulfidom, α -čestice su uzrokovale da svijetli, a pomoću lupe se moglo vidjeti i prebrojati pojedinačne bljeskove koji su se pojavili na ekranu kada bi svaki udario u njega α -čestice. Između izvora zračenja i ekrana postavljena je folija. Po bljeskovima na ekranu moglo se procijeniti rasipanje α -čestice, tj. o njihovom odstupanju od prvobitnog pravca prilikom prolaska kroz sloj metala.
Ispostavilo se da je većina α -čestice prolaze kroz foliju bez promjene smjera, iako je debljina folije odgovarala stotinama hiljada atomskih promjera. Ali neke α -čestice i dalje odstupaju mali uglovi, i povremeno α -čestice su naglo promijenile smjer svog kretanja i čak (oko 1 od 100.000) bile odbačene, kao da su naišle na ogromnu prepreku. Slučajevi tako oštrog odstupanja α -čestice se mogu posmatrati pomeranjem ekrana pomoću lupe duž luka.
Iz rezultata ovog eksperimenta mogli bi se izvući sljedeći zaključci:
- Postoji neka "prepreka" u atomu, koja se zvala jezgro.
- Jezgro ima pozitivan naboj (inače pozitivno nabijen α -čestice se ne bi reflektovale nazad).
- Jezgro ima vrlo male dimenzije u odnosu na veličinu samog atoma (samo mali dio α -čestice su promijenile smjer kretanja).
- Jezgro ima veliku masu u poređenju sa masom α -čestice
Rutherford je objasnio rezultate eksperimenta tako što je predložio "planetarni" model atoma, što ga je uporedilo sa Sunčevim sistemom. Prema planetarnom modelu, u centru atoma nalazi se vrlo malo jezgro, čija je veličina otprilike 100.000 puta manje veličine sam atom. Ovo jezgro sadrži gotovo cijelu masu atoma i nosi pozitivan naboj. Oko jezgra se kreću elektroni, čiji je broj određen nabojem jezgra. Vanjska trajektorija kretanja elektrona određuje vanjske dimenzije atom. Prečnik atoma je reda 10 -8 cm, a prečnik jezgra je reda 10 -13 ÷10 -12 cm.
Što više naplate atomsko jezgro, jače će se odgurnuti od njega α -čestica, to će se češće javljati slučajevi jakih odstupanja α -čestice koje prolaze kroz metalni sloj, iz početnog pravca kretanja. Stoga eksperimenti raspršivanja α -čestice omogućavaju ne samo otkrivanje postojanja atomskog jezgra, već i određivanje njegovog naboja. Već iz Rutherfordovih eksperimenata proizlazi da je naboj jezgra (izražen u jedinicama naelektrisanja elektrona) numerički jednak serijskom broju elementa u periodnom sistemu. Ovo je potvrđeno G. Moseley, koji je 1913. godine uspostavio jednostavnu vezu između valnih dužina određenih linija u rendgenskom spektru elementa i njegovog atomskog broja, i D. Chadwick, koji je 1920. godine s velikom preciznošću odredio naboje atomskih jezgara brojnih elemenata raspršivanjem α -čestice
Utvrđeno je fizičko značenje serijskog broja elementa u periodnom sistemu: ispostavilo se da je serijski broj najvažnija konstanta elementa, izražavajući pozitivni naboj jezgra njegovog atoma. Iz električne neutralnosti atoma slijedi da je broj elektrona koji rotiraju oko jezgre jednak atomskom broju elementa.
Ovo otkriće dalo je novo obrazloženje za raspored elemenata u periodnom sistemu. Istovremeno je eliminisala i očiglednu kontradikciju u sistemu Mendeljejeva – položaj nekih elemenata sa većom atomskom masom ispred elemenata sa nižom atomskom masom (telur i jod, argon i kalijum, kobalt i nikl). Pokazalo se da tu nema kontradikcije, jer je mjesto elementa u sistemu određeno nabojem atomskog jezgra. Eksperimentalno je utvrđeno da je nuklearni naboj atoma telura 52, a atoma joda 53; dakle telur, uprkos velikom atomska masa, mora stajati prije joda. Na isti način, naboji jezgara argona i kalijuma, nikla i kobalta u potpunosti odgovaraju redosledu rasporeda ovih elemenata u sistemu.
Dakle, naboj atomskog jezgra je osnovna veličina od koje zavise svojstva elementa i njegov položaj u periodnom sistemu. Zbog toga periodični zakon Mendeljejeva trenutno se može formulirati na sljedeći način:
Svojstva elemenata i jednostavnih i složenih supstanci koje oni formiraju periodično zavise od naboja jezgra atoma elemenata.
Određivanje serijskih brojeva elemenata na osnovu naboja jezgara njihovih atoma omogućilo je utvrđivanje ukupan broj smešta u periodnom sistemu između vodonika, koji ima redni broj 1, i uranijuma (atomski broj 92), koji se u to vreme smatrao poslednjim članom periodnog sistema elemenata. Kada je stvorena teorija strukture atoma, mjesta 43, 61, 72, 75, 85 i 87 ostala su nezauzeta, što je ukazivalo na mogućnost postojanja još neotkrivenih elemenata. Zaista, 1922. godine otkriven je element hafnij, što se dogodilo 72; zatim 1925. - renijum, koji je održan 75. Elementi koji bi trebalo da zauzmu preostala četiri slobodna sedišta ispostavilo se da su tablice radioaktivne i nisu pronađene u prirodi, ali su dobivene umjetno. Novi elementi su nazvani tehnecijum (redni broj 43), prometijum (61), astatin (85) i francijum (87). Trenutno su sve ćelije periodnog sistema između vodonika i uranijuma popunjene. Međutim, ona sama periodni sistem nije potpuna.
Atomski spektri
Planetarni model je bio veliki korak u teoriji strukture atoma. Međutim, u nekim aspektima to je bilo u suprotnosti sa čvrsto utvrđenim činjenicama. Razmotrimo dvije takve kontradikcije.
Prvo, Rutherfordova teorija nije mogla objasniti stabilnost atoma. Elektron koji kruži oko pozitivno nabijenog jezgra trebao bi, poput oscilirajućeg električnog naboja, emitovati elektromagnetnu energiju u obliku svjetlosnih valova. Ali emitiranjem svjetlosti, elektron gubi dio svoje energije, što dovodi do neravnoteže između centrifugalne sile povezane s rotacijom elektrona i sile elektrostatičkog privlačenja elektrona prema jezgri. Da bi se uspostavila ravnoteža, elektron se mora približiti jezgru. Tako će se elektron, koji neprekidno emituje elektromagnetnu energiju i krećući se spiralno, približiti jezgru. Nakon što je iscrpio svu svoju energiju, mora "pasti" na jezgro, a atom će prestati postojati. Ovaj zaključak je u suprotnosti sa stvarnim svojstvima atoma, koji su stabilne formacije i mogu postojati bez razaranja izuzetno dugo.
Drugo, Rutherfordov model je doveo do pogrešnih zaključaka o prirodi atomskih spektra. Kada se svjetlost koju emituje vruće čvrsto ili tekuće tijelo prođe kroz staklenu ili kvarcnu prizmu, na ekranu postavljenom iza prizme uočava se takozvani kontinuirani spektar, čiji je vidljivi dio obojena pruga koja sadrži sve boje rainbow. Ovaj fenomen se objašnjava činjenicom da se zračenje vrućeg čvrstog ili tekućeg tijela sastoji od elektromagnetnih valova različitih frekvencija. Talasi različitih frekvencija različito se lome od prizme i padaju na njih različitim mjestima ekran. Skup frekvencija elektromagnetno zračenje koju emituje supstanca naziva se emisionim spektrom. S druge strane, tvari apsorbiraju zračenje određenih frekvencija. Kombinacija potonjeg naziva se apsorpcijskim spektrom tvari.
Da biste dobili spektar, možete koristiti difrakcijsku rešetku umjesto prizme. Potonji je staklena ploča, na čijoj se površini nanose tanki paralelni potezi na vrlo maloj udaljenosti jedan od drugog (do 1500 poteza po 1 mm). Prolazeći kroz takvu rešetku, svjetlost se razlaže i formira spektar sličan onom koji se dobije upotrebom prizme. Difrakcija je svojstvena svakom kretanju valova i služi kao jedan od glavnih dokaza valne prirode svjetlosti.
Kada se zagrije, tvar emituje zrake (zračenje). Ako zračenje ima jednu talasnu dužinu, onda se ono naziva monohromatskim. U većini slučajeva, zračenje karakterizira nekoliko valnih dužina. Kada se zračenje razloži na monohromatske komponente, dobija se spektar zračenja, gde se njegove pojedinačne komponente izražavaju kao spektralne linije.
Spektri dobiveni emisijom slobodnih ili slabo vezanih atoma (na primjer, u plinovima ili parama) nazivaju se atomski spektri.
Zračenje koje emituju čvrste materije ili tečnosti uvek daje kontinuirani spektar. Zračenje koje emituju vrući plinovi i pare, za razliku od zračenja čvrstih tijela i tekućina, sadrži samo određene valne dužine. Stoga, umjesto neprekidne pruge na ekranu, dobijate niz pojedinačnih linija u boji razdvojenih tamnim razmacima. Broj i lokacija ovih vodova ovise o prirodi vrućeg plina ili pare. Dakle, para kalijuma proizvodi spektar koji se sastoji od tri linije - dvije crvene i jedne ljubičaste; u spektru para kalcijuma postoji nekoliko crvenih, žutih i zelenih linija itd.
Zračenje koje emituju čvrste materije ili tečnosti uvek daje kontinuirani spektar. Zračenje koje emituju vrući plinovi i pare, za razliku od zračenja čvrstih tijela i tekućina, sadrži samo određene valne dužine. Stoga, umjesto neprekidne pruge na ekranu, dobijate niz pojedinačnih linija u boji razdvojenih tamnim razmacima. Broj i lokacija ovih vodova ovise o prirodi vrućeg plina ili pare. Dakle, para kalijuma daje spektar koji se sastoji od tri linije - dvije crvene i jedne ljubičaste; u spektru para kalcijuma postoji nekoliko crvenih, žutih i zelenih linija itd.
Takvi spektri se nazivaju linijski spektri. Utvrđeno je da svjetlost koju emituju atomi plina ima linijski spektar, u kojem se spektralne linije mogu kombinovati u serije.
U svakoj seriji, raspored linija odgovara određenom uzorku. Mogu se opisati frekvencije pojedinih linija Balmerova formula:
Činjenica da atomi svakog elementa daju potpuno određen spektar, svojstven samo ovom elementu, i da je intenzitet odgovarajućih spektralnih linija veći, što je veći sadržaj elementa u uzetom uzorku, široko se koristi za određivanje kvalitativnog i kvantitativni sastav supstanci i materijala. Ova metoda istraživanja se zove spektralna analiza.
Pokazalo se da planetarni model strukture atoma nije u stanju da objasni linijski spektar emisije atoma vodika, a još manje kombinaciju spektralnih linija u nizu. Elektron koji rotira oko jezgra mora se približiti jezgru, neprestano mijenjajući njegovu brzinu. Frekvencija svjetlosti koju emituje određena je frekvencijom njegove rotacije i stoga se mora stalno mijenjati. To znači da emisioni spektar atoma mora biti kontinuiran, kontinuiran. Prema ovom modelu, frekvencija zračenja atoma mora biti jednaka mehaničkoj frekvenciji vibracija ili višestruka, što se ne slaže s Balmerovom formulom. Dakle, Rutherfordova teorija nije mogla objasniti ni postojanje stabilnih atoma ni prisustvo njihovih linijskih spektra.
Kvantna teorija svjetlosti
Godine 1900 M. Planck je pokazao da se sposobnost zagrijanog tijela da emituje zračenje može ispravno kvantitativno opisati samo uz pretpostavku da zračenje emituju i apsorbiraju tijela ne kontinuirano, već diskretno, tj. u odvojenim porcijama - kvanti. Istovremeno, energija E svaki takav dio je povezan sa frekvencijom zračenja odnosom tzv Plankove jednačine:
Sam Planck dugo vremena vjerovao da je emisija i apsorpcija svjetlosti kvantima svojstvo emitujućih tijela, a ne samog zračenja, koje je sposobno imati bilo koju energiju i stoga bi se moglo kontinuirano apsorbirati. Međutim, 1905 Einstein, analizirajući fenomen fotoelektričnog efekta, došao je do zaključka da elektromagnetna (zračeća) energija postoji samo u obliku kvanta i da je, prema tome, zračenje tok nedjeljivih materijalnih „čestica“ (fotona), čija je energija odredio Plankova jednačina.

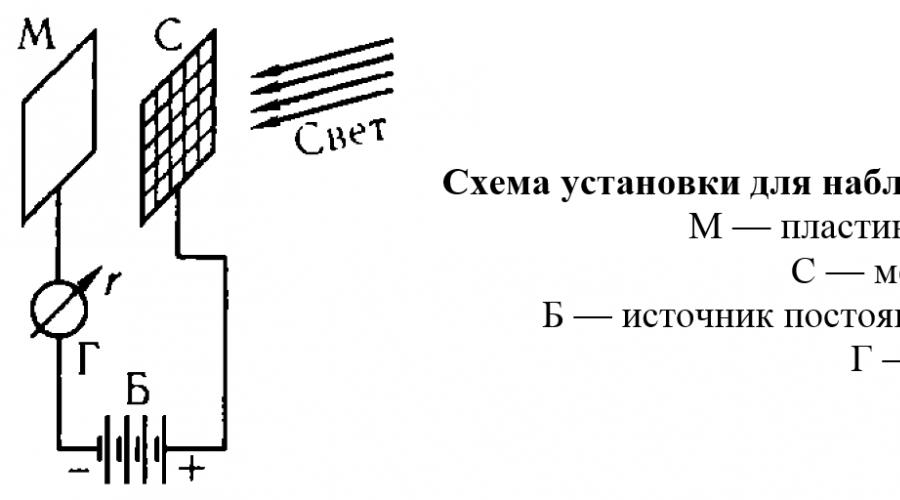
Fotoelektrični efekat je emisija elektrona metala pod utjecajem svjetlosti koja pada na njega. Ovaj fenomen je detaljno proučavan 1888-1890. A. G. Stoletov. Ako postavite instalaciju u vakuum i primijenite je na ploču M negativan potencijal, tada se u strujnom kolu neće primijetiti struja, jer u prostoru između ploče i mreže nema nabijenih čestica koje bi mogle nositi električnu struju. Ali kada je ploča osvijetljena izvorom svjetlosti, galvanometar detektuje pojavu struje (koja se naziva fotostruja), čiji su nosioci elektroni koje svjetlost emituje iz metala.
Pokazalo se da se pri promeni intenziteta osvetljenja menja samo broj elektrona koje emituje metal, tj. jačina fotostruje. Ali maksimum kinetička energija svaki elektron emitovan iz metala ne zavisi od intenziteta osvetljenja, već se menja samo kada se promeni frekvencija svetlosti koja pada na metal. Sa povećanjem talasne dužine (tj. sa smanjenjem frekvencije) energija elektrona koje emituje metal opada, a zatim, na talasnoj dužini specifičnoj za svaki metal, fotoelektrični efekat nestaje i ne pojavljuje se čak ni pri veoma visokog intenziteta svetlosti. Dakle, kada je obasjan crvenom ili narandžastom svetlošću, natrijum ne pokazuje fotoelektrični efekat i počinje da emituje elektrone samo na talasnoj dužini manjoj od 590 nm (žuto svetlo); u litiju, fotoelektrični efekat se detektuje na još nižim talasne dužine, počevši od 516 nm (zeleno svjetlo); a izbacivanje elektrona iz platine pod uticajem vidljive svetlosti uopšte ne nastaje i počinje tek kada se platina ozrači ultraljubičastim zracima.
Ova svojstva fotoelektričnog efekta potpuno su neobjašnjiva sa stanovišta klasične valovne teorije svjetlosti, prema kojoj učinak treba odrediti (za dati metal) samo količina energije, apsorbuje metalna površina u jedinici vremena, ali ne bi trebalo da zavisi od vrste zračenja koje pada na metal. Međutim, ta ista svojstva dobijaju jednostavno i uvjerljivo objašnjenje ako pretpostavimo da se zračenje sastoji od pojedinačnih dijelova, fotona, sa vrlo specifičnom energijom.
U stvari, elektron u metalu je vezan za atome metala, tako da se određena energija mora utrošiti da bi se iščupao. Ako foton ima potrebnu količinu energije (a energija fotona je određena frekvencijom zračenja), tada će elektron biti izbačen i fotoelektrični efekat će se uočiti. U procesu interakcije s metalom, foton u potpunosti predaje svoju energiju elektronu, jer se foton ne može podijeliti na dijelove. Energija fotona će se djelomično potrošiti na prekid veze između elektrona i metala, a dijelom na prenošenje kinetičke energije kretanja elektronu. Stoga, maksimalna kinetička energija elektrona izbačenog iz metala ne može biti veća od razlike između energije fotona i energije vezivanja elektrona sa atomima metala. Posljedično, s povećanjem broja fotona koji upadaju na površinu metala u jedinici vremena (tj. s povećanjem intenziteta osvjetljenja), samo će se broj elektrona izbačenih iz metala povećati, što će dovesti do povećanja fotostruje , ali se energija svakog elektrona neće povećati. Ako je energija fotona manja od minimalne energije potrebne za izbacivanje elektrona, fotoelektrični efekat se neće primijetiti ni za jedan broj fotona koji upadaju na metal, tj. pri bilo kom intenzitetu osvetljenja.
Kvantna teorija svjetlosti, razvijen Einstein, bio u stanju da objasni ne samo svojstva fotoelektričnog efekta, već i obrasce hemijskog delovanja svetlosti, temperaturna zavisnost toplotni kapaciteti čvrstih tela i niz drugih pojava. Pokazalo se izuzetno korisnim u razvoju ideja o strukturi atoma i molekula.
Od kvantna teorija svetlost, sledi da foton nije sposoban za fragmentaciju: on deluje kao celina sa elektronom metala, izbacujući ga iz ploče; u cjelini, on stupa u interakciju sa svjetlosno osjetljivom supstancom fotografskog filma, uzrokujući njegovo potamnjenje u određenoj tački itd. U tom smislu foton se ponaša kao čestica, tj. pokazuje korpuskularna svojstva. Međutim, foton ima i valna svojstva: to se očituje u talasnoj prirodi širenja svjetlosti, u sposobnosti fotona da interferira i difrakciju. Foton se razlikuje od čestice u klasičnom smislu tog pojma po tome što se njegov tačan položaj u prostoru, kao ni tačan položaj bilo kojeg talasa, ne može odrediti. Ali on se također razlikuje od „klasičnog” vala po svojoj nesposobnosti da se podijeli na dijelove. Kombinujući korpuskularna i talasna svojstva, foton, strogo govoreći, nije ni čestica ni talas – karakteriše ga korpuskularno-talasna dualnost.
Predavanje: Planetarni model atoma
Atomska struktura
Najprecizniji način za određivanje strukture bilo koje supstance je spektralna analiza. Zračenje svakog atoma elementa je isključivo individualno. Međutim, prije nego što shvatimo kako dolazi do spektralne analize, razumjet ćemo kakvu strukturu ima atom bilo kojeg elementa.
Prvu pretpostavku o strukturi atoma iznio je J. Thomson. Ovaj naučnik dugo vrijeme proučavao atome. Štaviše, upravo je on otkrio elektron - za koji je dobio nobelova nagrada. Model koji je Thomson predložio nije imao nikakve veze sa stvarnošću, ali je poslužio kao prilično snažan poticaj u Rutherfordovoj studiji strukture atoma. Model koji je predložio Thomson nazvan je "puding od grožđica".

Thomson je vjerovao da je atom čvrsta lopta s negativnim električnim nabojem. Da bi se to kompenziralo, elektroni se ubacuju u loptu, poput grožđica. Ukupni naboj elektrona poklapa se s nabojem cijelog jezgra, što atom čini neutralnim.
Proučavajući strukturu atoma, otkrili su da su svi atomi u čvrste materije počiniti oscilatorna kretanja. I, kao što znate, svaka pokretna čestica emituje talase. Zbog toga svaki atom ima svoj spektar. Međutim, ove izjave ni na koji način nisu bile uključene u Thomsonov model.
Rutherfordovo iskustvo
Da bi potvrdio ili opovrgnuo Thomsonov model, Rutherford je predložio eksperiment u kojem je atom određenog elementa bombardiran alfa česticama. Kao rezultat ovog eksperimenta, bilo je važno vidjeti kako će se čestica ponašati.
Alfa čestice su otkrivene kao rezultat radioaktivnog raspada radijuma. Njihovi tokovi su bili alfa zraci, od kojih je svaka čestica imala pozitivan naboj. Kao rezultat brojnih istraživanja utvrđeno je da je alfa čestica poput atoma helijuma kojem nedostaju elektroni. Koristeći trenutna saznanja znamo da je alfa čestica jezgro helijuma, u vrijeme kada je Rutherford vjerovao da su to joni helijuma.
Svaka alfa čestica imala je ogromnu energiju, zbog čega je mogla velikom brzinom letjeti prema dotičnim atomima. Stoga je glavni rezultat eksperimenta bio odrediti ugao otklona čestice.
Za izvođenje eksperimenta, Rutherford je koristio tanka folija od zlata. Usmjerio je na nju brze alfa čestice. Pretpostavio je da će kao rezultat ovog eksperimenta sve čestice proletjeti kroz foliju, i to uz mala odstupanja. Međutim, da bi to bio siguran, on je uputio svoje učenike da provjere da li te čestice imaju velika odstupanja.

Rezultat eksperimenta iznenadio je apsolutno sve, jer mnoge čestice ne samo da su odstupile za prilično veliki ugao - neki uglovi odstupanja dosezali su i više od 90 stepeni.
Ovi rezultati su iznenadili apsolutno sve; Rutherford je rekao da se osjećao kao da je komad papira stavljen na put projektila, koji nije dozvolio alfa čestici da prodre unutra, zbog čega se ona vratila.
Ako je atom zaista čvrst, onda bi ga trebao imati električno polje, što je usporilo česticu. Međutim, snaga polja nije bila dovoljna da ga potpuno zaustavi, a još manje da ga vrati. To znači da je Thomsonov model opovrgnut. Tako je Rutherford počeo raditi na novom modelu.
Rutherfordov model
Da bi se dobio takav eksperimentalni rezultat, potrebno je koncentrirati pozitivni naboj u manjoj veličini, što rezultira većim električnim poljem. Koristeći formulu potencijala polja, može se odrediti potrebna veličina pozitivna čestica koja može gurnuti alfa česticu u suprotnom smjeru. Njegov radijus bi trebao biti oko maksimuma 10 -15 m. Zbog toga je Rutherford predložio planetarni model atoma.

Ovaj model je tako nazvan s razlogom. Činjenica je da se unutar atoma nalazi pozitivno nabijeno jezgro, slično Suncu u Sunčevom sistemu. Elektroni se okreću oko jezgra, poput planeta. Sunčev sistem je dizajniran na način da planete privlače Sunce gravitacionim silama, ali ne padaju na površinu Sunca kao rezultat postojeće brzine koja ih drži u orbiti. Ista stvar se dešava i sa elektronima – Kulonove sile privlače elektrone u jezgro, ali zbog rotacije ne padaju na površinu jezgra.
Jedna od Thomsonovih pretpostavki pokazala se apsolutno tačnom - ukupni naboj elektrona odgovara naboju jezgra. Međutim, kao rezultat jakih interakcija, elektroni mogu biti izbačeni iz svoje orbite, zbog čega se naboj ne kompenzira i atom se pretvara u pozitivno nabijeni ion.
Veoma važna informacijaŠto se tiče strukture atoma, gotovo cijela masa atoma je koncentrisana u jezgru. Na primjer, atom vodika ima samo jedan elektron, čija je masa više od hiljadu i pol puta manja od mase jezgra.
| | |
Istorijski modeli1 atoma odražavaju nivoe znanja koji odgovaraju određenom periodu u razvoju nauke.
Prvu fazu razvoja atomskih modela karakteriziralo je odsustvo eksperimentalnih podataka o njegovoj strukturi.
Objašnjavajući fenomene mikrosvijeta, naučnici su tražili analogije u makrosvijetu, oslanjajući se na zakone klasične mehanike.
J. Dalton, tvorac hemijskog atomizma (1803), pretpostavio je da su atomi istog hemijskog elementa identične sferične male, pa stoga nedjeljive čestice.
Francuski fizičar Jean Baptiste Perrin (1901) predložio je model koji je zapravo anticipirao "planetarni" model. Prema ovom modelu, u centru atoma nalazi se pozitivno nabijeno jezgro, oko koje se po određenim orbitama kreću negativno nabijeni elektroni, poput planeta oko Sunca. Perinov model nije privukao pažnju naučnika, jer je dao samo kvalitativnu, ali ne i kvantitativnu karakteristiku atoma (na slici 7 to je prikazano neskladom između naboja atomskog jezgra i broja elektrona).
Godine 1902. engleski fizičar William Thomson (Kelvin) razvio je ideju o atomu kao pozitivno nabijenoj sfernoj čestici unutar koje osciliraju negativno nabijeni elektroni (emitujući i apsorbirajući energiju). Kelvin je skrenuo pažnju na činjenicu da je broj elektrona jednak pozitivnom naboju sfere, stoga, kao cjelina, atom nema električni naboj(Sl. 7).
Godinu dana kasnije, njemački fizičar Philipp Lenard predložio je model prema kojem je atom šuplja sfera, unutar koje se nalaze električni dipoli (dinamidi). Zapremina koju zauzimaju ovi dipoli znatno je manja od volumena sfere, a glavni dio atoma se ispostavi da je nepopunjen.
Prema zamisli japanskog fizičara Gontaroa (Hantaro) Nagaokija (1904), u središtu atoma nalazi se pozitivno nabijeno jezgro, a elektroni se kreću u prostoru oko jezgra u ravnim prstenovima, koji podsjećaju na prstenove planete Saturn (ovaj model je nazvan „saturnovskim“ atomom). Većina naučnika nije obratila pažnju na Nagaokine ideje, iako se one ponešto preklapaju sa modernom idejom atomske orbitale.
Nijedan od razmatranih modela (slika 7) nije objasnio kako su svojstva hemijski elementi povezane sa strukturom njihovih atoma.
Rice. 7. Neki istorijski modeli atoma
Godine 1907. J. J. Thomson je predložio statički model strukture atoma, koji je atom predstavljao kao sfernu česticu nabijenu pozitivnim elektricitetom, u kojoj su negativno nabijeni elektroni ravnomjerno raspoređeni ( model"puding“, sl. 7).
Matematički proračuni su pokazali da bi elektroni u atomu trebali biti smješteni na koncentrično smještenim prstenovima. Thomson je napravio vrlo važan zaključak: razlog za periodične promjene u svojstvima kemijskih elemenata povezan je s posebnostima elektronske strukture njihovih atoma. Zahvaljujući tome, Thomsonov atomski model su veoma cenili njegovi savremenici. Međutim, nije objasnio neke pojave, na primjer, raspršivanje α-čestica kada prođu kroz metalnu ploču.
Na osnovu svojih ideja o atomu, Thomson je izveo formulu za izračunavanje prosječne devijacije α-čestica, a ovaj proračun je pokazao da je vjerovatnoća raspršenja takvih čestica pod velikim uglovima blizu nule. Međutim, eksperimentalno je dokazano da je otprilike jedna od osam hiljada α-čestica koje padaju na zlatnu foliju otklonjena za ugao veći od 90°. Ovo je bilo u suprotnosti s Thomsonovim modelom, koji je pretpostavljao odstupanja samo pod malim uglovima.
Ernest Rutherford je, sumirajući eksperimentalne podatke, 1911. godine predložio "planetarni" (ponekad nazvan "nuklearni") model strukture atoma, prema kojem je 99,9% mase atoma i njegovog pozitivnog naboja koncentrisano u vrlo malom jezgro i negativno nabijeni elektroni, broj koji je jednak naboju jezgra, rotiraju oko njega, poput planeta Solarni sistem 1 (sl. 7).
Rutherford je zajedno sa svojim studentima izveo eksperimente koji su omogućili proučavanje strukture atoma (slika 8). Struja pozitivno nabijenih čestica (α-čestica) usmjerena je na površinu tanke metalne (zlatne) folije 2 iz izvora radioaktivnog zračenja 1. Duž njihove putanje postavljen je fluorescentni ekran 3, koji je omogućavao posmatranje pravca daljeg kretanja α-čestica.

Rice. 8. Rutherfordov eksperiment
Utvrđeno je da je većina α-čestica prošla kroz foliju, praktično bez promjene smjera. Samo nekoliko čestica (u prosjeku jedna od deset hiljada) se skretalo i letjelo gotovo u suprotnom smjeru. Zaključeno je da je većina mase atoma koncentrisana u pozitivno nabijenom jezgru, zbog čega se α čestice toliko skreću (slika 9).

Rice. 9. Rasipanje α-čestica atomskim jezgrom
Elektroni koji se kreću u atomu, u skladu sa zakonima elektromagnetizma, moraju emitovati energiju i, gubeći je, biti privučeni suprotno nabijenom jezgru i stoga "pasti" na njega. To bi trebalo dovesti do nestanka atoma, ali kako se to nije dogodilo, zaključeno je da je ovaj model neadekvatan.
Početkom 20. veka, nemački fizičar Maks Plank i teoretski fizičar Albert Ajnštajn stvorili su kvantnu teoriju svetlosti. Prema ovoj teoriji, energija zračenja, kao što je svjetlost, se emituje i apsorbira ne kontinuirano, već u odvojenim dijelovima (kvantima). Štaviše, veličina kvanta energije nije ista za različita zračenja i proporcionalna je frekvenciji oscilovanja elektromagnetni talas: E = hν, gdje je h – Plankova konstanta, jednaka 6,6266·10 –34 J·s, ν – frekvencija zračenja. Ovu energiju prenose čestice svjetlosti - fotoni.
Pokušavajući vještački spojiti zakone klasične mehanike i kvantne teorije, danski fizičar Niels Bohr je 1913. godine dopunio Rutherfordov model atoma s dva postulata o nagloj (diskretnoj) promjeni energije elektrona u atomu. Bohr je vjerovao da se elektron u atomu vodika može locirati samo na vrlo određenim pozicijama. stacionarne orbite, čiji su radijusi međusobno povezani kao kvadrati prirodni brojevi (1 2: 2 2: 3 2: ... :n 2). Elektroni se kreću oko atomskog jezgra u stacionarnim orbitama. Atom ostaje u stabilnom stanju, niti apsorbira niti emituje energiju - ovo je prvi Borov postulat. Prema drugom postulatu, do emisije energije dolazi samo kada se elektron kreće u orbitu bliže atomskom jezgru. Kada se elektron pomakne na udaljeniju orbitu, atom apsorbira energiju. Ovaj model je 1916. godine poboljšao njemački teorijski fizičar Arnold Sommerfeld, koji je ukazao na kretanje elektrona duž eliptične orbite.
Planetarni model se, zbog svoje jasnoće i Borovih postulata, već dugo koristi za objašnjenje atomskih i molekularnih fenomena. Međutim, pokazalo se da se kretanje elektrona u atomu, stabilnost i svojstva atoma, za razliku od kretanja planeta i stabilnosti Sunčevog sistema, ne mogu opisati zakonima klasične mehanike. Ova mehanika se zasniva na Newtonovim zakonima, a predmet njenog proučavanja je kretanje makroskopskih tijela brzinama malim u odnosu na brzinu svjetlosti. Za opisivanje strukture atoma potrebno je primijeniti koncepte kvantne (valne) mehanike o dualnoj korpuskularno-valnoj prirodi mikročestica, koje su 1920-ih formulirali teoretski fizičari: Francuz Louis de Broglie, Nijemci Werner Heisenberg i Erwin Schrödinger, Englez Paul Dirac, itd.
Godine 1924. Louis de Broglie je postavio hipotezu da elektron ima valna svojstva (prvi princip kvantna mehanika) i predložio formulu za izračunavanje njene talasne dužine. Stabilnost atoma objašnjava se činjenicom da se elektroni u njemu ne kreću po orbitama, već u određenim dijelovima prostora oko jezgra, koji se nazivaju atomske orbitale. Elektron zauzima gotovo cijeli volumen atoma i ne može „pasti na jezgro“ koje se nalazi u njegovom središtu.
Schrödinger je 1926. godine, nastavljajući razvoj ideja L. de Brogliea o valnim svojstvima elektrona, empirijski odabrao matematičku jednačinu sličnu jednačini vibracije strune, uz pomoć koje se mogu izračunati energije vezivanja elektrona u atom na različitim nivoima energije. Ova jednačina je postala osnovna jednačina kvantne mehanike.
Otkriće valnih svojstava elektrona pokazalo je da je širenje znanja o makrosvijetu na objekte mikrosvijeta nezakonito. Heisenberg je 1927. ustanovio da je nemoguće odrediti tačan položaj u prostoru elektrona koji ima određenu brzinu, pa su ideje o kretanju elektrona u atomu vjerovatnoće (drugi princip kvantne mehanike).
Kvantno mehanički model atoma (1926) opisuje stanje atoma kroz matematičke funkcije i nema geometrijski izraz (slika 10). Ovaj model ne razmatra dinamičku prirodu atomske strukture i pitanje veličine elektrona kao čestice. Vjeruje se da elektroni zauzimaju određene energetske razine i emituju ili apsorbiraju energiju kada se kreću na druge nivoe. Na sl. 10 energetskih nivoa je shematski prikazano u obliku koncentričnih prstenova koji se nalaze na različitim udaljenostima od atomskog jezgra. Strelice pokazuju prelaze elektrona između energetskih nivoa i emisiju fotona koja prati ove prelaze. Dijagram je prikazan kvalitativno i ne odražava stvarne udaljenosti između energetskih nivoa, koje se mogu razlikovati jedna od druge desetine puta.
Godine 1931. američki naučnik Gilbert Vajt prvi je predložio grafički prikaz atomskih orbitala i „orbitalni“ model atoma (slika 10). Atomski orbitalni modeli se koriste da odražavaju koncept elektronske gustine i pokazuju distribuciju negativnog naboja oko jezgra u atomu ili sistema atomskih jezgara u molekulu.

Rice. 10. Istorijski i moderni modeli atom
Godine 1963. američki umjetnik, vajar i inženjer Kenneth Snelson predložio je “prstenasti model” elektronskih omotača atoma (slika 10), koji objašnjava kvantitativnu raspodjelu elektrona u atomu preko stabilnih elektronskih ljuski. Svaki elektron je modeliran kao prstenasti magnet (ili zatvorena petlja sa električnom strujom koja ima magnetni moment). Prstenasti magneti se međusobno privlače i formiraju simetrične prstenaste oblike - annulus. Prisustvo dva pola u magnetima nameće ograničenje moguće opcije prstenasti sklopovi. Modeli stabilnih elektronskih ljuski su najsimetričnije figure prstenova, sastavljene uzimajući u obzir njihova magnetna svojstva.
Prisustvo spina u elektronu (vidi Odjeljak 5) jedan je od glavnih razloga za formiranje stabilnih elektronskih omotača u atomu. Elektroni formiraju parove sa suprotnim spinovima. Prstenasti model elektronskog para, ili ispunjene atomske orbitale, su dva prstena smještena u paralelne ravni na suprotnim stranama atomskog jezgra. Kada se više od jednog para elektrona nalazi u blizini jezgra atoma, elektroni u prstenu su prisiljeni da se međusobno orijentišu, formirajući elektronsku ljusku. U ovom slučaju, blisko raspoređeni prstenovi imaju različitim pravcima magnetna dalekovodi, što je označeno različite boje prstenovi koji predstavljaju elektrone.
Eksperiment modela pokazuje da je najstabilniji od svih mogućih prstenastih modela model sa 8 prstenova. Geometrijski, model je formiran na način kao da je atom u obliku sfere podijeljen na 8 dijelova (podeljen na pola tri puta) i da je u svaki dio postavljen po jedan prsten-elektron. Modeli sa ivicama prstena koriste prstenove dvije boje: crvene i plave, koji odražavaju pozitivan i negativan spin elektrona.
„Model sa talasnim aspektima“ (slika 10) sličan je modelu „prstenastog“ s tom razlikom što je svaki elektron atoma predstavljen „talasnim“ prstenom koji sadrži ceo broj talasa (kao što predlaže L. de Broglie).
Interakcija elektrona u elektronskom omotaču na ovom atomskom modelu prikazana je podudarnošću dodirnih tačaka plavog i crvenog „talasnog“ prstena sa čvorovima stajaćih talasa.
Atomski modeli imaju pravo na postojanje i granice primjene. Svaki model atoma je aproksimacija koja u pojednostavljenom obliku odražava određeni dio znanja o atomu. Ali nijedan od modela ne odražava u potpunosti svojstva atoma ili njegovih sastavnih čestica.
Mnogi modeli danas predstavljaju samo istorijski interes. Prilikom konstruisanja modela objekata u mikrosvijetu, naučnici su se oslanjali na ono što se moglo direktno posmatrati. Tako su se pojavili modeli Perrina i Rutherforda (analogija sa strukturom Sunčevog sistema), Nagaoke (nešto poput planete Saturn) i Thomsona („puding od grožđica“). Neke ideje su odbačene (Lenardov dinamički model), druge su ponovo razmotrene nakon nekog vremena, ali na novom, višem teorijskom nivou: Perrin i Kelvin modeli su razvijeni u Rutherford i Thomson modelima. Ideje o strukturi atoma stalno se poboljšavaju. Vrijeme će pokazati koliko je moderan „kvantnomehanički” model tačan. Zbog toga je na vrhu spirale nacrtan upitnik koji simbolizuje put znanja (slika 7).
Ideja da su atomi najmanje čestice materije prvo se pojavila u staroj Grčkoj. Međutim, samo u kasno XVIII veka, zahvaljujući radu naučnika kao što su A. Lavoisier, M.V. Lomonosov i neki drugi, dokazano je da atomi zaista postoje. Međutim, tada se niko nije pitao kakva je njihova unutrašnja struktura. Naučnici su još uvijek smatrali atome nedjeljivim "građevnim blokovima" koji čine svu materiju.
Pokušaji da se objasni struktura atoma
Ko je bio prvi naučnik koji je predložio nuklearni model? Prvi pokušaj da se napravi model ovih čestica pripao je J. Thomsonu. Međutim, ne može se nazvati uspješnim u punom smislu riječi. Uostalom, Thomson je vjerovao da je atom sferni i električno neutralan sistem. Istovremeno, naučnik je pretpostavio da je pozitivno naelektrisanje ravnomerno raspoređeno po zapremini ove lopte, a unutar nje je bilo negativno naelektrisano jezgro. Svi pokušaji naučnika da objasni unutrašnju strukturu atoma bili su neuspešni. Ernest Rutherford je taj koji je predložio nuklearni model strukture atoma nekoliko godina nakon što je Thomson iznio svoju teoriju.

Istorija istraživanja
Istražujući elektrolizu 1833. godine, Faraday je uspio ustanoviti da je struja u otopini elektrolita tok nabijenih čestica ili jona. Na osnovu ovih studija uspio je odrediti minimalni naboj jona. Također, važnu ulogu u razvoju ovog smjera u fizici odigrao je domaći hemičar D.I. Mendeleev. On je prvi postavio pitanje u naučnim krugovima da svi atomi mogu imati istu prirodu. Vidimo da je prije nego što je prvi put predložen Rutherfordov nuklearni model strukture atoma, veliki broj jednako važnih eksperimenata proveden od strane raznih naučnika. Oni su unaprijedili atomsku teoriju strukture materije.

Prvi eksperimenti
Rutherford je zaista briljantan naučnik, jer su njegova otkrića revolucionirala razumijevanje strukture materije. Godine 1911. uspio je postaviti eksperiment, uz pomoć kojeg su istraživači uspjeli pogledati u misteriozne dubine atoma i dobiti ideju o tome kakva je njegova unutrašnja struktura. Međutim, prve eksperimente naučnik je izveo uz podršku drugih istraživača glavnu ulogu na početku je još uvijek pripadao Rutherfordu.

Eksperimentiraj
Koristeći prirodni izvori radioaktivnog zračenja, Rutherford je bio u stanju da napravi pištolj koji je emitirao mlaz alfa čestica. Bila je to kutija od olova, unutar koje je bila radioaktivna supstanca. U pištolju je postojao prorez koji je omogućio svim alfa česticama da pogode olovni ekran. Mogli su da izlete samo kroz prorez. Na putu ovog snopa radioaktivnih čestica bilo je još nekoliko ekrana.
Odvojili su čestice koje su odstupile od prethodno određenog smjera. Strogo fokusiran pogodio je metu.Ratherford je koristio kao metu tanak list od zlatne folije. Jednom kada su čestice udarile u ovaj sloj, nastavile su svoje kretanje i na kraju pogodile fluorescentni ekran koji je postavljen iza ove mete. Kada alfa čestice udare u ovaj ekran, zabilježeni su bljeskovi iz kojih je naučnik mogao prosuditi koliko je čestica odstupilo od prvobitnog smjera prilikom sudara sa folijom i kolika je bila veličina tog odstupanja.

Razlike od prethodnih eksperimenata
Školarci i studenti koje zanima ko je predložio nuklearni model strukture atoma treba da znaju: slični eksperimenti izvedeni su u fizici prije Rutherforda. Njihova glavna ideja trebalo je prikupiti što je više moguće od odstupanja čestica od početne putanje više informacija o strukturi atoma. Sva ova istraživanja dovela su do akumulacije određene količine informacija u nauci i izazvala razmišljanje o tome unutrašnja struktura najmanjih čestica.
Već početkom 20. vijeka naučnici su znali da atom sadrži elektrone sa negativnim nabojem. Ali među većinom istraživača prevladavalo je mišljenje da unutrašnjost atoma više liči na mrežu ispunjenu negativno nabijenim česticama. Slična iskustva omogućilo nam da dobijemo mnogo informacija - na primjer, da utvrdimo geometrijske dimenzije atomi.
Sjajna pretpostavka
Rutherford je primijetio da niko od njegovih prethodnika nikada nije pokušao utvrditi mogu li alfa čestice odstupiti pod vrlo velikim uglovima od svoje putanje. Prethodni model, koji se među naučnicima ponekad naziva „puding od grožđica“ (jer su prema ovom modelu elektroni u atomu raspoređeni kao grožđice u pudingu), jednostavno nije dozvoljavao postojanje gustih komponenti strukture unutar atoma. Niko od naučnika se nije ni potrudio da razmotri ovu opciju. Istraživač je zamolio svog studenta da preopremi instalaciju na način da su zabilježena velika odstupanja čestica od putanje - samo da bi isključio tu mogućnost. Zamislite iznenađenje i naučnika i njegovog učenika kada se ispostavilo da se neke čestice raspršuju pod uglom od 180 stepeni.
Šta je unutar atoma?
Saznali smo ko je predložio nuklearni model strukture atoma i kakvo je iskustvo ovog naučnika. U to vrijeme, Rutherfordov eksperiment je bio pravi proboj. Bio je prisiljen zaključiti da je unutar atoma većina mase sadržana u vrlo gustoj materiji. Dijagram nuklearnog modela strukture atoma je krajnje jednostavan: unutra se nalazi pozitivno nabijeno jezgro.
Druge čestice koje se nazivaju elektroni kruže oko ovog jezgra. Ostatak je nekoliko redova veličine manje gustoće. Raspored elektrona unutar atoma nije haotičan - čestice su raspoređene po rastućoj energiji. Istraživač je unutrašnje dijelove atoma nazvao jezgrima. Imena koja je naučnik uveo i danas se koriste u nauci.
Kako se pripremiti za lekciju?
Oni školarci koje zanima ko je predložio nuklearni model strukture atoma mogu pokazati dodatna znanja na lekciji. Na primjer, možete govoriti o tome kako je Rutherford, dugo nakon svojih eksperimenata, volio da daje analogiju za svoje otkriće. Oružje za pobunjenike krijumčari se u jednu južnoafričku zemlju, sadržano u balama pamuka. Kako carinici mogu tačno utvrditi gdje se nalaze opasne zalihe ako je cijeli voz napunjen ovim balama? Carinik može početi da puca na bale, a gdje će meci odbiti je mjesto gdje se nalazi oružje. Rutherford je naglasio da je upravo tako došlo do njegovog otkrića.
Za školarce koji se na času pripremaju da odgovore na ovu temu, preporučljivo je da pripreme odgovore na sljedeća pitanja:
1. Ko je predložio nuklearni model strukture atoma?
2. Koja je bila svrha eksperimenta?
3. Razlika između nuklearnog modela i drugih modela.

Značaj Rutherfordove teorije
Radikalni zaključci koje je Rutherford izveo iz svojih eksperimenata naveli su mnoge njegove savremenike da sumnjaju u istinitost ovog modela. Čak ni sam Rutherford nije bio izuzetak - rezultate svog istraživanja objavio je samo dvije godine nakon otkrića. Uzimajući kao osnovu klasične ideje o tome kako se mikročestice kreću, predložio je nuklearni planetarni model strukture atoma. Sve u svemu, atom ima neutralan naboj. Elektroni se kreću oko jezgra, baš kao što se planete okreću oko Sunca. Ovo kretanje nastaje zbog Coulombovih sila. U ovom trenutku, Rutherfordov model je pretrpio značajnu modifikaciju, ali otkriće naučnika ne gubi na važnosti ni danas.
Planetarni model atoma predložio je E. Rutherford 1910. godine. Svoje prve studije strukture atoma napravio je koristeći alfa čestice. Na osnovu rezultata dobijenih iz njihovih eksperimenata rasejanja, Rutherford je predložio da je sav pozitivni naboj atoma koncentrisan u sićušnom jezgru u njegovom centru. S druge strane, negativno nabijeni elektroni su raspoređeni u ostatku svog volumena.
Malo pozadine
Prvu briljantnu pretpostavku o postojanju atoma iznio je starogrčki naučnik Demokrit. Od tada ideja o postojanju atoma, čije kombinacije stvaraju sve supstance oko nas, nije napustila maštu ljudi nauke. Razni njeni predstavnici su se periodično obraćali, ali sve do početka 19. veka njihove konstrukcije su bile samo hipoteze, ne potkrepljene eksperimentalnim podacima.
Konačno, 1804. godine, više od stotinu godina prije nego što se pojavio planetarni model atoma, engleski naučnik John Dalton iznio je dokaze o njegovom postojanju i uveo koncept atomske težine, što je bila njegova prva kvantitativna karakteristika. Kao i njegovi prethodnici, on je zamišljao atome kao sićušne komadiće materije, poput čvrstih kuglica koje se ne mogu podijeliti na još manje čestice.
Otkriće elektrona i prvi model atoma
Prošao je skoro vek kada je, konačno, kasno XIX veka takođe je Englez J. J. Thomson otkrio prvi subatomska čestica, negativno nabijeni elektron. Budući da su atomi električno neutralni, Thomson je mislio da se moraju sastojati od pozitivno nabijenog jezgra čiji su elektroni rasuti po cijelom volumenu. Na osnovu različiti rezultati dobijen eksperimentalno, 1898. predložio je svoj model atoma, koji se ponekad naziva "šljive u pudingu", jer je atom u njemu predstavljen kao sfera ispunjena nekom pozitivno nabijenom tekućinom u koju su ugrađeni elektroni, kao "šljive u pudingu". puding.” Radijus takvog sfernog modela bio je oko 10 -8 cm.Ukupni pozitivni naboj tečnosti je simetrično i ravnomerno uravnotežen negativnim naelektrisanjem elektrona, kao što je prikazano na donjoj slici.
Ovaj model je na zadovoljavajući način objasnio činjenicu da kada se supstanca zagreje, ona počinje da emituje svetlost. Iako je ovo bio prvi pokušaj da se razumije šta je atom, nije uspio zadovoljiti rezultate eksperimenata koje su kasnije izveli Rutherford i drugi. Thomson se 1911. složio da njegov model jednostavno ne može odgovoriti kako i zašto dolazi do eksperimentalno uočenog raspršenja α-zraka. Stoga je napušten i zamijenjen je naprednijim planetarnim modelom atoma.
Kako je atom strukturiran?
Ernest Rutherford je dao objašnjenje fenomena radioaktivnosti koji mu je donio Nobelovu nagradu, ali njegov najznačajniji doprinos nauci došao je kasnije kada je ustanovio da se atom sastoji od gustog jezgra okruženog orbitama elektrona, baš kao što je Sunce okruženo orbite planeta.

Prema planetarnom modelu atoma, većina njegove mase je koncentrisana u malom (u poređenju sa veličinom cijelog atoma) jezgri. Elektroni se kreću oko jezgra, putujući nevjerovatnim brzinama, ali najveći dio volumena atoma je prazan prostor.
Veličina jezgra je toliko mala da je njegov prečnik 100.000 puta manji od prečnika atoma. Rutherford je procijenio prečnik jezgra na 10-13 cm, za razliku od veličine atoma - 10-8 cm.Izvan jezgra, elektroni rotiraju oko njega sa velike brzine, što rezultira centrifugalnim silama koje balansiraju elektrostatičke sile privlačenja između protona i elektrona.
Rutherfordovi eksperimenti
Planetarni model atoma nastao je 1911. godine, nakon čuveni eksperiment sa zlatnom folijom, što je omogućilo da se dobiju neke fundamentalne informacije o njegovoj strukturi. Rutherfordov put do otkrića atomskog jezgra je dobar primjer uloga kreativnosti u nauci. Njegova potraga započela je davne 1899. godine, kada je otkrio da neki elementi emituju pozitivno nabijene čestice koje mogu probiti bilo šta. On je te čestice nazvao alfa (α) česticama (sada znamo da su to jezgra helijuma). Kao i svi dobri naučnici, Rutherford je bio radoznao. Pitao se mogu li se alfa čestice koristiti za učenje strukture atoma. Rutherford je odlučio da snop alfa čestica usmjeri na list vrlo tanke zlatne folije. Odabrao je zlato jer se od njega mogu napraviti listovi debljine i do 0,00004 cm.Iza lista zlatne folije postavio je ekran koji je svijetlio kada su u njega udarile alfa čestice. Korišćen je za detekciju alfa čestica nakon što prođu kroz foliju. Mali prorez na ekranu omogućio je snopu alfa čestica da dođe do folije nakon što napusti izvor. Neki od njih treba da prođu kroz foliju i nastave da se kreću u istom pravcu, drugi deo da se odbijaju od folije i reflektuju ispod oštri uglovi. Eksperimentalni dizajn možete vidjeti na donjoj slici.

Šta se dogodilo u Rutherfordovom eksperimentu?
Na osnovu J. J. Thomsonovog modela atoma, Rutherford je pretpostavio da će kontinuirane regije pozitivnog naboja koje ispunjavaju cijeli volumen atoma zlata skrenuti ili savijati putanje svih alfa čestica dok prolaze kroz foliju.
Međutim, velika većina alfa čestica prošla je ravno kroz zlatnu foliju, kao da nije tu. Činilo se da prolaze kroz prazan prostor. Samo nekoliko njih skreće s pravog puta, kako se očekivalo na početku. Ispod je grafikon broja čestica raspršenih u odgovarajućem smjeru u odnosu na kut raspršenja.

Iznenađujuće, mali procenat čestica se odbio od folije, poput košarkaške lopte koja se odbija od table. Rutherford je shvatio da su ova odstupanja rezultat direktnih sudara između alfa čestica i pozitivno nabijenih komponenti atoma.
Jezgro zauzima centralno mesto
Na osnovu malog procenta alfa čestica reflektovanih od folije, možemo zaključiti da je sav pozitivan naboj i skoro sva masa atoma koncentrisana u jednom malom prostoru, a ostatak atoma je uglavnom prazan prostor. Rutherford je područje koncentriranog pozitivnog naboja nazvao jezgrom. Predvidio je i ubrzo otkrio da sadrži pozitivno nabijene čestice, koje je nazvao protoni. Rutherford je predvidio postojanje neutralnih atomskih čestica zvanih neutroni, ali ih nije mogao otkriti. Međutim, njegov učenik James Chadwick otkrio ih je nekoliko godina kasnije. Slika ispod prikazuje strukturu jezgra atoma uranijuma.

Atomi se sastoje od pozitivno nabijenih teških jezgara okruženih negativno nabijenim ekstremno lakim česticama elektrona koje rotiraju oko njih, i to pri takvim brzinama da mehaničke centrifugalne sile jednostavno balansiraju njihovu elektrostatičku privlačnost prema jezgru, te je u tom smislu, navodno, osigurana stabilnost atoma. .
Nedostaci ovog modela
Rutherfordova glavna ideja odnosila se na ideju malog atomskog jezgra. Pretpostavka o orbitama elektrona bila je čista hipoteza. Nije znao tačno gde i kako se elektroni okreću oko jezgra. Stoga, Rutherfordov planetarni model ne objašnjava raspodjelu elektrona u orbitama.
Osim toga, stabilnost Rutherfordovog atoma bila je moguća samo uz kontinuirano kretanje elektrona po orbitama bez gubitka kinetičke energije. Ali elektrodinamički proračuni su pokazali da je kretanje elektrona duž bilo koje krivolinijske putanje, praćeno promjenom smjera vektora brzine i pojavom odgovarajućeg ubrzanja, neizbježno praćeno zračenjem. elektromagnetna energija. U ovom slučaju, prema zakonu održanja energije, kinetička energija elektrona treba vrlo brzo da se potroši na zračenje, te da padne na jezgro, kao što je shematski prikazano na donjoj slici.

Ali to se ne dešava, jer su atomi stabilne formacije. Između modela fenomena i eksperimentalnih podataka nastala je kontradikcija, tipična za nauku.
Od Rutherforda do Nielsa Bohra
Sledeći veliki korak napred atomska istorija dogodio se 1913. godine, kada je danski naučnik Niels Bohr objavio opis detaljnijeg modela atoma. To je jasnije definiralo mjesta na kojima se elektroni mogu locirati. Iako su naučnici kasnije razvili sofisticiranije atomske dizajne, Bohrov planetarni model atoma bio je u osnovi ispravan, a veliki dio se i danas prihvaća. Imala je mnogo korisne aplikacije, na primjer, koristi se za objašnjenje svojstava različitih kemijskih elemenata, prirode njihovog spektra zračenja i strukture atoma. Planetarni model i Bohrov model bili su najvažnije prekretnice koje su označile nastanak novog pravca u fizici - fizike mikrosvijeta. Bohr je 1922. dobio Nobelovu nagradu za fiziku za svoj doprinos našem razumijevanju strukture atoma.
Šta je novo Bohr unio u atomski model?
Dok je još bio mlad, Bor je radio u Rutherfordovoj laboratoriji u Engleskoj. Pošto je koncept elektrona bio slabo razvijen u Rutherfordovom modelu, Bohr se fokusirao na njih. Kao rezultat toga, planetarni model atoma je značajno poboljšan. Bohrovi postulati, koje je formulirao u svom članku “O strukturi atoma i molekula”, objavljenom 1913., glase:
1. Elektroni se mogu kretati oko jezgra samo na fiksnim udaljenostima od njega, koje su određene količinom energije koju imaju. On je ove fiksne nivoe nazvao energetskim nivoima ili elektronskim školjkama. Bor ih je zamislio kao koncentrične sfere, sa jezgrom u središtu svake. U ovom slučaju, elektroni sa nižom energijom će se naći na većoj niske nivoe, bliže jezgru. Oni sa više energije naći će se na više visoki nivoi, dalje od jezgra.
2. Ako elektron apsorbuje određenu (sasvim izvesnu za dati nivo) količinu energije, onda će skočiti na sledeći, viši energetski nivo. Suprotno tome, ako izgubi istu količinu energije, vratit će se na prvobitni nivo. Međutim, elektron ne može postojati na dva nivoa energije.
Ova ideja je ilustrovana crtežom.

Energetski dijelovi za elektrone
Bohrov atomski model je zapravo kombinacija dva različite ideje: Rutherfordov atomski model s elektronima koji se okreću oko jezgra (u suštini Bohr-Rutherfordov planetarni model atoma), i ideja njemačkog naučnika Maxa Plancka o kvantizaciji energije materije, objavljena 1901. Kvantni (in plural- quanta) je minimalna količina energija koju supstanca može apsorbovati ili emitovati. To je neka vrsta koraka diskretizacije količine energije.
Ako se energija poredi sa vodom i želite da je dodate materiji u obliku čaše, ne možete jednostavno sipati vodu u neprekidnom mlazu. Umjesto toga, možete ga dodati u malim količinama, poput kašičice. Bohr je vjerovao da ako elektroni mogu apsorbirati ili izgubiti samo fiksne količine energije, onda moraju mijenjati svoju energiju samo za te fiksne količine. Dakle, oni mogu zauzimati samo fiksne energetske nivoe oko jezgra koji odgovaraju kvantizovanim prirastima njihove energije.
Dakle, iz Borovog modela izrasta kvantni pristup objašnjavanju strukture atoma. Planetarni model i Borov model bili su jedinstveni koraci od klasične fizike do kvantne fizike, koja je glavni alat u fizici mikrosvijeta, uključujući atomsku fiziku.